水煤气变换
- 格式:doc
- 大小:88.00 KB
- 文档页数:11

2011-2012学年第二学期《专外与文献检索》课程考查成绩细则成绩:《专外与文献检索》课程考查低温水煤气变换反应研究进展摘要:低温水煤气变化反应由于它在许多工业过程起着重要作用,引起了研究者的极大兴趣,一直是研究领域的一个热点问题。
本文简要介绍了低温水煤气反应与起反应机理,对国内外水煤气变换反应催化剂研究进展进行概括与总结,重点陈述了负载金超微粒子催化剂的发展、催化机理、制备方法及载体的选取。
关键字:水煤气变换反应反应机理催化剂负载金催化剂低温水煤气变换反应( Water- Gas Shift Reaction, 简称WGSR) 的工业应用已有90多年历史,在以煤、石油和天然气为原料的制氢工业和合成氨工业具有广泛的应用,在合成气制醇、制烃催化过程中,低温水气变换反应通常用于甲醇重整制氢反应中大量CO 的去除,同时在环境科学甚至在民用化学方面起作用也不可忽视,如汽车尾气的处理、家用煤气降低CO的含量等。
近年来由于在燃料电池电动车上的应用,这一经典化学反应的研究再次引起国内外同行极大关注。
本文在参阅大量文献资料的基础上,简要介绍了国内外水煤气变换反应催化剂研究的进展。
1.WGSR的反应机理WGSR是一放热反应, 较低的反应温度有利于化学平衡, 但反应温度过低则会影响反应速率[1],从纯化学的角度来看,WGSR反应的正向反应是水合反应,逆向反应是一个加氢及脱水反应,对于这类反应的研究,具有一定的代表性。
CO+H2=CO2+H2△H=-41.1kJ/mol水煤气变换反应属于中等程度放热。
按照操作温度, 可分为低温水气变换反应( 180~250℃) 和中温水气变换反应( 220~350℃) 。
虽然近年来人们对WGSR 进行了广泛而深的研究, 但但鉴子各个研究者的实验手段及催化剂制备等方面的差异, 使得不同的研究者对其有着不同的看法。
截止目前, 已见报导的低变反应机理类型主要有以下四种[2]:(1)氧化还原机理H2O+M=H2+MO MO+CO=CO2+MM为铜系金属,MO为与M相对应的金属氧化物(2)三途反应机理H2O+(CO)=CO2+H2CO+(H2O)=CO2+H2CO+MO=CO2+M H2O+M=H2+MOH2O+M=H2+MO(CO)、(H2O)表示被吸附的CO、H2O,M为铜系金属,MO为与M相对应的金属氧化物。

水煤气变换反应(WGSR)Au/Fe 2O 3催化剂的相关影响因素薛学良(郑州大学化工与能源学院,河南郑州450001)摘要:通过H2-TPR、CO-TPD-MS、BET、XRD、UV-VIS、XRF等表征手段,初步考察Au/Fe 2O 3催化剂具有高催化活性的原因,并分析讨论催化剂的制备方法、助剂、金载荷量、、沉淀剂种类、烘焙温度、沉淀PH值、氢气氛处理等对Au/Fe 2O 3催化性能的影响,关键词:水煤气变换反应,Au/Fe 2O 3催化剂,助剂,金载荷量,沉淀剂种类,烘焙温度,沉淀PH值,氢气氛处理引言水煤气变换反应(WGSR)是三效催化剂用于汽车尾气净化处理时发生的一个重要反应。
不仅能有效促进CO的消除,而且生成的H 2也有利于去除NO X 。
甲醇燃料电池汽车的研制正在兴起,但制氢过程产生的CO会对铂电极造成严重的毒害作用。
可利用水蒸气将C0变换成H 2和CO 2,或再引入氧气选择性氧化CO。
鉴于WGSR在尾气治理过程中的重要性以及在甲醇燃料电池汽车上原料气(H 2)净化的应用前景,近年来该反应再次引起国内外研究者的极大兴趣。
目前,负载型金催化剂正受到人们的极大关注。
它对许多反应显示出优异的催化性能,如CO,H 2氧化、烃类催化燃烧、NOX直接分解或用CO还原、CO 2加氢反应、氯氟烃的催化分解以及不饱和烃的选择加成等。
国外对低温水煤气变换反应金催化剂作了较多研究。
自从Andreeva 等首次报道了Au/Fe 2O 3具有较高的低温水煤气变换反应催化活性后,人们对金催化剂的制备和微观结构进行了大量的研究,发现金催化剂的活性受制备方法的影响较大。
国内迄今未见负载型金催化剂用于该反应的研究报道。
由于金为贵金属,其价格相对较昂贵。
文献[]系统地考察了制备参数、预处理条件以及金负载量对Au/Fe 2O 3催化剂的低温水煤气变换活性影响。
但金催化剂在催化过程中易失活,稳定性差,制约了其在化工领域中的应用。

水煤气变换催化剂摘要:水煤气变换反应(WGRS)在化工生产中起着积极而重要的作用,一是人们研究的课题之一。
催化反应进行的催化剂是近年来的研究热点。
本文对各种催化剂的制备及性能、影响因素做了详细的阐述,并就我国低温水煤气变换催化剂的研发提出了一些见解。
关键词:水煤气;催化剂;发展0 引言众所周之,氢是工业领域中一种至关重要的天然材料,它已经在合成氨工业中广泛应用,分解高分子的天然油脂和脱硫。
除此之外,氢也是一种不平常的燃料,它的能量密度或者发热量远高于其他气体或者液体燃料。
氢的天然存在量很少,需要工业大量合成,水煤气变换反应是工业用氢气的主要来源。
水煤气变换反应(CO+H2O==CO+H2,△H=一41.9 Kmol/mo1),在合成氨、合成甲醇等制氢工业中)是一重要的反应过程。
水煤气变换反应速度相对较慢,需高性能的催化剂使放映得以进行。
工业化的变换催化剂均是固体催化剂,如铁系高温变换催化剂、铜锌系低温变换催化剂、钴钼系耐硫宽温变换催化剂等,且均采用固定床反应器[1]。
国外对气一水溶液体系水煤气变换反应一直没有间断过研究,研究主要从两个方面进行。
一是对各种无机化合物作为催化剂反应系统的效能进行考察,另一方面是对各种贵金属有机化合物作为催化剂进行研究,无机化合物作为催化剂的反应体系适用性较好,对氧气有一定的承受能力,而金属有机化合物作为催化剂的反应体系,对氧非常敏感,几乎要求在无氧条件下进行,PPM 级的杂质氧就能使催化剂失活[2],国内在这方面的研究也在不断进行。
1 水煤气变换反应关于水煤气变换反应的反应机理,目前普遍接受的是表面氧化还原机理,可表示为[3]:H 2O(g)一H2O(S) (1)H2O(S)一OH(S)+H(S) (2) OH(S)一O(S)+H(S) (3)2H(S)一H2(g) (4)CO(g)一CO(S) (5)CO(S)+O(S)一CO(S) (6)CO2(S)一CO2(g) (7)式中,g表示气态,S表示表面吸附态。

高三化学反应原理试题精编(二)1.(2019全国Ⅰ卷)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。
回答下列问题:(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
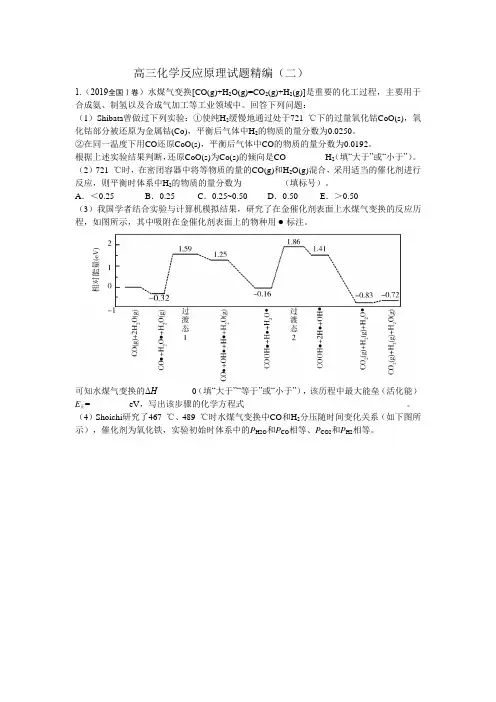
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_____________________________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的P H2O和P CO相等、P CO2和P H2相等。
计算曲线a 的反应在30~90 min 内的平均速率v (a)=___________kPa·min −1。
467 ℃时P H2和P CO 随时间变化关系的曲线分别是___________、___________。
489 ℃时P H2和P CO 随时间变化关系的曲线分别是___________、___________。
2019高考真题化学原理综合题汇编(带答案)1.(2019全国Ⅰ,28)(14分)水煤气变换[CO(g)+H 2O(g)=CO 2(g)+H 2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。
回答下列问题:(1)Shibata 曾做过下列实验:①使纯H 2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H 2的物质的量分数为0.0250。
②在同一温度下用CO 还原CoO(s),平衡后气体中CO 的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H 2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H 2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H 2的物质的量分数为_________(填标号)。
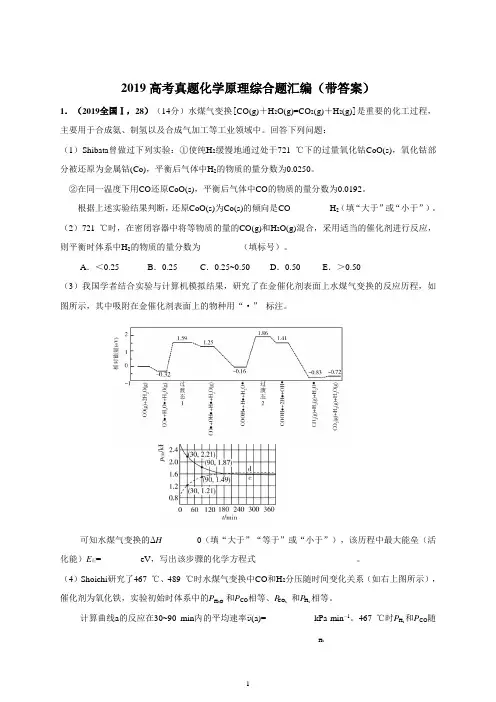
A .<0.25B .0.25C .0.25~0.50D .0.50E .>0.50(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用“·” 标注。
可知水煤气变换的ΔH ________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E 正=_________eV ,写出该步骤的化学方程式_______________________。
(4)Shoichi 研究了467 ℃、489 ℃时水煤气变换中CO 和H 2分压随时间变化关系(如右上图所示),催化剂为氧化铁,实验初始时体系中的P 和P CO 相等、P 和P 相等。
计算曲线a 的反应在30~90 min 内的平均速率v (a)=___________kPa·min −1。
467 ℃时P 和P CO 随H 2O CO2- H 2H 2H 2时间变化关系的曲线分别是___________、___________。

水煤气变换反应平衡常数1.引言1.1 概述水煤气变换反应平衡常数是指在反应达到平衡状态时,反应物和生成物的浓度之比的稳定值。
水煤气变换是一种重要的工业反应,其主要产物为一氧化碳和氢气。
水煤气作为一种重要的能源来源,对于了解和掌握水煤气变换反应平衡常数具有重要的理论和实际意义。
本文将对水煤气变换反应平衡常数的定义、影响因素进行详细分析和探讨。
首先,我们将介绍反应平衡常数的定义,即通过平衡常数可以描述反应的平衡状态。
其次,我们将探讨影响水煤气变换反应平衡常数的因素,包括温度、压力、反应物浓度和催化剂等。
通过对这些影响因素的研究和分析,可以为工业生产中的水煤气变换反应的优化和控制提供理论依据和实践指导。
本文的目的在于全面了解和掌握水煤气变换反应平衡常数的相关知识,为深入研究水煤气变换反应的机理和控制提供基础。
同时,通过对未来研究方向的展望,可以为相关学者和工程师提供一定的参考和指导,推动水煤气变换反应领域的发展和进步。
在接下来的正文部分,我们将详细介绍和讨论反应平衡常数的定义以及不同因素对水煤气变换反应平衡常数的影响。
最后,我们将总结反应平衡常数的重要性,并展望未来研究的方向。
通过本文的阐述,相信读者能够全面了解水煤气变换反应平衡常数的重要性和研究的价值,为相关领域的研究和应用提供一定的参考和指导。
文章结构部分主要描述了本文的组织结构和各个章节的内容概述。
通过这样的介绍,读者可以对整篇文章有一个整体的了解,同时也方便读者快速找到所感兴趣的内容。
本文的结构如下:1. 引言1.1 概述在这一部分,我们将介绍水煤气变换反应平衡常数的背景和意义,引出本文要讨论的主题。
1.2 文章结构在这一部分,我们将简要介绍本文的组织结构。
接下来的章节将分别讨论反应平衡常数的定义和影响因素,并在结论部分总结并展望未来的研究方向。
1.3 目的在这一部分,我们将明确本文的目的,即通过对水煤气变换反应平衡常数的讨论,加深我们对这一概念的理解,并为未来的研究提供一定的参考。

水煤气变换气净化探讨水煤气变换气净化探讨——崔静思摘要:现有的净化工艺下,高压的变换气经过净化后,其中的二氧化碳硫化氢以低压状态输出,其所具有的压力势能没有得到有效地利用。
通过该工艺流程的方案,净化过程中变换气中的二氧化碳硫化氢经过膨胀机膨胀做功,有效地利用其所具有的压力势能,达到变换气净化过程中的节能效应。
1目的变换气净化过程中实现对外界输出机械能,并对外界提供一定的制冷冷量2当前状况能源状况当前我国一直在提倡低碳经济,富煤少油缺气的的现状决定了我们必须有一定量的选择“爱恨交加”的煤炭消耗。
电力的需求,我们可以尽量开发利用水力能、太阳能、风能、核能等清洁能源,但化工的需求我们总还是要一定量的煤炭作为其他能源的替代的。
煤化工过程中尽量节能,在一定程度上就是低碳。
净化工艺煤化工过程少不了水煤气的净化,煤化工的过程中水煤气变换气含硫的特性,净化工艺普遍选择了净化程度高、能耗相对低的低温甲醇洗。
3技术背景(理论依据)高压的水煤气变换气净化后,有效的氢气、一氧化碳等气体基本被等压保留,二氧化碳、硫化氢等气体低压排出。
按阿马伽(Amagat)气体分体积定律,水煤气变换气中二氧化碳、硫化氢当量于高压的分率体积存在,具有相应的压力势能,在减压过程中有对应的能量释放,设计特定的工艺手段,让水煤气变换气中的二氧化碳、硫化氢的气体通过膨胀机做绝热膨胀,减压到低压状态,就可以得到相应的机械能,而且可以获取对应的制冷冷量。
理论层面上,水煤气变换气净化过程中可以获取一定的机械能和制冷冷量的。
4思路低温液化分离变换气中的二氧化碳、用液体二氧化碳做吸收介质脱除变换气中的硫化氢,液体二氧化碳经过气化、过热、膨胀机膨胀做功,变换气中二氧化碳和硫化氢的压力势能得以利用。
二氧化碳液体的最低饱和压力在,当前的煤气化工艺所产的水煤气压力都不足以经过冷冻液化分离二氧化碳就可以得到符合合成甲醇、天然气需要的净化气。
水煤气的变换气的净化必须经过压缩机提高变换气的压力,通过变换气的压力和冷冻后的温度控制净化气中二氧化碳的含量;硫化氢在液体二氧化碳中的溶解度随温度的降低而增大,通过对变换气换热降温,再利用液体二氧化碳吸收脱除,从而保证变换气二氧化碳液化后的量足够脱除变换气中的硫化氢以及液体二氧化碳中硫化氢的浓度。

一、选择题1.水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。
我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。
下列说法正确的是A.水煤气变换反应的∆H>0B.步骤③的化学方程式为:CO·+OH·+H2O(g)=COOH·+H2O·C.步骤⑤只有非极性键H-H键形成D.该历程中最大能垒(活化能)E正=1.86eV答案:B【详解】A.由示意图可知,反应物的总能量大于生成物的总能量,该反应为放热反应,△H<0,故A错误;B. 由示意图可知,步骤③为CO·、OH·、H2O(g)和H·反应生成COOH·、H2O·和H·,反应的化学方程式为:CO·+OH·+H2O(g)=COOH·+H2O·,故B正确;C.由示意图可知,步骤⑤除有非极性键H—H键形成外,还要碳氧极性键和氢氧极性键生成,故C错误;D.由示意图可知,步骤④的能垒最大,E正=1.86eV—(—0.16eV)=2.02eV,故D错误;答案选B。
2.已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,O -H为452.5,则断裂1 mol N-H所需的能量(kJ)是A.194B.316C.391D.658答案:C解析:依据图象分析,反应为N 2H 4+O 2=N 2+2H 2O ,反应的焓变△H=-534kJ/mol ,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量。
【详解】依据图象分析,反应为N 2H 4+O 2=N 2+2H 2O ,反应的焓变△H=-534kJ/mol ,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,设断裂1molN-H 键吸收的能量为x ,断裂化学键吸收的能量=2752-534=2218,形成新键释放的能量=4x+154+500=2218,解得:x=391。
![水煤气变换方法[发明专利]](https://uimg.taocdn.com/823d2c65a0116c175e0e48ca.webp)
专利名称:水煤气变换方法
专利类型:发明专利
发明人:P·D·科布登,S·沃尔斯珀吉尔,R·W·范登布林克,H·A·J·凡戴克
申请号:CN200980152370.4
申请日:20091123
公开号:CN102264633A
公开日:
20111130
专利内容由知识产权出版社提供
摘要:本发明提供了一种水煤气变换方法,该方法包括反应阶段。
所述反应阶段包括(a)提供含有CO、HO和酸性气体组分的气体混合物至含有吸附剂的反应器,以及(b)使该气体混合物处于水煤气变换反应条件下以进行水煤气变换反应。
所述吸附剂含有碱促进的水滑石材料。
所述酸性气体组分含有HS。
申请人:荷兰能源建设基金中心
地址:荷兰北荷兰省
国籍:NL
代理机构:北京润平知识产权代理有限公司
更多信息请下载全文后查看。
反应工程课程设计一.对课题的概述一氧化碳和氢气都是会燃烧的气体,工业上把这样的混合气叫“水煤气”。
CO 和H2因为水(H2O)的分子里有一个氧(O)原子和两个氢(H)原子,水一遇上火热的煤(C),氧原子立刻被煤(C)夺走了,结果生成一氧化碳(CO)和氢气(H2)。
水煤气一种低热值煤气。
由蒸汽与灼热的无烟煤或焦炭作用而得。
主要成分为氢气和一氧化碳,也含有少量二氧化碳、氮气和甲烷等组分;各组分的含量取决于所用原料及气化条件。
主要用作台成氨、合成液体燃料等的原料,或作为工业燃料气的补充来源。
工业上,水煤气的生产一般采用间歇周期式固定床生产技术。
炉子结构采用UGI 气化炉的型式。
在气化炉中,碳与蒸汽主要发生如下的水煤气反应:C+H2O→CO+H2C+2H2O→CO2+2H2以上反应均为吸热反应,因此必须向气化炉内供热。
通常,先送空气入炉,烧掉部分燃料,将热量蓄存在燃料层和蓄热室里,然后将蒸汽通入灼热的燃料层进行反应。
由于反应吸热,燃料层及蓄热室温度下降至一定温度时,又重新送空气入炉升温,如此循环。
当目的是生产燃料气时,为了提高煤气热值,有时提高出炉煤气温度,借以向热煤气中喷入油类,使油类裂解,即得所谓增热水煤气。
近年来,正在开发高温气冷堆的技术,用氦为热载体将核反应热转送至气化炉作为热源,以生产水煤气。
在工业生产中绝大多数的化学反应过程是在变温条件下进行。
这一方面由于化学反应过程都伴随着热效应,有些热效应还相当大,即使采用各种换热方式移走热量(放热反应)或者输入热量(吸热反应),对于工业反应器都难以维持等温。
特别是气固相固定床催化反应器,要想达到等温更为困难。
另一方面许多反应过程等温操作的效果并不好,而要求有一最佳温度分布。
如工业上进行合成氨,合成甲醇之类的可逆放热反应,便属于这种情况。
再者,对于一些复杂反应、其主、副反应的活化能大小不同,温度的高低对主、副反应速率的影响也不同。
所以,可通过改变温度的方法来改变产物的分布,使目的产物的收率最大。
当化学反应的热效应很大时,无论是放热的还是吸热的,采用绝热操作将会使反应器进出口的反应物料的温差很大。
对于放热反应,反应温度沿轴向而升高,这对于不可逆反应来说,问题不大,但由于其他原因反应温度一定要控制在一定范围内时,绝热反应器的应用就会受到限制;如果反应是可逆的,温度升高而平衡转化率减低,应用绝热反应器就不可能得到较高的转化率。
在绝热反应器中进行吸热反应时,无论是可逆还是不可逆,反应温度总是沿轴向而降低,使反应速率越来越慢,若反应是可逆的,还使平衡转化率下降,从而不可能获得高的转化率。
上面所说的这些情况,在化学反应进行的同时必须与环境进行热交换,若为放热反应需要将反应器冷却,吸热反应则要加热,使反应的温度控制在要求的范围内,以获得较好的转化率和安全地操作,特别是那些温度过高会发生爆炸,或者会损坏催化剂或设备的反应更为重要。
二.课程设计的目的和要求及意义课程设计是教学中综合性和实践性较活的环节,是理论联系实际的桥梁,同时也是对化工基础知识的初次尝试。
通过课程设计,要求学生理解工程设计的基本内容。
掌握设计的程序和方法,培养学生分析和解决工程实际问题的能力。
除此之外,还可培养学生的实事求是,严谨认真的学习态度。
通过课程设计可以训练学生如下几方面的能力:1、熟悉查阅文献资料,搜集有关数据正确选用公式。
2、培养整体分析能力,比如确定化工工艺流程,进行设备的选型。
3、用精练的语言,简洁的文字,清晰的图文表达自己的设计思想。
4、运用所学的计算机知识实践于课程设计中。
三.课程设计的内容1、设计方案的简介:根据课程指导书所提供的条件和要求,初步确定解决设计任务的方案。
2、主要设备的工艺计算:包括工艺参数的确定,物料衡算,热量衡算,设备工艺尺寸计算。
3、根据所学的计算机编程知识,为课程设计相关的编写程序,通过计算机求出所学的数据。
4、本次反应工程设计内容涉及到多段管式反应器,其限制条件少,应用灵活,催化剂用量少,工业上有一定的使用价值。
四.选做本题设计的原因选三段绝热两段换热固定床式反应器进行水煤气变换与生活比较贴近,学习了固定床反应器的相关知识,其在工业上有一定的使用价值,在生产中可提高起转化率,提高运用计算机编程的能力。
五.固定床式反应器的计算1、热量衡算式设流体在固定床式反应器内的流动状况与活塞流十分接近,因此可采用活塞流模型。
设进入床层的流体质量速度为G,关键组分A的质量分率为ωA0,取床层高度为dZ的微元作组分A的物料衡算可得(GωA0dXA)/MAdZ =ηo ρb(-RA)上式中的RA为以单位质量催化剂计算的组分A的转化速率,由于系以微元床层体积或催化剂的堆体积作衡算,因此需乘以催化剂的堆密度ρb进行换算。
如果不考虑轴向热扩散,对此微元体积作热量衡算则有GCpt dT/dZ=ηoρb(-RA)(-ΔHr)-4U(T-Tc)/dt以上两式对单一反应而导出的,若为多个反应,需作适当的改写。
设在床层内的反应共有M个,关键组分Ai的物料衡算式为d(u0ci)/dZ=ρb∑ηj|νij|rj(-ΔHr)j-4U(T-Tc)/dt相应的初值条件为Z=0 , T=T0 , Ci=Ci0, i=1,2,3...,k对于多段绝热式固定床反应器:设XAi 及XAi’分别为第i段进出口转化率,而Ti及Ti’为第i段进出口物料的温度。
若第i段的催化剂的量为Vri,那么催化剂的总用量为Vr=∑Vri=Vmin (1)为简化计算,令ηo (XA,T)[-RA(XA,T)]=RA*(XA,T)将式Vr={ FA0∫dXA/ηo(XA,T)[-RA(XA,T)]}/ρb代入式(1)有Vr=FA0[∫dXA/RA*(XA,T)+∫dXA/RA*(XA,T)+...+∫dXA/RA*(XA,T)]/ρb (2)对于N段反应器,各段进出口的温度及转化率共有四N个,但因最终转化率及第一段入口转化率为零已知,故需确定的变量数为(4N-2)个,又因任意一段的出口转化率等于下一段的进口转化率,即XAi+1=XAi’,故变量数目相应减少(N-1)个。
各段进出口转化率和温度应符合T-T0=λXA的关系,四个变量中有一个是不独立的,相应变量总数又减少了N个。
所以,独立变量总数应为(4N-2)-(N-1)-N=2N-1个。
选择各段进口温度Ti 和除第一段外各段的进口转化率XAi作为控制变量,总数恰好也是(2N-1)个。
将式(2)对XAi求偏导数,并令其等于零可得R A *(XAi,Ti-1’)=RA*(XAi,Ti), i=2,3,4....N .. (3)此式的意义是为了保证催化剂总用量最少,任何一段出口的转化速率应等于下一段进口的转化速率。
同理,将式(2)对Ti求偏导数,并令其等于零可得∫dXA /RA*(XA,T)/ Ti=0, i=1,2,3...N . (4)此式的意义为对于任何一段,在规定的进出口转化率下,存在一最佳的进口温度,使该段的催化剂的用量最少。
显然,每段的催化剂的用量最少,那么,催化剂的总用量也必定最少。
任何一段的反应过程中,任何一处的温度与进口温度T i 成线性关系,从而(4)式又可改写为∫[ (1/R A *(X A ,T))/ T]XA dX A =0, i=1,2,...N ......(5) 应用此式进行计算较方便。
六.设计思路(1)假定第一段的出口转化率,根据式(5)可确定第一段的进口温度,从而由T-T 0 =λX A 求第一段出口温度,并算出第一段的出口转化速率; (2)由式(3)求第二段的进口温度;(3)由式(5)求确定第二段的出口转化率,再用式T-T 0 =λX A 求第二段出口温度,并算出第而段的出口转化速率;依次类推,直到第n 段为止。
如果求得的第n 段出口转化率(即最终转化率)与要求不符,说明原先假定的第一段的出口转化率不合适,需要重新假设,然后重复以上各步的计算,直到最终转化率符合要求时结束计算。
七.程序示例(1)C 程序示例:水煤气变换课程设计计算程序double CTygDoc::Qr(double X,double A[]){//二次给值d ouble x=F*(X-A[1])/(A[0]-F);A[1]=X;X +=!A[0]?X/100:A[2]?x+(A[0]*x-F*A[3])/(A[2]-F):x/2; A [3]=x,A[2]=A[0],A[0]=F;return X;}double CTygDoc::Ac(){//辛普森法积分 double h=(x-xo)/500,ft=0; //步长 double X,pa,pb,pc,pd,k,kp,f; for(int i=0;i<=500;i++){//循环 X=xo+i*h;T=tr+155.2*i*h;//变量 pa=12830*(1-X);pb=59100-12830*X; pc=(39920+12830*X);pd=15960+12830*X;k=2.172*exp(-6542/T);kp=0.0165*exp(4408/T);Cr=pc*pd/pa/pb;Rr=k*(1-Cr/kp);f=6542/pa*(1.674*Cr/kp-1)/Rr/(1-Cr/kp)/T/T;//函数ft+=i%2?4*f:i>0&&i<500?2*f:f;}//四倍量,两倍量,端值return ft/3*h;}//总加和void CTygDoc::OnBianhuan(){d ouble xf=0.92;d ouble to,k,kp,t1,x1,te,t2,x2;f or(A[0]=0,F=1,to=630;F*F>1e-10;){xo=0,x=0.68,tr=to;//赋初值for(i=0;i<2;i++){if(i)t1=T,x1=x,te=tr,x=0.84;for(B[0]=0;fabs(F=Ac())>1e-6;)x=Qr(x,B);//积分,转化率tr=!i?590:560;// 赋初值xo=x;// 改初值for(B[0]=0,F=1;F*F>1e-15;){k=2.172*exp(-6542/tr);kp=0.0165*exp(4408/tr);//算速率F=k*(1-Cr/kp)-Rr;//比速率tr=Qr(tr,B);}}//变温度t2=T,x2=x,x=xf;//记结果for(B[0]=0;fabs(F=Ac())>1e-6;)x=Qr(x,B);//积分,转化率F=xf-x;to=Qr(to,A);}//变初温C String yf[5];y f[0]=" 反应工程课程设计程序\n";y f[1]="水煤气变换课题的计算结果是:\n";y f[2].Format("各段T0是:%9.3f%9.3f%9.3f\n",to,te,tr);y f[3].Format("各段Tf是:%9.3f%9.3f%9.3f\n",t1,t2,T);y f[4].Format("各段Xf是:%9.5f%9.5f%9.5f\n",x1,x2,x);f or(l=0;l<5;l++)strlt.AddTail(yf[l]);U pdateAllViews(NULL);//显结果S etModifiedFlag();}(2)VB程序示例:Dim t As Double, x0 As Double, x As Double, pa As Double, r As Double, C As Double Dim Tem As Double, FF As DoublePrivate Sub Command1_click()Dim A(4) As Double, B(4) As DoubleDim xf As Double, t0 As Double, k As Double, kp As Double, t1 As Double Dim x1 As Double, te As Double, t2 As Double, x2 As Doublexf = 0.92FF = 1t0 = 620Do While FF * FF > 0.0000000001x0 = 0x = 0.69 '赋初值t = t0For i = 0 To 3FF = fact()B(0) = 0Do While Abs(FF) > 0.000001x = Q(x, B)FF = fact()LoopIf i < 2 ThenIf i = 0 Thent = 600Elset = 560End Ifx0 = xB(0) = 0FF = 1Do While FF * FF > 0.0000000001k = 2.172 * Exp(-6542 / t) '算速率kp = 0.0165 * Exp(4408 / t) '比速率FF = k * pa * (1 - C / kp) – r '变温度t = Q(t, B)LoopIf i = 0 Thent1 = Temx1 = xte = tx = 0.86Elset2 = Tem '记结果x2 = xx = xfEnd IfEnd IfNext iFF = xf - xt0 = Q(t0, A) '变初温LoopPrint "变换课题的计算结果是:"Print "各段T0是:"; Format(t0, "#########.000"); " "; Format(te, "#######.000"); " "; Format(t, "########.000")Print "各段Tf是:"; Format(t1, "#######.000"); " "; Format(t2, "#######.000"); " "; Format(Tem, "#######.000")Print "各段Xf是:"; Format(x1, "0.00000"); " "; Format(x2, "0.00000"); " "; Format(x, "0.00000") '显结果End Sub'辛普森法积分Private Function fact() As DoubleDim h As Double, ft As DoubleDim f As Double, XX As Double, pb As Double, pc As Double, pd As Double, k As Double, kp As Doubleh = (x - x0) / 500ft = 0 '步长For i = 0 To 500XX = x0 + i * h '变量Tem = t + 155.2 * i * hpa = 12830 * (1 - XX)pb = 59100 - 12830 * XXpc = 39920 + 12830 * XXpd = 15960 + 12830 * XXk = 2.172 * Exp(-6542 / Tem)kp = 0.0165 * Exp(4408 / Tem)C = pc * pd / pa / pbr = k * pa * (1 - C / kp)f = 6542 * (1.674 * C / kp - 1) / r / (1 - C / kp) / Tem / Tem '函数'四倍量,两倍量,端值If i Mod 2 <> 0 Thenft = ft + 4 * fElseIf i > 0 And i < 500 Thenft = ft + 2 * fElseft = ft + fEnd IfNext ifact = ft / 3 * hEnd FunctionPrivate Function Q(XX As Double, A() As Double)Dim x As Double '二次给值x = FF * (XX - A(1)) / (A(0) - FF)A(1) = XXIf A(0) = 0 ThenXX = XX + XX / 100ElseIf A(2) <> 0 ThenXX = XX + x + (A(0) * x - FF * A(3)) / (A(2) - FF)ElseXX = XX + x / 2End IfA(3) = xA(2) = A(0)A(0) = FFQ = XXEnd FunctionPrivate Sub Command2_Click()ClsEnd Sub附窗体图片:运行结果:变换课题的计算结果是:各段T0是:642.490 600.168 557.991各段Tf是:746.039 628.949 568.439各段Xf是:0.66723 0.85268 0.9200八.运行结果讨论三段绝热中间换热固定床式水煤气变换方法采用固定床煤气炉,主要针对传统五步法的弊端进行改造,利用加热的空气来吹风,高温过热蒸汽制气,对加套锅炉进行特殊保温处理,提高了热效率。