水煤气变换反应
- 格式:docx
- 大小:40.16 KB
- 文档页数:11


2011-2012学年第二学期《专外与文献检索》课程考查成绩细则成绩:《专外与文献检索》课程考查低温水煤气变换反应研究进展摘要:低温水煤气变化反应由于它在许多工业过程起着重要作用,引起了研究者的极大兴趣,一直是研究领域的一个热点问题。
本文简要介绍了低温水煤气反应与起反应机理,对国内外水煤气变换反应催化剂研究进展进行概括与总结,重点陈述了负载金超微粒子催化剂的发展、催化机理、制备方法及载体的选取。
关键字:水煤气变换反应反应机理催化剂负载金催化剂低温水煤气变换反应( Water- Gas Shift Reaction, 简称WGSR) 的工业应用已有90多年历史,在以煤、石油和天然气为原料的制氢工业和合成氨工业具有广泛的应用,在合成气制醇、制烃催化过程中,低温水气变换反应通常用于甲醇重整制氢反应中大量CO 的去除,同时在环境科学甚至在民用化学方面起作用也不可忽视,如汽车尾气的处理、家用煤气降低CO的含量等。
近年来由于在燃料电池电动车上的应用,这一经典化学反应的研究再次引起国内外同行极大关注。
本文在参阅大量文献资料的基础上,简要介绍了国内外水煤气变换反应催化剂研究的进展。
1.WGSR的反应机理WGSR是一放热反应, 较低的反应温度有利于化学平衡, 但反应温度过低则会影响反应速率[1],从纯化学的角度来看,WGSR反应的正向反应是水合反应,逆向反应是一个加氢及脱水反应,对于这类反应的研究,具有一定的代表性。
CO+H2=CO2+H2△H=-41.1kJ/mol水煤气变换反应属于中等程度放热。
按照操作温度, 可分为低温水气变换反应( 180~250℃) 和中温水气变换反应( 220~350℃) 。
虽然近年来人们对WGSR 进行了广泛而深的研究, 但但鉴子各个研究者的实验手段及催化剂制备等方面的差异, 使得不同的研究者对其有着不同的看法。
截止目前, 已见报导的低变反应机理类型主要有以下四种[2]:(1)氧化还原机理H2O+M=H2+MO MO+CO=CO2+MM为铜系金属,MO为与M相对应的金属氧化物(2)三途反应机理H2O+(CO)=CO2+H2CO+(H2O)=CO2+H2CO+MO=CO2+M H2O+M=H2+MOH2O+M=H2+MO(CO)、(H2O)表示被吸附的CO、H2O,M为铜系金属,MO为与M相对应的金属氧化物。


水煤气变换反应(WGSR)Au/Fe 2O 3催化剂的相关影响因素薛学良(郑州大学化工与能源学院,河南郑州450001)摘要:通过H2-TPR、CO-TPD-MS、BET、XRD、UV-VIS、XRF等表征手段,初步考察Au/Fe 2O 3催化剂具有高催化活性的原因,并分析讨论催化剂的制备方法、助剂、金载荷量、、沉淀剂种类、烘焙温度、沉淀PH值、氢气氛处理等对Au/Fe 2O 3催化性能的影响,关键词:水煤气变换反应,Au/Fe 2O 3催化剂,助剂,金载荷量,沉淀剂种类,烘焙温度,沉淀PH值,氢气氛处理引言水煤气变换反应(WGSR)是三效催化剂用于汽车尾气净化处理时发生的一个重要反应。
不仅能有效促进CO的消除,而且生成的H 2也有利于去除NO X 。
甲醇燃料电池汽车的研制正在兴起,但制氢过程产生的CO会对铂电极造成严重的毒害作用。
可利用水蒸气将C0变换成H 2和CO 2,或再引入氧气选择性氧化CO。
鉴于WGSR在尾气治理过程中的重要性以及在甲醇燃料电池汽车上原料气(H 2)净化的应用前景,近年来该反应再次引起国内外研究者的极大兴趣。
目前,负载型金催化剂正受到人们的极大关注。
它对许多反应显示出优异的催化性能,如CO,H 2氧化、烃类催化燃烧、NOX直接分解或用CO还原、CO 2加氢反应、氯氟烃的催化分解以及不饱和烃的选择加成等。
国外对低温水煤气变换反应金催化剂作了较多研究。
自从Andreeva 等首次报道了Au/Fe 2O 3具有较高的低温水煤气变换反应催化活性后,人们对金催化剂的制备和微观结构进行了大量的研究,发现金催化剂的活性受制备方法的影响较大。
国内迄今未见负载型金催化剂用于该反应的研究报道。
由于金为贵金属,其价格相对较昂贵。
文献[]系统地考察了制备参数、预处理条件以及金负载量对Au/Fe 2O 3催化剂的低温水煤气变换活性影响。
但金催化剂在催化过程中易失活,稳定性差,制约了其在化工领域中的应用。

⽔煤⽓变换(1)反应⼯程课程设计⼀.对课题的概述⼀氧化碳和氢⽓都是会燃烧的⽓体,⼯业上把这样的混合⽓叫“⽔煤⽓”。
CO 和H2因为⽔(H2O)的分⼦⾥有⼀个氧(O)原⼦和两个氢(H)原⼦,⽔⼀遇上⽕热的煤(C),氧原⼦⽴刻被煤(C)夺⾛了,结果⽣成⼀氧化碳(CO)和氢⽓(H2)。
⽔煤⽓⼀种低热值煤⽓。
由蒸汽与灼热的⽆烟煤或焦炭作⽤⽽得。
主要成分为氢⽓和⼀氧化碳,也含有少量⼆氧化碳、氮⽓和甲烷等组分;各组分的含量取决于所⽤原料及⽓化条件。
主要⽤作台成氨、合成液体燃料等的原料,或作为⼯业燃料⽓的补充来源。
⼯业上,⽔煤⽓的⽣产⼀般采⽤间歇周期式固定床⽣产技术。
炉⼦结构采⽤UGI ⽓化炉的型式。
在⽓化炉中,碳与蒸汽主要发⽣如下的⽔煤⽓反应:C+H2O→CO+H2C+2H2O→CO2+2H2以上反应均为吸热反应,因此必须向⽓化炉内供热。
通常,先送空⽓⼊炉,烧掉部分燃料,将热量蓄存在燃料层和蓄热室⾥,然后将蒸汽通⼊灼热的燃料层进⾏反应。
由于反应吸热,燃料层及蓄热室温度下降⾄⼀定温度时,⼜重新送空⽓⼊炉升温,如此循环。
当⽬的是⽣产燃料⽓时,为了提⾼煤⽓热值,有时提⾼出炉煤⽓温度,借以向热煤⽓中喷⼊油类,使油类裂解,即得所谓增热⽔煤⽓。
近年来,正在开发⾼温⽓冷堆的技术,⽤氦为热载体将核反应热转送⾄⽓化炉作为热源,以⽣产⽔煤⽓。
在⼯业⽣产中绝⼤多数的化学反应过程是在变温条件下进⾏。
这⼀⽅⾯由于化学反应过程都伴随着热效应,有些热效应还相当⼤,即使采⽤各种换热⽅式移⾛热量(放热反应)或者输⼊热量(吸热反应),对于⼯业反应器都难以维持等温。
特别是⽓固相固定床催化反应器,要想达到等温更为困难。
另⼀⽅⾯许多反应过程等温操作的效果并不好,⽽要求有⼀最佳温度分布。
如⼯业上进⾏合成氨,合成甲醇之类的可逆放热反应,便属于这种情况。
再者,对于⼀些复杂反应、其主、副反应的活化能⼤⼩不同,温度的⾼低对主、副反应速率的影响也不同。
所以,可通过改变温度的⽅法来改变产物的分布,使⽬的产物的收率最⼤。

水煤气变换催化剂摘要:水煤气变换反应(WGRS)在化工生产中起着积极而重要的作用,一是人们研究的课题之一。
催化反应进行的催化剂是近年来的研究热点。
本文对各种催化剂的制备及性能、影响因素做了详细的阐述,并就我国低温水煤气变换催化剂的研发提出了一些见解。
关键词:水煤气;催化剂;发展0 引言众所周之,氢是工业领域中一种至关重要的天然材料,它已经在合成氨工业中广泛应用,分解高分子的天然油脂和脱硫。
除此之外,氢也是一种不平常的燃料,它的能量密度或者发热量远高于其他气体或者液体燃料。
氢的天然存在量很少,需要工业大量合成,水煤气变换反应是工业用氢气的主要来源。
水煤气变换反应(CO+H2O==CO+H2,△H=一41.9 Kmol/mo1),在合成氨、合成甲醇等制氢工业中)是一重要的反应过程。
水煤气变换反应速度相对较慢,需高性能的催化剂使放映得以进行。
工业化的变换催化剂均是固体催化剂,如铁系高温变换催化剂、铜锌系低温变换催化剂、钴钼系耐硫宽温变换催化剂等,且均采用固定床反应器[1]。
国外对气一水溶液体系水煤气变换反应一直没有间断过研究,研究主要从两个方面进行。
一是对各种无机化合物作为催化剂反应系统的效能进行考察,另一方面是对各种贵金属有机化合物作为催化剂进行研究,无机化合物作为催化剂的反应体系适用性较好,对氧气有一定的承受能力,而金属有机化合物作为催化剂的反应体系,对氧非常敏感,几乎要求在无氧条件下进行,PPM 级的杂质氧就能使催化剂失活[2],国内在这方面的研究也在不断进行。
1 水煤气变换反应关于水煤气变换反应的反应机理,目前普遍接受的是表面氧化还原机理,可表示为[3]:H 2O(g)一H2O(S) (1)H2O(S)一OH(S)+H(S) (2) OH(S)一O(S)+H(S) (3)2H(S)一H2(g) (4)CO(g)一CO(S) (5)CO(S)+O(S)一CO(S) (6)CO2(S)一CO2(g) (7)式中,g表示气态,S表示表面吸附态。
高三化学反应原理试题精编(二)1.(2019全国Ⅰ卷)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。
回答下列问题:(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
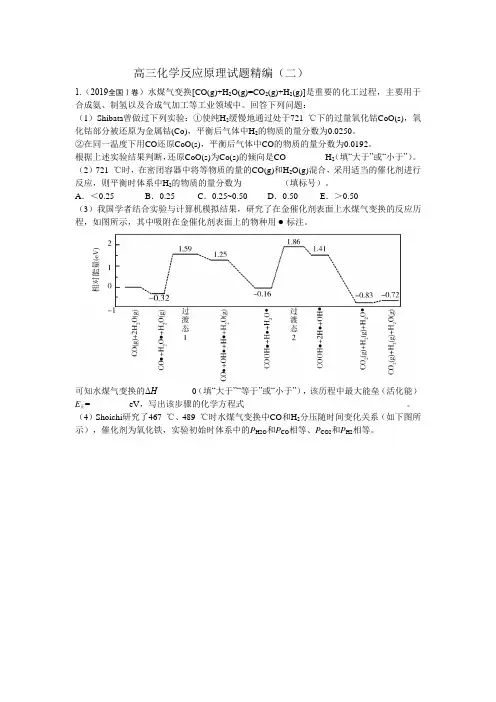
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_____________________________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的P H2O和P CO相等、P CO2和P H2相等。
计算曲线a 的反应在30~90 min 内的平均速率v (a)=___________kPa·min −1。
467 ℃时P H2和P CO 随时间变化关系的曲线分别是___________、___________。
489 ℃时P H2和P CO 随时间变化关系的曲线分别是___________、___________。


水煤气变换反应用于原位加氢研究进展胡元冲,秦 康,田 旺,侯朝鹏,李明丰(中国石化 石油化工科学研究院,北京 100083)[摘要]综述了近年来水煤气变换反应及其应用于模型化合物、馏分油、重油和油砂沥青原位加氢过程的研究进展。
重点介绍了水煤气变换反应机理、模型化合物原位加氢反应网络及动力学、原位氢与外源氢活性对比。
分析总结了原位氢活性来源、原位加氢相比传统加氢的优势。
并对水煤气变换反应用于原位加氢过程的发展前景进行了分析,未来原位加氢反应在油品加氢、重油改质方面的应用会更加广泛。
[关键词]水煤气变换;原位加氢;活化氢;重油改质[文章编号]1000-8144(2021)04-0368-06 [中图分类号]TQ 426 [文献标志码]ARecent advances on the water gas shift reaction for in -situ hydrogenationHu Yuanchong ,Qin Kang ,Tian Wang ,Hou Chaopeng ,Li Mingfeng(Sinopec Research Institute of Petroleum Processing ,Beijing 100083,China )[Abstract ]The research progress of water gas shift reaction and its application to in-situ hydrogenation of model compounds ,distillates ,heavy oils and tar sands in recent years was reviewed.The mechanism of water gas shift reaction ,the network and kinetics of in-situ hydrogenation of model compounds ,and the activity comparison between in-situ hydrogen and exogenous hydrogen were emphatically introduced.The sources of in-situ hydrogen activity and the advantages of in-situ hydrogenation over traditional hydrogenation were analyzed and summarized. The development prospect of water gas shift reaction in in-situ hydrogenation process was further analyzed that in-situ hydrogenation reaction might be more widely used in oil hydrogenation and heavy oil modification in the future.[Keywords ]water gas shift ;in-situ hydrogenation ;hydrogen activation ;heavy oil modificationDOI :10.3969/j.issn.1000-8144.2021.04.013[收稿日期]2020-12-11;[修改稿日期]2021-01-12。
2019高考真题化学原理综合题汇编(带答案)1.(2019全国Ⅰ,28)(14分)水煤气变换[CO(g)+H 2O(g)=CO 2(g)+H 2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。
回答下列问题:(1)Shibata 曾做过下列实验:①使纯H 2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H 2的物质的量分数为0.0250。
②在同一温度下用CO 还原CoO(s),平衡后气体中CO 的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H 2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H 2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H 2的物质的量分数为_________(填标号)。
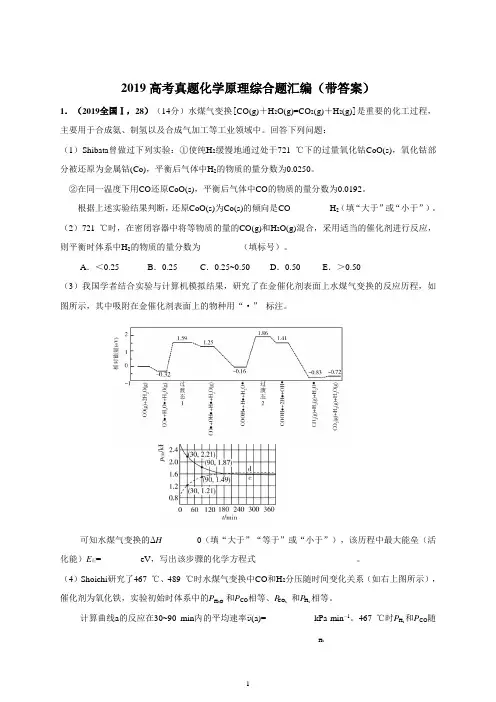
A .<0.25B .0.25C .0.25~0.50D .0.50E .>0.50(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用“·” 标注。
可知水煤气变换的ΔH ________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E 正=_________eV ,写出该步骤的化学方程式_______________________。
(4)Shoichi 研究了467 ℃、489 ℃时水煤气变换中CO 和H 2分压随时间变化关系(如右上图所示),催化剂为氧化铁,实验初始时体系中的P 和P CO 相等、P 和P 相等。
计算曲线a 的反应在30~90 min 内的平均速率v (a)=___________kPa·min −1。
467 ℃时P 和P CO 随H 2O CO2- H 2H 2H 2时间变化关系的曲线分别是___________、___________。

水煤气变换反应是一种化学反应,也称为"水煤气转化反应"。
这种反应的化学式为:
H2O + C -> CO2 + H2
这种反应的反应物是水和煤,生成物是二氧化碳和氢气。
这种反应是一种氧化反应,因为煤中的碳在反应中被氧化成二氧化碳。
这种反应可以通过加热、压缩或加入催化剂来加速。
水煤气变换反应在工业上有广泛应用,用于生产氢气和二氧化碳。
氢气可以用作工业原料,也可以用于汽车燃料。
二氧化碳则是一种常用的工业气体,广泛应用于食品加工、制药和冶金等行业。
水煤气变换反应平衡常数1.引言1.1 概述水煤气变换反应平衡常数是指在反应达到平衡状态时,反应物和生成物的浓度之比的稳定值。
水煤气变换是一种重要的工业反应,其主要产物为一氧化碳和氢气。
水煤气作为一种重要的能源来源,对于了解和掌握水煤气变换反应平衡常数具有重要的理论和实际意义。
本文将对水煤气变换反应平衡常数的定义、影响因素进行详细分析和探讨。
首先,我们将介绍反应平衡常数的定义,即通过平衡常数可以描述反应的平衡状态。
其次,我们将探讨影响水煤气变换反应平衡常数的因素,包括温度、压力、反应物浓度和催化剂等。
通过对这些影响因素的研究和分析,可以为工业生产中的水煤气变换反应的优化和控制提供理论依据和实践指导。
本文的目的在于全面了解和掌握水煤气变换反应平衡常数的相关知识,为深入研究水煤气变换反应的机理和控制提供基础。
同时,通过对未来研究方向的展望,可以为相关学者和工程师提供一定的参考和指导,推动水煤气变换反应领域的发展和进步。
在接下来的正文部分,我们将详细介绍和讨论反应平衡常数的定义以及不同因素对水煤气变换反应平衡常数的影响。
最后,我们将总结反应平衡常数的重要性,并展望未来研究的方向。
通过本文的阐述,相信读者能够全面了解水煤气变换反应平衡常数的重要性和研究的价值,为相关领域的研究和应用提供一定的参考和指导。
文章结构部分主要描述了本文的组织结构和各个章节的内容概述。
通过这样的介绍,读者可以对整篇文章有一个整体的了解,同时也方便读者快速找到所感兴趣的内容。
本文的结构如下:1. 引言1.1 概述在这一部分,我们将介绍水煤气变换反应平衡常数的背景和意义,引出本文要讨论的主题。
1.2 文章结构在这一部分,我们将简要介绍本文的组织结构。
接下来的章节将分别讨论反应平衡常数的定义和影响因素,并在结论部分总结并展望未来的研究方向。
1.3 目的在这一部分,我们将明确本文的目的,即通过对水煤气变换反应平衡常数的讨论,加深我们对这一概念的理解,并为未来的研究提供一定的参考。
一、选择题1.水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。
我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。
下列说法正确的是A.水煤气变换反应的∆H>0B.步骤③的化学方程式为:CO·+OH·+H2O(g)=COOH·+H2O·C.步骤⑤只有非极性键H-H键形成D.该历程中最大能垒(活化能)E正=1.86eV答案:B【详解】A.由示意图可知,反应物的总能量大于生成物的总能量,该反应为放热反应,△H<0,故A错误;B. 由示意图可知,步骤③为CO·、OH·、H2O(g)和H·反应生成COOH·、H2O·和H·,反应的化学方程式为:CO·+OH·+H2O(g)=COOH·+H2O·,故B正确;C.由示意图可知,步骤⑤除有非极性键H—H键形成外,还要碳氧极性键和氢氧极性键生成,故C错误;D.由示意图可知,步骤④的能垒最大,E正=1.86eV—(—0.16eV)=2.02eV,故D错误;答案选B。
2.已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,O -H为452.5,则断裂1 mol N-H所需的能量(kJ)是A.194B.316C.391D.658答案:C解析:依据图象分析,反应为N 2H 4+O 2=N 2+2H 2O ,反应的焓变△H=-534kJ/mol ,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量。
【详解】依据图象分析,反应为N 2H 4+O 2=N 2+2H 2O ,反应的焓变△H=-534kJ/mol ,反应的焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,设断裂1molN-H 键吸收的能量为x ,断裂化学键吸收的能量=2752-534=2218,形成新键释放的能量=4x+154+500=2218,解得:x=391。
水气变换反应方程式一、水气变换反应方程式是啥呢?哎呀,水气变换反应在化学里可算是个挺有趣的反应呢。
这个反应的方程式是CO + H₂O ⇌ CO₂+ H₂。
这方程式看起来简单,可里面的门道可不少哦。
二、反应的原理这个反应呀,就是一氧化碳和水反应,生成二氧化碳和氢气。
从微观角度看,一氧化碳分子里的碳原子和氧原子,跟水分子里的氢原子和氧原子重新组合,就变成了二氧化碳和氢气的分子。
就好像是一群小伙伴,本来是两个小团体,然后重新打乱组合成了另外两个小团体呢。
这个反应在很多工业过程里都特别重要,比如说在合成氨工业中,它可以调整原料气的组成,把一氧化碳转化为二氧化碳,然后就可以很方便地把二氧化碳除去啦。
三、反应条件这个反应不是随随便便就能发生得很好的哦,它需要一定的条件。
通常呢,会有催化剂的参与。
像铁铬系催化剂、铜锌系催化剂在这个反应里就很常用。
反应的温度和压力也会影响反应的进行。
一般来说,不同的催化剂对应的最佳反应温度和压力范围也不一样呢。
比如说铁铬系催化剂可能在比较高一点的温度下反应效果比较好,而铜锌系催化剂在相对低一点的温度下就很活跃啦。
就像不同的人适应不同的环境一样,这些催化剂也有自己的“舒适区”。
四、反应的实际应用在现实生活里,这个反应的应用可广泛啦。
在燃料电池领域,它可以用来为燃料电池提供氢气。
因为氢气作为燃料可是很清洁的呢,燃烧只生成水,对环境可友好了。
而且在化工生产中,它有助于优化原料的利用,提高产品的质量和产量。
就像一个小小的魔法反应,在很多地方都发挥着大作用呢。
五、反应的研究进展科学家们可没有停止对这个反应的研究哦。
他们一直在寻找更好的催化剂,想让这个反应进行得更快、更高效、更经济。
现在还有一些新的研究方向,比如说研究在不同的载体上负载催化剂,看看能不能提高催化剂的活性和稳定性。
就像是给催化剂找一个更好的“家”,让它在这个“家”里能够更好地发挥自己的作用呢。
还有就是研究如何在更低的成本下实现这个反应的大规模应用,毕竟如果能又便宜又好地实现这个反应,那对很多行业都是超级棒的事情呀。
逆水煤气变换原位红外什么是逆水煤气变换?逆水煤气变换(Reverse Water Gas Shift,RWGS)是一种化学反应,也被称为逆浓度焦煤气转换。
它是水煤气变换(Water Gas Shift,WGS)反应的反向过程。
在水煤气变换中,一氧化碳与水蒸气反应生成氢气和二氧化碳。
而在逆水煤气变换中,氢气与二氧化碳反应生成一氧化碳和水蒸气。
逆水煤气变换的化学方程式如下:CO₂+ H₂↔CO + H₂O逆水煤气变换的原位红外技术原位红外技术是一种能够在反应过程中实时监测和分析反应物、反应中间体和产物的高分辨率表征技术。
逆水煤气变换的原位红外技术通过红外光谱分析法实时监测反应物和产物的吸收光谱,以了解反应的动力学和热力学特性。
原位红外技术在逆水煤气变换中的应用步骤步骤一:实验设备和样品准备首先,建立一个实验室内的逆水煤气变换反应装置。
装置的关键部分包括一个反应器、气体供应和收集系统以及原位红外光谱仪。
样品准备包括制备所需的反应物和控制反应条件。
通常使用的反应物包括二氧化碳、氢气和适当的催化剂。
步骤二:逆水煤气变换反应的原位红外监测在逆水煤气变换反应过程中,将样品引入反应器中,通入适当比例的二氧化碳和氢气,并在一定温度下进行反应。
同时,使用原位红外光谱仪监测反应体系中的吸收光谱变化。
步骤三:数据处理和分析通过原位红外光谱仪获取到的光谱数据需要进行处理和分析。
根据反应物和产物的吸收峰的位置和强度变化,可以推测反应过程中反应物的消耗速率和产物的生成速率。
此外,还可以根据吸收峰的移动和强度的变化,推测反应体系中的物质浓度和相对浓度变化。
步骤四:结果和应用将对逆水煤气变换反应过程进行原位红外监测和分析所得到的结果与传统方法进行比较。
根据原位红外技术所提供的高分辨率动力学和热力学信息,可以更好地理解反应机理和反应路径。
此外,原位红外技术还可以用于催化剂的表征和优化,在化学工业中具有重要的应用前景。
结论逆水煤气变换是一种重要的化学反应过程,可以通过原位红外技术进行实时监测和分析。
2011-2012学年第二学期《专外与文献检索》课程考查成绩细则成绩:《专外与文献检索》课程考查低温水煤气变换反应研究进展摘要:低温水煤气变化反应由于它在许多工业过程起着重要作用,引起了研究者的极大兴趣,一直是研究领域的一个热点问题。
本文简要介绍了低温水煤气反应与起反应机理,对国内外水煤气变换反应催化剂研究进展进行概括与总结,重点陈述了负载金超微粒子催化剂的发展、催化机理、制备方法及载体的选取。
关键字:水煤气变换反应反应机理催化剂负载金催化剂低温水煤气变换反应( Water- Gas Shift Reaction, 简称WGSR) 的工业应用已有90多年历史,在以煤、石油和天然气为原料的制氢工业和合成氨工业具有广泛的应用,在合成气制醇、制烃催化过程中,低温水气变换反应通常用于甲醇重整制氢反应中大量CO 的去除,同时在环境科学甚至在民用化学方面起作用也不可忽视,如汽车尾气的处理、家用煤气降低CO的含量等。
近年来由于在燃料电池电动车上的应用,这一经典化学反应的研究再次引起国内外同行极大关注。
本文在参阅大量文献资料的基础上,简要介绍了国内外水煤气变换反应催化剂研究的进展。
1.WGSR的反应机理WGSR是一放热反应, 较低的反应温度有利于化学平衡, 但反应温度过低则会影响反应速率[1],从纯化学的角度来看,WGSR反应的正向反应是水合反应,逆向反应是一个加氢及脱水反应,对于这类反应的研究,具有一定的代表性。
CO+H2=CO2+H2△H=-41.1kJ/mol水煤气变换反应属于中等程度放热。
按照操作温度, 可分为低温水气变换反应( 180~250℃) 和中温水气变换反应( 220~350℃) 。
虽然近年来人们对WGSR 进行了广泛而深的研究, 但但鉴子各个研究者的实验手段及催化剂制备等方面的差异, 使得不同的研究者对其有着不同的看法。
截止目前, 已见报导的低变反应机理类型主要有以下四种[2]:(1)氧化还原机理H2O+M=H2+MO MO+CO=CO2+MM为铜系金属,MO为与M相对应的金属氧化物(2)三途反应机理H2O+(CO)=CO2+H2CO+(H2O)=CO2+H2CO+MO=CO2+M H2O+M=H2+MOH2O+M=H2+MO(CO)、(H2O)表示被吸附的CO、H2O,M为铜系金属,MO为与M相对应的金属氧化物。
(3)Langmuir-Hinshelwood机理CO+( )=(CO) H2O+( )=(H2O)(CO)+(H2O)=(CO2)+(H2) (CO2)=CO2+( )(H2)=H2+( )( )表示催化剂表面未被吸附活泼部位,(CO)、(H2O)、(CO2)、(H2)表示被吸附的CO、H2O、CO2、H2。
(4)甲酸型中间络合物机理CO+H2O=(H2CO2)=H2+CO2(H2CO2)表示吸附在催化剂表面且与甲酸具有相同化学计量式的中间和活化络合物。
2 .催化剂活性评价(1)催化剂活性用CO转化率表示CO 转化率( %) =( 1- Vco' /Vco)( 1+Vco') ×100%式中Vco为原料气中CO 的体积百分数, Vco' 为变换气中CO 的体积百分数。
(2)催化剂的选择性催化剂的选择性=变化气中氢气的量/原料中一氧化碳的量*100%3.WGSR反应催化剂的研究进展水煤气变换反应常常借助于催化剂而进行。
人们早期工作的着眼点, 是铁系氧化物催化剂,然而由于这一催化体系活性较底,必须在高温下进行操作,造成变换率降低, 这样就限制之中催化剂的应用,随后人们研制出以铜系氧化物为主体的变换催化剂,但这一催化剂仍存在缺陷。
进年来整体式( 构件型) 蜂窝状WGSR 催化剂与负载型催化剂引起了人们极大兴趣,尤其是负载金超微粒子催化剂[3]。
3.1铜催化剂低变反应所选用的催化剂, 是活性高而缺陷少的CuO-ZnO系催化剂其操作温度控制在150℃-250℃之间。
在这类催化剂中一般具有第三组分, 早期人们常常选用氧化铬, 但由于制备这种催化剂时, 会生成相当量的Cr+6而在催化剂使用之前的还原过程中, 可使Cr+6变成Cr+3 , 从而放出大量的热, 使催化剂烧结, 造成环境污染, 故近期人们所采用的催化剂多以CuO,ZnO,Al2O3 为主要组份。
Rothman Kama, CordeliaSelomulya[4]研究在低温水煤气变换反应催化剂Cu/ZnO中加入La以及不同La含量对催化剂稳定性与催化活性的影响,得出在催化剂加入2.3wt%La,Cu/ZnO 催化性能显著提高且优于CuO/ZnO/Al2O3催化剂。
马宇飞、张少华[5]通过简单的制备方法原位合成的Cu/α-MoC1-x,在低温200℃-300℃CO传化率达到65%以上,明显高于单纯Mo2C的催化活性,同时对催化剂样品的结构表征结果表明,铜促进了α-MoC1-x的形成,这应是其较高低温催化活性的原因。
RuiSia, Joan Raitanob等[6]研究通过不同方法制备的纳米级Cu–CeO2对低温条件下水煤气变换反应的催化性能,结果表明只有具有Cu–[Ox]–Ce的催化剂才氧化铈表面的氧空位结合,表现出较高的催化活性。
3.2 整体式( 构件型) 蜂窝状WGSR 催化剂许多相互隔离且均匀分布的直孔或曲孔的蜂窝状陶瓷或金属载体, 将催化活性组分均匀地分布在孔道的内壁, 改变了传统催化剂的形状, 从根本上克服了传统颗粒状催化剂及其采用的固定床反应器存在的局限,流动阻力小, 催化效率高, 可以实现大空速、小体积的化工强化过程, 单位反应器体积的表面积大, 反应速率快[7]。
杜霞茹,高典楠,袁中山等[8]采用微分反应器,研究了新型Re/Pt/Ce0. 8Zr0. 2O2蜂窝催化剂上低温水煤气变换反应的动力学行为。
利用非线性最小二乘法处理正交设计的实验数据,获得了动力学方程的模型参数。
得出反应速率对CO、H2O、H2和CO2的反应级数分别为0. 09、0. 88、-0. 54和-0. 11,与传统的Cu基低变催化剂上的反应级数相差较大,低温水煤气变换反应在两种催化剂上遵循不同的反应机理的结论。
3.3负载Ru、Pt超微粒催化剂朱剑,付启勇,杜玉扣等[9]制备了中孔分子筛SBA-15,以SBA-15为载体采用真空浸渍法制备了负载型Ru基水煤气变换反应的催化剂。
利用透射电子显微镜、X-射线粉末衍射等方法对样品进行了表征。
结果表明添加适量的La2O3助剂可以显著提高催化剂的低温活性,当Ru和La2O3的负载量分别为4%和8%时,催化剂对CO转化率在255℃和265℃下分别达到56%和98%。
Hajime Iida、Akira Igarashi等[10]研究催化剂Pt/TiO2低温水煤气变换反应的催化性能,采用TEM, XPS, TPD, FT-IR 等方法测定了催化剂的结构。
结果表明催化剂的催化性能受到载体与Pt相互作用的极大影响。
3.4.负载金超微粒子催化剂近几年来, 有关金催化剂的研究开发引起了人们的极大兴趣[11-13]。
负载型金催化剂的突出特点是具有较高的低温催化活性、较好的抗中毒性和稳定性,同时作为一种贵金属催化剂, 金催化剂的价格要远远低于铂和钯。
金原子位于周期表第IB 族,分子量为79,与Cu 和Ag为同族元素。
金的表面与表面分子之间的相互作用力很弱。
在单晶金的表面, 连极具反应活性的分子如氢、氧等, 都不易吸附, 然而对纳米金属负载催化剂来说,其表面的化学吸附及反应活性却随结构明显地发生变化,超微颗粒金常被负载于载体上,,大多含有几千个原子,形成粒度很小的金颗粒,这种小的颗粒很容易吸附简单分子。
但是更为重要的是当金属粒子小到一定程度以后, 金属本身的电子性质将发生变化, 从而导致其化学和物理性质出现突变。
正是由于这些性质上的突变使得高分散金催化剂的研究成为催化领域中一个新的热点。
3.4.1.负载型金催化剂的制备方法负载型金催化剂大概有浸渍法(Impregnation 简称IMP法)、共沉淀法(Coprecipitation简称CP法)、光化学沉积法(Photochemical deposition 简称PCD法)、沉积-沉淀法(简称DP法)、化学蒸发沉积法(Chemical vapor deposition 简称CVD法)、离子交换法(Ion exchange 简称IE 法)、金属有机配合物固载法(Organo-metal-complex grafting 简称OMCG法)、共溅镀法这几种制备方法[14]。
3.4.2.负载型金催化剂廖卫平,董园园,金明善等[11] 采用共沉淀法制备了不同锆铈摩尔比的Ce1-x Zr x O2(x=0, 0.1,0.3,0.5,0.7,1.0)氧化物,并以改性的浸渍法制备了金担载量1%(质量分数)的Au/Ce1-x Zr x O2催化剂.考察了催化剂在低温CO氧化和水煤气变换反应中的催化性能.应用氮物理吸附、X 射线衍射、透射电镜和H2程序升温还原等技术对氧化物载体及其负载金催化剂进行了表征。
得出ZrO2载体较大的孔径使金在载体表面分散均匀而粒子较小,与Au/CeO2和Au/Ce1-x Zr x O2相比, Au/ZrO2具有更好的低温CO氧化活性和水煤气变换活性,而Au/Ce1-x ZrxO2在高温下的水煤气变换反应中表现出更好的催化性能的结论。
李锦卫,陈崇启,林性贻,郑起[12]采用共沉淀法制备了系列Au/α-Fe2O3-MOx(M=Zr、Al、Mg、Ca、Ba)催化剂,通过N2物理吸附、XRD、H2-TPR和CO2-TPD-MS等手段对催化剂的物化性质进行表征,考察了富氢下低温水煤气变换(WGS)反应中助剂对Au/α-Fe2O3催化剂性能的影响,发现助剂ZrO2能有效提高Au/α-Fe2O3催化剂在富氢气氛下低温WGS反应活性和稳定性,反应温度150℃时CO转化率可达88. 45%,且催化剂具有较高的稳定性。
张燕杰, 詹瑛瑛等[13] 采用一种简便的水热法合成了一系列ZrO2,并采用沉积-沉淀法制得相应 1.0% Au/ZrO2催化剂, 在模拟甲醇重整气气氛下评价了它们的低温水煤气变换(WGS) 反应催化性能. 结果发现, 于150℃水热合成的ZrO2负载的Au 催化剂活性最佳,240℃反应时CO转化率达87%, 明显高于相同反应条件下Au 负载量较高的Au/Fe2O3, Au/CeO2及Au/CeZrO4催化剂。
廉红蕾,潘维成等[15] 系统考察了各种制备参数对ZnO负载的纳米金催化剂上低温水煤气变换反应性能的影响。
结果表明,不同的制备方法、沉淀剂种类、焙烧温度及金负载量均对催化剂的催化性能有较大的影响。