Bt转基因抗虫植物研究进展
- 格式:pdf
- 大小:364.98 KB
- 文档页数:4


bt基因植物抗虫原理
BT基因植物是具有抗虫性的转基因作物,也被称为农业生物技术中的一种环保、高效、安全、可持续的方法。
BT基因植物的抗虫原理是通过基因重组,在植物体内表达一种名为Bt(Bacillus thuringiensis)的细菌杀虫蛋白,从而使植物获得抵御虫害的能力。
Bt蛋白是一种天然的杀虫剂,存在于土壤中的一种细菌中。
该蛋白在昆虫肠道中发挥作用,与肠道中的酸性环境结合形成一种毒素,并刺激神经系统而导致昆虫死亡。
Bt蛋白通过转基因技术嵌入到植物基因组中,让植物在自身体内也能够合成Bt蛋白。
BT基因植物的抗虫性具有昆虫幼虫特异性,即仅对某些昆虫幼虫起作用,而对哺乳动物、鸟类、蜜蜂等有益生物无害。
这得益于Bt蛋白与昆虫肠道中一种酶的特殊相互作用,仅在昆虫肠道中发挥杀虫作用,而在其他生物体内被分解成无害的氨基酸。
BT基因植物的抗虫性对环境和人体健康具有积极作用。
传统的农业防治方法往往使用化学农药,长期使用会导致昆虫抗药性的产生以及对人类健康和土壤生态的影响。
而使用BT基因植物则可减少对环境的污染和药物残留。
此外,BT基因植物还可以提高农作物的产量和质量,在农业生产中具有广泛应用前景。
总之,BT基因植物的抗虫原理是在植物体内表达一种天然的杀虫蛋白,通过特异性相互作用仅对某些昆虫幼虫起作用,从而获得抵御虫害的
能力。
使用BT基因植物可以减少对环境和人类健康的影响,同时提高农作物的产量和质量,具有可持续农业发展的潜力。

转Bt基因作物毒素蛋白降解特性研究进展Abstract: The characteristics of Bt insecticidal proteins, soil remaining and accumulating of toxins released by transgenic Bt crops, and the impact of transgenic Bt crops on ecological environment were summarized. The degradation of Bt Protein in soil and its impacting factors were also discussed. It was suggested that the degradation of transgenic Bt crops stalks should be investigated, to degrade Bt proteins in transgenic Bt crops while degrading transgenic Bt crops stalks.Key words: transgenic Bt crops; toxins protein; soil; degradation自1983年转基因作物问世以来,转基因作物发展迅猛,全球种植面积从1996年的170万hm2增加到2009年的1.34亿hm2,翻了近80倍,累计达10亿hm2,截至2009年累计经济效益达519亿美元。2009年共有25个国家的1 400万农民种植了转基因作物,其中,美国是世界上最大的转基因作物种植国,占全世界的48%。2009年,转基因耐除草剂大豆仍然是主要的转基因作物,占全球转基因作物种植面积的52%,其次是转基因玉米(占31%)、转基因棉花(占12%)和转基因油菜(占5%)。2009年发展中国家转基因作物种植面积占世界的46%,中国居世界第六位。农业生物技术应用国际服务组织(ISAAA)预测:2015年,世界将有40个国家的2 000万农民种植转基因作物,种植面积将扩大到2亿hm2 [1]。转Bt基因作物是全球商品化程度最快的抗虫转基因作物,目前进行商业化种植的有转Bt基因玉米(Bt11、Mon810、Event176等)、棉花、马铃薯和杨树等。但转Bt基因作物大规模种植的潜在生态风险是许多科学家争论的焦点。研究表明,Bt杀虫晶体蛋白可以通过转Bt基因作物根系分泌物或作物残留等形式进入土壤生态系统,并且在土壤和环境中比较稳定,经过较长的时间后仍具有很高的活性,因此可能会对土壤微生物类群、土壤多样性以及周围生态环境产生不利影响。本研究综述了转Bt基因作物毒素蛋白的降解特性研究进展,旨在为开展Bt杀虫晶体蛋白的降解研究工作和系统评估转Bt基因作物的生态风险提供参考数据。1Bt杀虫蛋白1.1Bt杀虫蛋白的杀虫机制Bt(Bacillus thuringiensis)是一种革兰氏阳性需氧型芽孢杆菌,1901年Ishiwata首先在染病的蚕蛾中发现这种芽孢杆菌,但是没有保存下来。1909年,Berliner从德国苏云金省的地中海粉螟上重新分离到Bt,并正式定名为苏云金芽孢杆菌[2]。苏云金芽孢杆菌在其芽孢形成过程中,能产生一种杀虫晶体蛋白(Insecticidal crystal proteins)。Bt的毒素可分为内毒素和外毒素。外毒素指苏云金杆菌在生命活动过程中排出体外的代谢物,包括α-外毒素、β-外毒素、γ-外毒素、不稳定外毒素和水溶性外毒素等。内毒素又称δ-内毒素、晶体毒素或杀虫晶体蛋白。其中用于转基因植物的主要是δ-内毒素,δ-内毒素被敏感昆虫幼虫取食后,在其消化道内消化酶的作用下,蛋白被水解释放出Mr约60×103~70×103的活性毒蛋白分子(Toxin),毒蛋白与昆虫中肠上皮细胞上的特异性受体结合,并发生作用而使细胞膜穿孔。消化道细胞内的离子浓度和渗透压平衡遭破坏,使上皮细胞裂解,并导致昆虫死亡[3-8]。1.2Bt杀虫蛋白的应用1978年,Stahly等[9]确定了Bt杀虫蛋白基因的位置和可操作性。此后,各国科学家纷纷将Bt杀虫蛋白基因转入其他微生物,构建或改良可高效产生Bt杀虫晶体蛋白的工程菌株;或将其改造后转入植物体,以期获得抗虫的转基因植物。1987年,比利时的Vaeck等[10]利用农杆菌介导法将完整的Cry1Ab基因和3’端缺失后仅保留5’端编码毒蛋白核心区的不同长度的Cry1Ab基因导入烟草,获得了第一例转Bt基因的植物,同年还有3个实验室也报道了转Bt基因的烟草或番茄[4,10,11],但这些转基因植物的抗虫性都很弱,难以检测出mRNA的转录,Bt杀虫蛋白的表达量很低,主要原因是未改造的Bt基因具有原核性质不能在真核生物中高效表达。因此,为了提高Bt基因在转基因植物中的表达水平,科学家们纷纷对Bt基因进行改造或人工合成,将Bt基因的不稳定序列换成植物偏爱的密码子。Perlak等[12]在不改变Bt杀虫蛋白氨基酸序列的前提下,将CryIAb、CryIAc基因的密码子进行改造,使这两个基因在转基因棉花中的表达水平提高了近100倍,Bt杀虫蛋白的含量提高到占可溶性蛋白的0.05%~0.10%,抗虫功效明显增强。除了对Bt基因的密码子进行改造外,还可以通过使用组织特异性启动子或强启动子来提高Bt基因在转基因植物中的表达水平,从而达到抗虫的目的。随着生物技术的发展,近年来科学家们开始尝试用复合的具有非竞争性结合关系的Bt基因来转化植物,以获得对多种害虫都能产生抗性的转基因植物,Salm等[13]用分别属于CryIAb和CryIAc的活性片段构建了一个融合基因,并将其导入烟草和番茄,得到了对甜菜夜蛾、烟芽夜蛾、烟草夜蛾都有抗性的转基因植株。1.3国内转Bt基因植物研究现状国内有关转Bt基因作物的研究虽然起步较晚,但进展很快。1992年中国农业科学院生物技术研究所专家,按照高等植物偏爱密码子的原则,在保持杀虫蛋白活性中心与结构的前提下,人工全序合成了Cry1A基因,并与江苏省农业科学院合作采用花粉管通道途径将人工全序合成的Bt基因导入棉花,获得高抗棉铃虫的转Bt 抗虫棉花[14,15],使我国成为继美国之后获得拥有自主知识产权转基因抗虫棉的第二个国家。此外,中国科学院微生物所、上海植物生理研究所等单位也合成及部分改造了Cry1A基因并导入烟草、甘蓝和大豆,获得了抗虫转基因植株[16]。丁群星等[17]用子房注射法,将经修饰后Cry1Ac基因导入玉米,使玉米螟的平均死亡率达86.66%。另外,我国科学家对转Bt基因水稻的研究也较多,华中农业大学、浙江大学、中国科学院遗传与发育研究所、浙江省农业科学院等单位相继都获得了高抗虫的转Bt基因水稻,并已进行环境释放试验。但是,迄今为止我国只有转Bt基因的抗虫棉得到了商品化生产,转Bt基因抗虫玉米、水稻等粮食作物大部分还处于安全评价阶段。2009年11月27日,华中农业大学研发的转cry1Ab/cry1Ac基因抗虫水稻华恢1号和Bt汕优63获得了农业部颁发的生产应用安全证书,使转Bt基因水稻向商业化应用迈出了实质性的一步。2008年,科技部、农业部、财政部等部门联合启动了“转基因生物新品种培育科技重大专项”,专项实施的目标是获得一批具有重要应用价值和自主知识产权的基因,培育一批抗病虫、抗逆、优质、高产、高效的重大转基因生物新品种。专项的实施必将提高农业转基因生物研究和产业化整体水平,加快我国转基因作物新品种培育和商业化种植的步伐,为我国农业可持续发展提供强有力的科技支撑。2转Bt基因作物对土壤生态系统的影响转Bt基因作物的Bt杀虫蛋白可以通过根系分泌、残茬分解、秸秆还田以及花粉飘落等进入土壤生态系统,并快速紧密结合于土壤活性颗粒的表面,从而避免了被降解。研究表明,这些Bt杀虫蛋白能够在土壤中存在一段较长的时间,并且具有一定的活性,有可能对土壤的生态系统造成一定的影响。因此,最近几年转Bt基因作物对土壤生态系统的影响受到人们的广泛关注,成为转Bt基因作物安全的研究热点之一。2000年美国EPA将转Bt基因作物对土壤生态系统的影响列为转Bt基因作物风险评价的重要组成部分。2.1转Bt基因作物Bt杀虫蛋白在土壤中的残留和积累Bt杀虫蛋白在土壤中与土壤颗粒紧密结合,很难降解,并持续产生毒性[18]。1996年,Palm等[19]将转Bt基因抗虫棉的枝叶埋入5种不同微生态系统土壤中,140 d后,在其中的3种土壤中仍能检测到Bt杀虫蛋白,其含量分别为初始浓度的3%、16%和35%。1997年,James等[20]研究证实Bt杀虫蛋白可通过枯枝落叶而残留在土壤中,并进一步证明Bt杀虫蛋白可以与土壤黏粒结合,使其毒性难以降解,最长可以持续2~3个月。Saxena等[21]报道,转基因玉米Bt毒素蛋白通过根系分泌和残体降解释放到土壤中,并在土壤中残留最长可达350 d,Saxena等还研究了残留于土壤中的Bt杀虫蛋白的毒性,结果表明食用转Bt玉米分泌物的幼虫停止进食,5 d后死亡率高达95%~100%,而对照组玉米螟则未有死亡,这表明转Bt基因作物根系分泌物具有较强的Bt杀虫蛋白活性。虽然,转Bt基因作物分泌的Bt 杀虫蛋白具有较强的杀虫活性,并能够在土壤中残留一段较长的时间,但是Deepak等[22]研究表明,这些残留在土壤中的Bt杀虫蛋白不会被下一季作物吸收。因此,这些残留在土壤中的Bt杀虫蛋白并不会对下一季作物的抗虫活性产生影响。但是,农业生态系统相对简单,稳定性差,对干扰较敏感,转Bt基因作物的大面积种植导致的大量Bt杀虫蛋白进入土壤,可能会对土壤生态系统产生较大的影响[23]。2.2转Bt基因作物对土壤微生物区系的影响任馨等[24]在实验室条件下,比较了克螟稻Bt基因表达最高期秸秆和同一时期亲本稻秸秆的添加对淹水土壤可培养厌氧细菌数量和细菌群落组成的影响。结果表明,与亲本对照相比,培养初期克螟稻秸秆的添加对淹水土壤厌氧发酵性细菌、产氢产乙酸细菌、反硝化细菌和产甲烷细菌的数量产生了显著性影响,但培养后期这种显著性差异基本消失。PCR-DGGE指纹图谱和主成分分析(PCA)结果表明,两种秸秆处理土壤细菌群落组曾在培养的第三周和第五周达到显著性差异,随着培养时间的延长,两种秸秆处理土壤间细菌群落组成的差异逐渐减小,到培养的第11周,两种秸秆处理土壤间细菌群落组成的差异基本消失。王洪兴等[25]通过研究转Bt基因水稻及其亲本秸秆在降解过程中对土壤微生物主要类群的影响,发现在秸秆降解过程中,转Bt基因组细菌和放线菌数量显著低于非转基因组,而真菌数量显著高于非转基因组,转Bt基因组反硝化细菌活性显著低于非转基因组,而解磷微生物活性在各处理组之间无明显差异。但是,近年来Devare等[26]的一些研究结果显示转Bt基因作物并未给土壤生态系统造成重要影响。2004年,Devare等[26]经过半年多田间种植转Cry3Bb杀虫蛋白基因的转Bt基因玉米,并通过末端限制片段长度多态性分析评估了其根际与周围的土壤微生物数量、活跃度(包括土壤氮素矿化量、短期土壤消化作用、土壤呼吸作用)和细菌群落结构,发现同时期转Bt基因玉米根际与周围的土壤中,上述指标均不存在显著性差异,转Bt基因玉米未给土壤微生物数量、活跃度及细菌群落生态带来重要影响。2007年,Devare等[27]报道,经过3年的田间种植转Cry3Bb玉米,并通过测定种植3年转Cry3Bb玉米每年3个时期(作物种植前、开花期、收获期)收集的大批土壤样本的土壤微生物数量、活跃度数据,发现转Bt玉米对土壤微生物数量和活跃度的影响,呈现出明显的周期性变化。与其2004年报道的试验结论一致,转Bt基因玉米未给土壤生态系统带来重要影响。但是,目前对土壤中转Bt 杀虫蛋白的生态效应研究明显不足,评价的物种单一,周期短,对土壤中敏感微生物的研究仅局限在土壤微生物不到1%的可人工培养的种类上,尚未有对土壤微生物群落、生物多样性及功能的长期定位研究。我国在这方面的研究仍未引起足够的重视,而且研究方法和手段也比较落后。随着人们安全性意识的不断加强,必将增加这方面的研究投入,从而促进转基因生物产业的健康发展。2.3转Bt基因作物对土壤动物和植物的影响在种植过转Bt基因玉米或者加入其秸秆120~180 d后的土壤上,无论种植非转基因玉米、胡萝卜、萝卜或甘蓝,在这些后茬作物组织中用ELISA检测或幼虫生测均未检测到Bt杀虫蛋白,但是其土壤中仍有活性的Bt杀虫蛋白,表明土壤中已经存在的Bt杀虫蛋白不会被后茬非转基因作物吸收和利用[22],不会对这些非转基因作物的生长和特性产生影响。将蚯蚓培养在被Bt杀虫蛋白污染的土壤中45 d 后,其肠道内容物和粪便中均能检测到Bt杀虫蛋白,但这些Bt杀虫蛋白对蚯蚓种群的数量和生长状况没有影响,将蚯蚓转移到不含Bt杀虫蛋白的新鲜无污染土壤中培养2~3 d后,其肠道内容物中的Bt杀虫蛋白消失[28],表明结合态Bt杀虫蛋白不会影响蚯蚓的正常生长。3转Bt基因作物Bt杀虫蛋白在土壤中降解的影响因素目前,关于Bt杀虫蛋白在土壤中降解时间的报道差异较大,可能是因为土壤中Bt杀虫蛋白的降解受到多种因素的影响,其中主要因素可能是土壤微生物、土壤湿度、酸碱度、黏粒组成及含量。3.1土壤生物对Bt杀虫蛋白在土壤中降解的影响土壤生物是Bt杀虫蛋白在土壤中发生失活或降解的主要作用因子之一,尤其是土壤微生物,它是影响Bt杀虫蛋白在土壤中降解的最关键因子。Palm等[19]研究发现,在种植转Bt基因棉花的土壤中,Bt杀虫蛋白的量在前14 d快速下降,然后下降趋势逐渐减慢。而土壤经γ射线处理后,其中的Bt杀虫蛋白降解速度明显减慢。白耀宇等[29]研究发现,在前6 d内KMD2叶片冻干粉Cry1Ab蛋白的降解速度相当快,这与Palm等[19]的研究结果较为相似,推测其快速降解的主要原因是Cry1Ab杀虫蛋白在自由状态下被土壤微生物作为一种碳源或氮源分解利用。土壤微生物的数量及其生物活性与土壤的类型密切相关,通常有机质含量高的土壤中微生物数量多,土壤中的Bt杀虫蛋白易被土壤中的微生物降解;同时,一般情况下土壤pH值较高则土壤微生物活性也较高,有利于Bt杀虫蛋白的降解。另外,土壤生态环境中的昆虫也能消耗一些Bt杀虫蛋白,即土壤中的Bt杀虫蛋白进入昆虫(包括靶标害虫和非靶标昆虫)体内被降解。3.2土壤湿度对Bt杀虫蛋白在土壤中降解的影响土壤湿度是影响Bt杀虫蛋白在土壤中降解速度的主要因素之一[30]。白耀宇等[29]研究表明,土壤淹水可显著促进Cry1Ab的降解,且淹水后Cry1Ab的降解动态在不同土壤之间十分相似,但是淹水对Cry1Ab降解的促进作用仅发生在前12 d 之内,此后多数时间内淹水与非淹水处理间Cry1Ab的降解无显著差异。3.3土壤酸碱度对Bt杀虫蛋白在土壤中降解的影响土壤酸碱度对土壤中Bt杀虫蛋白的降解也有一定的影响,土壤pH值较高,则土壤中Bt杀虫蛋白降解较快,而土壤pH值较低,则不利于Bt杀虫蛋白的降解。首先,土壤中微生物活性受到土壤酸碱度的影响。一般情况下,土壤pH值高,则土壤微生物活性就大,微生物分解Bt杀虫蛋白的能力就强,致使大多数的Bt杀虫蛋白被微生物降解。在pH值为中性的土壤中,利用生物测定法检测Bt杀虫蛋白的活性,结果表明转Bt棉花和玉米中的Bt杀虫蛋白的活性很快被降解,而pH值较低的土壤则不利于微生物对Bt杀虫蛋白的降解[31]。其次,土壤中具有表面活性的微粒对Bt杀虫蛋白的吸附能力也受到土壤酸碱度的影响。pH值在4.4~10.0时,蒙脱石和高岭石对Bt杀虫蛋白的吸附量都随pH值的升高而呈线性降低,由于游离态的Bt 杀虫蛋白更容易降解,因此Bt杀虫蛋白的降解率随pH值的升高而呈线性升高[32]。Tapp等[33]报道Btk和Bt杀虫蛋白与土壤黏土矿物的吸附在pH值为6时达到最大值,因为Bt杀虫蛋白的等电点在5.5左右。当土壤的pH值接近杀虫蛋白的等电点时,中性杀虫蛋白所受的斥力最小,致使杀虫蛋白与土壤表面有最大的接触机会,从而提高杀虫蛋白与土壤颗粒的吸附力。结合到高岭石的杀虫蛋白可被ddH2O解吸,而结合在蒙脱石上的Bt杀虫蛋白只能被0.2%的Tris缓冲液解吸。另外,Bt杀虫蛋白在自然含有或人为加入高岭石的土壤中的杀虫活性比自然含有或人为加入蒙脱石的土壤高,且持续的时间长,其主要原因就是含蒙脱石的土壤pH 值高,细菌活性强[34]。3.4土壤黏粒对Bt杀虫蛋白在土壤中降解的影响土壤中黏粒的含量和组分也在很大程度上影响Bt杀虫蛋白的降解。Stotzky等[35]研究发现,土柱中Bt蛋白含量随着黏粒浓度的升高而降低。Donegan等[36]研究发现在沙壤土和黏壤土中,转Cry1Ab基因棉花叶片和茎秆分解释放杀虫蛋白的高活性状态可分别持续28 d和40 d,这是因为黏壤土中含有更多的土壤活性颗粒,而土壤中的沙粒和泥沙粒由于不具有表面活性的缘故,则不能吸附毒素。而进一步的研究证实,Bt杀虫蛋白与土壤黏粒的结合,大大减少了其在土壤中的降解。此外,光照(特别是紫外线)、气候和转Bt基因作物的品种类型、Bt杀虫蛋白浓度也影响其在土壤中的降解速率。4展望目前的研究表明,转Bt基因作物通过各种形式向土壤生态系统中释放Bt杀虫蛋白。位于地表的Bt杀虫蛋白,可以很容易被光降解,而土壤中的Bt杀虫蛋白可以与土壤中具有表面活性的颗粒吸附并紧密结合,从而延缓了土壤微生物对Bt杀虫蛋白的降解,致使大量的Bt杀虫蛋白在土壤中长期滞留甚至富集。由于Bt杀虫蛋白与土壤颗粒结合后其蛋白结构并没有发生改变,依然保持较高的活性,因此,Bt 杀虫蛋白在土壤中的残留和富集可能会对土壤中非靶标生物造成不良影响,从而影响土壤生态系统的平衡。转基因植物在进入田间释放和商业化应用的过程中应该开展土壤生态学影响的研究和监测,相对而言,发达国家在这方面已开展了不少工作,但由于研究方法和试验条件的限制,许多问题仍未弄清。转Bt基因作物环境影响的研究是一个长期而复杂的过程,因此,需要从不同的角度开展系统的研究工作,为全面评价转Bt基因作物释放Bt杀虫蛋白可能引起的生态环境风险提供理论依据。大面积种植转Bt基因作物后,会产生大量的含有Bt杀虫蛋白的植物秸秆,这些秸秆如果“秸秆还田”则使秸秆中含有的Bt杀虫蛋白进入土壤生态系统,造成Bt 杀虫蛋白在土壤中的累积,从而影响土壤生态系统的平衡。因此,我们需要对转Bt 基因作物秸秆的处置和综合利用进行研究,开发转Bt基因作物秸秆处置新技术,在利用秸秆的同时降解秸秆中的Bt杀虫蛋白,从而大大降低进入土壤生态系统的Bt杀虫蛋白。秸秆是一种非常丰富的生物质能源,被广泛地应用于生产生活的各个领域,例如利用植物纤维开发生物燃料,通过微生物处理生产生物肥料、生物饲料,利用植物纤维进行造纸等。在利用转Bt基因作物秸秆生产沼气、生物肥料的过程中,需要对秸秆中Bt杀虫蛋白的降解情况进行研究和监测,争取通过对生产技术的改进(比如加入特定的微生物和酶)来提高秸秆中Bt杀虫蛋白的降解速度,从而从根本上消除Bt杀虫蛋白对生态系统的潜在影响。本实验室经过一段时间的研究,从转Bt基因水稻种植田筛选出了一种能够降解Bt杀虫蛋白的细菌,在实验室条件下,4 d内该细菌能够降解转Bt基因水稻秸秆中90%以上的Bt杀虫蛋白,这对于利用转Bt基因作物秸秆生产生物肥料、沼气过程中,降解秸秆中的Bt杀虫蛋白,彻底消除Bt杀虫蛋白对生态系统的潜在影响,具有非常高的应用价值。参考文献:[1] JAMES C. 2009年全球生物技术/转基因作物商业化发展态势——第一个十四年1996~2009[J].中国生物工程杂志,2010,30(2):1-22.[2] SCHNEPF E, CRICKMORE N, V AN RIE J, et al. Bacillus thuringiensis and its pesticidal crystal proteins [J]. Microbiology and Molecular Biology Reviews,1998,62(3):775-806.[3] ALSTAD D N, ANDOW D A. Managing the evolution of insect resistance to transgenic plants[J]. Science,1995,268(5219):1894-1896.[4] BARTON K A, WHITELEY H R, YANG N S. Bacillus thuringiensis δ-endotoxin expressed in transgenic nicotiana tabacum provides resistance to lepidopteran insects[J]. Plant Physiology,1987,85(4):1103-1109.[5] CUMMINGS C E, ARMSTRONG G, HODGMAN T C, et al. Structural and function studies of a synthetic peptide mimicking a proposed membrance inserting region of a Bacillus thu ringiensis δ-endotoxin[J]. Mol Memb Biol,1994,11(2):87-92.[6] FERRE J, ESCRICHE B, BEL Y, et al. Biochemistry and genetics of insect resistance to Bacillus thuringiensis insecticidal crystal proteins[J]. FEMS Microbiology Letters,1995,132(1-2):1-7.[7] KOZIEL M G, CAROZZI N B, CURRIER T C, et al. The insecticidal crystal proteins of Bacillus thuringiensis: past, present and future uses[J]. Biotechnology & Genetic Engineering Reviews,1993,11:171-228.[8] 贾士荣,郭三堆,安道昌. 转基因棉花[M]. 北京:科学出版社,2001. 15-29.[9] STAHLY D P, DINGMAN D W, BULLA LA JR, et al. Possible origin and function of the parasporal crystal in Bacillus thuringiensis[J]. Biochemical and Biophysical Research Communications,1978,84(3):581-588.[10] V AECK M, REYNANERTS A, HOFTE H, et al. Transgenic plants protected from insect attack[J]. Nature,1987,328:33-37.[11] ADANG M L, STA VER M J, ROCKELEAU T A, et al. Characterized full-length and truncated plasmid clones of the crystal protein of Bacillus thuringiensis subsp. Kurstaki HD-73 and their toxicity to Manduca sexta[J]. Gene,1985,36(3):289-300.[12] PERLAK F J, FUCHS R L, DEAN D A, et al. Modification of the coding sequence enhances plant expression of insect control protein genes[J]. Proc Natl Acad Sci,1991,88(8):3324-3328.[13] PERLAK F J,STONE T B,MUSKOPF Y M, et al. Genetically improved potatoes: protection from damage by Colorado potato beetles [J]. Plant Mol Biol,1993,22(2):313-321.[14] PALM C J, Schaller D L, Donegan K K,et al. Persistence in soil of transgenic plant pro duced Bacillus thuringiensis var. kurstaki δ-endotoxin[J]. Canadian Journal of Microbiology, 1996,42(2):1258-1262.[15] 倪万潮,张震林,郭三堆. 转基因抗虫棉的培育[J]. 中国农业科学,1998,31(2):8-13.[16] 田颖川,秦晓峰,许丙寅,等. 表达苏云金杆菌δ-内毒素基因的转基因烟草的抗虫性[J]. 生物工程学报,1991,7(1):1-10.[17] 丁群星,谢友菊,戴景瑞,等. 用子房注射法将Bt毒蛋白基因导入玉米的研究[J]. 中国科学(B辑),1993,23(7):707-713.[18] MAYENC A N, GLEICH G L. Eosinophilia-myalgia syndrome and tryptophan production: a cautionary tale[J]. Trends in Biotechnology,1994,12(9):346-352.[19] PALM C J,SEIDLER R J,SCHALLER D L,et al. Persistence in soil of transgenic plant produced Bacillus thuringiensis var. kurstaki delta-endotoxin[J]. Canadian Journal of Microbiology, 1996,42(12):1258-1262.[20] JAMES R R. Utilizing a social ethic toward the environment in assessing genetically engineered insect-resistance in trees[J]. Agriculture and Human Values,1997,14(3):237-249.[21] SAXENA D, FLOREST S, STOTZKY G. Insecticidal toxin in root exudates from Bt corn [J]. Nature,1999,402(6761):480.[22] SAXENA D, STOTZKY G. Bt toxin uptake from soil by plants[J]. Nat Biotechnol,2001,19:199.[23] ANGLE J S. Release of transgenic plants: biodiversity and population-level considerations[J]. Mol Ecol,1994,3(1):45-50.[24] 任馨,吴伟祥,叶庆富,等. 转Bt基因克螟稻秸秆对淹水土壤细菌菌落的影响[J]. 环境科学学报,2004,24(5):871-877.[25] 王洪兴,陈欣,唐建军,等. 转Bt基因水稻秸秆降解对土壤微生物可培养类群的影响[J].生态学报,2004,24(1):89-94.[26] DEV ARE M H, JONES C M, THIES J E. Effect of Cry3Bb transgenic cornand tefluthrin on the soil microbial community: biomass, activity, and diversity[J]. J Environ Qual,2004,33(3): 837-843.[27] DEV ARE M, LONDONO-R L M,THIES J E. Neither transgenic Bt maize (MON863) nor tefluthrin insecticide adversely affect soil microbial activity and biomass: A 3-year field analysis[J]. Soil Biology and Biochemistry,2007,39(8):2038-2047.[28] SAXENA D, STOTZKY G. Bacillus thuringiensis (Bt) toxin released from root exudates and biomass of Bt corn has no apparent effect on earthworms, nematodes, protozoa, bacteria, and fungi in soil[J]. Soil Biol Biochem,2001,33(9): 1225-1230.[29] 白耀宇,蒋明星,程家安,等. 转Bt基因水稻Cry1Ab杀虫蛋白在水稻土中的降解[J]. 中国水稻科学,2004,18(3):255-261.[30] SIMS S R, HOLDEN L R. Insect Bioassay for determining soil degradation of Bicillus thuringiensis subsp. Kurstaki cry1A(b) protein in corn tissue[J]. Environ Entomol,1996, 25(3):659-664.[31] TREVORS J T, KYIKMAN P, WA TSON B. Transgenic plants and biochemical cycles [J]. Molecular Ecology,1994,3(1):57-64.[32] STOTZKY G. Persistence and biological activity in soil of insecticidal proteins from Bacillus thuringiensis and of bacterial DNA bound on clays and humic acids[J]. J Environ Qual,2000,29(3):691-705.[33] TAPP H, CALAMAI L, STOTZKY G. Adsorption and binding of the insecticidal proteins from Bacillus thuringiensis subsp. Kurstaki and subsp. tenebrionis on clay minerals [J]. Soil Biol Biochem,1994,26(6):663-679.[34] 刘玉荣,付庆灵,粱巍,等. 转Bt基因作物毒素在土壤中降解特性的研究进展[J]. 湖北农业科学,2006,45(3):377-381.[35] SAXENA D, FLORES S, STOTZKY G. Vertical movement in soil of insecticidal Cry1Ab protein from Bacillus thuringiensis [J]. Soil Biol Biochem,2002,34(1):111-120.[36] DONEGAN K K,PALM C J, FIELAND V J, et al. Changes in levels, species and DNA fingerprints of soil microorganisms associated with cotton expressing the Bacillus thuringiensis var. kurstai endotoxin [J]. Appl Soil Ecol,1995, 2(2):111-124.。

西北农业学报 1998,7(4):1~3Acta Agricultur ae Bo r ea li-occidentalis SinicaBt杀虫蛋白基因导入新疆棉花获得抗虫转基因植株孙 严1 倪万潮2 郭三堆3(1新疆农科院核技术生物技术研究所 乌鲁木齐 830000;2 江苏农科院经济作物研究所 南京 210014;3 中国农科院生物技术研究中心 北京 100081)摘 要 通过花粉管通道法将人工全序合成的Bt杀虫蛋白基因导入新陆早4号和C6524两品种中,收获注射过Bt杀虫蛋白基因的棉花种子2万余粒。
经棉铃虫饲喂的抗虫性生物检测,得到高抗虫的18株新陆早4号转化苗和36株C6524转化苗;以Bt基因的一对引物进行PCR分析,54株抗棉铃虫的转化棉苗均扩增出部分Bt杀虫蛋白基因的目标带。
未转化的对照棉苗则无此条带,证实Bt杀虫蛋白基因已整合到转化抗虫棉株的染色体上,首次获得了新疆转目的基因的高效抗虫棉。
关键词 棉花;Bt杀虫蛋白基因;棉铃虫;花粉管通道法棉铃虫(Helicoverpa armigera)是我国棉花生产的重要致灾害虫,可使棉花损失15%~20%。
每年用于棉花害虫防治的杀虫剂量占杀虫剂使用总量的一半,致使主要棉花害虫抗药性快速增长,防效下降,严重制约了棉花生产的持续稳定发展。
生物技术的发展使不同物种间基因转移得以实现,将Bt (Bacillus thuringiensis)杀虫蛋白基因导入棉花,培育抗虫转基因棉花新品种,是解决棉花受棉铃虫危害的一条重要途径。
1990年Perlak[1]、1991年谢道昕[2]相继报道已将Bt毒蛋白基因导入棉花,但却难以达到控制棉铃虫的水平。
美国M onsanto公司对Bt毒蛋白基因结构进行了改造,使其适应于在植物体内的表达,Bt蛋白的表达量因而提高了100倍[3],具备了实用价值。
本研究采用花粉管通道法,拟将中国农科院生物技术研究中心按照高等植物优选密码子原则人工全序合成的Bt杀虫蛋白基因,导入新疆棉花栽培品种,以期获得抗棉铃虫的转基因棉花新种质。

bt转基因棉花抗虫原理BT转基因棉花是目前世界上主流的转基因棉花品种之一,这种棉花经过基因工程改造,具有抗虫功能,可以防治棉铃虫和蓟马等害虫,从而提高棉花产量和质量。
但是,很多人对BT转基因棉花的作用原理却不是很了解,本文将深入讲解BT转基因棉花抗虫原理。
一、BT转基因棉花的简介BT转基因棉花是在一种名为Bacillus thuringiensis (BT)的细菌中,抽取了其一种自然的杀虫毒素基因,通过基因重组技术,将其植入到棉花的基因组中,从而使棉花本身具有抗虫功能。
这种转基因棉花品种在全球已经成功商业化,我国也引进了BT转基因棉花,成为了我国目前面积最大、抗虫效果最好的转基因棉花品种之一。
二、BT杀虫毒素作用原理BT杀虫毒素是细菌毒素的一种,其不同毒素对不同昆虫有不同的杀虫作用谱。
BT杀虫毒素的作用机制是,杀虫毒素中有一段富含降解成分的蛋白质,被吞噬后到达昆虫肠道,这些蛋白质会被肠道中的酸性环境分解成毒素刺激肠道上皮细胞,出现孔道,让肠道内细菌和毒素进入体腔,对昆虫造成中毒致死。
三、BT转基因棉花的抗虫机制BT转基因棉花具有抗虫功能的原理与BT杀虫毒素的作用机制有关。
转基因棉花植株含有BT杀虫毒素基因,能够在棉花生长中不断表达BT毒素;当害虫食用棉花,BT毒素会被肠道吸收并作用在其肠道细胞中,从而导致害虫死亡。
BT转基因棉花的抗虫机制与传统农药不同,传统农药主要是通过亲触或进食中毒方式杀虫,而BT转基因棉花是通过害虫食用棉花植株,再被BT毒素杀死,因此其对害虫的杀伤作用更直接、更高效。
同时,BT杀虫毒素作用机制是非常特异的,能够有针对性地对棉铃虫和蓟马等害虫进行杀伤,而对其他昆虫和人类则无任何影响,因此在使用BT转基因棉花时,无需担心对环境和人体安全产生危害。
四、BT转基因棉花的优势相比于传统的防治方法,BT转基因棉花能够降低农民使用农药的成本,避免对人体、环境以及耕地、农畜产品的污染;同时,其抗虫效果也更加持久,可以避免害虫的反复孳生和进化,保证棉花产量和质量稳定。


转Bt基因抗虫棉后期病虫发生新特点及防治技术摘要介绍了转Bt基因抗虫棉后期病虫发生的新特点及防治技术。
关键词转Bt基因抗虫棉;特点;防治大丰市是江苏沿海主要产棉区,棉花种植历史长,植棉水平高,常年种植面积在1.5万hm2左右。
为了扼制棉铃虫的肆虐,20世纪末该市开始引进试种转Bt基因抗虫棉,由于其良好的抗虫性,以及简便的栽培手段和较好的丰产性,种植面积逐年扩大。
但近年来逐步暴露出种植转Bt基因抗虫棉病虫发生出现了一些新的特点,给防治上提出了新的要求。
为此,笔者对近年来转Bt基因抗虫棉后期病虫发生特点进行了总结分析,并对后期病虫防治技术提出了意见。
1Bt抗虫棉后期病虫发生特点1.1棉盲蝽上升为棉花后期的重点防控对象大面积种植转Bt基因抗虫棉后,棉盲蝽已急剧上升为棉田第一大害虫。
2001~2007年有5年棉盲蝽达偏重以上发生水平,后期重发田百株残虫数在100头以上,小铃被害率高达40%,对产量影响明显。
其原因是种植转基因抗虫棉后棉铃虫等鳞翅目害虫发生程度急剧下降,棉田内针对棉铃虫用药量大幅度降低,从而对棉盲蝽的兼治效果削弱;寄主增多,食源充足。
近年来,随着产业结构调整,盲蝽喜食作物如苜蓿、棉花、蔬菜、果树等种植面积不断扩大,为棉盲蝽提供了充足的食源和越冬场所;忽视对棉田外寄主的治,导致虫源增殖系数高。
1.2棉铃虫、玉米螟、红铃虫等鳞翅目害虫为害明显减轻四代棉铃虫、三代玉米螟过去一直是大丰市棉花后期主要害虫,发生期从8月中下旬持续到9月上中旬,此时正值棉花结铃期,为害性极大,造成棉花蛀杆、蛀铃,盖顶桃很难安全成铃,以1997年为例,四代棉铃虫百株累计卵1758.7粒,百株蛾量4550头,高峰期百株虫230头,铃害率24.5%;玉米螟百株卵量20.2块,蛀杆率5.3%,铃害率8.2%,仅这2种害虫对棉花的为害,平均每株棉花有3.2个棉铃被蛀食。
2000年以来,转基因抗虫棉在大丰市种植面积不断扩大,对控制后期棉铃虫、玉米螟等鳞翅目害虫的作用十分明显,红铃虫几乎绝迹。

Bt基因及其在抗鞘翅目害虫上的应用Bt基因是一种重要的农业遗传工程技术,它可以用于抵抗鞘翅目害虫。
在这篇文章中,我们将介绍Bt基因及其在抗鞘翅目害虫上的应用。
Bt基因是一种来自于土壤中孢子杆菌(Bacillus thuringiensis,简称Bt)的一种基因,这种基因可以生产一种特殊的蛋白质,被称为Bt毒素,它在作物中产生并能杀死鞘翅目害虫。
Bt毒素是一种对鞘翅目害虫具有高度毒力的蛋白质,它能够扰乱害虫的肠道功能,最终导致害虫死亡。
Bt基因已经被成功地应用于一些作物的改良中,例如玉米、棉花和马铃薯等。
在这些转基因作物中,Bt基因被转入植物细胞中,使得作物能够在自身生长的过程中产生Bt毒素,这样一来,作物便能够抵抗鞘翅目害虫的侵害。
Bt基因在抗鞘翅目害虫上的应用,不仅可以降低农药使用量,减少环境污染,还可以提高作物的产量和质量。
由于Bt基因可以在植物自身产生杀虫蛋白,因此转基因作物在抗虫方面有着显著的优势。
在Bt棉花和Bt玉米等作物上,害虫对农药的抗药性逐渐增强,而对Bt毒素的抗性较少,这使得Bt转基因作物在抗虫的效果上更为持久和可靠。
除了在作物上应用Bt基因,Bt基因也可以通过其他方式应用于抗鞘翅目害虫。
研究人员可以利用Bt基因制备Bt剂,然后喷洒到作物上,用于防治害虫。
还可以利用Bt基因改良农作物的亲本,培育出具有抗虫性状的新品种,以此来减少对化学农药的依赖,提高农业生产的可持续性。
尽管Bt基因对抗鞘翅目害虫有很好的效果,但其应用也存在一些问题。
Bt基因可能对非靶标昆虫和其他生物造成影响,因此需要谨慎使用。
害虫可能产生对Bt毒素的抗性,这就需要不断地研发新的Bt毒素和改良Bt基因的技术,以应对害虫的抗性。
Bt基因在抗鞘翅目害虫上的应用具有重要的意义,它不仅可以减少农药使用,降低环境污染,还可以提高作物的产量和质量。
在应用Bt基因的也需要充分了解其潜在的风险,并不断进行技术改良和监测,以确保其安全和有效地应用于农业生产中。
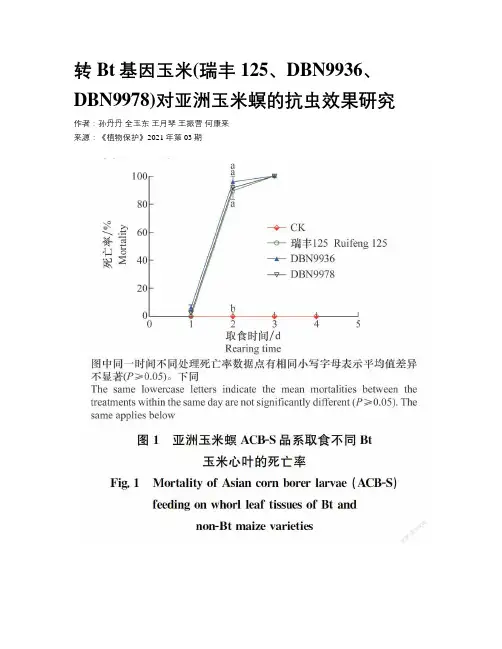
转Bt基因玉米(瑞丰125、DBN9936、DBN9978)对亚洲玉米螟的抗虫效果研究作者:孙丹丹全玉东王月琴王振营何康来来源:《植物保护》2021年第03期摘要:評价转Bt基因玉米对靶标生物亚洲玉米螟的杀虫作用是转基因玉米研发的重要一环。
本文采用室内生测法对3种转Bt基因抗虫玉米‘瑞丰125’(表达Cry1Ab/Cry2Aj杀虫蛋白),‘DBN9936’‘DBN9978’(表达Cry1Ab杀虫蛋白)对亚洲玉米螟敏感品系ACB-S及抗Cry1Ab品系ACB-AbR、抗Cry1Ac品系ACB-AcR、抗Cry1F品系ACB-FR、抗Cry1Ah品系ACB-AhR、抗Cry1Ie品系ACB-IeR的杀虫活性进行测定,同时采用心叶期和抽丝期人工接虫法进行田间抗虫效果鉴定。
结果表明,取食3种Bt玉米的ACB-S幼虫, 3 d死亡率100%,而取食对照常规玉米3 d存活率100%。
取食3种Bt玉米的5个抗性品系幼虫除ACB-AbR和ACB-AcR有2%~6%的个体存活4~5 d, 6 d死亡率也达到了100%,其余品系均在3 d全部死亡,而取食对照玉米5~6 d的死亡率仅为4%~14%,差异显著。
田间心叶期食叶级别及穗期活虫数、雌穗被害和茎秆被蛀等为害等级说明3种Bt玉米高抗亚洲玉米螟。
明确了‘瑞丰125’‘DBN9936’和‘DBN9978’对亚洲玉米螟有很高的杀虫活性和田间防治效果。
5个Bt蛋白抗性亚洲玉米螟品系幼虫在常规玉米上显示一定的适合度劣势。
关键词:转基因玉米; Bt杀虫蛋白; 亚洲玉米螟; 寄主抗性中图分类号:S 435.132文献标识码: ADOI: 10.16688/j.zwbh.2020008Resistance of transgenic Bt maize (Ruifeng 125, DBN9936 & DBN9978) toAsian corn borerSUN Dandan, QUAN Yudong, WANG Yueqin, WANG Zhenying, HE Kanglai*(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,Chinese Academy of Agricultural Sciences, Beijing 100193, China)AbstractEvaluation for resistance to the targets such as Asian corn borer (ACB), Ostrinia furnacalis, is an important step of research and development novel insect resistant transgenic Bt maize. In present research, three kinds of insect resistant transgenic Bt maize,i.e. ‘Ruifeng 125’ expressing Cry1Ab/Cry2Aj protein,‘DBN9936’ and ‘DBN9978’ expressing Cry1Ab protein, were evaluated in the laboratory and field. Laboratory bioassays were conducted by exposing neonates of ACB susceptible strain (ACB-S), Cry1Ab resistant strain (ACB-AbR), Cry1Ac resistant strain (ACB-AcR), Cry1F resistant strain (ACB-FR), Cry1Ah resistant strain (ACB-AhR), and Cry1Ie resistant strain (ACB-IeR) to fresh whorl leaves, respectively. Field trials were conducted by artificial infestation of ACB at whorl and silking stages. Mortalities were 100% within 3 days when ACB-S larvae fed on three Bt maize leaf tissues, whereas all larvae survived when they fed on the control of conventional maize leaf tissues. When ACB-AbR and ACB-AcR larvae fed on three Bt maize leaf tissues, 2%-6% of larvae could survival for 4-5 days, but not longer than six days. In contrast, there were 4%-14% of larval mortalities when these larvae fed on control within six days. Leaf feeding ratings from whorl stage infestation, larval survivals and ear and stalk bored and tunnels indicated that three Bt maize varieties were highly resistant to ACB. In conclusion,Bt maize ‘Ruifeng 125’ ‘DBN9936’ and ‘DBN9978’ are highly toxic to ACB and could provide season-long protection against ACB. Laboratory selected Cry1Ab, Cry1Ac, Cry1Ah,Cry1F, and Cry1Ie resistant strains demonstrate certain fitness cost.Key wordstransgenic maize; Bt insecticidal protein; Ostrinia furnacalis; host plant resistance转Bt基因玉米因具有特定且高效的目标性状而受到种植者的欢迎[13]。

摘要棉铃虫(Helicoverpa armigera)是棉花生长过程中的主要害虫,从苗期到吐絮期整个生育期均能造成危害。
在过去的20多年中,转Bt基因抗虫棉的出现和应用有效限制了棉铃虫危害并减少了化学农药制剂的使用,为国家带来了显著的社会效益与经济效益,因此选育高抗、高产、优质抗虫棉逐渐成为棉花育种工作的重点。
随着抗虫棉的应用,人们发现随着世代的增加抗虫棉存在着抗虫性减弱的现象,不利于抗虫棉应用的同时,也不利于转基因抗虫棉品种的选育。
本研究用两种不同遗传背景的转Bt基因抗虫棉品种杂交构建遗传群体,并以F2和F2:3代材料调查了群体的抗虫表现并对结果进行分析,为Bt抗虫棉育种提供帮助。
同时探究抗虫棉抗虫性与相关产量品质性状的关系,为选育高抗优质品种提供理论依据。
主要研究结果如下:1.对所构建抗虫杂交棉遗传群体F2代进行Bt基因检测,结果发现Bt基因在遗传时出现缺失现象,卡那霉素检测与PCR检测结果并非完全相同,并经过综合筛选构建F2:3代群体。
2.对所构建抗虫杂交棉遗传群体F2:3代进行室内生物抗虫测定,结果发现群体抗虫性出现分离现象,并根据棉铃虫幼虫死亡率评级,其中73份材料抗性级别为“高抗”,86份材料抗性级别为 “抗”,8份材料抗性级别为“低抗”,6份材料抗性级别为“感”。
3.在棉花苗期、蕾期、铃期对抗虫棉杂交F2:3代群体棉花叶片、棉蕾和棉铃的Bt蛋白表达量进行检测,结果表明不同材料的Bt蛋白表达量均无相关性并存在时空表达差异,总体上时间差异表达结果为:蕾期>苗期>铃期;空间差异表达结果为:营养器官>生殖器官。
4.幼虫死亡率与蕾期叶片Bt蛋白呈现极显著正相关关系,结果显示Bt蛋白表达量越高,抗虫棉的杀虫性越高抗虫性越好。
育种上可以根据Bt蛋白表达量水平来判断抗虫棉品种的抗虫性。
5.分析了本试验遗传群体F2:3代Bt蛋白与纤维品质性状的相关性,结果表明Bt蛋白并不影响棉花纤维品质。
同时结合抗虫性与品质性状对F2:3代群体进行筛选,得到L-76与L-78两份高抗、高产、优质性状材料。

转基因抗虫棉的研究历程与展望转基因抗虫棉是指通过对棉花进行基因工程技术改造,使得棉花具备对虫害具有抗性的能力。
转基因抗虫棉的研究历程可以追溯到1990年代,自那时起,经过多年的努力,已经取得了显著的成果。
未来,转基因抗虫棉的研究将继续深入,以提高产量和质量,并降低对农药的依赖。
1990年代初期,研究人员首次尝试通过基因转移的方法在棉花中引入抗虫基因。
1996年,美国得克萨斯农工大学的研究人员成功地将一种叫做Bt杆菌的基因引入到棉花中,这种杆菌产生的一种名为Bt蛋白的毒素可以杀死多种寄生虫。
这种转基因抗虫棉成为了第一个商业化生产的转基因作物。
转基因抗虫棉的研究持续进行,不断改良和开发新的品种。
在过去的二十多年里,不仅有越来越多的转基因抗虫棉品种被研发出来,也有一些转基因抗虫棉面临了一些挑战。
一些害虫的抗性逐渐地增强,需要不断地研究新的抗虫基因,以应对害虫的演化。
未来,转基因抗虫棉的研究将着重于以下几个方面:首先,研究人员将继续改良已有的抗虫基因,并寻找其他有效的抗虫基因。
不同的虫害对不同的抗虫基因有不同的抵抗能力,因此,研究人员需要不断地寻找新的抗虫基因,提高抗虫能力。
其次,研究人员还将继续研究抗虫基因的作用机制。
对于抗虫基因的作用机制的深入了解,可以帮助研究人员更好地设计转基因抗虫棉品种,并提高其抗虫能力。
此外,研究人员将致力于解决可能出现的抗性问题。
害虫具有较高的繁殖能力和适应能力,可能会出现对其中一种抗虫基因的抗性。
因此,研究人员需要不断开发新的抗虫基因,并采用多基因组合的方式,以提高转基因抗虫棉品种对抗虫害的效果。
最后,转基因抗虫棉的研究还将注重减少对农药的依赖。
农药使用对环境和人类健康都会带来负面影响,而转基因抗虫棉的应用可以减少农药的使用。
未来,研究人员将努力提高转基因抗虫棉的抗虫能力,以减少或甚至消除对农药的需求。
总之,转基因抗虫棉的研究历程已经取得了显著的成果,但仍需继续深入研究。
新疆农业科学2010,47(3):495-498Xinjiang Agricultural SciencesBt杀虫蛋白在转基因抗虫棉中的表达王冬梅,李建平,孟庆玉(新疆农业科学院核技术生物技术研究所,乌鲁木齐830091)摘要:=目的>评价转基因抗虫棉的生物安全性。
=方法>利用3个由花粉管通道法获得的转Bt基因的抗虫棉品系,通过Southern杂交技术研究了抗虫棉的插入数,通过棉铃虫饲喂、半定量RT-PC R和E LISA测定了抗虫棉的Bt杀虫活性的时间和空间的动态变化。
=结果>B t基因在抗虫棉中为1~2个拷贝数;Bt蛋白杀虫活性的时空动态表现为在不同生育期的同一器官中,苗期叶片的表达比花铃期的叶片强,在同一生育期内,不同器官表达不同,叶片和铃壳的表达高于苞叶、花和雌雄蕊。
=结论>Bt杀虫蛋白在转基因抗虫棉中的抗性具有时空表达特异性。
关键词:转基因抗虫棉;棉铃虫;抗性中图分类号:S562103513文献标识码:A文章编号:1001-4330(2010)03-0495-04Expression of Bt(Bacillus thuringiensis)InsecticidalProtein in Transgenic Bt CottonWANG Dong-mei,LI Jian-ping,MENG Qing-yu(Institute o f Nuclear and Biological Technology,Xinjiang Academy o f Agricultural Sciences,Urumqi,830091, China)Abstract:=Objective and Method>For biosecurity of transgenic insect-resistante cotton,the insert copy and spatio-temporal change of insecticidal activities and draft distance of three transgenic cotton lines transferring B t gene were evaluated.=Result>There is one or two c opy in insect-resistant cotton by southern blotting.The correc t death ratio of boll w orm and content of Bt insecticidal protein were studied through laboratory bioassay and ELISA.In the different growth stages of the same plant,the insecticidal ac tivities of the lea ves of seedling stage were stronger than those of the leaves of flowering stage and bolling stage,and in the different tissue of the same period,the e xpression of leaves and boll was higher than bracts,flowers and pistil and stamen.s.=C onclusion>The insec t resistance of Bt protein in transgenic c otton has the specific te mporal and spatial e xpression.Key words:transgenic insect-resistance c otton;boll w orm;resistance0引言=研究意义>棉花是世界上种植最多的经济作物之一,因其独有的棉纤维而关系到人们的生活。
大豆抗病虫害基因工程研究进展近年来,基因工程技术在植物育种领域取得了长足的发展,为解决作物抗病虫害问题提供了新的途径。
大豆作为世界上重要的粮食作物之一,一直受到各种病虫害的困扰。
为了提高大豆的抗病虫害能力,科研人员们一直在探索利用基因工程技术进行改良的可能性。
本文将对大豆抗病虫害基因工程研究的进展进行详细介绍。
1.抗病基因工程研究大豆生长期间易受到多种真菌、细菌和病毒感染,导致减产和严重的经济损失。
因此,研究人员致力于利用基因工程技术进一步提高大豆对病原菌的抵抗力。
一种常见的策略是通过转基因方法引入外源抗病基因,增强大豆的抗病能力。
近年来,研究人员尝试将拥有抗菌活性的抗菌肽基因导入大豆中。
抗菌肽是一种天然存在于植物和动物体内的小分子蛋白,具有抗菌活性。
通过转基因方法将抗菌肽基因导入大豆后,大豆植株可产生抗菌肽,从而增强其对病原菌的抵抗能力。
实验结果显示,这种方法可以显著提高大豆对真菌和细菌的抗性,有效减少病害的发生率。
此外,研究人员还发现利用激素信号通路来提高大豆对病原菌的抗性是一种有效的方法。
激素信号通路在调节植物生长发育和抗病能力方面具有重要作用。
通过转基因方法调控大豆植株中与激素信号通路相关的基因表达,可以显著提高大豆植株对病原菌的抗性。
这为大豆的抗病育种提供了新的思路和方向。
2.抗虫基因工程研究除了引入Bt基因外,研究人员还发现利用植物天然抗虫物质来提高大豆抗虫能力是一种有效的方法。
植物天然抗虫物质是植物自身产生的对害虫具有毒性或驱避作用的物质。
通过调控大豆植株中与这些抗虫物质合成相关的基因表达,可以提高大豆对害虫的抵抗力。
这为大豆的抗虫育种提供了新的思路和方法。
总的来说,通过基因工程技术研究大豆的抗病虫机制,发现了一系列可以提高大豆抗病虫能力的方法和途径。
这些方法不仅可以有效减少大豆的病害和虫害,还可以提高大豆的产量和品质,为大豆生产提供了新的发展方向。
但是,需要进一步开展更多的研究,探索更多的基因工程方法,提高大豆的抗病虫能力,为大豆产业的持续发展做出贡献。
Bt基因及其在抗鞘翅目害虫上的应用1. 引言1.1 Bt基因的发现Bt基因是一种来源于土壤中一种叫做溶石芽胞杆菌(Bacillus thuringiensis)的细菌的毒素基因。
这种细菌在1897年首次被德国科学家陶辛(Ernst Berliner)发现,并在不久之后被发现能够杀死鳞翅目害虫。
在20世纪70年代,科学家们开始研究这种细菌产生的杀虫毒素,发现这种毒素对鞘翅目害虫有高度毒力,而对其他昆虫、植物和人类等无害。
经过多年的研究和改良,Bt基因被成功应用于生产抗虫转基因作物,成为一种绿色、环保的生物农药。
这种天然杀虫剂的发现和应用对传统农业有着革命性的影响,为农作物的生产提供了一种全新的解决方案,也为农业的可持续发展提供了新的契机。
1.2 鞘翅目害虫的危害性鞘翅目害虫是一类对农作物造成严重危害的害虫,其危害性主要体现在以下几个方面:1. 鞘翅目害虫食性广泛,可以侵害多种农作物。
稻谷、小麦、玉米、棉花等农作物都是鞘翅目害虫的重要寄主,它们以作物的叶片、茎、果实等为食,导致作物生长发育受到严重影响,甚至导致减产甚至绝收。
2. 鞘翅目害虫繁殖能力强,破坏速度快。
由于鞘翅目害虫的繁殖周期短,数量庞大,一旦发生大面积的侵害,很容易造成农作物的大面积损失,给农民带来经济损失。
3. 鞘翅目害虫具有抗药性,并且易产生抗药性。
长期使用化学农药会导致鞘翅目害虫对农药产生抗性,使得传统农药的防治效果逐渐减弱,难以有效控制害虫的侵害。
鞘翅目害虫的危害性严重,给农业生产带来巨大的损失,因此急需寻找一种有效的方法来控制这一类害虫,保障农作物的正常生长和丰收。
Bt基因技术的应用为解决这一难题提供了新的思路和可能性。
1.3 Bt基因在农业上的重要性Bt基因技术的应用还能够降低化学农药在环境中的残留量,减少对土壤和水资源的污染,有利于维护生态平衡。
通过推广Bt基因技术,可以提高农产品的质量和品质,同时减少对人类健康的潜在影响。
转Bt基因抗虫水稻的研究进展
张丽萍;查仁明;李尚伟
【期刊名称】《天津农业科学》
【年(卷),期】2012(018)006
【摘要】介绍了Bt基因及转Bt基因抗虫水稻的作用机理,综述了转Bt基因水稻的研究概况,分析了转Bt水稻的生物安全性,并展望了Bt水稻的发展趋势,以期为Bt 水稻的安全性评价及大规模商业化种植提供参考.
【总页数】5页(P9-13)
【作者】张丽萍;查仁明;李尚伟
【作者单位】贵州大学昆虫研究所贵州山地农业病虫害重点实验室,贵州贵阳550025;贵州大学农学院,贵州贵阳550025;贵州大学昆虫研究所贵州山地农业病虫害重点实验室,贵州贵阳550025
【正文语种】中文
【中图分类】S511
【相关文献】
1.转Bt基因抗虫水稻对稻田生物群落的影响 [J], 陈晓娟;何树林;程开禄;任光俊
2.抗虫转Bt基因水稻外源转基因成分环介导等温扩增技术检测方法的建立及应用[J], 王永;兰青阔;赵新;朱珠;程奕
3.转Bt基因抗虫水稻的研究进展与生态安全评价 [J], 刘雨芳
4.转Bt基因抗虫杂交水稻亲本8个农艺性状配合力及遗传力分析 [J], 王鑫; 朱昌兰; 贺浩华; 彭小松; 欧阳林娟; 王春雷; 孙玥; 周大虎; 彭东华; 傅军如; 贺晓鹏; 陈小
荣
5.5个转Bt基因抗虫水稻恢复系的品质配合力分析 [J], 陈种凯;傅军如;陈小荣;朱昌兰;贺浩华;彭小松;宋丽艳;王鑫;孙玥;李双;王春雷;周大虎;欧阳林娟;贺晓鹏
因版权原因,仅展示原文概要,查看原文内容请购买。