连续式封口机验证报告
- 格式:doc
- 大小:286.00 KB
- 文档页数:13

编号:RD/ADS 752-04杭州医疗器械有限公司封口工艺验证报告杭州医疗器械有限公司2017年9月15日封口工艺验证报告一、总则2017年9月13日,验证小组根据批准的封口工艺验证方案(项目编号:ADS-2017-014),对本公司纸塑复合型包装的封口工艺过程进行验证,达到了预期效果,现将验证过程进行总结。
1.1验证目的对公司的泡罩包装机封口工艺实施验证,以确定充分、适宜、有效的封口工艺参数,确保封口过程能满足产品加工要求。
1.2验证依据1)《医疗器械生产质量管理规范》;2)各设备操作规程以及使用说明书;1.3验证范围适用于本公司一次性使用无菌换药包应用数控系统控制的全自动泡罩吸塑包装机形成的纸塑复合型的初包装封口过程的验证,涉及该过程的设备如下:表1:泡罩包装机技术参数表1.4工艺概述a、在设备的供水、供气、供电连好后,合上控制柜门板的电源开关,启动“ON”按钮,设置如单模距离、链条速度、点动速度、预热时间、吸塑时间、脱模时间、对版时间、装料时间、印刷等一系列运行参数,经完成一个循环的状态下进行机械化自动运行。
b、将薄膜(萧山荣新,415*0.38mm)和包装纸(嘉兴科邦,国产68g热熔胶纸*宽410mm)分别按要求进行开卷、穿纸,安装待用。
c、工作时,热合下模上升至下模上面的硅胶条顶面略高于薄膜,热合下模下面的气囊推动下模和上模的加热板压合上,将包装纸与薄膜紧紧得压合,同时在高温下将其封合。
1.5验证小组及职责开展验证前,所有验证小组人员均应进行本验证方案的培训,验证小组由以下人员组成:1.6验证时间及进度安排二、验证结果及分析2.1验证结论按验证方案要求对纸塑复合型包装的封口过程实施验证,并对各试验组产品实施检测,结果:按预定的封口工艺参数实施封口,产品外观、密封性能、封口强度检测结果如下:确认有效以及最佳的工艺参数如下:2.2再验证周期常规情况下,每年进行一次,当出现下列情况时应立即开展再验证:1)封口设备发生变更;2)封口工艺参数发生变更;3)封口对象(如材质)发生变更;三、附件3.1附表表1:封口工艺验证记录。
文件类型:验证文件文件名称:无菌包装封口效果验证报告文件编号:使用部门:生产部1.验证目的通过确认证明产品经过内包装后,是否能达到规定的要求,确认包装过程是否安全有效。
通过一系列试验和文件记录,证实封口机可以持续提供可被接受的无菌包装封口过程。
2.验证范围2.1适用于本公司*****封口机的验证2.2纸塑包装袋上海浦茂包装材料有限公司提供的1073B+10丝进口易撕袋与1059B+6丝进口易撕袋。
技术参数见供应商提供的《产品质量检验报告单》。
3.概述封口机技术参数3.1封印速度:10m/min3.2封印温度:80-220°C3. 3封印压缝宽:12mm3. 4 电源:220V/50HZ3. 5 外形尺寸:620X260X250mm3. 6 重量:23KG3.7国产滚轮尺寸:宽X深X高=830X280X60mm4.验证小组及成员5.确认依据5. 1 GB/T19633-2005《最终灭菌医疗器械的包装》屏障系统和包装系统要求》5.3 IS011607-2: 2006《最终灭菌医疗器械的包装一第二部分:形成、密封和装配的确认要求》装的密封泄露》泡法)》GB/T4857. 10-2005正弦变频振动试验 5.22中国药典2019版 5.23 ISO 11135-1:2014环氧乙烷灭菌医疗器械确认和控制5.4 YY/T 0681.1-2009 无菌医疗器械包装试验方法第1部分:加速老化试验指南 5.5 YY/T 0681.2-2010《无菌医疗器械包装试验方法第2部分:软性屏障材料密封强度试验》5.6 YY/T 0681.3-2010《无菌医疗器械包装试验方法第3部分: 无约束包装抗内压破坏试验》5.7 YY/T 0681.4-2010《无菌医疗器械包装试验方法第4部分: 染色液穿透法测定透气包5.8 YY/T 0681. 5-2010《无菌医疗器械包装试验方法第5部分: 内压法检测粗大泄漏(气5.9 ASTM F 1929中规定的试验方法检查密封口的密封渗漏性, 封口应完整5. 10 ASTM F1886-98目力检测方法5. 11 DIN 58953-6: 2006琼脂接触攻击试验 5. 12 ASTM F1929-98染料渗漏试验 5. 13 ASTM Fl 140-07爆破试验 5. 14 ASTM F88-09封口剥离试验 5. 15 ASTM F2096-04气泡试验 5. 16 ASTM F1886-2009目视检测试验5. 17 GB/T4857. 2-2005温湿度处理试验 5. 185. 19 GB/T4857. 5-1992 跌落试验5.20 EBJS-TS-014《包装物资采购及检验标准》5.21 《产品初始污染菌操作规程》6无菌包装封口过程确认的过程一般应包括安装确认,运行确认和性能确认。
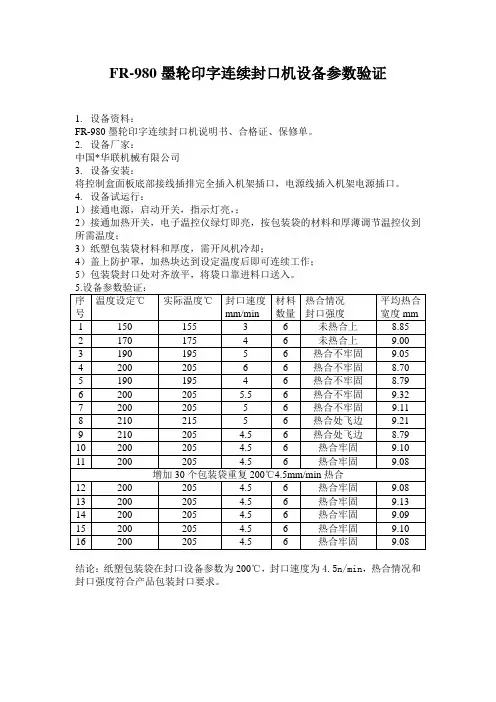
FR-980墨轮印字连续封口机设备参数验证
1.设备资料:
FR-980墨轮印字连续封口机说明书、合格证、保修单。
2.设备厂家:
中国*华联机械有限公司
3.设备安装:
将控制盒面板底部接线插排完全插入机架插口,电源线插入机架电源插口。
4.设备试运行:
1)接通电源,启动开关,指示灯亮,;
2)接通加热开关,电子温控仪绿灯即亮,按包装袋的材料和厚薄调节温控仪到所需温度;
3)纸塑包装袋材料和厚度,需开风机冷却;
4)盖上防护罩,加热块达到设定温度后即可连续工作;
5)包装袋封口处对齐放平,将袋口靠进料口送入。
结论:纸塑包装袋在封口设备参数为200℃,封口速度为4.5n/min,热合情况和封口强度符合产品包装封口要求。

封口验证报告目录1.验证目的 (1)2.验证范围 (1)3.验证依据 (1)4.人员职责 (1)5.设备、包装材料介绍 (1)5.1封口机的描述 (1)5.2包装材料说明 (2)6.灭菌过程描述 (2)7.步骤确认 (2)8.安装确认 (3)8.1设备信息 (3)8.2安装条件 (3)8.3文档 (3)8.4安全性能 (3)8.5设备核实 (4)8.5临界参数 (4)8.6日常维修保养 (4)8.7报警和警示 (4)8.8人员资格 (4)9.运行确认 (5)9.1包装材料成形和密封过程的适应性 (5)10.性能确认 (10)10.1参数信息 (10)10.2实际运行包装的验证 (10)11.过程的控制与监视 (11)12.过程更改和重新验证 (12)13验证批准 (12)附件1:特卫强透析袋生产厂家资质及材质检验报告 (13)附件2:封口作业指导书 (13)附件3:封口机安装确认表 (13)附件4:设备日常维修保养记录 (13)附件5:封口机自检报告 (13)附件6:培训考核记录 (13)封口验证报告■初次验证□再次验证1.验证目的为了验证封口机设备能安全和有效地进行封口包装,并确保产品在使用前的有效性和安全性。
2.验证范围本验证报告适用于封口验证,此产品系列型号仅用一种灭菌屏障包装。
3.验证依据依据灭菌屏障封口验证方案。
4.人员职责5.设备、包装材料介绍本次验证使用的设备有高速自动吸塑封口机,设备编号:QY-SC-010,设备安装在净化车间内。
5.1封口机的描述5.2包装材料说明6.灭菌过程描述7.步骤确认8.安装确认8.1设备信息8.2安装条件8.3文档8.4安全性能8.5设备核实8.5临界参数8.6日常维修保养8.7报警和警示8.8人员资格9.运行确认9.1包装材料成形和密封过程的适应性此项性能指标检查结果如下表:9.1.1包装封口后的外观确认9.1.3包装完整性测试确认(染剂渗漏实验)9.1.4最佳封口参数确认报告10.性能确认10.1参数信息10.2实际运行包装的验证根据OQ的验证结果,选择封口温度范围120±2℃,时间控制在2.5±0.2S,进行3个批10.3验证结论封口温度范围120±2℃,时间控制在2.5±0.2S条件下,密封性能的测试CP值≥1,一次性举宫器封口包装要求。

连续式封口机验证报告报告编号:YJ/VR-023-A使用部门:生产二车间验证报告审批表以下是各部门负责人签字,代表本文件已审核并批准实施目录1.验证概述 (4)2.验证目的 (4)3.验证范围 (4)4.验证小组成员及职责 (4)5.验证进度计划 (5)6.验证依据 (5)7.验证 (5)8.偏差及变更控制 (13)9.结果评价及建议 (13)10.再验证周期 (13)1.验证概述1.1设备描述连续式封口机主要用于**公司无菌医用纱布、无菌医用无纺布、无菌医用药棉、一次性口罩、无菌医用外科口罩等产品的内包装袋的密封包装,该设备性能稳定,操作简单,封口美观,封口质量良好,符合产品的生产要求。
2.验证目的为证明连续式封口机满足生产操作要求以及运行的稳定性,确保生产的产品符合生产产品质量要求,即对连续式封口机进行安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
3.验证范围本方案适用于**公司生产二车间连续式封口机的安装、运行和性能确认。
4.验证小组成员及职责4.1验证相关部门职责4.1.1设备部4.1.1.1起草验证方案、报告;4.1.1.2负责连续式封口机的安装、运行和性能确认;4.1.1.3提供设备相关技术资料;4.1.1.4组织安装、调试并作好记录,收集、归纳并评估调试结果;4.1.1.6建立设备档案;4.1.2 品质部4.1.2.1现场监督保证整个操作过程按照验证方案实施;4.1.2.2负责验证方案和报告的审核,及操作过程中对验证文件修订的审核工作;4.1.2.3负责批准验证方案和报告;验证方案及验证报告的归档工作4.1.3生产车间4.1.3.1负责验证方案和报告的审核4.1.3.2负责协调验证的各项工作,保证本方案规定的项目能够顺利实施;5.验证进度计划验证从2012年5月开始,至性能确认结束。
6.验证依据6.1《医疗器械生产质量管理规范》6.2 YJ/SMP-QA-018《验证管理规程》6.3 YJ/SOP-PR-038《FRB-10连续式塑袋封口机操作规程》6.4 美国标准ASTMF88、ASTMF1929、ASTMF18866.5 ISO11607-2006 、ISO2859-19996.6 EN8687.验证7.1设备基本情况设备名称:连续式塑袋封口机使用部门:生产部二车间7.2验证判断标准7.2.1安装确认判断标准:设备应具备的技术资料应齐全归档,设备安装符合实际设计要求。

包装验证报告***************医疗科技有限公司包装工序工艺验证报告一、验证目的:确认最佳包装工艺参数,确保产品质量达到标准要求。
二、验证依据:《作业指导书》、《检验规程》三、验证日期:购买后加Q2742294118,发完整word版,多年实操经验,体系建立、产品注册服务。
四、验证人员资格确认参与验证的化验室人员****************************并取得了化验员资格证书,具备检验资格。
五、安装确认5.1安装确认(IQ)经确认,连续封口机安装基本情况均符合要求。
见表1;所有仪器量具均经过校验合格且在有效期之内,具体确认信息见表2;附表1:连续封口机安装确认表编号:***************编制:审核:批准:日期:附表2:仪表校验信息表六、运行确认(OQ)6.1包装材料的选择评价6.1.1包装材料的物理和化学特性a.评价目的可供选择的包装材料基本的物理、化学性能符合产品要求。
b.评价项目对包装材料进行物理特性、化学特性的评价。
c.判定标准通过供应商资质,详见附件。
6.1.2包装材料的毒理学特征a.评价目的确认包装材料应不释放出足以损害健康的毒性特质。
b.评价项目对包装材料进行毒理学测试。
c.评价方法通过确认供应商提供的检测报告。
6.1.3包装材料与成型和密封过程的适应性。
a.评价目的确认包装材料与成型和密封过程的适应性。
b.评价项目外观、热封强度、包装完整性。
c.外观检查由具有正常视力(或矫正视力)的检测人员肉眼或放大镜观察:1)最终包装外表面规整(无明显污物、脏点、变色、破漏等缺陷)为接受标准;2)对开启后的包装外来物质、无菌屏蔽材料内表面的不规整、密封特性、湿气、水分、水印。
d.热封强度测试参考YY/T 0698.5-2009 第4.5条,指定样品灭菌前后的热封强度必须达到依据产品包装方式和采用的包装材料所确定的标准,对于本产品,热封强度值取不小于30N/15mm。

FR-980墨轮印字连续封口机设备参数验证
1.设备资料:
FR-980墨轮印字连续封口机说明书、合格证、保修单。
2.设备厂家:
中国*华联机械有限公司
3.设备安装:
将控制盒面板底部接线插排完全插入机架插口,电源线插入机架电源插口。
4.设备试运行:
1)接通电源,启动开关,指示灯亮,;
2)接通加热开关,电子温控仪绿灯即亮,按包装袋的材料和厚薄调节温控仪到所需温度;
3)纸塑包装袋材料和厚度,需开风机冷却;
4)盖上防护罩,加热块达到设定温度后即可连续工作;
5)包装袋封口处对齐放平,将袋口靠进料口送入。
结论:纸塑包装袋在封口设备参数为200℃,封口速度为4.5n/min,热合情况和封口强度符合产品包装封口要求。

编号:YZ/SB/XN/00900900型多功能自动薄膜封口机验证方案版 次: 口新订 口替代: __________________制定人: ____________________ ___________ 年—月—日部 门:自动薄膜封口机设备验证小组页码:共10页,第1页类别:验证方案目录、验证项目------------------------------------------------------------------- 3二、验证组织--------------------------------------------------------------------- 31、验证委员会 ------------------------------------------------------------------- 32、验证小组 --------------------------------------------------------------------- 33、部门职责 --------------------------------------------------------------------- 3三、概述 ------------------------------------------------------------------------ 4四、主要技术资料------------------------------------------------------------------ 4五、适用范围--------------------------------------------------------------------- 4六、验证目的 -------------------------------------------------------------------- 4七、验证内容--------------------------------------------------------------------- 41、预确认 ----------------------------------------------------------------------- 42、运行确认 -------------------------------------------------------------------- 53、性能确认 --------------------------------------------------------------------- 6八、时间进度表------------------------------------------------------------------ 6九、验证周期--------------------------------------------------------------------- 7十、验证结果评价和建议----------------------------------------------------------- 7十^一、附件---------------------------------------------------------------------- 7一、验证项目:明确对FRM--980型墨轮印子连续封口机进行验证二、验证组织1验证小组:1.1验证小组职责(1)负责验证方案的批准;(2)负责验证报告的批准。


吸塑包装过程确认报告编制:日期:审核:日期:批准:日期:验证小组成员目录一、验证方案1.目的2.范围3.描述4.验证内容4.1安装确认4.2运行确认4.3性能确认5.结果评价6.验证周期二、验证报告1.目的2.范围3.描述4.验证内容4.1安装确认4.2运行确认4.3性能确认5.结果评价6.验证周期吸塑包装验证方案1.目的对本公司无菌产品的初包装设备、包装热封机进行热封包装过程确认,以确保能提供安全有效的包装工艺。
2.范围2.1设备:本次验证确认的设备为杭州天琅自动化设备有限公司吸塑包装热封机,内部设备编号:KFSC01102.2材料:本次确认使用的材料为透析纸和 PE 薄膜。
3.描述采用气动元件驱动压板工作,使用可调节电发热原理完成 PE 与透析纸的封合,利用脉冲发热原理根据工件大小(热合面积)选择不同电流输出及通电时间,然后在冷却加压情况下完成热合包装。
通过调换模具,可粘合不同尺寸,不同形状的泡罩。
封口设备温度可调控,适应于不同厚度塑料泡罩粘合。
4.依据文件. ISO11607-1:2009《最终灭菌医疗器械的包装第 1 部分:材料、无菌屏障系统、包装系统的要求》. ISO11607-2:2006《最终灭菌医疗器械的包装第 2 部分:成形、密封和组装过程的确认要求》. GB/T 2828.1-2012 计数抽样检验程序第1 部分:按接收质量限(AQL)检索的逐批检验抽样计划. 热封包装操作规程. 设备管理制度. 医用透析纸质量标准. 产品初始污染菌操作规程5.内容5.1包装材料的选择5.1.1包装材料的物理化学特性5.1.1.1评价目的:可供选择的包装材料基本的物理、化学性能符合产品要求。
5.1.1.2评价项目:对包装材料进行物理特性(如外观、克重、厚度、透气性、耐水度、撕裂强度等)、化学特性(如薄膜的溶出物指标、PH 值、氯、硫含量等)的评价。
5.1.1.3评价方法:通过确认供方提供的检测报告书验证。

目录1、验证目的 (1)2、验证范围 (1)3、验证依据 (1)4、人员职责分工 (1)5、设备、包装材料介绍 (1)5.1设备介绍 (1)5.2仪器仪表 (1)5.3安装确认 (1)5.4运行确认 (1)6、验证包装材料 (2)7、验证方法 (2)7.1方法原理 (2)7.2参数范围 (2)8、检测 (2)8.1样品的试制 (2)8.2 抽样 (2)8.3 检验项目 (2)8.4 接收标准 (3)8.5 结果记录 (3)9、封口参数的确定 (3)10 、不合格处理 (3)11、封口工艺评价 (3)12 、再验证周期 (3)附录1 人员资格确认记录 (I)附录2仪器、仪表的检测记录 (II)附录3设备安装确认记录 (III)附录4设备运行确认记录 (Ⅳ)附录5参数适宜性鉴定试验记录 (Ⅴ)附录6验证评价 (Ⅵ)附录7验证结论 (Ⅷ)附录8验证报告 (Ⅸ)附录9验证证书 (Ⅹ)1 验证目的确保封口机设备进行热合包装在产品使用前保持产品的有效性、安全性(无菌性),确保产品的无菌屏障质量在有效期内不受包装的影响。
2验证范围一次性使用胸腔引流装置水封式单腔-1300 初包装;一次性使用胸腔引流装置水封式二腔-1500 初包装;一次性使用胸腔引流装置水封式三腔-1500 初包装;SF-B型封口机(单腔-1300、二腔-1500、三腔-1500)3验证依据GB/T 19633-2005/ISO 11607:2006《最终灭菌医疗器械的包装》EN868-1:1997《医用物品灭菌的包装材料和系统第一部分:通用要求和测试方法》4人员职责分工4.1生技科——生技科长负责批准方案、批准报告;——生技科制定确认方案和形成确认报告;——负责样品制作;4.2 质管科——提供试验方法,接收标准,样品的试验测试,提供试验结果和记录。
参与确认的试验人员应有相关培训记录或证书;确认结果记录于表:BZ-001《人员资格确认记录》5 设备、包装材料介绍5.1设备介绍单腔型、二腔型、三腔型SF-B主要工作参数如下:工作电压:220V封口速率:0.2s~3s(可调节、最小刻度0.1s,刻度增量0.5s,封口宽度2mm)5.2 仪器仪表与验证有关的监视和测量设备应能提供相应的检定记录确认结果记录于表:BZ-002《仪器、仪表确认记录》5.3安装确认5.3.1检查并确认封口机的使用说明书、装箱清单、备品、附件的完整与收集、保存。
XXXXXXXXXXXXXX有限公司封口验证报告二O一六年十二月一、概述我公司生产的XXX产品为为PE袋热压封口,由全自动创口贴包装机一次成型。
二、验证内容1密封性验证1.1检查连续封口机是否完好,运转是否正常,操作环境是否符合要求;1.2检查设备上的电源并关、信号灯、电流表、温度及时间调节器等是否正常;1.3检查电源等是否处于正常状态等;1.4按连续封口机设备使用说明书进行操作,看设备运行是否正常,并随意设定几个温度参数,看各项技术指标控制是否如说明书所述。
1.5将以上各项检查和设备运行情况进行记录,确认小组人员签字。
表一全自动创口贴包装机安装确认经过检查,创口贴机器的安装符合设计要求检验:马XX 复核:李XX 日期:2016.9.15表二连续封口机安装确认表格经确认,有色印字连续封口机安装符合设计要求,可以投入使用,检验:马XX 复核:李XXX 日期:2016.9.15 2过程确认(OQ)2.1需封口产品包装袋材料为冷封纸和由薄膜和纸复合而成的医用涂塑纸做成的包装袋,封口涉及相关技术参数为温度。
2.2选用每种包装的抽样3批进行试验。
2.3封口过程技术参数进行确认。
2.4冷封纸过程确认根据卷材的多少设定张力参数,第一次作业的前半个小时每隔十分钟测量其密封性,Pe袋过程确认参数设置见下表:表三封口过程确认参数设置完全粘合,190℃以上材料开始变形、收缩。
温度170℃-190℃,速度定为8m/min,封口效果都可满足预期质量要求。
但是考虑封口机的寿命,因此将温度确定在170℃-180℃之间。
检验:马XX 复核:李XX 日期:2016.9.24合,260℃以上材料开始变形、收缩。
温度230℃-255℃,速度定为180瓶/分,封口效果都可满足预期质量要求。
但是考虑封口机的寿命,因此将温度确定在230℃-250℃之间。
检验:马XX 复核:李XX 日期:2016.9.24 3性能确认(PQ)3.1采用经确认过的最佳温度参数值对一个正常生产批的封口过程进行性能确认:3.1.1每个产品抽取三个生产批,每批做3只进行渗漏试验,若合格,表明性能确认可完成。
目录1.验证概述 (2)2.验证目的 (2)3.验证围 (2)4.验证人员职责 (3)5.验证依据 (3)6.验证容及标准 (4)7.验证时间安排 (5)8.偏差及变更控制 (5)9.结果评价及建议 (5)10.再验证周期 (5)11.附表 (5)1.验证概述1.1设备描述FRD-1000型连续式油墨印码封口机连续式封口机主要用于本公司医用防护口罩、医用防护口罩C型等产品的包装袋的密封包装,具有连续输送、封口、油墨印制标签(出厂日期、生产批量等)一次完成之功效,可封合印制任何一种可热性的薄膜。
该机属二合一机型,即可连续封口,又可油墨印制标签,且一次完成。
该设备性能稳定,操作简单,封口美观,封口质量良好,符合产品的生产要求。
1.1仪器的基本情况1.1.1设备名称:连续式油墨印码封口机1.1.2设备型号:FRD-1000型1.1.3制造厂商:利波机械1.1.4设置场所:包装间1.2主要技术参数电源电压:220±10V 50HZ墨源:固体墨轮、塑料墨轮印字字数:≤45(4号字)输送速度:0-20米/分输送载荷:≤5公斤封口温度:0-400℃(可调)封口宽度:5-15毫米(可调)封口厚度:0.01-0.20毫米封口长度:不限2.验证目的为证明连续式封口机满足生产操作要求以及运行的稳定性,确保生产的产品符合生产产品质量要求,即对连续式封口机进行安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
3.验证围本方案适用于盛实医疗科技公司FRD-1000型连续式油墨印码封口机的安装、运行和性能确认。
4.验证人员职责4.1验证小组职责:4.1.1 验证领导小组4.1.1.1负责组建验证小组,确认验证小组组长及小组成员;4.1.1.2组织协调验证实施,确保验证按方案设定时间完成;4.1.1.3审核批准验证方案,验证报告。
4.1.2 生产部4.1.2.1起草验证方案,对小组成员进行方案培训;4.1.2.2编写设备操作规程、维护保养规程并负责培训;4.1.2.3核实所有的测试已完成,收集整理验证数据;4.1.2.4负责形成完整验证报告及完成报告评价,验证报告上报履行审核批准;4.1.2.5建立设备档案。
连续式封口机验证报告
报告编号:YJ/VR-023-A
使用部门:生产二车间
验证报告审批表以下是各部门负责人签字,代表本文件已审核并批准实施
目录
1.验证概述 (4)
2.验证目的 (4)
3.验证范围 (4)
4.验证小组成员及职责 (4)
5.验证进度计划 (5)
6.验证依据 (5)
7.验证 (5)
8.偏差及变更控制 (13)
9.结果评价及建议 (13)
10.再验证周期 (13)
1.验证概述
1.1设备描述
连续式封口机主要用于**公司无菌医用纱布、无菌医用无纺布、无菌医用药棉、一次性口罩、无菌医用外科口罩等产品的内包装袋的密封包装,该设备性能稳定,操作简单,封口美观,封口质量良好,符合产品的生产要求。
2.验证目的
为证明连续式封口机满足生产操作要求以及运行的稳定性,确保生产的产品符合生产产品质量要求,即对连续式封口机进行安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
3.验证范围
本方案适用于**公司生产二车间连续式封口机的安装、运行和性能确认。
4.验证小组成员及职责
4.1验证相关部门职责
4.1.1设备部
4.1.1.1起草验证方案、报告;
4.1.1.2负责连续式封口机的安装、运行和性能确认;
4.1.1.3提供设备相关技术资料;
4.1.1.4组织安装、调试并作好记录,收集、归纳并评估调试结果;
4.1.1.6建立设备档案;
4.1.2 品质部
4.1.2.1现场监督保证整个操作过程按照验证方案实施;
4.1.2.2负责验证方案和报告的审核,及操作过程中对验证文件修订的审核工作;
4.1.2.3负责批准验证方案和报告;验证方案及验证报告的归档工作
4.1.3生产车间
4.1.3.1负责验证方案和报告的审核
4.1.3.2负责协调验证的各项工作,保证本方案规定的项目能够顺利实施;
5.验证进度计划
验证从2012年5月开始,至性能确认结束。
6.验证依据
6.1《医疗器械生产质量管理规范》
6.2 YJ/SMP-QA-018《验证管理规程》
6.3 YJ/SOP-PR-038《FRB-10连续式塑袋封口机操作规程》
6.4 美国标准ASTMF88、ASTMF1929、ASTMF1886
6.5 ISO11607-2006 、ISO2859-1999
6.6 EN868
7.验证
7.1设备基本情况
设备名称:连续式塑袋封口机使用部门:生产部二车间
7.2验证判断标准
7.2.1安装确认判断标准:设备应具备的技术资料应齐全归档,设备安装符合实际设计要求。
7.2.2运行确认判断标准:安装确认后,空机运转检测设备各部件应性能完好,操作各控制器应灵活有效,并能完全达到规定的技术指标和使用要求。
7.2.3性能确认判断标准:设备投入使用后,设备运行、生产产品质量等能满足生产工艺要求。
7.3 验证内容
7.3.1安装确认
7.3.1.1设备的使用说明书等技术资料齐全归档。
7.3.1.2设备安装周围应有足够的活动空间,便于操作,地面应坚固、平整等。
7.3.1.3环境安装要求,即洁净度等级要求。
7.3.1.4检查与设备有关的所有仪器仪表,应显示正常有效。
7.3.1.5电力供应正常,管线走向安全合理,电线无老化等现象。
7.3.1.6确认连续式封口机的相关文件已建立。
7.3.1.7人员培训
对验证小组所有成员应该进行连续式封口机验证方面的培训;对设备操作人员进行操作规程方面的培训。
附表1:主要技术资料确认
附表2:安装环境确认
附表4:文件确认记录
员工培训记录与考核表QR-620-02
7.3.2运行确认
7.3.2.1将设备空载运转,检测设备运转正常流畅,各部件应性能完好,并能完全达到规定的技术指标和使用要求。
7.3.2.2所有控制开关应能灵活使用,所有仪表的显示全部正常、有效、显示准确。
7.3.2.3检查设备固定状况,应无明显震动或移位。
7.3.2.4电机应正常运行,无异常声音。
7.3.2.5按设备的操作规程运行设备,确认标准操作规程的可行性。
附表1:连续式封口机运行确认检查记录
7.3.3性能确认
7.3.3.1与19120605批医用外科口罩(无菌)的生产同步进行验证,生产过程中每隔10分钟抽样4袋检查其外观、热合强度、密封性等是否符合生产工艺要求。
7.3.3.2性能确认项目及标准
7.3.3.2.1外观应无脏点、污渍、破损、变色等,封口边缘应平整。
7.3.3.2.2使用电子织物强力机进行热封强度试验,封口热封强度应≥2.5N/25.4mm。
7.3.3.2.3密封性试验(染色渗透试验):将包装袋一分二,在封口处滴入渗透试验液,30秒钟后观察封口是否有液体渗透,无渗透则产品密封性合格。
附表1:连续式封口机性能确认记录
8.偏差及变更控制
验证实施过程中产生的所有变更及偏差,均应统计进入验证报告。
9.结果评价及建议
连续式封口机运行正常,验证数据准确,能够满足生产操作要求,能够确保产品质量,本次验证合格。
批准人:日期:
10.再验证周期
10.1连续式封口机大修后、场地变更后必须再验证。
10.2连续式封口机再验证周期:1年/次。