化工热力学重点难点考点剖析
- 格式:pdf
- 大小:76.98 KB
- 文档页数:2



化工热力学一、重点1、临界点定义及表达式:维持气液平衡的最高温度和压力点。
、。
c 0T T p V =∂⎛⎫= ⎪∂⎝⎭220cT T p V =⎛⎫∂= ⎪∂⎝⎭2、Virial 方程体积表达式:231pV B C DZ RT V V V ==++++L 压力表达式:231pVZ B p C p D p RT'''==++++L3、偏心因子的定义及表达式:各种物质在时,纯态流体对比蒸汽0.7r T =压对数值与Ar ,Kr ,Xe 的值的偏差,即。
()0.7lg 1.00r s r T p ω==--物理意义:偏心因子表征物质的偏心度,即非球型分子偏离球对称的程度。
4、普遍化Virial 系数01ccBp B B RT ω=+011r r r rp p Z B B T T ω=++0 1.61 4.20.4220.0830.1720.139r r B T B T =-=-普遍化Virial系数与普遍化压缩因子适用范围5、Prausnitz 混合规则()()()()0.5311331222cij ci cj ijcicjcij cij ci zj cij cij cij cijcij i j T T T k V V V Z Z Z p Z RT V ωωω=-⎛⎫+ ⎪=⎪ ⎪⎝⎭=+==+6、熵的表达式的推导第一方程dS 当时,则有(),S S T V =V TS S dS dT dVT V ∂∂⎛⎫⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭因 V V V V Q TdS S C T T T T ∂∂⎛⎫⎛⎫⎛⎫=== ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭得 V V C S T T ∂⎛⎫= ⎪∂⎝⎭又 T V S p V T ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭所以 V VdT p dS C dV T T ∂⎛⎫=+ ⎪∂⎝⎭积分得到000ln T V V T V Vp S S S C d T dVT ∂⎛⎫-=∆=+ ⎪∂⎝⎭⎰⎰第二方程dS 当时,则有(),S S T p =p TS S dS dT dp T p ⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭因 p p C S T T ∂⎛⎫= ⎪∂⎝⎭p TS V p T ⎛⎫∂∂⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭所以 p pdT V dS C dp T T ∂⎛⎫=- ⎪∂⎝⎭积分得到000ln Tpp T p pV S S S C d T dpT ∂⎛⎫-=∆=- ⎪∂⎝⎭⎰⎰第三方程dS 当时,则有(),S S p V =p VS S dS dp dVp V ⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭因为VV V V V C S T S T p p T p T ⎛⎫⎛⎫⎛⎫∂∂∂∂⎛⎫== ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭p p p p p C S T S T V V T V T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫== ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭p V pV C C T T dS dp dV T p TV ⎛⎫∂∂⎛⎫=+⎪ ⎪∂∂⎝⎭⎝⎭积分得到000pV p V p V pVC C T T S S dp dV T p T V ⎛⎫∂∂⎛⎫-=+ ⎪ ⎪∂∂⎝⎭⎝⎭⎰⎰7、焓的表达式推导利用刚刚导出的三个方程来得到三个方程。

化工热力学知识要点1、化工热力学的研究方法:宏观研究方法 微观研究方法。
2、热力学体系:孤立体系(无物质无能量) 封闭体系(无物质 有能量) 敞开体系(有物质 有能量)。
3、体系 环境:在热力学分析中,将研究中涉及的一部分物质(或空间)从其余物质(或空间)中划分出来。
其划分出来部分称为体系,其余部分称为环境。
4、状态函数:描述体系所处状态的宏观物理量成为热力学变量(状态函数)。
常用的状态函数有压力、温度、比容、内能、焓、熵、自由焓等。
5、循环:体系经过一系列的状态变化过程后,最后由回到最初状态,则整个的变化称为循环。
分为正向循环和逆向循环。
6、临界点:气化线的另一个端点是临界点C,它表示气液两相能共存的最高压力和温度,即临界压力cp 和临界温度cT 。
7、临界点的数学表达式:临界等温线在临界点上的斜率和曲率都等于零。
数学上表示为0=⎪⎭⎫⎝⎛∂∂=cTT V p 022=⎪⎪⎭⎫ ⎝⎛∂∂=cTT V p8、直线直径定律:当以饱和液体和饱和蒸气密度的算术平均值对温度作图时,得一近似的直线。
9、纯物质的p-V-T 图:P 510、理想气体状态方程:RT pV =式中,p 为气体压力;V 为气体摩尔体积;T 为绝对温度;R 为通用气体常数 8.314J/(mol ·K)11、范德华方程(van der Waals 方程):2V ab V RT p --= 其中cc pT R a 642722=;cp RTb 8=。
12、R-K 方程: )(5.0b V V T ab V RT p +--= 其中ccp T R a /42748.05.22=;cc p RT b /08664.0=。
13、维里方程(Virial 方程):++++==321V DV C V B RT pV Z (2-26) 或者 ++++==32'''1p D p C p B RTpVZ式中, 、、、)'()'()'(D D C C B B 分别称为第二、第三、第四、 Virial 系数。

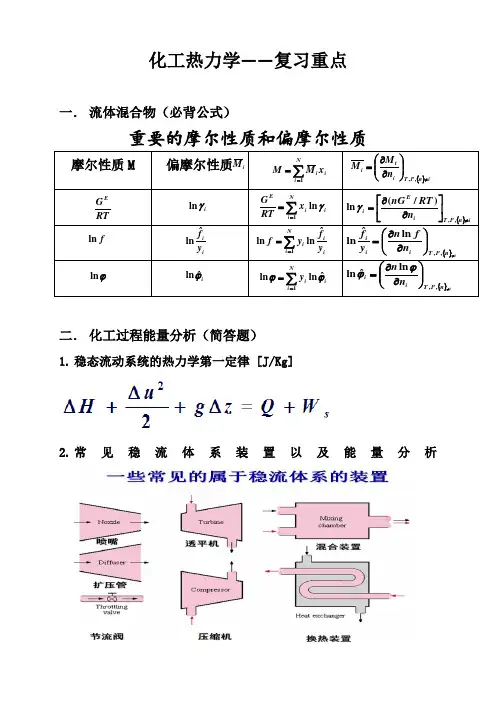
化工热力学——复习重点一. 流体混合物(必背公式)重要的摩尔性质和偏摩尔性质摩尔性质M偏摩尔性质二. 化工过程能量分析(简答题)1. 稳态流动系统的热力学第一定律 [J/Kg]2. 常见稳流体系装置以及能量分析i M ∑==Ni ii x M M 1{}in P T i ti nM M ≠⎪⎪⎭⎫ ⎝⎛∂∂=,,RTG Ei γln ∑==Ni i i Ex RT G 1ln γ{}in P T i E i n RT nG ≠⎥⎦⎤⎢⎣⎡∂∂=,,)/(ln γf ln iiy f ˆln ∑==Ni i ii y fy f 1ˆln ln {}in P T i i i n f n y f≠⎪⎪⎭⎫ ⎝⎛∂∂=,,ln ˆln ϕln iϕˆln ∑==Ni i i y 1ˆln ln ϕϕ{}in P T i i n n ≠⎪⎪⎭⎫⎝⎛∂∂=,,ln ˆln ϕϕ三.蒸汽动力循环与制冷循环(简答题)1.蒸汽动力循环能量分析(Energy Analysis)Turbine汽轮机:1 –2表示过热蒸汽在汽轮机中的可逆绝热膨胀过程,对外所做轴功可由膨胀前后水蒸汽的焓值求出。
Condensor冷凝器:2 –3表示乏汽在冷凝器中的等温等压冷凝过程,放出的热量。
Pump水泵:3 –4表示冷凝水通过水泵由P3升压至P4的可逆绝热压缩过程,需要消耗的轴功。
把水看作是不可压缩流体,则Boiler锅炉:4 –1表示液体水在锅炉中被等压加热汽化成为过热蒸汽的过程。
工质在锅炉中吸收的热量。
2.制冷循环(单级制冷循环)能量分析(Energy Analysis) 1-2可逆绝热压缩过程:W s = H2-H1 kJ/kg2-4等压冷却、冷凝过程:q2 = H4 - H2 kJ/kg4-5节流膨胀过程:H5 = H45-1等压、等温蒸发过程:q0 = H1-H5 kJ/kg。

化工热力学考试重点化工热力学是研究化学过程中能量转化和热力学性质的分支学科。
在化工工程中,热力学考试是重要的评估学生理解能力和应用能力的手段之一。
本文将介绍化工热力学考试的重点内容,包括热力学基本概念、热力学过程以及热力学计算方法。
一、热力学基本概念1. 系统和环境在热力学中,我们将研究对象称为系统,而系统以外的一切称为环境。
系统和环境之间可以进行物质和能量的交换。
2. 状态函数和过程函数状态函数是系统状态的特性,与系统的初始状态和最终状态有关,例如温度、压力、体积等。
过程函数是与系统经历的过程有关的函数,例如热量、功、摩尔数等。
在热力学计算中,需要了解状态函数和过程函数的特性及其在不同过程中的变化规律。
3. 热力学第一定律热力学第一定律是能量守恒定律的推广。
它表明能量可以从一种形式转化为另一种形式,但总能量守恒。
它可以表示为ΔU = Q - W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做功。
二、热力学过程1. 等温过程在等温过程中,系统的温度保持不变。
根据热力学第一定律,等温过程中的吸热量与所做的功相等,即Q = W。
2. 绝热过程在绝热过程中,系统与外界没有热量交换。
根据热力学第一定律,绝热过程中吸热量和所做的功为零,即Q = 0,W = 0。
3. 等压过程在等压过程中,系统的压力保持不变。
根据热力学第一定律,等压过程中的吸热量等于系统所做的功加上外界对系统所做的功,即Q = ΔH = ΔU + PΔV。
4. 等体过程在等体过程中,系统的体积保持不变。
根据热力学第一定律,等体过程中的吸热量等于系统内能的增量,即Q = ΔU。
三、热力学计算方法1. 熵变计算熵是一个系统热力学状态函数,它描述了系统的无序程度。
熵变可以通过ΔS = Q/T计算得到,其中ΔS表示熵变,Q表示吸热量,T表示系统的温度。
2. Gibb自由能计算Gibb自由能是判断系统在恒温恒压条件下是否可逆进行的指标。

一, 课程简介化工热力学是化学工程学科的一个重要分支,是化工类专业学生必修的基础技术课程。
化工热力学课程结合化工过程阐述热力学基本原理, 定理及其应用,是解决工业过程(特殊是化工过程)中热力学性质的计算和预料, 相平衡计算, 能量的有效利用等实际问题的。
二, 教学目的培育学生运用热力学定律和有关理论知识,初步驾驭化学工程设计及探讨中获得物性数据;对化工过程中能量和汽液平衡等有关问题进行计算的方法,以及对化工过程进行热力学分析的基本实力,为后续专业课的学习及参与实际工作奠定基础。
三, 教学要求化工热力学是在基本热力学关系基础上,重点探讨能量关系和组成关系。
本课程学习须要具备肯定背景知识,如高等数学和物理化学等方面的基础知识。
采纳敏捷的课程教学方法,使学生能正确理解基本概念,娴熟驾驭各种基本公式的应用领域及应用技巧,驾驭化学工程设计及探讨中求取物性数据及平衡数据的各种方法。
以课堂讲解, 自学和作业等多种方式进行。
四, 教学内容第一章绪论本章学习目的及要求:了解化工热力学的发展简史, 主要内容及探讨方法。
第二章流体的P-V-T关系本章学习目的及要求:了解纯物质PVT的有关相图中点, 线, 面的物理意义,驾驭临界点的物理意义及其数学特征;理解志向气体的基本概念和数学表达方法,驾驭采纳状态方程式计算纯物质PVT性质的方法;了解对比态原理,驾驭用三参数对比态原理计算纯物质PVT性质的方法;了解真实气体混合物PVT性质的计算方法。
第一节纯物质的PVT关系1. 主要内容: P-V相图,流体。
2. 基本概念和知识点:临界点。
3. 实力要求:驾驭临界点的物理意义及其数学特征。
第二节气体的状态方程式1. 主要内容:志向气体状态方程,维里方程,R-K方程。
2. 基本概念和知识点:志向气体的数学表达方法,维里方程,van der Waals方程,R-K方程。
3. 实力要求:驾驭采纳状态方程式计算纯物质PVT性质的方法。
第三节对比态原理及其应用1. 主要内容:三参数对比态原理,普遍化状态方程。

黑龙江省考研化工与制药工程复习资料化工热力学重要内容解析在初步了解题目需求后,我将按照化工热力学的重要内容为您整理一篇1500字的文章。
以下是该文章的内容:一、热力学基础概念热力学是研究物质热现象和能量转化的科学,是化工过程中不可或缺的重要学科。
在化工与制药工程的考研复习中,对热力学基本概念的掌握是关键。
其中,温度、压力、物质量以及能量等概念是最基础的要素。
温度是物质内部的热运动程度的物理量,可用开尔文(K)或摄氏度(℃)表示。
压力是单位面积上的力的大小,通常以帕斯卡(Pa)表示。
物质量指的是物质所包含的质量,以千克(kg)为单位。
能量是物质发生变化时所表现的能力,常以焦耳(J)来衡量。
二、热力学第一定律热力学第一定律(能量守恒定律)是热力学中最重要的基本定律之一。
它表明,在一个系统中,能量既不会凭空消失,也不会凭空产生,只会进行转化。
能量守恒定律可以表示为Q = U + W,其中Q表示热量的增量,U表示内能的增量,W表示对外界做的功。
该定律的理解对于化工工程的设计和能量优化至关重要。
三、热容、焓和熵热容指的是物质在温度变化时吸收或释放的热量与温度变化的比值。
它是反映物质热惰性的重要物理量,用来描述物体对热能转移的响应能力。
焓是在恒压条件下物质含有的能量,常用来描述化学反应过程中的能量变化。
熵是将系统的无序程度定量化的物理量,它与反应的方向性以及热力学均衡密切相关。
四、热力学第二定律热力学第二定律是热力学中的核心定律之一,也是制药工程中重要的基础。
它涉及到了热能的转化方向,表明热量只能从高温物体传递到低温物体。
根据热力学第二定律,熵的总体变化在一个孤立系统中始终为正,即系统的总熵增加。
这个原理在工业过程中的应用十分广泛。
五、化工反应热力学化工反应热力学研究化学反应过程中能量的转化和热平衡状态。
其中最常用的是焓变和反应热。
焓变是指在化学反应过程中,所涉及的物质间能量差别的变化。
反应热则是指热量在化学反应中的变化。


化工热力学知识点框架总结热力学是一门研究能量转化和能量传递规律的自然科学。
在化工领域,热力学是一门重要的基础学科,它不仅是理论研究的基础,也是工程设计和实践的重要依据。
本文将对化工热力学的相关知识点进行总结,包括热力学基本概念、热力学系统与过程、物态方程、热力学第一定律、热力学第二定律、熵和热力学函数等内容。
1. 热力学基本概念热力学是研究能量转化和能量传递的规律的一门科学,它是人们认识能源转化过程的基础。
热力学基本概念包括系统、边界、环境、状态、过程等。
系统是研究对象的一部分,可以是封闭系统、开放系统或闭合系统;边界是系统与环境之间的分界面;环境是系统外部的一切事物;状态是系统在一定条件下所处的特定状态,可以通过状态方程描述;过程是系统从一个状态变为另一个状态的行为。
2. 热力学系统与过程根据热力学研究对象的不同,系统可以分为孤立系统、封闭系统和开放系统。
孤立系统与外界无能量和物质的交换;封闭系统能与外界进行能量交换但不能与物质交换;开放系统能与外界进行能量和物质的交换。
根据系统的体积和质量的变化,热力学过程可以分为等体过程、等压过程、等温过程和绝热过程。
等体过程中系统的体积不变,等压过程中系统的压强不变,等温过程中系统的温度不变,绝热过程中系统与外界无热交换。
3. 物态方程物态方程描述了气体的状态参数之间的关系,最常用的气体状态方程是理想气体状态方程。
理想气体状态方程描述了理想气体的压强、体积、温度之间的关系,可以表示为P*V=n*R*T,其中P为气体的压强,V为气体的体积,n为气体的物质量,R为气体的特定常数,T为气体的温度。
除了理想气体状态方程,还有范德瓦尔斯方程等描述气体状态的方程。
在实际工程中,通过物态方程可以描述气体在不同条件下的状态参数,为工程设计和生产提供基础数据。
4. 热力学第一定律热力学第一定律是能量守恒定律的表达,在闭合系统中能量不会自发减少或增加。
热力学第一定律可以表达为系统内能的变化等于系统所做的功与系统所吸收的热的代数和。
第一章绪论考核知识点1.1 化工热力学的地位和作用1.2 化工热力学的主要内容、方法与局限性1.2.1化工热力学研究的主要内容1.2.2化工热力学研究的主要方法1.2.3化工热力学的局限性1.3化工热力学在化工研究与开发中的重要应用1.4 如何学好化工热力学1.5 热力学基本概念回顾考核要求领会:(1)热力学是研究能量、能量转化以及与能量转化有关的热力学性质间相互关系的科学;(2)化工热力学是研究热力学原理在化工过程中的应用了解:热力学的状态函数法、热力学演绎方法与理想化方法等基本研究方法以及以Gibbs函数作为学习化工热力学课程的学习方法第二章流体的p-V-T关系考核知识点2.1纯物质的p-V-T性质2.2 流体的状态方程2.2.1 立方型状态方程2.2.2 多参数状态方程2.3 对应态原理及其应用2.3.1对应态原理2.3.2 三参数对应态原理2.3.3 普遍化状态方程2.4流体的蒸气压、蒸发焓和蒸发熵2.4.1 蒸气压2.4.2蒸发焓和蒸发熵2.5 混合规则与混合物的p-V-T关系2.5.1混合规则2.5.2混合物的状态方程2.6液体的pVT关系2.6.1液体状态方程2.6.2普遍化关联式考核重点:Virial 方程;立方型状态方程要求了解与掌握:(1)纯流体p、V、T行为:纯物质p-V图、p-T图及图中点、线和区域意义;临界点意义、超临界区(流相区)特性(2)状态方程分类和价值:①理想气体状态方程、气体通用常数R的意义和单位;②Virial方程:压力多项式、体积多项式、截项Virial方程Virial系数BC意义;③立方型状态方程:立方型状态方程中参数ab意义;立方型状态方程迭代计算法;立方型状态方程三个根的意义(3)对比态原理和普遍化关系①对比态原理②偏心因子ω定义、物理意义和计算;③以偏心因子ω为第三参数计算压缩因子的方法:普遍化第二Virial系数法和普遍化压缩因子法(4)真实气体混合物与液体的p-V-T关系①真实气体混合物p-V-T关系简便计算方法:虚拟临界参数法;②常用混合规则意义混合物的第二Virial系数与混合物立方型方程;③液体的p-V-T关系第三章纯物质(流体)的热力学性质与计算考核知识点3.1 热力学性质间的关系3.1.1 热力学基本方程3.1.2 点函数间的数学关系3.1.3 Maxwell关系式3.1.4 Maxwell关系式的应用3.2 单相系统的热力学性质3.3 用剩余性质计算系统的热力学性质3.4 用状态方程计算热力学性质3.5 气体热力学性质的普遍化关系3.5.1 普遍化Virial系数法3.5.2 普遍化压缩因子法3.6 纯组分的逸度与逸度系数3.6.1 逸度和逸度系数的定义3.6.2 纯气体逸度(系数)的计算3.6.3 温度和压力对逸度的影响3.6.4 纯液体的逸度3.7 纯物质的饱和热力学性质计算3.7.1 纯组分的气液平衡原理3.7.2 饱和热力学性质计算3.8 纯组分两相系统的热力学性质及热力学图表3.8.1 纯组分两相系统热力学性质3.8.2 热力学性质图表3.8.3 热力学性质图表制作原理考核重点:①热力学性质计算、剩余性质及其应用;②T-S图及水蒸气特性表意义和应用考核要求(1)热力学性质间关系①单相封闭系统的热力学基本方程;②状态函数间的数学关系式;③Maxwell关系式要求了解与掌握:(1)dS方程、dH方程和dU方程(2)热力学性质计算①剩余性质MR定义:HR、SR和GR基本计算式;②由HR和SR计算焓H和熵S的方法;③由普遍化第二Virial系数法和普遍化压缩因子法计算HR和SR以及H和S的方法(3)纯物质逸度和逸度系数①纯物质逸度、逸度系数完整定义和物理意义;②纯气体逸度计算方法;③纯液体逸度计算方法(4)两相系统热力学性质及热力学图表①单组分系统气液平衡两相混合物热力学性质计算方法;②干度x的意义;③T-S图意义及应用;常见化工过程物质状态变化在T-S图上的表示方法;用T-S图数据计算过程热和功以及热力学性质的变化值;④水蒸汽表中各栏目意义及关系水蒸汽表使用方法第四章溶液热力学基础考核知识点4.1 可变组成系统的热力学关系4.2 偏摩尔性质4.3 Gibbs.Duhem方程4.4 混合物组分的逸度和逸度系数4.4.1 混合物逸度与逸度系数的计算方法4.4.2 混合物逸度与组分逸度之间的关系4.4.3 组分逸度与温度、压力间的关系4.5 理想溶液4.5.1 理想溶液与标准态4.5.2理想溶液的特征4.5.3理想溶液标准态之间的关系4.6 混合过程性质变化、体积效应与热效应4.6.1 混合体积效应与混合热效应4.6.2 混合热效应4.7过量性质与活度系数4.8液体混合物中组分活度系数的测定方法4.8.1 汽液平衡法4.8.2 Gibbs-Duhem方程法4.8.3 溶剂与溶质的活度系数4.8.4 溶剂与溶质的活度系数测定法4.9 活度系数模型4.9.1 正规溶液与Scatchard-Hildebrand活度系数方程4.9.2 无热溶液与Flory-Huggins方程4.9.3 Wohl方程4.9.4 基于局部组成概念的活度系数方程考核重点: 偏摩尔性质;逸度和逸度系数;活度、活度系数和超额自由焓;理想溶液与非理想溶液考核要求(1)敞开系统的热力学基本方程①单相敞开系统的热力学基本方程:d(nU)d(nH)d(nG)d(nA)表达式及应用范围;②化学位μi定义式的各种形式(2)偏摩尔性质①偏摩尔性质定义和物理意义与计算法;②与M的关系;③与μi关系;④Gibbs - Duhem方程的常用形式及用途(3)混合物逸度和逸度系数①混合物的组分逸度和逸度系数定义;②混合物的组分逸度和逸度系数基本计算式;③混合物(整体)的逸度与组分逸度的关系温度和压力对逸度的影响(4)理想溶液①研究理想溶液的目的与理想溶液模型;②理想溶液中组分i的逸度与i组分在标准态下的逸度的关系;③两种理想溶液模型与相应的两种标准态、的表示方法;④理想溶液的特征(5)活度和活度系数活度和活度系数定义、物理意义和应用(6)混合性质变化ΔM①混合性质变化ΔM和混合偏摩尔性质变化定义、物理意义和两者关系;②ΔM和与标准关系;③ΔG与活度关系;④理想溶液混合性质变化ΔGid、ΔUid、ΔHid和ΔSid(7)过量性质ME①过量性质ME和偏摩尔过量性质定义和物理意义;②ME与混合过程过量性质变化ΔME以及混合性质变化ΔM的关系;③GE物理意义GE与活度系数γi关系式及应用(8)活度系数与组成关联式由实验数据确定活度系数①非理想溶液的GE模型:正规溶液模型和无热溶液模型;②常用活度系数与组成关联式:Redlich-Kister关系式;Wohl型方程及其常用形式;Margules方程、Van Laar 方程局部组成概念与Wilson方程、NRTL方程;③确定活度系数与组成关联式中参数的简便方法:由一组精确的气液平衡实验数据由恒沸点下气液平衡数据以及由无限稀释活度系数;以及由少量实验数据确定全浓度范围的活度系数了解与掌握(1)Wilson 方程优点和局限性;(2)UNIQUAC方程与UNIFAC方程第五章相平衡热力学考核知识点5.1 平衡性质与判据5.2 相律与Gibbs.Duhem方程5.3 二元气液平衡相图5.4 气液相平衡类型及计算类型5.4.1 气液相平衡类型5.4.2 气液相平衡计算的准则与方法5.4.3气液平衡过程5.5 由实验数据计算活度系数模型参数5.6 Gibbs-Duhem方程与实验数据的热力学一致性检验5.6.1等温二元汽液平衡数据热力学一致性校验5.6.2 等压二元汽液平衡数据热力学一致性校验5.7 共存方程与稳定性5.7.1 溶液相分裂的热力学条件5.7.2 液液平衡相图及类型5.8 液.液相平衡关系与计算类型5.8.1 液液相平衡准则5.8.2二元系液-液平衡的计算5.8.3 三元系液-液平衡的计算5.9 固.液相平衡关系及计算类型5.10 含超临界组分的气液相平衡考核重点:汽液平衡基本问题及中低压下汽液平衡计算考核要求(1)平衡判据与相律①多相多元系统的相平衡判据及其最常用形式:②相律及其应用(2)汽液平衡基本问题①相变化过程需解决的两类问题:由平衡的温度压力计算平衡各相组成及由平衡各相组成确定平衡的温度压力;②完全互溶二元体系汽液平衡相图;③汽液平衡两种常用的热力学处理方法:活度系数法和状态方程法(3)汽液平衡的计算①工程上常见汽液平衡问题的五种类型:泡点温度、泡点压力、露点温度、露点压力、闪蒸计算②常压或低压下汽液平衡计算方法:完全理想系(气相为理想气体、液相为理想溶液)和部分理想系(气相为理想气体、液相为非理想溶液)汽液平衡计算法(4)汽液平衡数据的热力学一致性检验①热力学一致性检验的基本方程Gibbs - Duhem方程及其扩展形式;②面积法检验恒温VLE数据和恒压VLE数据第六章热力学第一定律及其工程应用考核知识点6.1敞开系统热力学第一定律6.1.1 封闭系统的能量平衡6.1.2 敞开系统的能量平衡6.2 稳定流动与可逆过程6.2.1 稳定流动过程6.2.2 可逆过程6.3 轴功的计算6.3.1 可逆轴功6.3.2 气体压缩及膨胀过程热力学分析6.3.3节流膨胀6.3.4等熵膨胀6.3.5膨胀过程中的温度效应6.4 喷管的热力学基础6.4.1 等熵流动的基本特征6.4.2 气体的流速与临界速度考核重点:能量平衡方程在稳流过程中的应用考核要求:热力学第一定律和能量平衡方程①能量守恒和转化原理;②敞开体系能量平衡方程;③能量平衡方程的不同形式稳流体系能量平衡方程的应用;④轴功的计算;⑤喷管的热力学基础第七章热力学第二定律及其工程应用考核知识点7.1热力学第二定律的表述方法7.1.1过程的不可逆性7.1.2熵7.1.3热源熵变与功源熵变7.2熵平衡方程7.2.1 封闭系统的熵平衡方程式7.2.2 敞开系统熵平衡方程式7.3 热机效率7.4 理想功、损失功与热力学效率7.4.1 理想功7.4.2 稳定流动过程理想功7.4.3 损耗功7.4.4 热力学效率7.5 熵分析法在化工过程中的应用7.5.1 传热过程7.5.2混合与分离过程7.6 有效能及其计算方法7.6.1 有效能的概念7.6.2 有效能组成7.6.3 有效能的计算7.6.4 无效能7.7 有效能衡算方程与有效能损失7.7.1有效能平衡方程7.7.2有效能损失7.8 化工过程能量分析及合理用能7.8.1能量平衡法7.8.2 有效能分析法7.8.3 合理用能准则5.2 考核重点5.2.1能量平衡方程在稳流过程中的应用5.2.2 热功的不等价、熵增原理5.2.3 理想功和损失功考核目标(1)热力学第二定律热功转换的不等价性和熵①热力学第二定律原理热功转化的不等价性:功全部能变化成热热只能够部分变为功热变功的最大效率;②热力学第二定律的三种不同说法;③了解系统的熵变、熵流和熵产等基本概念与描述(2)理想功和损失功①理想功定义和物理意义"完全可逆"的含义;②损耗功定义和物理意义损耗功与过程不可逆性关系;③热力学效率定义和用途④稳流过程的理想功和损耗功的计算(4)有效能①能量存在品质(级别)差异;②有效能的物理意义基态;③有效能和理想功的关系;④稳流物系物理有效能、热量有效能、化学有效能及动能有效能、位能有效能的计算方法;以及有效能效率;(5)熵衡算方程、有效能衡算方程及其应用;(6) 化工过程能量分析及合理用能准则第八章蒸汽动力循环与制冷循环考核知识点8.1 蒸汽动力循环-Rankine 循环过程分析8.1.1 Rankine循环8.1.2 Rankine循环的改进8.2 内燃机热力过程分析8.2.1 定容加热循环8.2.2 定压加热循环8.4 燃气轮机过程分析8.5 制冷循环原理与蒸汽压缩制冷过程分析8.4.1 逆向Carnot循环8.4.2 蒸汽压缩制冷循环8.6 其它制冷循环8.6.1 蒸汽喷射制冷8.6.2 吸收制冷8.7 热泵及其应用8.8 深冷循环与气体液化8.7.1 Linde-Hampson系统工作原理8.7.2 系统的液化率及压缩功耗考核要求(1)蒸汽动力循环①理想Rankine循环装置、工作原理和循环工质状态变化;②循环过程热和功、热变功的效率、等熵效率及汽耗率的意义和计算;③提高Rankine循环效率和降低汽耗率的途径:使用回热循环和热电循环④用T-S图表示循环工质各状态点用蒸汽表数据进行有关计算(2)气体绝热膨胀的制冷原理①节流膨胀降温(制冷)原理、Joule-Tompson系数和温度降;②对外做功绝热膨胀降温(制冷)原理、等熵系数和温度降;③两种降温(制冷)方法比较(深度冷冻循环不作要求)(2)制冷循环①蒸汽压缩制冷循环装置、工作原理和工作参数(蒸发温度、冷凝温度和过冷温度)的确定制冷系数的意义;②制冷剂选择要求(多级制冷和复迭式制冷不要求);③由制冷循环工作参数及制冷量确定制冷剂循环量、制冷系数和功耗在T-S图上表示循环工质各状态点④吸收制冷循环装置和工作原理和热能利用系数计算第九章化学反应平衡考核知识点9.1 反应进度与化学反应计量学9.2 化学反应平衡常数及其计算9.2.1化学反应平衡的判据9.2.2标准自由能变化与反应平衡常数9.2.3平衡常数的估算9.3 温度对平衡常数的影响9.4 平衡常数与组成的关系9.4.1 气相反应9.4.2 液相反应9.4.3非均相化学反应9.5 单一反应平衡转化率的计算9.6反应系统的相律和Duhem理论9.7复杂化学反应平衡的计算9.7.1 以反应进度为变量的计算方法9.7.2 Gibbs自由能最小原理计算方法考核要求(1)化学反应计量系数与反应进度①反应进度定义;②封闭系统物质摩尔数微分变化与反应进度微分变化的关系(2)化学反应平衡常数及有关计算①化学反应平衡判据:标准自由焓变化ΔGΘ与平衡常数K的关系用活度或逸度表示平衡常数K;ΔGΘ与ΔG意义和作用差异;②平衡常数估算方法(3)平衡常数与平衡组成关系①气相反应中K、Kf 、Kp、Ky的意义及相互关系;②由K计算平衡组成的方法(气相反应);液相反应中由K计算平衡组成的方法(4)温度对平衡常数的影响温度与平衡常数关系基本方程-Van't Hoff等压方程式微分形式和积分形式(5)工艺参数与平衡组成关系温度、压力及惰气量对平衡组成影响表达式及应用。
化工热力学专业知识点总结一、物质的热力学性质1.热力学状态方程:描述热力学系统状态的方程,可以通过实验数据拟合得到,常见的有理想气体状态方程、范德华方程等。
2.热力学过程:系统经历的状态变化过程,包括等温过程、等容过程、绝热过程等,这些过程可以通过热力学定律进行定量描述和分析。
3.热力学势函数:用来描述系统稳定状态的函数,常见的有焓、内能、吉布斯函数等。
4.相变热力学性质:液相、气相、固相之间的相互转化过程,包括液气平衡、固液平衡等。
5.热力学平衡条件:系统达到热力学平衡的条件,包括热平衡、力学平衡、相平衡等。
二、热力学定律1.热力学第一定律:能量守恒定律,即能量既不会凭空消失,也不会凭空产生,只会在不同形式之间进行转化。
2.热力学第二定律:热不能自发地从低温物体传递到高温物体,这是宇宙中熵增加的基本规律。
3.热力学第三定律:当温度趋近于绝对零度时,系统的熵趋于常数,这是绝对零度不可能实现的热力学定律。
化工热力学不仅包含了上述物质的热力学性质和热力学定律,还涉及到一些实际的应用技术和工程问题。
例如,化工过程中的热力学分析、热力学循环、热能利用、燃烧热力学等内容。
下面我们来重点介绍一些与化工工程实际相关的热力学知识点。
三、热力学循环1.卡诺循环:理想可逆循环过程,由等温膨胀、绝热膨胀、等温压缩和绝热压缩四个过程组成,是热机效率的理论极限。
2.汽轮机循环:以水蒸气为工质的循环,包括理想朗肯循环、实际朗肯循环、再热朗肯循环等。
3.制冷循环:以制冷剂为工质的循环,包括制冷机、空调机、冷冻机等。
四、燃烧热力学1.燃烧过程:燃烧是一种复杂的热力学过程,包括燃烧反应机理、燃料燃烧热值、燃烧平衡等内容。
2.燃烧产物:燃料燃烧的产物包括二氧化碳、水蒸汽、一氧化碳、氨气、硫化物等,这些产物的生成与燃烧条件密切相关。
3.燃烧效率:燃料的利用效率,可以通过燃烧反应焓变来计算。
五、化工热力学应用1.热力学分析:化工反应器设计、炼油装置设计、化工装备热力计算等都需要进行热力学分析。
化工热力学知识点总结思维导图化工工程是涉及化学反应、热传递、质量转移等许多学科的交叉学科。
在这个复杂的过程中,热力学是一个非常重要的学科,它研究了化学反应、物质转化过程中的能量关系。
热力学在化工工程中有着广泛的应用,涉及到反应过程的热力学性质、热力学分析和计算等方面。
本文将对化工热力学知识点进行总结,并提供一份简洁的思维导图。
第一部分:基本概念1.1 热力学系统定义:热力学所研究的任何物体或物质都称为系统。
分类:封闭系统、开放系统、孤立系统。
1.2 状态量定义:用于描述系统状态的量,如压力、温度、体积、物质的量等。
分类:广延量、强度量、定量量、自由量、参量等。
1.3 热力学过程定义:由一个状态变化到另一个状态的过程称为热力学过程。
分类:可逆过程、不可逆过程、等压过程等。
1.4 热力学第一定律定义:能量守恒定律。
公式:ΔU=Q-W解释:U代表系统内能,Q代表热量,W代表功。
第二部分:热力学计算2.1 热力学平衡定义:系统属性、热力学状态处于平衡状态的条件称为热力学平衡。
条件:熵最大、内能最小。
2.2 热力学计算公式:ΔG=ΔH-TΔS解释:G代表吉泽自由能,H代表焓,S代表熵。
2.3 热力学逆过程定义:系统在平衡状态下,由外界施加的微小变化。
公式:dS/dt=Q/T第三部分:化学反应3.1 化学反应热力学性质定义:化学反应在热力学上可以由焓和熵来描述。
公式:ΔH=ΔHp-ΔHr解释:Hp代表生成热,Hr代表反应热。
3.2 变温变压等热力学性质计算公式:(ΔG/ΔT)p=ΔH/ΔT-V(ΔS/ΔT)(ΔG/ΔP)p=V(ΔS/ΔP)-ΔV/ΔP解释:ΔG代表自由能变化量,ΔH代表焓变化量,ΔS代表熵变化量,ΔV代表体积变化量。
第四部分:区域综合4.1 热力学循环定义:通过吸收和放出热量,沿固定的轨迹完成气态、液态和固态之间的相互转换的过程。
条件:热机循环和制冷循环。
4.2 活动热力学定义:在非平衡状态下,化学势是描述物质转移的最适宜量。
第一章热力学第一定律及其应用本章内容:*介绍有关热力学第一定律的一些基本概念,热、功、状态函数,热力学第一定律、热力学能和焓,明确准静态过程与可逆过程的意义,进一步介绍热化学。
第一节热力学概论*热力学研究的目的、内容*热力学的方法及局限性*热力学基本概念一.热力学研究的目的和内容目的:热力学是研究热和其它形式能量之间相互转换以及转换过程中所应遵循的规律的科学。
内容:热力学第零定律、第一定律、第二定律和本世纪初建立的热力学第三定律。
其中第一、第二定律是热力学的主要基础。
一.热力学研究的目的和内容把热力学中最基本的原理用来研究化学现象和化学有关的物理现象,称为化学热力学。
化学热力学的主要内容是:*利用热力学第一定律解决化学变化的热效应问题;*利用热力学第二律解决指定的化学及物理变化实现的可能性、方向和限度问题,建立相平衡、化学平衡理论;*利用热力学第三律可以从热力学的数据解决有关化学平衡的计算问题。
二、热力学的方法及局限性方法:以热力学第一定律和第二定律为基础,演绎出有特定用途的状态函数,通过计算某变化过程的有关状态函数改变值,来解决这些过程的能量关系和自动进行的方向、限度。
而计算状态函数的改变只需要根据变化的始、终态的一些可通过实验测定的宏观性质,并不涉及物质结构和变化的细节。
二、热力学的方法及局限性优点:*研究对象是大数量分子的集合体,研究宏观性质,所得结论具有统计意义。
*只考虑变化前后的净结果,不考虑物质的微观结构和反应机理,简化了处理方法。
二、热力学的方法及局限性局限性:*只考虑变化前后的净结果,只能对现象之间的联系作宏观的了解,而不能作微观的说明或给出宏观性质的数据。
例如:热力学能给出蒸汽压和蒸发热之间的关系,但不能给出某液体的实际蒸汽压的数值是多少。
*只讲可能性,不讲现实性,不知道反应的机理、速率。
*系统与环境系统:用热力学方法研究问题时,首先要确定研究的对象,将所研究的一部分物质或空间,从其余的物质或空间中划分出来,这种划定的研究对象叫体系或系统(system)。
第一章绪论
(1) 明确化工热力学的主要任务是应用经典热力学原理,推算物质的平衡性质,从而解决实际问题,所以物性计算是化工热力学的主要任务。
(2) 掌握热力学性质计算的一般方法
(3) 热力学性质计算与系统有关。
大家必须明确不同系统的热力学性质计算与其热力学原理的对应关系,这一点对于理解本课程的框架结构十分重要。
第二章流体的P-V-T关系
(4) 应该理解状态方程不仅可以计算流体的p-V-T性质,而且在推算热力学性质中状态方程是系统特征的重要模型。
(5) 熟悉纯物质的P-V-T相图及其相图上的重要概念,如三相点、临界点、汽化线、熔化线、升华线、等温线、等压线等容线、单相区、两相共存区、超临界流
体区等。
能在p-v图和p-T图中定性表达出有关热力学过程和热力学循环。
(6) 掌握由纯物质的临界点的数学特征约束状态方程常数的方法。
(7) 理解以p为显函数和以V为显函数的状态方程的形式,以及它们在性质计算中的区别。
(8) 能借助于软件用PR和SRK方程进行p-V-T性质计算,清楚计算时所需要输入的物性常数及其来源。
对于均相混合物性质的计算,需要应用混合法则,了解
相互作用参数的含义和取值。
(9) 理解对应态原理的概念,掌握用图表和三参数对应态原理计算物性的方法,了解偏心因子对应态原理。
(10) 能够通过查寻有关手册,估算蒸汽压、饱和气液相摩尔体积、汽化焓等物性,清楚它们之间的关系。
第三章纯流体热力学性质的计算
(11) 均相封闭系统的热力学原理给出了热力学性质之间的普遍化依赖关系,结合表达系统特征的模型就能获得不同热力学性质之间的具体表达式。
在物性推算中
应该明确需要给定的独立变量,需要计算的从属变量,以及从属变量与独立变
量之间的关系式。
另外,还必须输入有关模型参数,结合一定的数学方法,才
能完成物性推算。
(12) 清楚剩余性质的含义,能用剩余性质和理性气体热容表达状态函数的变化。
能够用给定的状态方程推导出剩余性质表达式。
(13) 掌握状态方程计算纯物质饱和热力学性质饿原理,这是属于非均相系统性质计算,在计算时需要将状态方程与相平衡准则结合起来。
(14) 掌握纯物质的压焓图和温熵图的特征以及相图上的重要的点、线、面。
运用压焓图和温熵图定性表达热力学状态、过程和定量计算热力学性质。
了解压焓图、温熵图以及p-V-T相图之间的相互对应关系。
(15) 熟练掌握并能运用水的性质表。
(16) 了解用热力学性质解析计算方法来制作热力学性质图、表的基本原理。
第四章溶液热力学
(17) 通过本章的学习,必须弄清非均相系统与均相敞开系统之间的关系。
对于非均相系统的物性计算,首先必须确定系统的相平衡状态,然后才能进一步计算平
衡的各相的性质。
为了得到非均相系统的相平衡准则,均相敞开系统的热力学
原理是不可缺少的基础。
另外,均相敞开系统的热力学关系式对于混合物的性质随组成的变化也十分重要。
(18) 通过本章的学习,我们已经掌握了两种计算混合物性质的方法:一种是第三章中所讨论的均相系统的热力学关系,即视作为一个定组成混合物;另一种则是将混合物看作为一均相敞开系统,讨论摩尔性质随组成的变化。
(19) 掌握偏摩尔性质的定义及用途,特别重视偏摩尔性质之间的约束关系式——Gibbs-duhem方程及其应用。
(20) 弄清楚混合过程性质变化、超额性质之间的区别和联系。
(21) 理解纯物质和定组成混合物的逸度和逸度系数的定义、逸度及逸度系数的意义和作用。
掌握逸度和逸度系数与温度、压力之间的微分和积分关系式,能用状态方程推导出逸度和逸度系数的关系式。
能用状态方程和三参数对应态原理计算逸度、逸度系数以及其他热力学性质。
(22) 理解混合物中组分逸度、组分逸度系数和活度系数的定义和作用。
(23) 本章中两个较难理解的概念是两个理想溶液参考态,即Lewis-Randall规则和Henry规则。
作为理想溶液应同时满足这两个规则,但真实稀溶液的溶剂和溶质也分别符合Lewis-Randall规则和Henry规则。
(24) 超额性质和活度系数都要涉及到参考态的选择问题。
一般,对于亚临界组分,采用Lewis-Randall规则的对称归一化;而对于超临界组分,应采用参考Henry 规则的不对称归一化。
应了解两种不同归一化定义的活度系数之间的关系。
(25) 熟悉常见的活度系数模型。
第六章化工过程的能量分析
(26) 稳定流动系统的热力学第一定律与封闭系统是不一样的,常用焓值进行热量衡算,若使用热力学性质图,常使用温熵图和压焓图。
(27) 能量的可利用程度或品质高低由有效能来衡量。
通过有效能来计算过程的能量变化,可使我们知道过程是否合理,为优化工艺路线提供热力学上的依据。
第七章压缩、制冷和蒸气动力循环
(28) 将稳流系统热力学第一定律应用于动力循环和制冷循环中,进行热量和热力学效率计算。
常用的是水蒸气和空气图表以及氨、氟里昂的温熵图和压焓图。
当然还可以通过焓的热力学关系式并利用合适的状态方程进行焓和熵的计算。
(29) 多级压缩制冷循环和复迭式压缩制冷循环。