碳酸氢钠碳酸氢钙硫单质
- 格式:ppt
- 大小:2.58 MB
- 文档页数:45

碳酸钠、碳酸氢钠和碳酸钙教学设计一、教学目标:1、了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙的主要性质及其用途;2、掌握鉴定(检验)碳酸根离子的方法;3、掌握判断复分解反应发生的条件;4、充分认识到生活中处处有化学。
二、教学重难点:重点:1、氯化钠、碳酸钠、碳酸氢钠和碳酸钙的主要性质及其用途;2、鉴定(检验)碳酸根离子的方法难点:能根据复分解反应发生的条件判断酸、碱、盐之间的反应能否发生。
三、教学过程[板书]二、碳酸钠、碳酸氢钠和碳酸钙[引导]上节课我们了解了氯化钠的重要用途,那这三种盐又会有什么用途呢? [介绍](播放有关录像)碳酸钠在工业上广泛用于玻璃、造纸、纺织和洗涤剂的生产等。
碳酸钙大量用于建筑业,天然存在的石灰石、大理石的主要成分就是碳酸钙,它们都是重要的建筑材料。
天安门前的华表、人民大会堂的许多柱子就是用大理石做的。
碳酸钙还用作补钙剂。
碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一。
在医疗上,它是治疗胃酸过多症的一种药剂。
[提问]你能写出这三种物质的化学式,说出它们的俗称吗?[回答]碳酸钠:Na2CO3,俗称纯碱、苏打;碳酸氢钠:NaHCO3,俗称小苏打;碳酸钙:CaCO3。
[教师]我们知道:纯碱在化工生产中具有重要的用途,那我国是不是最早生产纯碱的国家呢?[投影] 我国制碱工业的先驱——侯德榜纯碱工业始创于18世纪,在很长一段时间内制碱技术把持在英、法、德、美等西方发达国家手中。
1921年正在美国留学的侯德榜先生为了发展我国的民族工业,应爱国实业家范旭东先生之邀毅然回国,潜心研究制碱技术,成功地摸索和改进了西方的制碱方法,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法)。
侯德榜为纯碱和氮肥工业技术的发展作出了杰出的贡献。
[教师]侯德榜先生凭借自己对科学的一片赤诚,怀着一颗爱国的心,为我国的制碱工业作出了巨大贡献,发展了我国的民族工业。
希望大家也能利用自己的所学为祖国,为社会做点事情。
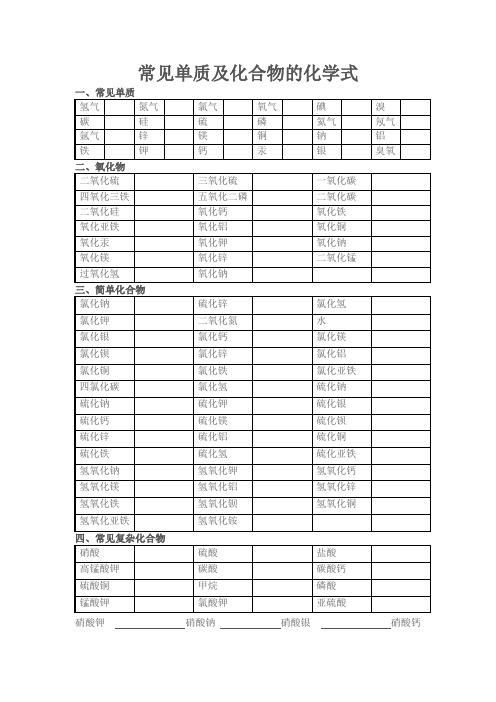
常见单质及化合物的化学式一、常见单质氢气氮气氯气氧气碘溴碳硅硫磷氦气氖气氩气锌镁铜钠铝铁钾钙汞银臭氧二、氧化物二氧化硫三氧化硫一氧化碳四氧化三铁五氧化二磷二氧化碳二氧化硅氧化钙氧化铁氧化亚铁氧化铝氧化铜氧化汞氧化钾氧化钠氧化镁氧化锌二氧化锰过氧化氢氧化钠三、简单化合物氯化钠硫化锌氯化氢氯化钾二氧化氮水氯化银氯化钙氯化镁氯化钡氯化锌氯化铝氯化铜氯化铁氯化亚铁四氯化碳氯化氢硫化钠硫化钠硫化钾硫化银硫化钙硫化镁硫化钡硫化锌硫化铝硫化铜硫化铁硫化氢硫化亚铁氢氧化钠氢氧化钾氢氧化钙氢氧化镁氢氧化铝氢氧化锌氢氧化铁氢氧化钡氢氧化铜氢氧化亚铁氢氧化铵四、常见复杂化合物硝酸硫酸盐酸高锰酸钾碳酸碳酸钙硫酸铜甲烷磷酸锰酸钾氯酸钾亚硫酸硝酸钾硝酸钠硝酸银硝酸钙硝酸镁硝酸钡 硝酸锌 硝酸铝 硝酸铜 硝酸铁硝酸亚铁 硝酸铵 硫酸钾 硫酸钠 硫酸银硫酸钙 硫酸镁 硫酸钡 硫酸锌 硫酸铝硫酸铜 硫酸铁 硫酸亚铁 硫酸铵 碳酸钾碳酸钠 碳酸银 碳酸钙 碳酸镁 碳酸钡碳酸锌 碳酸铝 碳酸铜 碳酸铁 碳酸亚铁碳酸铵 甲烷 葡萄糖 高锰酸钾 锰酸钾氯酸钾 碳酸氢钠 碳酸氢钙 磷酸氢钙 磷酸二氢钙五、请写出下列反应的化学方程式 碳在氧气中燃烧C +O2点燃 CO2 硫在氧气中燃烧S +O2点燃 SO2 磷在氧气中燃烧4P +5O2点燃 2P2O5 镁在氧气中燃烧2Mg+ O2点燃2MgO 铁在氧气中燃烧3Fe +2O2点燃 Fe3O4 铁生锈4Fe +3O2 2Fe2O3铜与氧气反应 2Cu +O2点燃2CuO 氯酸钾受热分解2KClO3 2KCl +3O2↑高锰酸钾受热分解2KMnO4△ K2MnO4+MnO2+O2↑水电解2H2O 通电2H2↑+O2↑氢气燃烧生成水2H2+O2点燃2H2O双氧水在二氧化锰作用下分解2H2O2 2H2O+ O2↑二氧化碳使澄清石灰水变浑浊Ca(OH)2+CO2===CaCO3↓+H2O碳酸钙与盐酸反应制取二氧化碳CaCO3+2HCl===CaCl2+H2O+CO2↑二氧化碳通入水中CO2+H2O==H2CO3碳酸受热分解H2CO3△CO2↑+H2O往浑浊的石灰水中继续通入二氧化碳,石灰水变澄清CaCO3+H2O+CO2===Ca (HCO3)2将上面得到的溶液加热,石灰水又变浑浊Ca(HCO3)2△CaCO3↓+H2O+CO2↑工业上制取二氧化碳CaCO3高温CaO+CO2↑生石灰与水反应生成熟石灰CaO+H2O Ca(OH)2用氢氧化钠吸收二氧化碳2NaOH+CO2Na2CO3+H2O 光合作用6CO2+12H2O光C6H12O6+6O2叶肉细胞呼吸作用C6H12O6+6O2酶6CO2+12H2O甲烷燃烧CH4+2O2点燃CO2+2H2O。

高考化学大题常考知识点高考化学作为高中化学课程的一种特殊形式,大题有哪些常考的知识点呢?接下来我为你整理了,一起来看看吧。
:碳酸盐1.一些碳酸盐的存在、俗称或用途。
大理石、石灰石、蛋壳、贝壳、钟乳石—CaCO3;纯碱、苏打—Na2CO3;小苏打—NaHCO3可用于食品发泡,治疗胃酸过多症碳铵—NH4HCO3氮肥;草木灰的主要成分—K2CO3钾肥;锅垢的主要成分—CaCO3和MgOH2;制普通玻璃原料—石灰石、纯碱、石英;制水泥的原料—石灰石、粘土2.碳酸的正盐和酸式盐1、相互转化:碳酸钙和碳酸氢钙的转化实验现象;石灰岩洞和钟乳石形成碳酸钠和碳酸氢钠的转化碳酸钠溶液跟盐酸反应不如碳酸氢钠剧烈;除去碳酸氢钠溶液中的碳酸钠杂质;除去碳酸钠中碳酸氢钠杂质;除去二氧化碳中的氯化氢杂质为什么不用碳酸钠溶液而用碳酸氢钠溶液等问题;在饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠析出的原因:①消耗了水②碳酸钠的溶解度大于碳酸氢钠③生成碳酸氢钠的质量大于原溶液中碳酸钠的质量2、共同性质:都能跟酸比碳酸强的酸反应生成二氧化碳气体。
碳酸盐的检验3、稳定性比较:正盐比酸式盐稳定稳定性:酸<酸式盐<正盐,是一个比较普遍的现象如HClO<CaClO2;H2SO3<Na2SO3等碳酸氢钠受热的实验现象;碳酸氢钙溶液受热的实验现象4、溶解性比较:一般说酸式盐的溶解性强于正盐如CaHCO32>CaCO3,反例:NaHCO3<Na2CO35、碳酸氢钠与碳酸钠某些反应的异同①、都有碳酸盐的通性—-与盐酸反应生成二氧化碳要注意熟悉反应时耗酸量及生成气体量的各种情况下的比较。
②、跟石灰水或氢氧化钡溶液都生成白色沉淀;③、碳酸氢钠能跟氢氧化钠等碱反应而碳酸钠不反应;④、碳酸钠跟氯化钙或氯化钡溶液易生成碳酸盐沉淀,而碳酸氢钠跟盐类稀溶液不易生成沉淀。
:氯化氢与盐酸1、浓盐酸被二氧化锰氧化实验室制氯气2、盐酸、氯化钠等分别与硝酸银溶液的反应盐酸及氯化物溶液的检验;溴化物、碘化物的检验3、盐酸与碱反应4、盐酸与碱性氧化物反应5、盐酸与锌等活泼金属反应6、盐酸与弱酸盐如碳酸钠、硫化亚铁反应7、盐酸与苯酚钠溶液反应8、稀盐酸与漂白粉反应9、氯化氢与乙烯加成反应10、氯化氢与乙炔加成反应制聚氯乙烯11、漂白粉与空气中的二氧化碳反应说明碳酸酸性强于HClO12、HF、HCl、HBr、HI酸性的比较HF为弱酸,HCl、HBr、HI为强酸,且酸性依次增强13、用于人工降雨的物质有哪些?干冰、AgI:一些常见物质的成分1.漂白粉有效成分CaClO2,非有效成分CaCl22.黄铁矿FeS2;3.黑火药C,KNO3,S;4.明矾KAlSO42??12H2O;5.绿矾FeSO4??7H2O;6.蓝矾胆矾CuSO4??5H2O;7.重晶石BaSO48.纯碱、苏打Na2CO3;9小苏打NaHCO3;10生石灰CaO;11熟石灰、消石灰CaOH2;12.石灰石,大理石CaCO3;13王水浓硝酸浓盐酸1∶3;14.石英.水晶硅石SiO2;15.刚玉Al2O3;16.锅垢CaCO3和MgOH2;17.铁红,赤铁矿Fe2O318.磁性氧化铁,磁铁矿Fe3O4;19.铅笔芯材料—粘土和石墨;20.煤—有机物和无机物组成的复杂混合物;21.石油—主要由烷烃,环烷烃,芳香烃组成的复杂混合物22.沼气,天然气CH4;23碱石灰CaO,NaOH;24氯仿CHCl3;24.电石CaC2;25.甘油—丙三醇;26.石炭酸—苯酚;27.福尔马林--甲醛溶液;28.肥皂—高级脂肪酸的钠盐:硫单质及其化合物一硫单质的反应非金属性弱于卤素、氧和氮1.硫与氧气反应只生成二氧化硫,不生成三氧化硫2.硫与氢气加热反应3.硫与铜反应生成+1价铜化合物,即硫化亚铜4.硫与铁反应,生成+2价铁化合物,即硫化亚铁5.硫与汞常温反应,生成HgS撒落后无法收集的汞珠应撒上硫粉,防止汞蒸气中毒7.硫与强碱溶液反应生成硫化物和亚硫酸盐试管上粘附的硫除了可用CS2洗涤以外,还可以用NaOH溶液来洗3S+6NaOH=2Na2S+Na2SO3+3H2O二二氧化硫或亚硫酸的反应弱氧化性,强还原性,酸性氧化物1.氧化硫化氢2.被氧气氧化工业制硫酸时用催化剂;空气中的二氧化硫在某些悬浮尘埃和阳光作用下被氧气氧化成三氧化硫,并溶解于雨雪中成为酸性降水。

2023届高考化学重难点化学方程式(无机)一、碱金属1.钠露置在空气中变暗:4Na + O2= 2Na2O2.钠的燃烧(工业生产过氧化钠):2Na + O2Na2O23.钠与硫混合爆炸:2Na + S = Na2S4.钠投入水中:2Na + 2H2O = 2NaOH + H2↑5.钠投入硫酸铜溶液中:2Na + CuSO4+ 2H2O = Na2SO4+ Cu(OH)2↓+ H2↑6.过氧化钠与水反应:2Na2O2+ 2H2O = 4NaOH + O2↑7.过氧化钠与二氧化碳反应:2Na2O2+ 2CO2= 2Na2CO3+ O28.碳酸氢钠与氢氧化钠溶液反应:NaHCO3+ NaOH = Na2CO3+ H2O9.碳酸氢钠溶液与盐酸反应:NaHCO3+ HCl = NaCl + H2O + CO2↑10.向碳酸钠溶液中逐滴加入盐酸:Na2CO3+ HCl(少量)= NaCl + NaHCO3盐酸足量时:Na2CO3+2HCl(足量)=2NaCl + H2O + CO2↑11.少量石灰水与碳酸氢钠溶液反应:Ca(OH)2+ 2NaHCO3= CaCO3↓+ 2H2O + Na2CO3离子方程式:Ca2++2OH-+2HCO3-=CaCO3↓+ 2H2O + CO32-12.足量石灰水与碳酸氢钠溶液反应:Ca(OH)2+ NaHCO3= CaCO3↓+ H2O + NaOH离子方程式:Ca2++ OH-+ HCO3-=CaCO3↓+ H2O13.少量氢氧化钠与碳酸氢钙溶液反应:Ca(HCO3)2+ NaOH = CaCO3↓+ NaHCO3+ H2O离子方程式:Ca2++ OH-+ HCO3-=CaCO3↓+ H2O14.足量氢氧化钠与碳酸氢钙溶液反应:Ca(HCO3)2+ 2NaOH = CaCO3↓+ Na2CO3+ 2H2O离子方程式:Ca2++2HCO3-+2OH-=CaCO3↓+ 2H2O + CO32- 15.侯德榜制碱法:①向NaCl溶液中先通入NH3后通入CO2:NH3+ CO2+ NaCl + H2O = NaHCO3↓+ NH4Cl①碳酸氢钠受热分解:2NaHCO3Na2CO3+ CO2↑+ H2O 16.向饱和碳酸钠溶液中通入二氧化碳气体:Na2CO3+ CO2+ H2O= 2NaHCO3↓二、卤素1.钠在氯气中燃烧:2Na + Cl22NaCl2.铜在氯气中燃烧:Cu + Cl2CuCl23.铁在氯气中燃烧:2Fe + 3Cl22FeCl34.铁与溴单质反应:2Fe + 3Br22FeBr35.碘与铁反应:Fe + I2FeI2(Fe与I2反应时,Fe只能生成+2价)6.氯气与氢气混合光照:H2+ Cl22HCl(爆炸)7.工业制盐酸:H2+ Cl22HCl8.氯气与磷点燃:2P + 3Cl2(少量)2PCl3(液);2P + 5Cl2(足量)2PCl5(固) 9.氯气使湿润布条褪色(氯气溶解于水):Cl2+ H2O HCl + HClO10.次氯酸溶液见光:2HClO2HCl + O2↑11.氯气使湿润的碘化钾淀粉试纸变蓝:Cl2+ 2KI = 2KCl + I212.工业制漂白粉:2Ca(OH)2+ 2Cl2= CaCl2+ Ca(ClO)2+ 2H2O离子方程式:Ca(OH)2+ Cl2= Ca2++Cl-+ClO-+H2O13.漂白粉使用原理:Ca(ClO)2+ CO2+ H2O = CaCO3↓+ 2HClO14.向漂白粉溶液中通入足量SO2气体:Ca(ClO)2+2SO2+2H2O=Ca SO4↓+2HCl+H2SO4离子方程式:Ca2++2ClO -+2SO2+H2O = CaSO4↓+SO42-+Cl-+4H+15.漂白粉固体久置变质:①Ca(ClO)2+ CO2+ H2O = CaCO3+ 2HClO;①2HClO 2HCl + O2↑16.实验室制氯气:①4HCl(浓)+MnO2MnCl2+ Cl2↑+ 2H2O(这是最常用的);①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O①KClO3+6HCl = KCl + 3Cl2↑+ 3H2O①KClO+2HCl=KCl+Cl2↑+H2O17.工业制氯气(氯碱工业):2NaCl + 2H2O Cl2↑+ H2↑+ 2NaOH18.实验室制氯气时尾气吸收(制84消毒液):Cl2+ 2NaOH = NaCl + NaClO + H2O19.氯气溶于热浓碱溶液:3Cl2+6KOH5KCl +KClO3+3H2O20.氯化钾与氯酸钾在酸性条件下生成氯气:5KCl + KClO3+3H2SO4= 3K2SO4+3Cl2↑+3H2O21.氯酸钾与盐酸生成氯气:6HCl + KClO3= KCl +3Cl2↑+3H2O22.氯离子检验:Cl-+Ag+=AgCl↓(白色沉淀不溶于硝酸)23.溴离子检验:Br-+Ag+=AgBr↓(浅黄色沉淀不溶于硝酸)24.碘离子检验:I-+Ag+=AgI↓(黄色沉淀不溶于硝酸)25.氟气溶于水:2F2+ 2H2O = 4HF +O226.氟与氢气反应:F2+ H2= 2HF27.碘与氢气反应:I2+ H22HI28.溴化银感光成像原理:2AgBr2Ag + Br2三、硫硫酸1.硫与铜共热:2Cu + S Cu2S2.硫与铁共热:Fe + S FeS3.硫与氢气反应:H2+ S H2S4.硫在氧气中燃烧:S + O2SO25.硫与氢氧化钾溶液反应:3S + 6KOH2K2S + K2SO3+ 3H2O6.同元素的两种盐溶液遇酸生成该元素单质:2K2S+K2SO3+3H2SO4= 3S↓+3K2SO4+3H2O7.硫化氢燃烧(O2不足):2H2S + O22S + 2H2O ;(O2充足):2H2S + 3O22SO2+ 2H2O8.氢硫酸露置在空气中变浊:2H2S + O2= 2S↓+ 2H2O9.硫化氢隔绝空气加热:H2S H2+ S10.硫化氢与卤单质X2(Cl2、Br2、I2)反应:H2S +X2= S↓+ 2HX11.硫化氢气体通入硫酸铜溶液:H2S + CuSO4= CuS↓+ H2SO412.硫化氢与二氧化硫气体混合:2H2S + SO2= 3S↓+ 2H2O13.硫化氢气体不能用浓硫酸干燥:H2S + H2SO4(浓)=S↓+ SO2+ 2H2O 14.二氧化硫气体溶于水:SO2+ H2O H2SO315.实验室制二氧化硫气体:Na2SO3+ H2SO4= Na2SO4+ SO2↑+ H2O16.实验室用碱液吸收硫化氢:H2S(少量)+2NaOH=Na2S + 2H2O;H2S(过量)+NaOH=NaHS+ H2O17.实验室用碱液吸收二氧化硫:SO2(少量)+2NaOH=Na2SO3+ H2O;SO2(过量)+NaOH=NaHSO318.纯碱溶液吸收少量二氧化硫:SO2(少量)+2Na2CO3+ H2O = Na2SO3+2NaHCO3纯碱溶液1:1吸收二氧化硫:SO2+Na2CO3= Na2SO3+ CO2纯碱溶液吸收过量二氧化硫:2SO2+Na2CO3+ H2O = 2NaHSO3+ CO219.硫酸工业用氨水吸收二氧化硫及循环使用:①SO2+ 2NH3·H2O = (NH4)2SO3+ H2O;①(NH4)2SO3+ H2SO4= (NH4)2SO4+ H2O + SO2↑20.二氧化硫通入氯水(SO2与Cl2混合失去漂白性):SO2+ Cl2+ 2H2O = H2SO4+ 2HCl21.二氧化硫通入溴水(SO2使溴水褪色):SO2+ Br2+ 2H2O = H2SO4+ 2HBr 22.二氧化硫使酸性高锰酸钾溶液褪色:5SO2+ 2KMnO4+ 2H2O = 2H2SO4+ K2SO4+ 2MnSO423.二氧化硫与稀硝酸:3SO2+ 2HNO3(稀)+2H2O =3H2SO4+2NO24.亚硫酸钠与稀硝酸:3Na2SO3+ 2HNO3= 3Na2SO4+ 2NO↑+ H2O25.亚硫酸钠溶液与卤单质X2(Cl2、Br2、I2)反应:Na2SO3+X2+ H2O = Na2SO4+ 2HX26.亚硫酸盐放在空气中变质:2Na2SO3+ O2= 2Na2SO427.二氧化硫与二氧化氮气体不共存:SO2+ NO2= SO3+ NO28.浓硫酸与铜反应:Cu +2 H2SO4(浓)CuSO4+ SO2↑+ 2H2O29.浓硫酸与碳反应:C + 2H2SO4(浓)CO2↑+ 2SO2↑+ 2H2O30.浓硫酸与硫共热:S + 2H2SO4(浓)3SO2↑+ 2H2O31.工业制硫酸:① 4FeS2+ 11O22Fe2O3+ 8SO2;也可以是S + O2SO2);①2SO2+ O22SO3;①SO3+ H2O = H2SO432.氧气与臭氧互相转化:3O22O3;2O33O233.臭氧使碘化钾淀粉试纸变蓝:O3+ 2KI + H2O = I2+2KOH + O234.双氧水与硫化氢:H2S + H2O2= S↓+ 2H2O35.双氧水与二氧化硫:SO2+ H2O2= H2SO436.双氧水与亚硫酸钠溶液:Na2SO3+ H2O2= Na2SO4+ H2O37.双氧水与高锰酸钾酸性溶液反应:2KMnO4+ 5H2O2+ 3H2SO4= K2SO4+ 2MnSO4+ 5O2↑+ 8H2O38.双氧水与氯气:H2O2+ Cl2=2HCl + O239.双氧水催化分解(实验室制氧气之一):2H2O22H2O + O2↑40.氯酸钾催化加热分解(实验室制氧气之二):2KClO32KCl + 3O2↑41.高锰酸钾加热分解(实验室制氧气之三):2KMnO4K2MnO4+MnO2+O2↑42.硫酸酸雨形成过程:SO2+ H2O H2SO3 ,2H2SO3+ O2=2H2SO4 43.硫代硫酸盐在酸性条件下自身氧化还原:Na2S2O3+ H2SO4== Na2SO4+ SO2↑+ S↓+ H2O44.钙基固硫(煤的脱硫)消除二氧化硫污染:①CaO + SO2CaSO3;①2CaSO3+ O22CaSO4四、氮和磷1.工业合成氨:N2+ 3H22NH32.二氧化氮自身二聚:2NO2(棕色)N2O4(无色)3.自然界形成硝酸酸雨(雷雨发庄稼):①氮气与氧气放电N2+ O22NO;①一氧化氮被氧气氧化:2NO + O2= 2NO2;①二氧化氮溶于水:3NO2+ H2O = 2HNO3+ NO4.工业制硝酸:① 4NH3+ 5O24NO + 6H2O;①2NO + O2= 2NO2;①3NO2+ H2O = 2HNO3+ NO5.镁在氮气中燃烧:3Mg + N2Mg3N26.氮化镁投入水中:Mg3N2+ 6H2O = 3Mg(OH)2+ 2NH3↑7.氮化镁与盐酸反应生成两种盐:Mg3N2+ 8HCl = 3MgCl2+ 2NH4Cl8.氨气溶于水显碱性:NH3+ H2O NH3·H2O NH4++ OH-9.氨气与氯化氢的“白烟”实验:NH3+ HCl = NH4Cl10.氨气的催化氧化:4NH3+ 5O24NO + 6H2O11.工业制硝酸中尾气中NO2与NO共同与碱液反应:NO2+ NO + 2NaOH = 2NaNO2+ H2O12.二氧化氮与氢氧化钠溶液反应:2NO2+ 2NaOH = NaNO2+ NaNO3+ H2O 13.氨气与氯气反应:2NH3(少量)+3Cl2= N2+ 6HCl;8NH3(足量)+3Cl2= N2+ 6NH4Cl14.氯化铵受热:NH4Cl NH3↑+ HCl↑15.碳酸氢铵分解:NH4HCO3NH3↑+ H2O + CO2↑16.实验室制氨气(常用碱石灰与氯化铵):2NH4Cl + Ca(OH)22NH3↑+ CaCl2+ 2H2O17.浓硝酸常显黄色原因:4HNO34NO2↑+ 2H2O + O2↑18.铜与浓硝酸(实验室制NO2):Cu + 4HNO3(浓)=Cu(NO3)2+ 2NO2↑+ 2H2O 19.铜与稀硝酸:3Cu + 8HNO3(稀)=3Cu(NO3)2+ 2NO↑+4H2O20.银与稀硝酸:3Ag +4HNO3(稀)=3AgNO3+NO↑+2H2O21.少量铁与稀硝酸:Fe + 4HNO3(稀)=Fe(NO3)3+ NO↑+ 2H2O22.过量铁与稀硝酸:3Fe + 8HNO3(稀)=3Fe(NO3)2+ 2NO↑+ 4H2O23.浓硝酸与磷共热:P + 5HNO3(浓)H3PO4+5NO2↑+ H2O24.浓硝酸与硫共热:S + 6HNO3(浓)H2SO4+ 6NO2↑+ 2H2O25.浓硝酸与碳共热:C + 4HNO3(浓)CO2↑+ 4NO2↑+ 2H2O26.工业用磷矿石制普钙:Ca3(PO4)2+2H2SO4(浓)=2CaSO4+Ca(H2PO4)2 27.工业用磷矿石制重钙:Ca3(PO4)2+4H3PO4== 3Ca(H2PO4)228.工业用磷矿石制磷酸:Ca3(PO4)2+ 3H2SO4(浓)=3CaSO4+ 2H3PO429.五氧化二磷与热水反应:P2O5+ 3H2O2H3PO430.五氧化二磷与冷水反应:P2O5+ H2O= 2HPO3五、碳和硅1.工业制二氧化碳:CaCO3CaO + CO2↑2.硅的燃烧:Si + O2SiO23.工业制粗硅:SiO2+ 2C Si + 2CO↑4.粗硅精制:①Si + 2Cl2SiCl4;① SiCl4+ 2H2Si + 4HCl5.制金刚砂:SiO2+ 3C SiC + 2CO↑6.硅与氢氧化钠溶液反应:Si + 2NaOH + H2O = Na2SiO3+ 2H2↑7.硅与氢氟酸反应:Si + 4HF = SiF4↑+ 2H2↑8.二氧化硅与氢氧化钠溶液反应(强碱腐蚀玻璃):SiO2+ 2NaOH = Na2SiO3+ H2O9.氢氟酸雕刻(腐蚀)玻璃:SiO2+ 4HF = SiF4↑+ 2H2O10.工业制玻璃:SiO2+ Na2CO3Na2SiO3+ CO2↑;SiO2+ CaCO3CaSiO3+ CO2↑11.硅酸钠溶液中通二氧化碳气体:Na2SiO3+ CO2+ H2O = H2SiO3(胶体)+ Na2CO312.硅酸钠溶液中加入盐酸:Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl 13.硅酸钠溶液与铵盐混合:Na2SiO3+ 2NH4Cl + 2H2O = H2SiO3↓+ 2NaCl + 2NH3·H2O14.工业制氢气:①C + H2O CO + H2,①CO + H2O CO2+ H215.工业制水煤气(煤的气化):C + H2O CO + H216.草酸使高锰酸钾溶液褪色:2KMnO4+ 5H2C2O4+ 3H2SO4= K2SO4+ 2MnSO4+10CO2↑+ 8H2O六、镁、铝、铁1.镁与水反应:Mg + 2H2O Mg(OH)2+ H2↑2.镁在二氧化碳中燃烧:2Mg + CO22MgO + C3.镁与氯化铵等水解显酸性的盐溶液反应:Mg + 2NH4Cl = MgCl2+ 2NH3↑+ H2↑镁与氯化铜等水解显酸性的盐溶液反应:Mg + CuCl2+ 2H2O= MgCl2+Cu (OH)2↓+H2↑4.氢氧化镁溶于氯化铵溶液:Mg(OH)2+ 2NH4Cl = MgCl2+ 2NH3·H2O5.铝与盐酸:2Al + 6HCl = 2AlCl3+ 3H2↑6.铝与氢氧化钠溶液:2Al + 2NaOH + 2H2O = 2NaAlO2+ 3H2↑7.铝与氧化铁(铝热反应之一):2Al + Fe2O32Fe + Al2O38.氧化铝溶于盐酸中:Al2O3+ 6HCl = 2AlCl3+ 3H2O9.氧化铝溶于氢氧化钠溶液中:Al2O3+ 2NaOH = 2NaAlO2+ H2O10.氢氧化铝溶于盐酸中:Al(OH)3+3HCl=AlCl3+3H2O11.氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH=NaAlO2+2H2O 12.氢氧化铝的两种电离方式:Al3++ 3OH-Al(OH)3H++ AlO2-+ H2O 13.向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+ 3NaOH = Al(OH)3↓+ 3NaCl 14.向氯化铝溶液中加入过量氢氧化钠溶液:AlCl3+ 4NaOH = NaAlO2+ 3NaCl + 2H2O15.向偏铝酸钠溶液中加入少量盐酸:NaAlO2+ HCl + H2O = Al(OH)3↓+ NaCl 16.向偏铝酸钠溶液中加入过量盐酸:NaAlO2+ 4HCl = AlCl3+ NaCl + 2H2O 17.向偏铝酸钠溶液中通入少量二氧化碳:2NaAlO2+ CO2+ 3H2O =2Al(OH)3↓+ Na2CO318.向偏铝酸钠溶液中通入过量二氧化碳:NaAlO2+ CO2+ 2H2O = Al(OH)3↓+ NaHCO319.偏铝酸钠溶液与氯化铝溶液:3NaAlO2+ AlCl3+ 6H2O = 4Al(OH)3↓+ 3NaCl 20.实验室制取Al(OH)3:Al2(SO4)3+6NH3·H2O =2Al(OH)3↓+ 3(NH4)2SO4 21.工业生产铝(电解熔融的Al2O3):2Al2O34Al + 3O2↑22.铁与硫共热:Fe + S FeS23.铁在氧气中燃烧:3Fe + 2O2Fe3O424.氯气与铁点燃:2Fe + 3Cl22FeCl325.碘与铁反应:Fe + I2FeI226.铁与氯化铁溶液:Fe + 2FeCl3= 3FeCl227.铁与高温水蒸汽反应:3Fe + 4H2O(g)Fe3O4+ 4H228.氯化铁溶液与铜:Cu + 2FeCl3= CuCl2+2FeCl229.氯化铁溶液与硫化氢:2FeCl3+ H2S = 2FeCl2+ S↓+ 2HCl30.氯化铁溶液与碘化氢:2FeCl3+ 2HI = 2FeCl2+ I2+ 2HCl31.氯化铁溶液与二氧化硫:2FeCl3+ SO2+ 2H2O = 2FeCl2+ H2SO4+ 2HCl 32.氯化亚铁与氯气:2FeCl2+ Cl2= 2FeCl333.氯化亚铁酸性溶液与双氧水:2FeCl2+2HCl + H2O2= 2FeCl3+ 2H2O 34.氯化亚铁溶液在空气中变质:4FeCl2+ O2+ 4HCl = 4FeCl3+ 2H2O35.氯化亚铁与氢氧化钠溶液:FeCl2+ 2NaOH = Fe(OH)2↓+ 2NaCl36.氢氧化亚铁放空气中变色:4Fe(OH)2+ O2+ 2H2O = 4Fe(OH)337.氯化亚铁与铁氰酸钾(亚铁离子检验):3FeCl2+2K3[Fe(CN)6] =Fe3[Fe(CN)6]2↓(蓝色)+6KCl38.氯化铁溶液与硫氰酸钾(铁离子检验):FeCl3+ 3KSCN Fe(SCN)3(血红色溶液)+ 3KCl39.氯化铁溶液与氢氧化钠溶液(铁离子检验):FeCl3+ 3NaOH = Fe(OH)3↓(红褐色沉淀)+ 3NaCl40.除去氯化铜溶液中的氯化铁(沉淀转化):2FeCl3+ 3Cu(OH)2=Fe(OH)3+ 3CuCl241.工业用氧化铁冶铁(与一氧化碳)反应:Fe2O3+ 3CO2Fe + 3CO2 42.氧化铜与碳:CuO + C Cu + CO↑;CuO + CO Cu + CO243.重铬酸钾的酸碱性转化:K2Cr2O7+H2O K2CrO4+H2CrO4离子方程式:Cr2O72-+ H2O CrO42-+ 2H+。


常见硫单质
硫单质是指由硫元素组成的物质,常见的硫单质有以下几种:1. 硫磺(S8):硫磺是硫单质中最常见的形式,是由八个硫原子构成的环状分子。
硫磺呈黄色晶体或结晶性粉末,具有辛辣的气味。
2. 硫化氢(H2S):硫化氢是由一个硫原子和两个氢原子组成的化合物,为无色、有刺激性臭味的气体。
它是一种强还原剂。
3. 二硫化碳(CS2):二硫化碳是由一个碳原子和两个硫原子构成的化合物,为无色的液体。
它具有特殊的臭味,易挥发,可溶于有机溶剂。
4. 亚硫酸(H2SO3):亚硫酸是一种无色液体,由一个硫原子、两个氧原子和两个氢原子组成。
它是一种较弱的酸,在水中能部分电离。
5. 亚硫化钠(Na2S):亚硫化钠是一种白色结晶固体,由两个钠原子和一个硫原子组成。
它可溶于水,是一种较强的还原剂。
这些是硫单质的常见形式,它们的性质和用途各不相同。
1.碳酸钠与碳酸氢钠的性质探究(1)Na2CO3和NaHCO3在水中的溶解性及其水溶液的酸碱性操作步骤及结论 1 g Na2CO3 1 g NaHCO3a.加入几滴水后,用手触摸试管壁白色粉末,加水结块变成晶体,放热细小白色粉末,加水部分溶解,感受不到热量变化b.继续向试管中加入10 mL水振荡时间长时可溶解固体量减少操作步骤及结论 1 g Na2CO3 1 g NaHCO3 c.向试管中再加入2滴酚酞溶液溶液变红色(较深) 溶液变红色(较浅)初步结论加少量水先结合成含结晶水的晶体(Na2CO3·x H2O),溶液碱性比NaHCO3的强加水部分溶解,溶解性Na2CO3>NaHCO3,溶液碱性比Na2CO3的弱(2)Na2CO3和NaHCO3的热稳定性装置物质现象发生反应的化学方程式结论Na2CO3澄清石灰水不变浑浊不反应Na2CO3受热不分解NaHCO3澄清石灰水变浑浊2NaHCO3=====△Na2CO3+H2O+CO2↑NaHCO3受热易分解(3)碳酸钠在空气中的转变Na2CO3(粉末)+x H2O 潮湿空气中或加入少量水干燥空气中Na2CO3·x H2O(水合碳酸钠,晶体)碳酸钠带有结晶水的叫水合碳酸钠,有一水碳酸钠(Na2CO3·H2O)、七水碳酸钠(Na2CO3·7H2O)和十水碳酸钠(Na2CO3·10H2O)三种。
十水碳酸钠又叫洗濯苏打、洗濯碱或晶碱。
2.Na2CO3与NaHCO3的性质比较化学式/名称Na2CO3(碳酸钠)NaHCO3(碳酸氢钠)俗名纯碱、苏打、洗涤碱小苏打水溶液的酸碱性碱性碱性同浓度的溶液碱性强弱强弱类别离子化合物离子化合物颜色、状态白色粉末(Na2CO3·10H2O为晶体)细小白色粉末溶解性易溶于水在水中溶解度比Na2CO3小稳定性稳定,受热难分解,但结晶碳酸钠Na2CO3·10H2O 易风化不稳定,受热易分解与酸反应(如HCl)Na2CO3 + 2HCl = 2NaCl + H2O +CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑与碱反应NaOH ______(不反应)NaHCO3+NaOH=Na2CO3+H2OCa(OH)2Na2CO3+Ca(OH)2==CaCO3↓+2NaOH①少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O②过量的NaHCO3与Ca(OH)2反应:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O用途化工原料(三酸二碱:硫酸、盐酸、硝酸、烧碱、纯碱)、蒸馒头时的碱面制药,可以治疗胃酸过多;食品业中作疏松剂;与硫酸铝反应的原理作泡沫灭火器;皮肤洒上酸后,用大量水冲洗后,涂抹碳酸氢钠相互转化①向Na 2CO 3溶液中通入过量的CO 2Na 2CO 3+CO2+H 2O==2NaHCO 3②固体加热在NaHCO 3溶液中加入适量的NaOH 溶液 NaHCO 3+NaOH=Na 2CO 3+H 2O、3.Na 2CO 3、NaHCO 3与酸反应放出CO 2快慢的原因分析 Na 2CO 3与HCl 反应时,第一步生成NaHCO 3,无气体放出。
硫及其化合物的化学方程式汇总一、硫单质Fe + S FeS (黑色不溶于水固体) 2Cu + S Cu 2S (黑色不溶于水固体)3Cl 2+2Fe 2FeCl 3 (棕黄色的固体,溶液为棕黄色)Cl 2+CuCu Cl 2(棕黄色的固体,稀溶液为蓝色,浓溶液为绿色)3、硫在空气中燃烧: S + O 2 点燃SO 24、硫与氢气反应: S+H 2△H 2S5、SO 2与水反应:SO 2+H 2OH 2SO 36、钙基固硫: SO 2+CaO==CaSO 3 2CaSO 3+ O 2==2CaSO 4二、硫化氢与氢硫酸1、受热分解H 2S H 2 + S2、往氢氧化钠溶液中通硫化氢气体H 2 S+ 2NaOH → Na 2S +2 H 2O H 2 S+ Na 2S → 2NaHS (连续反应) H 2 S+ 2NaOH → Na 2S +2 H 2OH 2 S+ NaOH → NaHS + H 2O (平行反应)3、硫化氢通入氯水、溴水、碘水中都产生浅黄色沉淀。
H 2S+X 2→S+2HX (X 2=Cl 2、Br 2、I 2)4、 H 2S + CuSO 4 → CuS ↓ + H 2SO 4(此反应可用于检验硫离子)H 2S + 2AgNO 3 → Ag 2S ↓ + 2HNO 3H 2S + Pb (CH 3COO )2 → PbS ↓ + 2CH 3COOH 5、实验室制硫化氢气体FeS + 2HCl → FeCl 2 + H 2S ↑ FeS + H 2SO 4 → FeSO 4 + H 2S ↑6、 完全燃烧 方程式为2H 2S + 3O 2 2H 2O + 2SO 2不完全燃烧 方程式为 2H 2S + O 2 2H 2O + 2S7、H 2S +H 2SO 4(浓) → S +SO 2 ↑+2H 2O (不能用浓硫酸干燥硫化氢气体)三、二氧化硫1、 SO 2 + H 2O H 2SO 32、澄清石灰水中通入至过量SO 2:SO 2 + Ca(OH)2 → CaSO 3↓+ H 2O (鉴别SO 2与 CO 2不能用澄清石灰水)SO 2 + CaSO 3 + H 2O → Ca (HSO 3)2(连续反应) SO 2 (少量)+ Ca(OH)2→ CaSO 3↓+ H 2OSO 2(过量) + Ca(OH)2 → Ca (HSO 3)2↓(平行反应) 3、 SO 2+CaO →CaSO 32CaSO 3+O 2→2CaSO 4(含硫煤燃烧时加生石灰) 4、.少量SO 2通入中NaOH 溶液中:SO 2+2NaOH==Na 2SO 3+H 2O SO 2 + 2OH -==SO 32-+H 2O5.二氧化硫的弱氧化性 2H 2S +SO 2→3S +2H 2O 6、2SO 2 + O 2 2 SO 37. SO 2通入氯水中:SO 2+Cl 2+2H 2O==H 2SO 4+2HClSO 2+Cl 2+2H 2O== 4H ++SO 42-+2Cl -8、SO 2通入卤水中: SO 2+X 2+2H 2O==H 2SO 4+2HXSO 2+X 2+2H 2O== 4H ++SO 42-+2X - (X=Cl 、Br 、I )→→点燃→→点燃9、SO 2与H 2S (气体、溶液均能反应):SO 2+2H 2S==3S ↓+2H 2O (氧化产物:还原产物=2:1)10、SO 2 +2 FeCl 3 +2H 2O →H 2SO 4+2FeCl 2+2HCl 11、5SO 2 + 2KMnO 4+2H 2O →K 2SO 4+2MnSO 4+2H 2SO 412、实验室制二氧化硫Na 2SO 3 (固)+H 2SO 4 (浓)→Na 2SO 4+SO 2↑ +H 2O 13、酸雨形成的两个途径途经1:2SO 2 + O 2 2 SO 3(空气中烟尘作催化剂) SO 3+ H 2O →H 2SO 4 途经2:SO2 + H 2OH 2SO 3 2H 2SO 3 +O 2 →2H 2SO 43NO 2 + H 2O==2HNO 3 + NO14、Na 2SO 3长期放置于空气中:2Na 2SO 3 +O 2 →2Na 2SO 4 15.亚硫酸钠除余氯的原理Cl 2+2Na 2SO 3 +H 2O →2Na 2SO 4+2HCl三、硫酸1、高沸点的浓硫酸制挥发性的酸2NaCl+H 2SO 4(浓) NaHSO 4+HCl ? (微热)NaCl+ NaHSO 4Na 2SO 4+HCl ? (连续反应)2NaCl+H 2SO 4(浓) NaHSO 4+HCl ? 2NaCl+H 2SO 4(浓)Na 2SO 4+2HCl ?(平行反应)NaNO 3+H 2SO 4(浓) NaHSO 4+HNO 3? (微热,硝酸受热易分解)CaF 2+H 2SO 4(浓) CaSO 4+2HF ? (不能在玻璃仪器中制取) 2、Cu + 2H 2SO 4(浓) 2SO 2↑+CuSO 4+2H 2O3、2H 2SO 4(浓)+C2SO 2↑+CO 2↑+2H 2O4、往热的浓硫酸中逐渐加铁至过量依次发生反应的方程式2Fe+ 6H 2SO 4(浓)3SO 2↑+Fe 2(SO 4)3+6H 2OFe +Fe 2(SO 4)3→3FeSO 4 Fe+H 2SO 4→FeSO 4+H 2↑5、往浓硫酸中逐渐加锌至过量依次发生反应的方程式Zn + 2H 2SO 4(浓) → ZnSO 4+2SO 2↑+ 2H 2O Zn+H 2SO 4→ZnSO 4+H 2↑6、浓硫酸不能干燥氨气、H 2S 、HBr 、HI 2NH 3+H 2SO 4 → ( NH 4)2SO 4H 2S +H 2SO 4(浓) → S +SO 2 ↑+2H 2O 2HBr +H 2SO 4(浓) → Br 2 +SO 2 ↑+2H 2O 2HI+H 2SO 4(浓) → I 2 +SO 2 ↑+2H 2O 7、实验室用硫酸制取的气体 制氢气:Zn+H 2SO 4→ZnSO 4+H 2↑制硫化氢:FeS + H 2SO 4 → FeSO 4 + H 2S ↑制氯化氢:2NaCl+H 2SO 4(浓)NaHSO 4+HCl ? (微热)2NaCl+H 2SO 4(浓)Na 2SO 4+2HCl ? (平行反应)制二氧化硫:Na 2SO 3 (固)+H 2SO 4 (浓)→Na 2SO 4+SO 2↑ +H 2O制乙烯:(浓硫酸作催化剂,脱水剂) CH 3CH 2OH H 2O + CH 2=CH 2 ↑8、硫酸的工业制备 原理:4FeS 2+11O 22Fe 2O 3+8SO 2 2SO 2 + O 2 2 SO 3 SO 3+H 2O→H 2SO 4尾气吸收: SO 2(少量)+2NH 3+H 2O →(NH 4)2SO 3 SO 2+(NH 4)2SO 3+H 2O →2NH 4HSO 3 (连续反应) SO 2(少量)+2NH 3+H 2O →(NH 4)2SO 3 SO 2(足量)+ NH 3+H 2O →NH 4HSO 3(平行反应)。
高中化学电子式书写规则在元素符号周围用"·〞和"×〞来表示原子的最外层电子〔价电子〕,这种式子叫做电子式。
1. 原子的电子式由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元素符号周围。
排列方式为在元素符号上、下、左、右四个方向,每个方向不能超过2个电子。
例如,⋅H 、⋅⋅N ....、⋅⋅O ....、⋅⋅F ....。
2. 金属阳离子的电子式金属原子在形成阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应在元素符号右上角标出。
所以金属阳离子的电子式即为离子符号。
如钠离子的电子式为Na +;镁离子的电子式为Mg 2+,氢离子也与它们类似,表示为H +。
3. 非金属阴离子的电子式一般非金属原子在形成阴离子时,得到电子,使最外层到达稳定构造,这些电子都应画出,并将符号用"[]〞括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。
例如,[:]H -、[:..:]..F -、[:..:]..S 2-。
4. 共价化合物的电子式共价化合物是原子间通过共用电子对结合而成的。
书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出。
因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子。
例如,H Cl :..:..、:..:..:....Cl Cl 。
5. 根离子的电子式根离子中,假设不同原子间以共价键结合,画法同共价化合物,因根离子带有电荷,所以应把符号用"[]〞括起来,右上角标出电荷数。
例如,铵根阳离子:[:..:]..H N HHH +;氢氧根离子:[:..:]..O H -。
6. 离子化合物的电子式先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子间隔排列,注意一样离子不能合并。