高中化学硫及其化合物知识大全
- 格式:docx
- 大小:16.38 KB
- 文档页数:2

硫及其化合物一、硫及其重要化合物的主要性质及用途: 1.硫:(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态)Al 2S 3的唯一途径) 2S (黑色) ②与非金属反应2 (说明硫化氢不稳定)③与化合物的反应 S+6HNO 34+6NO 2↑+2H 2O S+2H 2SO 4+2H 2O 2S+Na 2SO 3+3H 2O (用热碱溶液清洗硫)(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
三药一柴:医药、火药、农药、和火柴的原料。
2.硫的氢化物:①硫化氢的物理性质:H 2S 是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质A .可燃性:当22/O S H n n ≥2/1时,2H 2S+O 22O (H 2S 过量)当22/O S H n n ≤2/3时,2H 2S+3O 2 点燃2SO 2+2H 2O (O 2过量)当23222<<O S H n n 时,两种反应物全部反应完,而产物既有硫又有SO 2 B .强还原性:常见氧化剂Cl 2、Br 2、I 2、Fe 3+、HNO 3、浓H 2SO 4、KMnO 4等,甚至SO 2均可将H 2S 氧化。
③H 2S 的水溶液叫氢硫酸,是二元弱酸。
除杂:用CuSO 4溶液除去H 2S : CuSO 4+H 2S===CuS ↓+H 2SO 4 3.硫的氧化物:(1)二氧化硫:①SO 2是无色而有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
②SO 2是酸性氧化物,能跟水反应生成亚硫酸,亚硫酸是中强酸。
③SO 2有强还原性 常见氧化剂(见上)均可与SO 2发生氧化一还原反应 如:SO 2 + Cl 2 +2H 2O == H 2SO 4 + 2HCl④SO 2也有一定的氧化性 2H 2S + SO 2 == 3S ↓ +2H 2O⑤SO 2具有漂白性,能跟有色有机化合物生成无色物质(可逆、非氧化还原反应)⑥实验室制法:Na 2SO 3 + H 2SO 4(浓) == Na 2SO 3 + H 2O +SO 2↑或Cu + 2H2SO4(浓) === CuSO4 + 2H2O + SO2↑(2)三氧化硫:是一种没有颜色易挥发的晶体;具有酸性氧化物的通性,遇水剧烈反应生成硫酸并放出大量的热。

硫及其化合物知识点硫是一种常见的非金属元素,化学符号为S,原子序数为16。
它存在于自然界中的许多化合物中,并且在工业和科学领域有广泛的应用。
本文将重点介绍硫及其化合物的一些主要知识点。
1. 硫的性质硫是一种淡黄色的固体,常温下为柔软的结晶体。
它具有强烈的刺激性气味,不溶于水,但可以溶于有机溶剂。
硫具有较高的熔点和沸点,熔点为115.21摄氏度,沸点为444.67摄氏度。
硫是一种化学活性较高的元素,与氧、氮和大部分金属都可以反应。
当硫与氧反应时,会生成二氧化硫(SO2),这种气体是一种重要的工业原料和环境污染物。
此外,硫还可以与氢反应生成硫化氢(H2S),它是一种有毒的气体。
2. 硫的用途硫在工业上有广泛的用途。
其中最重要的是用于制取硫酸和硫酸盐。
硫酸是一种重要的化工原料,在制造肥料、纺织品、橡胶、塑料和炸药等方面都有应用。
硫酸盐也被广泛用于农业、建筑和制药工业。
此外,硫还被用于制备橡胶加硫剂、染料、制革剂和农药。
硫还可以用于冶金工业中的熔炼和提炼金属。
例如,硫可以用于提取铜、铅和锌等金属。
3. 硫化物硫化物是由硫和其他元素形成的化合物。
其中最常见的硫化物是硫化铁(FeS),它是一种黑色的固体。
硫化铁被广泛用作草坪肥料和防霉剂,同时也是电池的重要组成部分。
硫化物还包括硫化氢、硫化钠和硫化铜等。
硫化氢是一种有毒气体,在工业和医药领域中被用作杀菌剂和还原剂。
硫化钠是一种重要的工业化学品,用于制造纺织品、纸浆、皮革和肥皂等。
硫化铜则被广泛用于制备农药和杀菌剂。
4. 环境影响硫及其化合物对环境有着重要的影响。
硫氧化物是导致酸雨的主要成分之一,当硫化物被燃烧或氧化时,会产生二氧化硫和三氧化硫等气体,它们与大气中的水蒸气和氧反应,形成硫酸和亚硫酸。
这些酸性物质降落在地面上,对植物、水域和土壤造成严重的污染。
此外,硫化氢是一种有毒气体,对人类和动物的健康有害。
长期接触硫化氢可能导致呼吸系统疾病和神经系统问题。
为了减少硫及其化合物对环境的影响,许多国家对硫排放量进行了限制,并采取了一系列措施来减少二氧化硫的排放。

引言概述:
硫及其化合物是高中化学学习中重要的知识点之一。
硫具有广泛的应用领域,包括化工、冶金、材料等。
本文将从硫的性质、化合物的分类与性质、硫的制取方法、硫化合物的应用以及环境中的硫化物等方面进行详细阐述。
正文内容:
1.硫的性质
1.1.物理性质
1.2.化学性质
1.3.同素异形体
2.硫化合物的分类与性质
2.1.硫化物
2.1.1.金属硫化物
2.1.2.非金属硫化物
2.2.硫酸盐
2.2.1.亚硫酸盐
2.2.2.碱式硫酸盐
2.3.硫醇
2.4.亚硫酸及其盐
3.硫的制取方法
3.1.从矿石中提取
3.2.由硫化氢或二硫化碳制取
3.3.工业制取方法
4.硫化合物的应用
4.1.硫酸
4.2.硫化物的应用
4.3.硫胺素的应用
4.4.硫脲的应用
5.环境中的硫化物
5.1.大气中的二氧化硫
5.2.水中的硫化物
5.3.地下水中的硫酸盐
总结:
硫及其化合物在化学领域中有着重要的应用。
硫具有独特的物理性质和化学性质,可以形成多种硫化合物。
硫的制取方法主要包括从矿石中提取和工业制取方法。
硫化合物广泛应用于化工、冶金、材料等领域,如硫酸的制备和硫化物的应用。
同时,硫化物也存在于环境中,如大气中的二氧化硫和水中的硫化物。
因此,了解
硫及其化合物的性质和应用对于学习化学知识和环境保护具有重要意义。

第十讲硫及其化合物要点一:硫单质1、硫单质的存在(1)游离态:火山喷口附近或地壳的岩层内(2)化学态:①硫化物:硫铁矿(FeS2)、黄铜矿(CuFeS2)①硫酸盐:石膏(CaSO4•2H2O);芒硝(Na2SO4•10H2O)2、物理性质硫俗称硫磺,淡黄色固体,不溶于水,微溶于酒精,易溶于二硫化碳,可用二硫化碳洗涤沾有硫单质的试管。
3、化学性质(从0价降到-2价,氧化性)H2S、FeS←S→SO2、SO3(从0价升到+4价)典型例题1、下列说法错误的是()A.单质硫是一种分子晶体,呈淡黄色B.硫的化合物常存在于火山喷出的气体中和矿泉水里C.单质硫难溶于水,微溶于酒精,易溶于二硫化碳D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫【解答】解:A.硫为非金属单质,为分子晶体,呈淡黄色,故A正确;B.硫的化合物常存在于火山喷出的气体中,多为二氧化硫,矿泉水里含有硫酸盐,故B正确;C.硫为非极性分子,硫不溶于水,微溶于酒精,易溶于四氯化碳,故C正确;D.在氧气中燃烧只生成SO2,SO2和氧气在催化剂的条件下可生成SO3,故D错误。
故选:D。
变式训练1、0.1mol某单质与足量硫充分反应,质量增加了1.6g,则组成这种单质的元素不可能是()A.Ag B.Fe C.Cu D.K要点二:硫的化合物1、硫化氢(1)物理性质具有臭鸡蛋气味的有毒气体,密度比空气大,能溶于水。
(2)化学性质2、硫的氧化物(1)二氧化硫①物理性质无色有刺激性气味的有毒气体,密度比空气大,易溶于水,易液化。
①化学性质a.具有酸性氧化物的通性:SO2可使紫色石蕊溶液变红;与碱反应:SO2+2NaOH====Na2SO3+H2O;与碱性氧化物反应;SO2+CaO====CaSO3;与水反应:SO2+H2O====H2SO3b.氧化性:2H2S+SO2====2H2O+3S↓c.还原性:与氧气反应:SO2+O2①SO3(加热并且加催化剂)SO2还能被I2、Cl2、Br2、MnO4-、ClO-、Fe3+、H2O2、NO3-(H+)等氧化。

高一硫及其化合物的知识点硫是地壳中非常常见的元素之一,它的化学性质和用途非常广泛。
在高一化学学习中,掌握硫及其化合物的知识点是非常重要的。
本文将就硫及其化合物的性质、制备方法以及应用进行探讨。
一、硫的性质硫是一种非金属元素,其原子序数为16,原子量为32.1。
硫的常见同素异形体有一元硫和八元环硫。
硫有一定的韧性,可以打成薄片或拉成细丝。
在自然界中,硫以硫矿的形式存在,最常见的是黄铁矿。
硫的化学性质活泼,能与多种元素发生反应。
例如,硫可以与氧气发生反应生成二氧化硫,该反应是一种燃烧反应。
硫还能与氧化剂反应生成硫酸。
此外,硫还可以与金属形成硫化物,例如与铜反应生成硫化铜。
二、硫的制备方法硫的制备方法有很多种,以下介绍几种常见的方法。
1. 从硫矿中提取硫矿中的硫可以通过熔炼、蒸馏等方法提取出来。
这种方法在实践中应用广泛,是一种较常见的制备硫的方法。
2. 从石油中提取石油中含有硫化物,可以通过蒸馏等方法将硫从石油中提取出来。
这种方法适用于工业规模的硫制备。
3. 通过实验合成在实验室中,硫可以通过不同的化学反应合成。
例如,可以通过金属与硫酸反应,生成金属的硫化物,再通过酸解反应提取出硫。
三、硫化物的性质及应用硫化物是硫和其他元素形成的化合物。
硫化物有很多种,常见的有硫化铁、硫化铜等。
硫化物的性质和用途各不相同。
1. 硫化铁硫化铁是一种黑色晶体,常见的矿石有黄铁矿和辉铁矿。
硫化铁在冶金工业中应用广泛,可以用来提取金属铁。
2. 硫化铜硫化铜是一种红色或黑色的晶体,常见的矿石有闪锌矿和黄铜矿。
硫化铜在冶金工业中也有重要的应用,可以用来提取金属铜。
3. 有机硫化合物除了无机硫化物外,有机硫化合物也是硫化合物的一种重要类别。
例如,硫化氢是一种常见的有机硫化物,具有刺激性气味。
硫化氢在化工工业中应用广泛,可用于合成其他有机化合物。
四、硫在环境与生活中的应用硫在环境与生活中也有重要的应用。
其中,最常见的是二氧化硫的应用。

高一化学硫及其化合物知识点总结
硫及其化合物是高中化学中一个重要的知识点,本文将从硫的性质、制备、用途以及硫化物的性质和应用等方面进行总结。
1. 硫的性质
硫是一种非金属元素,存在于自然界中的硫矿石、石膏等物质中。
硫的物理性质包括颜色、形态和密度等方面,其中最常见的是黄色的硫粉,它具有脆性和易于破碎的特点。
在化学反应中,硫可以与氧气、氢气、氮气等元素发生反应。
此外,硫也是一种良好的还原剂,它可以将其他物质还原成更低的氧化态。
2. 硫的制备
硫的制备方法有很多种,常见的方法包括从硫矿石中提取、从天然气中提取和从工业废气中提取等。
其中,从硫矿石中提取是最常用的方法,它主要是通过高温熔炼硫矿石,然后将得到的液态硫喷到水中进行冷却,从而得到硫的固态产品。
3. 硫的用途
硫的用途非常广泛,它被广泛应用于化工、农业、制药、橡胶等行业中。
其中,硫在化工行业中被用作生产硫酸等化学品的原料,它也可以用于制造染料、橡胶加工等。
在农业领域,硫可以用于生产化肥和杀虫剂等,它可以起到保护作物和杀虫的作用。
4. 硫化物的性质和应用
硫化物是硫和其他元素形成的化合物,它们具有多种不同的性质和应用。
其中,硫化氢是一种无色、有刺激性气味的气体,它可以被用于生产硫化铵、硫化铜等材料。
硫化铁是一种黑色固体,它可以被用于生产钢铁、汽车轮胎等。
此外,硫化物还可以用于生产电池、半导体元件等。
硫及其化合物是高中化学中一个重要的知识点,它们具有多种不同的性质和应用。
对于学生来说,了解硫及其化合物的基本知识可以帮助他们更好地理解和应用化学知识,同时也可以为他们今后的学习和工作提供帮助。

高中化学知识点:无机物硫及其化合物高中化学作为一门自然科学,必然有它的核心概念和理论,它的逻辑性非常强。
既便是在高中它的知识体系也是较完整的。
化学核心知识必然派生的知识网络,平常若融会贯通,就构建了在考场上能想到的知识体系。
下面小编为同学们总结一些高中化学知识点:无机物--硫及其化合物。
(一)高中化学无机物硫单质的反应(非金属性弱于卤素、氧和氮)1.硫与氧气反应(只生成二氧化硫,不生成三氧化硫)2.硫与氢气反应(可逆反应)3.硫与铜反应(生成+1价铜化合物,即硫化亚铜)4.硫与铁反应,(生成+2价铁化合物,即硫化亚铁)5.硫与钠、铝等反应生成相应的硫化物6.硫与汞常温反应,生成HgS(撒落后无法收集的汞珠应撒上硫粉,防止汞蒸气中毒)7.硫与强碱溶液反应生成硫化物和亚硫酸盐(试管上粘附的硫除了可用CS2洗涤以外,还可以用NaOH溶液来洗)(二)高中化学无机物硫化氢的反应(不稳定性、强还原性、酸性)1.受热分解2.燃烧(充分燃烧与不充分燃烧产物不同)3.与卤素单质如Br2反应,硫被置换4.与醋酸铅反应生成黑色醋酸铅(可用醋酸铅试纸或者硝酸铅试纸检验硫化氢)5.与硫酸铜或氯化铜反应生成黑色硫化铜沉淀(但不能与亚铁盐溶液发生类似反应)6.与氯化铁溶液反应,硫化氢可被氧化成单质硫7.被浓硫酸氧化(通常氧化成单质硫)8.被二氧化硫氧化9.氢硫酸在空气中被氧气氧化而浑浊(三)二氧化硫或亚硫酸的反应(弱氧化性,强还原性,酸性氧化物)1.氧化硫化氢2.被氧气氧化(工业制硫酸时用催化剂;空气中的二氧化硫在某些悬浮尘埃和阳光作用下被氧气氧化成三氧化硫,并溶解于雨雪中成为酸性降水。
)3被卤素氧化SO2+Cl2+2H2O==H2SO4+2HCl4.被硝酸氧化5.与水反应6.与碱性氧化物反应7.与碱反应8.有漂白性(与有机色质化合成无色物质,生成的无色。

硫及其化合物主要内容和思路
硫及其化合物是高中化学的重要内容之一,以下是主要内容和思路的总结:
1. 硫的性质:硫是一种非金属元素,具有还原性和氧化性。
它可以与许多金属反应,生成相应的硫化物。
2. 硫的氧化物:二氧化硫(SO2)和三氧化硫(SO3)是硫的两种重要氧化物。
二氧化硫是一种无色、有刺激性气味的气体,可与水反应生成亚硫酸,具有漂白性。
三氧化硫是一种无色、易挥发的液体,溶于水生成硫酸。
3. 硫酸:硫酸是一种强酸,具有高沸点和高密度。
它可以与许多物质反应,生成硫酸盐。
硫酸的工业制备通常采用接触法,通过硫磺或含硫矿石的燃烧产生二氧化硫,再将其氧化为三氧化硫,最后用水吸收生成硫酸。
4. 硫酸盐:硫酸盐是由硫酸根离子(SO4^2-)与金属离子结合而成的化合物。
常见的硫酸盐有硫酸钠(Na2SO4)、硫酸镁(MgSO4)等。
硫酸盐在工业和农业中有广泛应用。
5. 硫的其他化合物:除了上述化合物,硫还可以形成其他化合物,如硫化物、硫代硫酸盐、亚硫酸盐等。
这些化合物在化学反应和实际应用中也有重要作用。
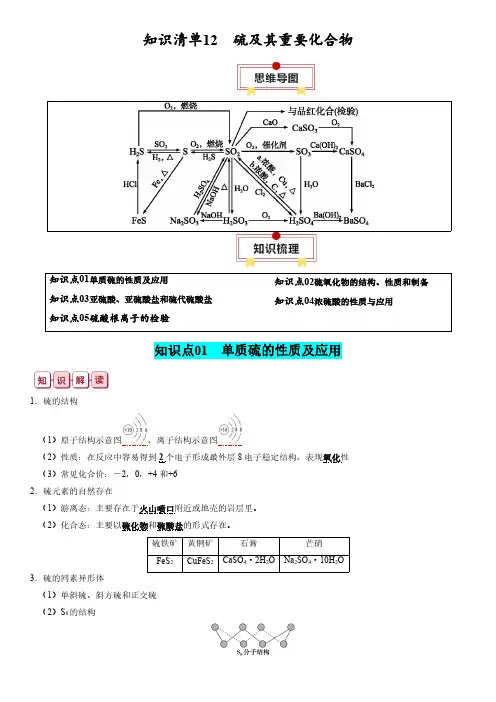
知识清单12硫及其重要化合物知识点01单质硫的性质及应用知识点03亚硫酸、亚硫酸盐和硫代硫酸盐知识点05硫酸根离子的检验知识点02硫氧化物的结构、性质和制备知识点04浓硫酸的性质与应用知识点01单质硫的性质及应用1.硫的结构(1)原子结构示意图,离子结构示意图(2)性质:在反应中容易得到2个电子形成最外层8电子稳定结构,表现氧化性(3)常见化合价:-2,0,+4和+62.硫元素的自然存在(1)游离态:主要存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
硫铁矿黄铜矿石膏芒硝FeS 2CuFeS 2CaSO 4·2H 2ONa 2SO 4·10H 2O3.硫的同素异形体(1)单斜硫、斜方硫和正交硫(2)S 8的结构①化学键/mol :8②S 原子的杂化方式:sp 3③分子极性:非极性分子4.硫单质物理性质(1)色、态:黄色或淡黄色的固体,俗称硫黄(2)溶解性:不溶于水,微溶于酒精,易溶于二硫化碳5.弱氧化性:Fe ------→S加热FeS ;Cu -----→S加热Cu 2S 6.燃烧反应(1)反应:S+O 2SO 2;S ---------→过量O 2点燃SO 2(2)氧气浓度不同,产物相同,现象不同①空气:产生微弱的淡蓝色火焰②氧气:产生明亮的蓝紫色火焰易错点:硫的易错知识点(1)单质硫燃烧时,产物只能是SO 2,无论O 2的量是否充足,均不会生成SO 3。
(2)硫单质的氧化性较弱,与变价金属反应时一般生成低价态金属硫化物(和Cl 2与变价金属的反应情况相反),如FeS 、Cu 2S 等。
(3)等量的硫在空气中完全燃烧比在氧气中完全燃烧放热多(光能少)(4)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
(5)实验室中,残留在试管内壁上的硫可用CS 2溶解除去,也可用热的NaOH 溶液除去,反应化学方程式为3S+6NaOH2Na 2S+Na 2SO 3+3H 2O 。

课时19 硫及其重要化合物知识点一 硫及其氧化物的性质【考必备·清单】 1.硫单质 (1)硫元素存在形态①游离态:硫单质俗称硫黄,主要存在于火山喷口附近或地壳的岩层里。
②化合态:主要以硫化物和硫酸盐的形式存在,有关化学式如下:(2)物理性质(3)化学性质①与金属反应⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫Cu :2Cu +S=====△Cu 2S Fe :Fe +S=====△FeS 表现氧化性 ②与非金属反应⎩⎪⎨⎪⎧O 2:S +O 2=====点燃SO 2,表现还原性H 2:S +H 2=====△H 2S ,表现氧化性③与强氧化剂反应(如浓硫酸):S +2H 2SO 4(浓)=====△3SO 2↑+2H 2O ,表现还原性。
④与NaOH 溶液反应:3S +6NaOH=====△2Na 2S +Na 2SO 3+3H 2O ,表现氧化性和还原性。
[名师点拨] ①硫与变价金属反应时,生成低价态金属硫化物(如Cu 2S 、FeS)。
②汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
2.二氧化硫(SO 2) (1)物理性质SO 2是无色、有刺激性气味的有毒气体,是大气污染物之一;易溶于水,通常状况下,1体积水溶解约40体积SO 2。
(2)化学性质按要求完成下列化学方程式:①酸性氧化物的通性⎩⎨⎧与H 2O 反应:SO 2+H 2O H 2SO 3与NaOH (足量)反应:2NaOH +SO 2===Na 2SO 3+H 2O②氧化性(如与H 2S 溶液反应): SO 2+2H 2S===3S↓+2H 2O③还原性⎩⎪⎨⎪⎧O 2:2SO 2+O 2催化剂△2SO 3氯水:Cl 2+SO 2+2H 2O===2HCl +H 2SO 4④漂白性:可使品红溶液等有机色质褪色,生成不稳定的化合物。
[名师点拨] ①工业上可利用SO 2来漂白纸浆、毛、丝、草帽辫等,但不能用于食品的增白。
SO 2还用于杀菌、消毒等,可用作干果的防腐剂。

高一硫化学知识点归纳总结硫化学是高中化学课程中的一个重要内容,它涉及了硫的性质、合成方法、化合物的性质与用途等方面的知识。
下面将对高一硫化学知识点进行归纳总结。
一、硫的性质硫是一种非金属元素,存在于自然界中的石膏、黄铁矿等矿石中。
硫的原子序数为16,电子排布为1s²2s²2p⁶3s²3p⁴,其外层电子为6个,具有稳定的电子排布。
硫的物理性质:硫为黄色固体,常温下呈流动状,熔点为115.2℃,沸点为444.6℃。
硫具有不溶于水、可溶于无机溶剂的特点。
硫的化学性质:硫是一种活泼的化学元素,能与多种元素发生反应。
与氧气反应生成二氧化硫气体,与金属直接反应生成金属硫化物。
二、硫化物及其性质硫化物是硫与其他元素形成的化合物,广泛存在于自然界中。
硫化物的主要性质有以下几个方面。
1.氮化物的性质:硫化物通常为固体,具有不同的颜色和晶体结构。
例如,四硫化二锌为白色结晶固体,六硫化二钴为红色结晶固体。
2.硫化物的溶解性:不同的硫化物在溶液中的溶解度不同。
例如,硫化银具有很低的溶解度,而硫化钠则能溶解于水中形成硫化氢。
3.硫化物的稳定性:硫化物的稳定性取决于其中金属离子的极性和尺寸。
一些金属硫化物不易被化学反应破坏,如硫化铜稳定性较高。
三、硫化反应硫化反应是指硫与其他元素或化合物发生化学反应,生成硫化物。
常见的硫化反应包括与金属的反应、酸与金属的反应以及与氧化物的反应等。
1.金属与硫的反应:金属可以与硫直接反应生成金属硫化物。
例如,铁与硫反应生成硫化铁。
2.硫化物与酸的反应:硫化物可与酸反应生成硫化氢气体。
例如,硫化铵与盐酸反应生成硫化氢和氯化铵。
3.硫化物与氧化物的反应:硫化物可与氧化物反应生成硫酸盐。
例如,硫化亚铁与二氧化硫反应生成硫酸亚铁。
四、硫的应用硫在生活和工业中有着广泛的应用。
1.硫的应用于农业:硫是植物生长所必需的微量元素,可以促进植物的生长和亩产。
硫还可以用于制作农药,抑制害虫的繁殖。
高一化学硫知识点及方程式化学是一门关于物质的研究科学,其中硫是一个重要的元素。
在高中化学中,我们将学习关于硫的知识点和相关的化学方程式。
本文将为大家介绍高一化学中与硫相关的重要知识点和方程式。
一、硫的性质硫是位于周期表第16族的元素,原子符号为S,原子序数为16,原子量为32.06。
硫是一种非金属元素,存在于自然界中的硫矿石中。
硫在常温下为黄色固体,难以溶解于水,但可以溶于二氧化硫。
二、硫的化合物1. 二氧化硫(SO2):二氧化硫是一种无色气体,具有刺激性气味,易溶解于水。
它是由燃烧硫、硫化物或含硫矿石时产生的,也是一种工业废气。
二氧化硫是一种重要的化合物,它不仅在工业中被广泛应用,还与大气污染和酸雨形成有关。
2. 三氧化硫(SO3):三氧化硫是硫的另一种氧化物,是一种白色结晶固体。
它可以通过将二氧化硫通入硝酸的脱水剂中制备,也是一种重要的工业化合物,用于制造硫酸。
3. 二硫化碳(CS2):二硫化碳是一种无色液体,具有特殊的异味。
它是由碳和硫直接反应得到的,具有较高的挥发性。
二硫化碳在化学实验中常被用作溶剂。
4. 硫化氢(H2S):硫化氢是一种无色气体,具有恶臭的腐蚀性气味,类似于腐烂的鸡蛋。
它是由硫化物经过还原反应产生的,也是一种常见的工业废气。
硫化氢具有强酸性,可以与金属反应生成对应的金属硫化物。
三、硫的氧化还原反应在化学中,硫可以与其他元素发生氧化还原反应,形成硫化物或亚硫酸盐。
以下是一些常见的氧化还原反应方程式:1. 硫的还原反应:2S + O2 → 2SO2这个方程式描述了硫被氧气氧化为二氧化硫的过程。
2. 硫的氧化反应:SO2 + O2 → SO3这个方程式描述了二氧化硫被氧气进一步氧化为三氧化硫的过程。
3. 硫的与金属反应:H2S + 2Cu → Cu2S + 2H2这个方程式描述了硫化氢与铜反应生成硫化亚铜的过程。
四、硫的应用硫作为一种重要的元素,在工业和农业生产中有广泛的应用。
1高中化学必修一3.1硫及其重要化合物-知识点1、黑火药中含有硫,纯净的硫一种黄色或淡黄色的固体,俗称硫黄。
硫很脆,容易研磨成粉末,不溶于水,微溶于酒精,易溶于二硫化碳。
2、硫的化学性质比较活泼,与氧气相似,容易与金属、其他非金属发生反应。
①硫与铁粉混合加热,S+Fe −→−∆ FeS ,②铜在硫蒸气中燃烧,S+2Cu −→−∆ Cu S ,③常温下硫与汞反应,S+Hg →HgS ,④硫在空气中燃烧,S+O 2 −−→−点燃SO 2,⑤硫与氢气加热生成硫化氢,S+H −→−∆H S 。
3、硫的常见化合态有:-2,+4,+6 ,硫的常见氧化物是SO 2和SO 3。
4、二氧化硫是无色、有刺激性气味的有毒气体,密度比空气大,易溶于水,通常情况下,1体积的水可溶解40 体积的二氧化硫。
溶于水的二氧化硫与水反应生成亚硫酸(不稳定的中强酸,易分解),是可逆反应,SO 2+H 2O ⇌H 2SO 3 。
5、二氧化硫有漂白作用,能漂白品红等有色物质。
它能与这些有色物质反应生成不稳定的无色物质,这种无色物质受热后容易分解,从而使有色物质恢复至原来的颜色。
(SO 2的漂白性是可逆的,但Cl 2的漂白性不可逆)。
二氧化硫还具有杀菌防腐作用,可用作食品加工的防腐剂。
6、SO 2是酸性氧化物,化学性质活泼。
①氧化性,SO +2H S →3S+2H O ;②还原性,2SO 2+O 2−−−−→←催化剂,加热2SO 3 。
将SO 2气体通入KIO 3淀粉溶液,溶液先变蓝后褪色,是因为KIO 3被SO 2还原成碘单质后,碘单质又继续被还原成碘离子。
7、SO 2与碱的反应类似于CO 2,SO 2不足时生成亚硫酸钙沉淀CaSO 3,SO 2过量时生成亚硫酸氢钙溶液Ca(HSO 3)2 。
8、SO 2与CO 2的鉴别。
SO 2:既能使品红溶液褪色,又能使澄清石灰水变浑浊;CO 2:不能使品红溶液褪色,但能使澄清石灰水变浑浊。
另外,SO 2具有还原性,而CO 2没有还原性,可用高锰酸钾溶液来除去CO 2气体中混有的SO 2。
高中化学硫及其化合物知识大全
1、硫元素的存在:硫元素最外层电子数为6个,化学性质较活泼,容易得到2个电子呈-2价或者与其
他非金属元素结合成呈+4价、+6价化合物。
硫元素在自然界中既有游离态, 又有化合态。
(如火山口中的硫就以游离态存在)
2、硫单质:①物质性质:俗称硫磺,淡黄色固体,不溶于水,微溶于
酒精,易溶于二硫化碳,熔点低。
②化学性质:S+O2 ===(点燃) SO
2
(空气中点燃淡蓝色火焰,纯氧中为蓝紫色)
Fe+SFeS 2Cu+SCu
2S 2Na+S=Na
2
S
Hg+S==HgS(汞滴处理)
3S+6NaOH(浓)2Na
2S+Na
2
SO
3
+3H
2
O(洗硫)
3、二氧化硫(SO
2
)
(1)物理性质:有刺激性气味有毒气体, 可溶于水(1:40),易液化。
(2)化学性质:
①SO
2能与水反应:SO
2
+H
2
O H
2
SO
3
亚硫酸为中强酸,此反应为可逆
反应。
可逆反应定义:在相同条件下,正逆方向同时进行的反应。
(关键词:相同条件下)
②SO
2
为酸性氧化物,可与碱反应生成盐和水。
a、与NaOH溶液反应:SO
2(少量)+2NaOH=Na
2
SO
3
+H
2
O
SO
2(过量)+NaOH=NaHSO
3
对比CO
2与碱反应:CO
2
(少量)+Ca(OH)
2
=CaCO
3
↓(白色)+H
2
O
2CO
2(过量)+Ca(OH)
2
=Ca(HCO
3
)
2
(可溶)
将SO
2逐渐通入Ca(OH)
2
溶液中先有白色沉淀生成,后沉淀消失,与CO
2
逐渐
通入Ca(OH)
2溶液实验现象相同,故不能用石灰水来鉴别SO
2
和CO
2。
能使
石灰水变浑浊的无色无味的气体一定是二氧化碳,这说法是对的,因为SO
2是有刺激性气味的气体。
b、SO
2将通入酚酞变红的溶液,溶液颜色褪去,体现了SO
2
和水反应生
成亚硫酸,是酸性氧化物的性质,而不是漂白性,SO2不能漂白指示剂。
③SO
2具有强还原性,能与强氧化剂(如酸性KMnO
4
溶液、Cl
2
、O
2
(催化
剂:粉尘、V
2O
5
)等)反应。
SO
2
能使酸性KMnO
4
溶液、新制氯水褪色,显
示了SO
2的强还原性(不是SO
2
的漂白性)。
(将SO
2气体和Cl
2
气体混合后作用于有色溶液,漂白效果将大大减
弱。
)
④SO
2的弱氧化性:如2H
2
S+SO
2
=3S↓+2H
2
O(有黄色沉淀生成)
⑤SO
2的漂白性:SO
2
能使品红溶液褪色,加热会恢复原来的颜色。
用此
可以检验SO
2
的存在。
SO
2
:漂白某些有色物质使湿润有色物质褪色
原理:与有色物质化合生成不稳定的无色物质,加热,能恢复原色(无色物质分解)
Cl
2
:与水生成HClO,HClO具有漂白性,将有色物质氧化成无色物质,加热不能复原
⑥SO
2
的用途:漂白剂、杀菌消毒、生产硫酸等。
4、硫酸(H
2SO
4
)
(1)浓硫酸的物理性质:纯的硫酸为无色油状粘稠液体,能与水以任意比互溶(稀释浓硫酸要规范
操作:注酸入水且不断搅拌).不挥发,沸点高,密度比水大。
(2)浓硫酸三大性质:
①吸水性:浓硫酸可吸收结晶水、湿存水和气体中的水蒸气,可作
干燥剂,可干燥H
2、O
2
、SO
2
、
CO
2等气体,但不可以用来干燥NH
3
、H
2
S、HI、HBr气体。
②脱水性:能将有机物(蔗糖、棉花等)以H和O原子个数比2︰1脱去,炭化变黑。
③强氧化性:浓硫酸在加热条件下显示强氧化性(+6价硫体现了强氧化性),能与大多数金属
反应,也能与非金属反应。
(ⅰ)与大多数金属反应(如铜):(此反应浓硫酸表现出酸性和强氧化性 )
(ⅱ)与非金属反应(如C反应):(此反应浓硫酸表现出强氧化性 )
注意:常温下,Fe、Al遇浓H
2SO
4
或浓HNO
3
发生钝化,而不是不反应。
浓硫酸的强氧化性使许多金属能与它反应,但在常温下,铝和铁遇浓硫酸时,因表面被浓硫
酸氧化成一层致密氧化膜,这层氧化膜阻止了酸与内层金属进一步反应.这种现象叫金属的钝化.铝和铁也能被浓硝酸钝化,所以,常温下可用铁或铝制容器盛放浓硫酸和浓硝酸.
(3)硫酸的用途:作干燥剂、制化肥、炸药、蓄电池、农药、医药等。
点评:SO
2的性质及酸雨一直是高考命题的热点内容,如SO
2
的漂白性,还原性
等。
特别注意:①能使下列物质褪色体现的是SO
2
的何种性质?能使溴水、氯水、高锰酸钾溶液褪色;能使酚酞试液变红的溶液褪色
等。
②将SO
2通入BaCl
2
溶液中,是否有沉淀生成?若再通入足量的
氨气、氯气是否产生白色沉淀?原理是什么?写出对应的化学方程式。