第三章第二节第1课时 钠的重要化合物
- 格式:ppt
- 大小:2.54 MB
- 文档页数:26



第二节几种重要的金属化合物课时1 钠的重要化合物(氧化钠和过氧化钠)教学目标(一)知识与技能1.掌握过氧化钠和氧化钠的的性质的异同2.了解过氧化钠的用途(二)过程与方法1.充分利用表格形式,通过比较,掌握知识2.通过实物展示实险演示和学生参与实验相结合的方法,学习元素化合物知识(三)情感态度与价值观培养学生认真细致的科学态度,激发学生的求知欲教学重难点过氧化钠的化学性质教学过程【情景导入]】同学们知道,二氧化碳通常是可以用来灭火的,那么,大家知不知道,有时,二氧化碳却能使物质燃烧起来呢?下面,我们来观看一段视频《过氧化钠与二氧化碳的反应》。
【板书】钠的重要化合物(氧化钠和过氧化钠)一、过氧化钠1.颜色、状态:淡黄色固体2.化学性质(1)与CO2的反应2 Na2O2+2CO2 ==2 Na2CO3+O2环节一【合作探究】[实验3-5] 过氧化钠与水的反应把水滴入盛有少量过氧化钠固体的试管中,立即将带火星的香头放在试管口,检验生成的气体。
用手触摸试管的外壁,有什么感觉?然后向反应后的溶液中滴入1-2滴酚酞试液,有什么现象产生?将所观察的实验现象及所得出的结论填写在导学案上。
【小组展示】现象及结论:1.试管外壁发热,说明反应放热;2.滴加水后产生大量气泡,带火星的香头复燃,说明反应剧烈并生成氧气;3.向试管中滴入酚酞后变红色,说明生成了氢氧化钠。
【教师点评】(如果学生提出刚刚变红的溶液现在褪色了,可告诉学生是过氧化钠的漂白性起作用,引导学生课后查阅资料,在研究性学习的时间加以解决)【板书】(2)与水的反应2Na2O2+2H2O==4NaOH+O2↑【思考与交流1】金属钠着火怎么办?【小组展示】金属钠着火主要生成过氧化钠,所以不能用水或二氧化碳来灭火,得用砂子盖灭。
【思考与交流2】用双线桥法表示Na2O2与H2O、与CO2反应的电子转移情况,并指出氧化剂、还原剂。
【小组展示】环节二【思考与交流3】1.回忆前面所学知识,描述氧化钠的颜色、状态。

钠的重要化合物说课稿
钠的重要化合物说课稿
我说课的题目是:高中化学必修1第三章第二节第一课时《钠的重要化合物》。
一、教材的作用和地位本章是学生第一次综合运用归纳和演绎的方法学习元素化合物,这种学习模式将为今后元素化合物的教学做铺垫。
钠的重要化合物是本章教材的重点之一,通过钠的重要化合物的学习,可以加深对上一节钠的知识的理解,并为学习其他几种重要金属化合物奠定基础,故本节教材具有承上启下的作用。
二、教学目标的确定及依据根据《化学课程标准》,结合教材,本着面向全体学生,使学生自主、全面、主动发展的原则,我确定本节课的教学目标如下:请。


高中化学必修1《钠重要化合物》说课稿高中化学必修1《钠重要化合物》说课稿高中化学必修1《钠的重要化合物》说课稿我说课的题目是:高中化学必修1第三章第二节第一课时《钠的重要化合物》。
一、说教材1.教材的地位和作用钠的重要化合物是本章教材的重点之一,本节知识是钠单质性质的延伸和发展,钠单质在化学反应中易失电子转变为钠的化合物,所以钠单质和钠的化合物之间存在着必然的因果关系。
只有既了解了钠单质的性质又了解了钠的化合物性质,才会比较全面的了解钠这种金属。
通过钠单质及钠的重要化合物的学习,既复习巩固了氧化还原反应和离子反应,又为学习其他几种重要金属化合物奠定基础和提供理论模式。
2、教学目标根据《化学课程标准》,结合教材,本着面向全体学生,使学生自主、全面、主动发展的原则,我确定本节课的教学目标如下:【知识与技能】1)、掌握钠的重要化合物的性质和用途。
2)、通过碳酸钠和碳酸氢钠的对比实验,学生能了解两者性质的差异、掌握二者的转化关系及鉴别方法。
【过程与方法】1)、通过碳酸钠和碳酸氢钠的对比学习,学生应初步掌握对比、推理、归纳的能力。
2)、教学中通过学生的实验和探究。
可以进一步提高学生的观察能力、实验能力和思维能力。
【情感态度与价值观】1)、通过实验探究的过程,学生更容易体会到知识的形成过程,体验到动手合作的乐趣,在交流中养成团结合作的良好品质。
2)、通过学习我国化学家侯德榜对世界制碱工业、我国化学工业作出的巨大贡献,增加学生民族自豪感。
3、教学重点难点根据教材及学生特点和已有知识,我确定如下教学重点和难点:教学重点:过氧化钠的性质,碳酸钠和碳酸氢钠的性质及转化。
教学难点:Na2O2的性质。
二、说学情在本节课之前,学生已经学习了氧化还原反应、离子反应、以及钠单质的性质等知识,能够对化学反应的得失电子情况及离子反应的本质做出正确的判断。
在能力上,学生已经初步具备观察能力、实验能力、思维能力,喜欢通过实验探究的方式来研究物质的性质,可以通过对实验现象的分析、对比,归纳出实验结论。

第三章《金属化合物》第二节第一课时《钠的重要化合物》教案[教学目标]1、通过实验探究,使学生掌握过氧化钠的性质及其用途。
2、通过对比实验,使学生初步掌握碳酸钠、碳酸氢钠的性质及其用途。
3、通过实验探究,使学生了解焰色反应,能用焰色反应判断某些金属元素(钠、钾)的存在。
[能力目标]1、通过指导学生实验,使学生初步了解研究化学问题的方法,培养学生认真细致和严谨求实的科学态度。
2、利用对比的实验方法,培养学生的观察能力和分析问题的能力,提高学生的实验能力和创新能力。
[教学重点]1、过氧化钠的性质2、碳酸钠、碳酸氢钠的性质[教学难点]过氧化钠与水反应;碳酸钠、碳酸氢钠的性质比较。
[教学方法]实验探究法[教学过程][导入] “吹气生火”实验[引言]今天我们的题目是第三章第二节《几种重要的金属化合物》第一课时,首先给大家做个小魔术,怎样解开这个谜团呢?这就涉及我们今天所学习的内容。
[新课板书] §3—2 钠的重要化合物[过渡]钠是一种活泼的金属元素,在自然界不存在游离态的钠,钠元素都是以化合态存在于自然界的。
其中,氢氧化钠和氯化钠我们在初中已有所了解。
[板书] 一、氧化钠和过氧化钠[思考与交流]1.回忆前面做过的实验,描述氧化钠和过氧化钠的颜色状态及生成条件。
2.氧化钠与水、CO2的反应和氧化钙与水、CO2的反应类似,请你写出氧化钠与反应的化学方程式.。
水、CO2[学生活动]填写表1,回答问题[追问] Na2O2是否有相似的性质?[学生实验探究] Na2O2与水反应(课本P55实验3-5)把水滴入盛有过氧化钠的试管中,立即把带火星的木条放在试管口,检验生成的气体。
用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞溶液,有什么现象发生?得出什么结论?[现象] 1 、剧烈反应,试管温度升高2、产生的气体使带火星的木条复燃3、滴加酚酞试液变红、振荡后红色又褪去。
[结论] 过氧化钠有强氧化性、漂白性,用来漂白织物、麦秆、羽毛等。
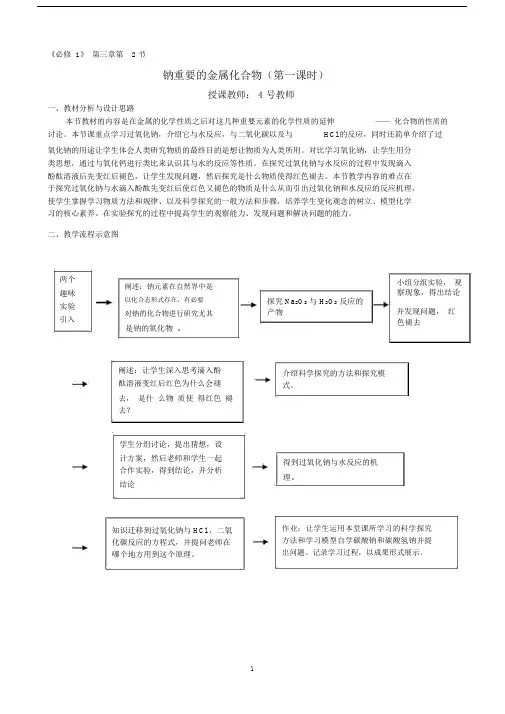
《必修 1》第三章第 2 节钠重要的金属化合物(第一课时)授课教师: 4 号教师一、教材分析与设计思路本节教材的内容是在金属的化学性质之后对这几种重要元素的化学性质的延伸——化合物的性质的讨论。
本节课重点学习过氧化钠,介绍它与水反应,与二氧化碳以及与HCl 的反应,同时还简单介绍了过氧化钠的用途让学生体会人类研究物质的最终目的是想让物质为人类所用。
对比学习氧化钠,让学生用分类思想,通过与氧化钙进行类比来认识其与水的反应等性质。
在探究过氧化钠与水反应的过程中发现滴入酚酞溶液后先变红后褪色,让学生发现问题,然后探究是什么物质使得红色褪去。
本节教学内容的难点在于探究过氧化钠与水滴入酚酞先变红后使红色又褪色的物质是什么从而引出过氧化钠和水反应的反应机理,使学生掌握学习物质方法和规律、以及科学探究的一般方法和步骤,培养学生变化观念的树立、模型化学习的核心素养。
在实验探究的过程中提高学生的观察能力、发现问题和解决问题的能力。
二、教学流程示意图两个阐述:钠元素在自然界中是趣味以化合态形式存在,有必要实验对钠的化合物进行研究尤其引入是钠的氧化物。
阐述:让学生深入思考滴入酚酞溶液变红后红色为什么会褪去,是什么物质使得红色褪去?学生分组讨论,提出猜想,设计方案,然后老师和学生一起合作实验,得到结论,并分析结论知识迁移到过氧化钠与 HCl 、二氧化碳反应的方程式,并提问老师在哪个地方用到这个原理。
小组分组实验,观察现象,得出结论探究 Na2O2与 H2O2反应的产物并发现问题,红色褪去介绍科学探究的方法和探究模式。
得到过氧化钠与水反应的机理。
作业:让学生运用本堂课所学习的科学探究方法和学习模型自学碳酸钠和碳酸氢钠并提出问题。
记录学习过程,以成果形式展示。
1三、教学设计教学目标知识与技能:1.对比学习Na 2O2、Na2O,能宏观辨识物质,能正确书写Na2O2与 H 2O、 CO2反应的方程式,能从微观探析角度分析。
2.能发现 Na2O2与 H 2O 反应后滴入酚酞颜色先变红又褪去,让学生探究红色褪去的原因,提高化学实验的设计、评价、改进的能力,培养学生实验探究的能力和证据推理的能力。
