高中学业水平考试化学第三章 第四节 第1课时
- 格式:pdf
- 大小:532.04 KB
- 文档页数:6

加油!有志者事竟成答卷时应注意事项1、拿到试卷,要认真仔细的先填好自己的考生信息。
2、拿到试卷不要提笔就写,先大致的浏览一遍,有多少大题,每个大题里有几个小题,有什么题型,哪些容易,哪些难,做到心里有底;3、审题,每个题目都要多读几遍,不仅要读大题,还要读小题,不放过每一个字,遇到暂时弄不懂题意的题目,手指点读,多读几遍题目,就能理解题意了;容易混乱的地方也应该多读几遍,比如从小到大,从左到右这样的题;4、每个题目做完了以后,把自己的手从试卷上完全移开,好好的看看有没有被自己的手臂挡住而遗漏的题;试卷第1页和第2页上下衔接的地方一定要注意,仔细看看有没有遗漏的小题;5、中途遇到真的解决不了的难题,注意安排好时间,先把后面会做的做完,再来重新读题,结合平时课堂上所学的知识,解答难题;一定要镇定,不能因此慌了手脚,影响下面的答题;6、卷面要清洁,字迹要清工整,非常重要;7、做完的试卷要检查,这样可以发现刚才可能留下的错误或是可以检查是否有漏题,检查的时候,用手指点读题目,不要管自己的答案,重新分析题意,所有计算题重新计算,判断题重新判断,填空题重新填空,之后把检查的结果与先前做的结果进行对比分析。
亲爱的小朋友,你们好! 经过两个月的学习,你们一定有不小的收获吧,用你的自信和智慧,认真答题,相信你一定会闯关成功。
相信你是最棒的!12024年安徽普通高中学业水平选择性考试化学试题及答案注意事项:1.答题前,考生务必将自己的姓名和座位号填写在答题卡和试卷上。
2.作答选择题时,选出每小题答案后,用铅笔将答题卡上对应题目的答案选项涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案选项。
作答非选择题时,将答案写在答题卡上对应区域。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 N 14 O 16 Cl 35.5 Fe 56 Zn 65 Sn 119一、选择题:本题共14小题,每小题3分;共42分。
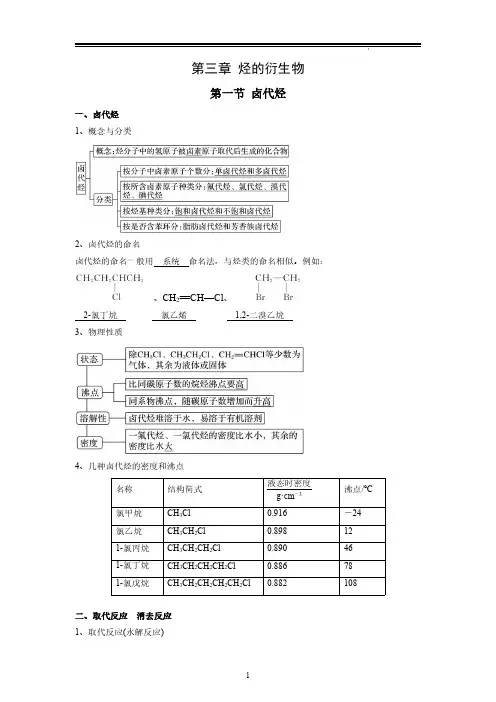
第三章烃的衍生物第一节卤代烃一、卤代烃1、概念与分类2、卤代烃的命名卤代烃的命名一般用系统命名法,与烃类的命名相似。
例如:、CH 2==CH—Cl 、2-氯丁烷氯乙烯1,2-二溴乙烷3、物理性质4、几种卤代烃的密度和沸点名称结构简式液态时密度g·cm -3沸点/℃氯甲烷CH 3Cl 0.916-24氯乙烷CH 3CH 2Cl 0.898121-氯丙烷CH 3CH 2CH 2Cl 0.890461-氯丁烷CH 3CH 2CH 2CH 2Cl 0.886781-氯戊烷CH 3CH 2CH 2CH 2CH 2Cl0.882108二、取代反应消去反应1、取代反应(水解反应)实验装置实验现象①中溶液分层②中有机层厚度减小,直至消失④中有淡黄色沉淀生成实验解释溴乙烷与NaOH 溶液共热产生了Br -由实验可知:(1)溴乙烷与氢氧化钠溶液共热时断裂的是C—Br,水中的羟基与碳原子形成C—O,断下的Br 与水中的H 结合成HBr。
(2)溴乙烷与NaOH 溶液共热反应的化学方程式为:CH 3CH 2Br +NaOH――→水△CH 3CH 2OH +NaBr 。
反应类型为取代反应。
2、消去反应由实验可知:(1)1-溴丁烷与氢氧化钠的乙醇溶液共热反应后,化学方程式为CH 3CH 2CH 2CH 2Br +NaOH――→乙醇△CH 3CH 2CH==CH 2↑+NaBr +H 2O 。
(2)消去反应:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H 2O 、HX 等),而生成含不饱和键的化合物的反应。
(3)问题讨论:①实验中盛有水的试管的作用是为了除去挥发出来的乙醇,原因是乙醇也能使酸性高锰酸钾溶液褪色,干扰丁烯的检验。
②除酸性高锰酸钾溶液外还可以用溴的四氯化碳溶液来检验丁烯,此时气体还用先通入水中吗?不用,理由是乙醇与溴不反应,不会干扰丁烯的检验。
三、卤代烃的化学性质及卤代烃中卤素原子的检验1、卤代烃的化学性质(1)取代反应(水解反应)R—X +NaOH――→水△R—OH +NaX 。

§3。
1 最简单的有机化合物—--—-甲烷有机化合物: (有机物)含碳元素的化合物(碳的氧化物、碳酸及其盐等除外)。
组成元素除碳外,常含有氢、氧,还含有氮、硫、卤素、磷等. 碳氢化合物:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
一、甲烷的物性及存在1、存在:甲烷是天然气、沼气、油田气和煤矿坑道气(坑气)的主要成分。
2、分子组成和结构 ⑴分子式:CH4⑵电子式:⑶结构式:⑷结构简式:CH4⑸空间构型:具有正四面体形结构。
用CH 2Cl 2 只有一种结构可以证明 .3、化学性质:在通常情况下,甲烷比较稳定,与高锰酸钾等强氧化剂不发生反应,与强酸、强碱也不发生反应。
但是,在一定的条件下,甲烷也会发生某些反应。
⑴氧化反应甲烷可以在空气(或氧气)中安静燃烧,产生淡蓝色火焰,同时放出大量的热。
CH 4+2O 2−−→−点燃 CO 2+2H 2O 注意有机物化学反应方程式的书写。
用“→"不用“=" 点燃甲烷和空气(或氧气)的混合气体,可能会发生爆炸,因此在进行甲烷燃烧实验时,必须先检验其纯度.⑵取代反应(有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应)注意:1。
反应条件——光照(室温下在暗处不发生反应)。
2.反应物质——纯卤素单质,例如甲烷与氯水、溴水不反应,与氯气、溴蒸气光照条件下发生取代反应。
3.甲烷分子中的四个氢原子可逐一被取代,故甲烷的卤代物并非一种,而是几种卤代物的混合物。
⑶受热分解在隔绝空气并加热至1000℃的条件下,甲烷分解生成炭黑和氢气。
总结:二、烷烃定义:烃分子中的碳原子之间只以单键结合成链状,碳原子剩余的价键全部跟氢原子相结合,使每个碳原子的化合价都已充分利用,都达到“饱和”。
这样的烃叫做饱和烃,又叫烷烃。
要点:1、碳碳单键;2、“饱和”- 每个碳原子都形成四个单键。
下列物质中是否属于烷烃?为什么?CH2=CH2 否CH3-CH2-CH2-CH2-CH3 是1、结构简式:2、烷烃的通式:C n H2n+2(n≥1 )3、烷烃的命名:(1)习惯命名法:碳原子数在10个以内,依次用“天干"(甲、乙、丙、丁、戊、已、庚、辛、壬、癸)代表碳原子总数,其后加上“烷"字;碳原子数在10个以上,用汉字数字表示.(2)系统命名法4、烷烃的物理性质烷烃均不溶于水,熔沸点随碳原子数增多而升高(四个碳原子以内的烷烃常温下呈气态),密度随碳原子数增多而增大。



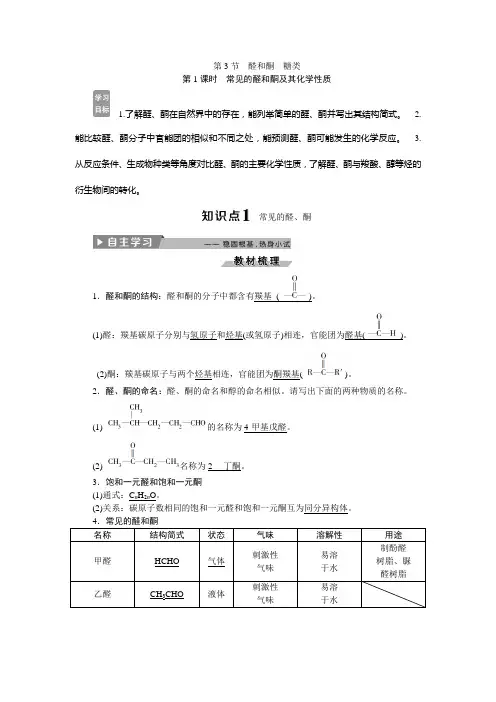
第3节醛和酮糖类
第1课时常见的醛和酮及其化学性质
1.了解醛、酮在自然界中的存在,能列举简单的醛、酮并写出其结构简式。
2.能比较醛、酮分子中官能团的相似和不同之处,能预测醛、酮可能发生的化学反应。
3.从反应条件、生成物种类等角度对比醛、酮的主要化学性质,了解醛、酮与羧酸、醇等烃的衍生物间的转化。
常见的醛、酮
1.醛和酮的结构:醛和酮的分子中都含有羰基()。
(1)醛:羰基碳原子分别与氢原子和烃基(或氢原子)相连,官能团为醛基()。
(2)酮:羰基碳原子与两个烃基相连,官能团为酮羰基()。
2.醛、酮的命名:醛、酮的命名和醇的命名相似。
请写出下面的两种物质的名称。
(1)的名称为4-甲基戊醛。
(2)名称为2丁酮。
3.饱和一元醛和饱和一元酮
(1)通式:C n H2n O。
(2)关系:碳原子数相同的饱和一元醛和饱和一元酮互为同分异构体。
名称结构简式状态气味溶解性用途
甲醛HCHO 气体刺激性
气味
易溶
于水
制酚醛
树脂、脲
醛树脂
乙醛CH3CHO 液体刺激性
气味
易溶
于水。

人教版高中化学第三章知识点及相关练习精编版MQS system office room 【MQS16H-TTMS2A-MQSS8Q8-MQSH16898】第三章有机化合物知识点及练习、碳酸、碳绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO、CO2酸盐、金属碳化物等少数化合物,它们属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:甲烷1、甲烷不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色,与强酸、强碱也不反应,性质比较稳定。
2、氧化反应(燃烧)注:可燃性气体点燃之前一定要验纯CH4+2O2−−→−点燃CO2+2H2O(淡蓝色火焰)3、取代反应(条件:光;气态卤素单质;以下四反应同时进行,产物有5种)CH4+Cl2−→−光CH3Cl+HClCH3Cl+Cl2−→−光CH2Cl2+HClCH2Cl2+Cl2−→−光CHCl3+HClCHCl3+Cl2−→−光CCl4+HCl注意事项:①甲烷与氯气在光照下发生取代反应,甲烷分子里的四个氢原子逐步被氯原子取代;②反应能生成五种产物,四种有机取代产物都不溶于水,常温下,一氯甲烷是气体,其他是液体,三氯甲烷称氯仿,四氯甲烷可作灭火剂;产物中HCl气体产量最多;③取代关系:1H~~Cl2;④烷烃取代反应是连锁反应,产物复杂,多种取代物同时存在。
4、高温分解:2100042HCCH C+−−→−乙烯1.氧化反应I.燃烧C2H4+3O2−−→−点燃2CO2+2H2O(火焰明亮,伴有黑烟)II.能被酸性KMnO4溶液氧化为CO2,使酸性KMnO4溶液褪色。
2.加成反应CH2=CH2+Br2−→−CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色)在一定条件下,乙烯还可以与H2、Cl2、HCl、H2O等发生加成反应CH2=CH2+H2催化剂△CH3CH3CH2=CH2+HCl催化剂△CH3CH2Cl(氯乙烷:一氯乙烷的简称)CH2=CH2+H2O高温高压催化剂CH3CH2OH(工业制乙醇)3.加聚反应nCH2=CH2催化剂△(聚乙烯)注意:①乙烯能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。

第四节 羧酸 羧酸衍生物第1课时 羧酸课标·内容要求课标·学业要求1.认识羧酸的组成和结构特点、性质、转化关系及其在生产生活中的应用。
2.认识羧酸取代(酯化)反应的特点和规律。
3.结合生产、生活实际了解羧酸对环境和健康可能产生的影响1.能写出羧酸的官能团、简单代表物的结构简式和名称,能够列举羧酸的简单代表物的物理性质。
2.能基于官能团、化学键的特点与反应规律分析和推断羧酸的化学性质教材梳理·概念认知知识点 一羧酸的概述1.羧酸:由烃基(或氢原子)与羧基()相连构成的有机化合物。
2.分类(1)根据与羧基相连的烃基的不同分类羧酸可以分为脂肪酸(如甲酸、乙酸)和芳香酸(如苯甲酸)。
(2)根据羧酸分子中羧基的数目分类羧酸可以分为一元羧酸(如丙酸)、二元羧酸(如乙二酸)和多元羧酸等。
3.常见的羧酸 名称 甲酸 苯甲酸 乙二酸 俗称 蚁酸—草酸结构 简式HOOC —COOH物理 性质 无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶无色晶体,易升华,微溶于水,易溶于乙醇无色晶体,可溶于水和乙醇化学 性质 表现羧酸和醛的性质表现羧酸和苯环的性质 表现羧酸的性质重要作还原剂,合成医药、农药合成香料、药物等,其钠盐是化学分析中常用的还用途和染料等的原料常用的食品防腐剂原剂,重要化工原料【点拨】有些有机酸分子中既含有羧基也含有羟基,故又叫羟基酸,既具有羧基的性质,也具有羟基的性质,如乳酸()、柠檬酸()、苹果酸等。
4.羧酸的物理性质物理性质规律举例溶解性分子中碳原子数较少的羧酸能够与水互溶甲酸、乙酸、乙二酸随着分子中碳原子数的增加,一元羧酸在水中的溶解度迅速减小,甚至不溶于水高级脂肪酸(不溶于水的蜡状固体)沸点随着分子中碳原子数的增加,一元羧酸的沸点逐渐升高丙酸>乙酸>甲酸【点拨】羧酸与相对分子质量相当的其他有机化合物相比,沸点较高,这与羧酸分子间可以形成氢键有关。
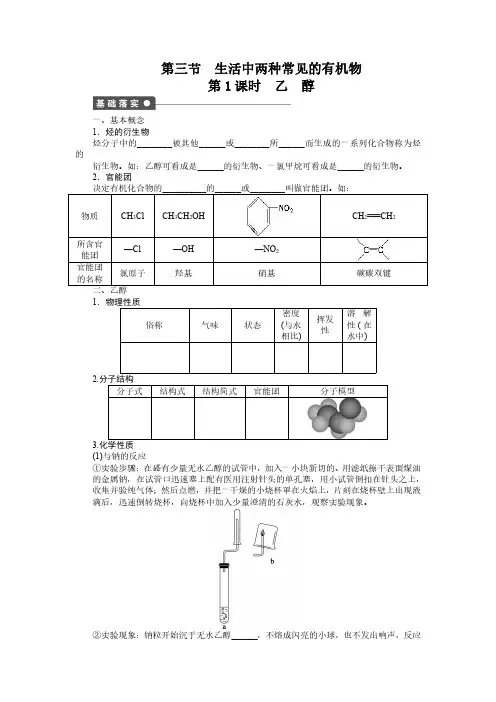

【引导阅读】:乙烯的化学性质P60【板书】二、乙烯的化学性质【共同讨论】:师生共同进行【板书】乙烯物理性质:无色稍有气味的气体,比空气轻,难溶于水。
1、氧化反应(1)、燃烧—乙烯在空气中燃烧,产生明亮的火焰并伴有黑烟,同时放出大量的热。
反应方程式:C2H4+3O22CO2+2H2O【思考与交流】乙烯在空气中燃烧,为什么会有黑烟?【教师】乙烯燃烧时产生的黑烟主要是由于乙烯中碳元素含量较大,发生不完全燃烧,反应中有碳单质生产。
(2)、乙烯使酸性高锰酸钾溶液褪色反应的实质是酸性高锰酸钾溶液具有强氧化性,能使乙烯被氧化。
【板书】2、加成反应——有机物分子中的不饱和键(双键或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
【教师】在加成反应中,不饱和键中的1个(双键或三键)或2个键(三键)断裂。
不饱和键两端的原子分别与其他原子或原子团连接在一起。
如乙烯与溴的加成反应:这就是溴水褪色的原因【练习】写出下列反应的化学方程式(1)乙烯与氢气反应(2)乙烯与氯气反应(3)乙烯与氯化氢反应(4)乙烯与水在加压、加热和催化剂条件下反应【思考与交流】如何鉴别甲烷和乙烯气体,你能设计出几种方案?【板书】3、加聚反应【教师】从打开双键看乙烯的自身加成——高分子材料乙烯的加聚反应:【教师】聚乙烯无毒,生活中用来包装食品的塑料袋就是聚乙烯【思考】根据乙烯发生加聚反应的原理,判断下列物质能否发生加成反应,能发生的写出反应的化学方程式。
①CH2=CHCl(氯乙烯)②CF2=CF2(四氟乙烯)【教师】氯乙烯加聚后得到的产物叫聚氯乙烯,也可制成塑料包装袋,但不能用来包装食品,因为聚乙烯点燃聚氯乙烯有毒【教师】认识了乙烯的典型化学性质,乙烯有什么用途呢?学生阅读教材P61页。
【板书】三、乙烯的用途【小结】制取酒精、橡胶、塑料等,并能作为植物生长调解剂和水果的催熟剂等。
【课堂练习】布置作业板书设计第二节来自石油和煤的两种基本化工原料――乙烯一、乙烯的分子组成和结构分子式:C2H4,电子式:结构式:结构简式:CH2== CH2分子构型:平面型;键角:120°二. 乙烯物理性质:无色稍有气味的气体,比空气轻,难溶于水。
第1课时认识有机化合物的一般性质与结构特点必备知识基础练进阶训练第一层知识点1认识有机化合物的一般性质1.下列物质中属于有机化合物的是( )①乙醇②蛋白质③石墨④甲烷⑤蔗糖⑥碳酸⑦一氧化碳⑧碳酸钙⑨乙酸A.①②④⑤⑨B.①④⑤⑨C.①④⑤⑦⑧⑨ D.①②④⑨2.下列关于有机化合物性质的叙述不正确的是( )A.大多数有机化合物难溶于水,易溶于有机溶剂B.有机化合物参加的反应比较复杂,一般情况下反应较慢C.有机化合物一般硬度大、熔点高D.绝大多数有机化合物受热易分解,容易燃烧3.下列关于有机化合物叙述不正确的是( )A.碳原子性质较活泼,除C原子之间可以成键外,C原子与其他元素的原子也可形成化学键B.碳原子间能形成单键,也能形成双键或三键,进而形成碳链或碳环C.易溶于汽油、酒精、苯等有机溶剂中的物质不一定是有机化合物D.有机化合物所发生的反应,一般比较复杂,并且还常伴有副反应发生4.下列有关有机物的说法正确的是( )A.有机物只能从动植物中提取B.所有的有机反应都比较复杂、缓慢,并且常伴有副反应发生C.所有的有机物都易燃烧D.有机物都含有碳元素,但含碳化合物不一定是有机物知识点2认识有机化合物的结构特点5.下列物质中,属于有机物但不属于烃的是( )A.CO B.CH3COOHC.CaCO3D.C2H66.验证某有机物属于烃,应完成的实验内容是( )A.只测定它的碳、氢原子个数比B.只要证明它完全燃烧后的产物只有H2O和CO2C.只测定其燃烧产物中H2O和CO2的物质的量的比值D.测定该试样的质量及试样完全燃烧后生成H2O和CO2的质量7.下列关于甲烷结构的说法错误的是( )A.甲烷分子的空间构型为正四面体结构B.甲烷分子中的4个氢原子不在同一平面上C.甲烷分子中最多有4个原子在同一平面上D.甲烷分子中任意两个碳氢键之间的夹角相等8.下列分子与甲烷的结构相同的是( )9.下列有关碳原子之间相互结合的方式不正确的是( )A.碳原子之间可以以单键相连B.碳原子之间可以形成双键,也可以形成三键C.多个碳原子之间可以形成碳环,也可以形成碳链D.在一种有机物中,碳原子之间只能结合成碳链或者结合成碳环10.下列关于碳原子成键的说法正确的是( )A.所有有机化合物中每个碳原子均与4个氢原子形成4个共价单键B.碳原子与氢原子以及碳原子之间只能形成共价单键C.碳原子间可以构成链状结构,也可以构成环状结构D.有机化合物中碳原子间形成的共价键数一定小于碳原子数11.碳原子之间的不同结合方式使得有机物种类繁多,下列碳原子的结合方式中错误的是(假设碳原子其余共价键全部与氢原子结合)( )12.下列叙述中不正确的是( )A.碳原子既可以跟碳原子又可以跟其他原子(如氢原子)形成4个共价键B.碳原子性质非常活泼,易跟多种原子形成共价键C.碳原子之间既可以形成单键,又可以形成双键和三键D.多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合13.下列化学用语或模型正确的是( )A.NH4Cl的电子式:B.中子数为7的氮原子:15N7C.丙烷分子的球棍模型:D.乙烯的结构简式:CH2CH214.常温下取一支大硬质试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )A.此反应无光照也可发生B.甲烷和Cl2反应后的产物只有CH3Cl和HClC.CH4和Cl2完全反应后液面上升,液体充满试管D.盛放饱和食盐水的水槽底部会有少量晶体析出15.下列有关甲烷的取代反应的叙述正确的是( )A.甲烷与氯气的物质的量之比为1∶1,混合发生取代反应只生成CH3ClB.甲烷与氯气的取代反应,产物中CH3Cl最多C.甲烷与氯气的取代反应,产物为混合物D.1 mol甲烷与氯气反应生成CCl4,最多消耗2 mol氯气关键能力综合练进阶训练第二层一、选择题:每小题只有一个选项符合题意。
第1课时从天然气、石油和煤中获取燃料石油裂解与乙烯必备知识基础练进阶训练第一层知识点1从天燃气、石油和煤中获取燃料1.下列叙述正确的是( )A.煤中含有的苯和甲苯可通过煤的干馏来制得B.丁烷(C4H10)的一氯代物的同分异构体有4种C.煤的气化和液化均属于物理变化D.某有机化合物完全燃烧后,生成CO2和H2O,说明该有机化合物中一定含有C、H、O 三种元素2.下列有关说法正确的是( )①石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油②石油的分馏是化学变化③石油的分馏实验中,温度计水银球插入液面以下,因为它测的是混合液的温度④石油分馏得到的汽油仍是混合物A.①③ B.②④ C.①④ D.②③3.下列说法正确的是( )A.石油催化裂化是工业上获得乙烯的主要途径B.石油裂解得到的汽油是纯净物C.天然气是一种清洁的化石燃料D.水煤气是通过煤的液化得到的气体燃料4.如图是石油分馏塔的示意图。
下列关于a、b、c三种馏分的说法正确的是( )A.a的沸点最高B.b的沸点最低C.c的平均相对分子质量最大D.每一种馏分都是纯净物5.下列关于煤、石油、天然气的说法正确的是( )A.石油裂解得到的产物是纯净物B.石油分馏后的产物都可用于聚合反应C.天然气是一种清洁燃料D.可燃冰是甲烷6.标准状况下的11.2 L甲烷和22.4 L氧气混合后点燃,恢复到原状况时,气体的体积共( )A.11.2 L B.22.4 L C.33.6 L D.44.8 L7.甲烷是最简单的有机化合物。
(1)下列关于甲烷性质的叙述中,正确的是________(填字母)。
A.甲烷是一种无色无味的气体B.甲烷的密度比空气的密度小C.甲烷极难溶于水D.只有纯净的甲烷才能安静地燃烧(2)在标准状况下,32 g CH4的物质的量为________ mol,它的体积为________ L,它所含有氢原子的数目为________。
(3)为了除去混在甲烷中的二氧化碳和水蒸气,可将混合气体先通过盛有________________(填物质名称,下同)的洗气瓶除去________再通过盛有________的洗气瓶除去________。