复旦大学材料科学导论课后习题(搭配石德珂《材料科学基础》教材)
- 格式:doc
- 大小:904.50 KB
- 文档页数:10

第一部分名校考研真题导论1.试举例分析材料加工过程对材料使用性能的影响。
[中南大学2007研]答:材料加工过程对材料使用性能有重要而复杂的影响,材料也必须通过合理的工艺流程才能制备出具有实用价值的材料来。
通过合理和经济的合成和加工方法,可以不断创制出许多新材料或改变和精确控制许多传统材料的成分和结构,可以进一步发掘和提高材料的性能。
材料的制备/合成和加工不仅赋予材料一定的尺寸和形状,而且是控制材料成分和结构的必要手段。
如钢材可以通过退火、淬火、回火等热处理来改变它们内部的结构而达到预期的性能,冷轧硅钢片经过复杂的加工工序能使晶粒按一定取向排列而大大减少铁损。
2.任意选择一种材料,说明其可能的用途和加工过程。
[中南大学2007研]答:如Al-Mg合金。
作为一种可加工、不可热处理强化的结构材料,由于具有良好的焊接性能、优良的耐蚀性能和塑性,在飞机、轻质船用结构材料、运输工业的承力零件和化工用焊接容器等方面得到了广泛的应用。
根据材料使用目的,设计合金成分,考虑烧损等情况进行配料,如A15Mg合金板材,实验室条件下可在电阻坩埚炉中750℃左右进行合金熔炼,精炼除气、除渣后720℃金属型铸造,430~470℃均匀化退火10~20h后,在380~450℃热轧,再冷轧至要求厚度,在电阻炉中进行稳定化处理,剪切成需要的尺寸或机加工成标准试样,进行各种组织、性能测试。
3.说说你对材料的成分、组织、工艺与性能之间关系的理解。
[中南大学2007研]答:材料的成分、组织、工艺与性能之间的关系非常紧密,互相影响。
材料的性能与它们的化学成分和组织结构密切相关,材料的力学性能往往对结构十分敏感,结构的任何微小变化,都会使性能发生明显变化。
如钢中存在的碳原子对钢的性能起着关键作用,许多金属材料中一些极微量的合金元素也足以严重影响其性能。
然而由同一元素碳构成的不同材料如石墨和金刚石,也有着不同的性能,有些高分子的化学成分完全相同而性能却大不一样,其原因是它们有着不同的内部结构。



绪论1、仔细观察一下白炽灯泡,会发现有多少种不同的材料每种材料需要何种热学、电学性质2、为什么金属具有良好的导电性和导热性3、为什么陶瓷、聚合物通常是绝缘体4、铝原子的质量是多少若铝的密度为cm3,计算1mm3中有多少原子5、为了防止碰撞造成纽折,汽车的挡板可有装甲制造,但实际应用中为何不如此设计说出至少三种理由。
6、描述不同材料常用的加工方法。
7、叙述金属材料的类型及其分类依据。
8、试将下列材料按金属、陶瓷、聚合物或复合材料进行分类:黄铜钢筋混凝土橡胶氯化钠铅-锡焊料沥青环氧树脂镁合金碳化硅混凝土石墨玻璃钢9、 Al2O3陶瓷既牢固又坚硬且耐磨,为什么不用Al2O3制造铁锤晶体结构1、解释下列概念晶系、晶胞、晶胞参数、空间点阵、米勒指数(晶面指数)、离子晶体的晶格能、原子半径与离子半径、配位数、离子极化、同质多晶与类质同晶、正尖晶石与反正尖晶石、反萤石结构、铁电效应、压电效应.2、(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求出该晶面的米勒指数;(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的米勒指数。
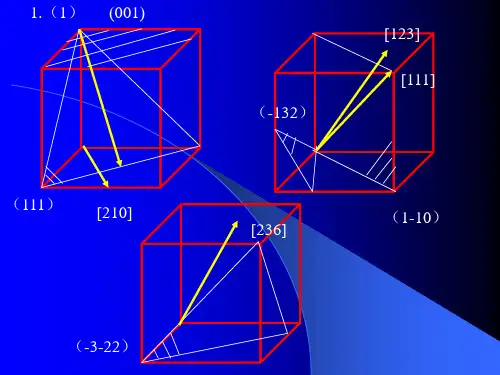
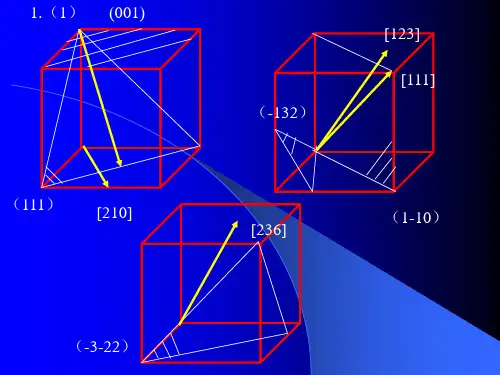
3、在立方晶系的晶胞中画出下列米勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与[111],(322)与[236],(257)与[111],(123)与[121],(102),(112),(213),[110],[111],[120],[321]4、写出面心立方格子的单位平行六面体上所有结点的坐标。
5、已知Mg2+半径为,O2-半径为,计算MgO晶体结构的堆积系数与密度。
6、计算体心立方、面心立方、密排六方晶胞中的原子数、配位数、堆积系数。
7、从理论计算公式计算NaC1与MgO的晶格能。
MgO的熔点为2800℃,NaC1为80l℃, 请说明这种差别的原因。
8、根据最密堆积原理,空间利用率越高,结构越稳定,金钢石结构的空间利用率很低(只有%),为什么它也很稳定9、证明等径圆球面心立方最密堆积的空隙率为25.9%;10、金属镁原子作六方密堆积,测得它的密度为克/厘米3,求它的晶胞体积。


《材料科学基础》选择题第一章 材料结构的基本知识1、原子结合健中 B 的键的本质是相同的A 、金属键与离子键B 、氢键与范德瓦尔斯键C 、离子键与共价键2、钨、钼熔点很高,其结合键是 A 的混合键A 、金属键和离子键B 、金属键和共价键C 、离子键和共价键3、MgO 、Al2O3等的结合键是 C 的混合键A 、金属键和离子键B 、金属键和共价键C 、离子键和共价键4、工程材料的强度与结合键有一定的联系,结合键能高的其强度也 A 些。
A 、高B 、低5、激活能反应材料结构转变 B 的大小;A 、动力B 、阻力6、材料处于能量最低状态称为 A ;A 、稳态结构B 、亚稳态结构7、一般而言,晶态结构的能量比非晶态要 B ;A 、高B 、低C 、相等第二章 材料的晶体结构1. 氯化铯(CsCl )为有序体心立方结构,它属于 CA 、体心立方B 、面心立方C 、简单立方点阵;2. 理想密排六方结构金属的c/a 为 BA 、B 、2(2/3)1/2; C 、2/33. 对面心立方晶体而言,表面能最低的晶面是 cA 、 (100);B 、(110),C 、(111);D 、(121)4. 下列四个六方晶系的晶面指数中,哪一个是错误的: CA 、(1322);B 、(0112);C 、(0312) ;D 、(3122)5. 面心立方结构的铝中,每个铝原子在本层(111)面上的原子配位数为 BA 、12;B 、6;C 、4;D 、36. 简单立方晶体的致密度为 CA 、100%B 、65%C 、52%D 、58%7. 立方晶体中(110)和(211)面同属 D 晶带A 、[110]B 、[100]C 、[211]D 、[111]8. 立方晶体中(111)和(101)面同属 D 晶带A 、[111]B 、[010]C 、[011]D 、]011[9.原子排列最密的一族晶面其面间距A、最小B、最大10.六方晶系中和(1121)晶面等同的晶面是 AA、(1211)面;B、(1112)面;C、(1211)面;D、(2111)面11.配位数是指晶体结构中: BA、每个原子周围的原子数;B、每个原子周围最邻近的原子数;C、每个原子周围的相同原子数;D、每个原子周围最邻近的和次近邻的原子数之和12.密排六方与面心立方均属密排结构,他们的不同点是: DA、晶胞选取方式不同;B、原子配位数不同;C、密排面上,原子排列方式不同;D、原子密排面的堆垛方式不同13.在立方晶系中,与(101)、(111)同属一晶带的晶面是: dA、(110); Bb、(011); C、(110); D、(010)14.TiC与NaCl具有相同的晶体结构,但它们不属于同一类中间相,这是因为: DA、TiC是陶瓷,NaCl是盐;B、NaCl符合正常化合价规律,TiC不符合正常化合价规律;C、TiC中电子浓度高,D、NaCl的致密度高15.立方晶体中(110)和(310)面同属 D 晶带A、[110]B、[100]C、[310]D、[001]16.14种布拉菲点阵: AA、按其对称性分类,可归结为七大晶系;B、按其点阵常数分类,可归结为七大晶系;C、按阵点所在位置分类,可归结为七大晶系D;、按其几何形状分类,可归结为七大晶系17.与(113)和(112)同属一晶带的有: CA、(112),B、(221)C、(110)D、(211)18.引入空间点阵概念是为了: CA、描述原子在晶胞中的位置,B、描述晶体的对称性,C、描述晶体结构周期性,D、同时描述晶体结构周期性和对称性19.有A、B两晶体,下面几种说法中正确的是 C ;A、所属空间点阵相同,则此两晶体的结构相同;B、晶体结构相同,它们所属空间点阵可能不同;C、晶体结构不同,它们所属空间点阵必然不同;D、所属空间点阵不同,晶体结构可能相同20.体心立方晶体中间隙半径比面心立方中的小,但BCC的致密度却比FCC低,这是因为: DA、BCC中原子半径小,B、BCC中的密排方向<111>上原子排列比FCC密排方向上的原子排列松散,C、BCC中的原子密排面{110}的数量太少,D、BCC中的原子配位数比FCC中原子配位数低21.组成固溶体的两组元完全互溶的必要条件是: BA、两组元的电子浓度相同,B、两组元的晶体结构相同,C、两组元的原子半径相同,D、两组元的电负性相同,22.晶体结构和空间点阵的相互关系 CA、空间点阵的每一阵点代表晶体中的一个原子;B、每一种空间点阵代表唯一的一种晶体结构;C、晶体结构一定,它所属的空间点阵也唯一地被确定;D、每一种晶体结构可以用不同的空间点阵表示23.晶体中配位数和致密度之间地关系是 AA、配位数越大,致密度越大;B、配位数越小,致密度越大;C、配位数越大,致密度越小,D、两者之间无直接联系24.离子晶体和纯金属晶体各有配位数的概念,两者的含义: CA、完全相同,B、不同,离子晶体的配位数是指最近邻的同号离子数,而纯金属晶体的配位数是指最近邻的原子数,C、不同,离子晶体的配位数是指最近邻的异号离子数,而纯金属晶体的配位数是指最近邻的原子数,D、不同,离子晶体的配位数是指最近邻的异号离子数,而纯金属晶体的配位数是指最近临和次近邻的原子数之和25.在离子晶体中 BA、阳离子半径大于阴离子半径;B、阴离子半径大于阳离子半径;C、阳离子半径与阴离子半径相等;D、阳离子半径可以大于阴离子半径;也可以小于阴离子半径;26.硅酸根四面体中的氧离子 CA、只属于一个硅酸根四面体;B、可以被多个硅酸根四面体共用;C、只能被两个硅酸根四面体共用;D、可以被四个硅酸根四面体共用第三章高分子材料的结构1.已知聚氯乙烯的平均相对分子质量是27500,则其平均聚合度是(A )。


第9章固体材料的电子结构与物理性能一、简答题1.简明解释为什么晶格中两个电子可以由吸引作用而形成库柏对。
答:电子间通过交换格波声子而产生间接的相互作用,例如波矢为的电子发射一个波矢为的声子被散射到波矢为的状态,第二个电子本来的波矢为,吸收了第一个电子发射的声子进入波矢为的状态。
另一过程是第一个电子吸收一个由第二个电子发射的波矢为的声子而由k1散射到第二个电子则从散射到,按照量子理论,如果能量差是声子角频率),则相互作用能为负,即电子间具有净的吸引作用而形成库柏对。
显然,只有在费密面附近的是德拜角频率)范围内的电子才能满足上述条件。
2.(1)写出固体热导率的定义和公式。
(2)指出传导热流的元激发。
(3)指出在低温和高温下热导率对温度的依赖关系,并描述在这两个区间内的主要物理过程。
答:(1)固体热导率的定义为:单位温度梯度所引起的热量流密度,即式中的系数k,在非金属固体热导率的表示式为式中,c为固体热容;为声子的平均速度;l为声子的平均自由程。
(2)传导热流的元激发为声子。
(3)对于金属,其热导率通常由晶格热导率k a(由声子贡献)及电子热导率k e(由自由电子贡献)两部分所组成,即式中,以典型值代入后得因此,典型金属的热导率主要由自由电子贡献,即式中,le为电子平均自由程,依赖于电子-声子散射过程。
所以式中,为温度为T时的平均声子数。
在高温区:,则,所以,,与温度无关。
在低温区:,则,所以,在极低温区:声子数很少,主要是杂质散射,是杂质密度)与t无关,所以3.示意画出n型半导体电导率随温度的变化曲线,并用能带理论定性解释上述曲线。
答:(1)如图9-1所示。
图9-1(2)n型半导体中的载流子包括掺杂的施主电子及本征半导体固有的电子和空穴,但施主电子跃迁所需克服的能垒E d小于本征电子和空穴跃迁所需克服的能垒E g/2。
①温度较低时,本征电子和空穴的热激活跃迁几率很小,而施主电子跃迁几率较大且随温度升高而呈指数增大,此时电导率主要由掺杂的施主电子提供。

材料科学导论课后习题答案第一章材料科学概论1.氧化铝既牢固又坚硬且耐磨,但为什么不能用来制造榔头?答:氧化铝脆性较高,且抗震性不佳。
2.将下列材料按金属、陶瓷、聚合物和复合材料进行分类:黄铜、环氧树脂、混泥土、镁合金、玻璃钢、沥青、碳化硅、铅锡焊料、橡胶、纸杯答:金属:黄铜、镁合金、铅锡焊料;陶瓷:碳化硅;聚合物:环氧树脂、沥青、橡胶、纸杯;复合材料:混泥土、玻璃钢3.下列用品选材时,哪些性能特别重要?答:汽车曲柄:强度,耐冲击韧度,耐磨性,抗疲劳强度;电灯泡灯丝:熔点高,耐高温,电阻大;剪刀:硬度和高耐磨性,足够的强度和冲击韧性;汽车挡风玻璃:透光性,硬度;电视机荧光屏:光学特性,足够的发光亮度。
第二章材料结构的基础知识1.下列电子排列方式中,哪一个是惰性元素、卤族元素、碱族、碱土族元素及过渡金属?(1) 1s2 2s2 2p6 3s2 3p6 3d7 4s2(2) 1s2 2s2 2p6 3s2 3p6(3) 1s2 2s2 2p5(4) 1s2 2s2 2p6 3s2(5) 1s2 2s2 2p6 3s2 3p6 3d2 4s2(6) 1s2 2s2 2p6 3s2 3p6 4s1答:惰性元素:(2);卤族元素:(3);碱族:(6);碱土族:(4);过渡金属:(1),(5)2.稀土族元素电子排列的特点是什么?为什么它们处于周期表的同一空格内?答:稀土族元素的电子在填满6s态后,先依次填入远离外壳层的4f、5d层,在此过程中,由于电子层最外层和次外层的电子分布没有变化,这些元素具有几乎相同的化学性质,故处于周期表的同一空格内。
3.描述氢键的本质,什么情况下容易形成氢键?答:氢键本质上与范德华键一样,是靠分子间的偶极吸引力结合在一起。
它是氢原子同时与两个电负性很强、原子半径较小的原子(或原子团)之间的结合所形成的物理键。
当氢原子与一个电负性很强的原子(或原子团)X结合成分子时,氢原子的一个电子转移至该原子壳层上;分子的氢变成一个裸露的质子,对另外一个电负性较大的原子Y表现出较强的吸引力,与Y之间形成氢键。
《材料科学导论》“Introduction to Materials Science”小时))课程类型:专业平台课(54(54小时主讲人:杨振国室407室办公室:先进材料楼407电话:65642523话: zgyang@ 电子信箱:电子信箱电子信箱::本课程主要教学参考书课教参考1. W. F. Smith & J. Hasgemi, Foundations of Materials Science and Engineering (4ed)McGraw Hill and Engineering (4th ed) , McGraw Hill , ed) , McGraw Hill , 20062006 2. 石德珂主编,材料科学基础材料科学基础,机械工业出版社,,机械工业出版社,2003 3. R.W. Cahn, The Coming of Materials Science, Elsevier, 2001化学工业出版社2001注:(中译本)《走进材料科学走进材料科学》》,化学工业出版社, 2001 4. 冯端、师昌绪、刘治国,材料科学导论,化学工业出版社, 20025潘金生仝建民田民波材料科学基础5. 潘金生、仝建民、田民波,材料科学基础,清华大学出版社,2000.46. 胡赓祥、蔡珣主编,材料科学基础,上海交通大学出版社,2000.11课教参考本课程主要教学参考书7. 顾家琳编著,材料科学与工程概论,清华大学出版社,20058. J. P. Schaffer,The Science and Design of EngineeringMcGraw--Hill Companies Inc., 1999Materials,McGraw注:《工程材料科学与设计工程材料科学与设计》》(中译本) ,机械工业出版社,20039. D. R. AskelandAskeland,The Science and Engineering of Materials’9. D. R.9D R The Science and Engineering of Materials’(5th), Nelson , Division of Thomson Limited, 200610. W. D. CallisterCallister,Materials Science and Engineering: an 10. W. D.Introduction, John Wiley & Songs Inc.,200711. Y.W. Chuang,Introduction to Materials Science andEngineering, Taylor & Francis Group, 2007本课程网址:http://10.108.0.74/s/255/t/550/main.jspy第一章材料科学概论材料与物质1.1 材料与物质材料的分类1.2 材料的分类会1.3 材料与社会发展1.4 材料科学与工程1.5 材料科学在工程中的作用1.6 材料科学技术的发展重点1.1 材料与物质●材料是人类赖以生存和发展的物质基础, 也是一切科学技术的基础。
第1章材料结构的基础知识一、简答题1.在元素周期表中,同一周期或同一主族元素原子结构有什么共同特点?从左到右或从上到下元素结构有什么区别?它的性质如何递变?答:同一周期元素具有相同原子核外电子层数,但从左→右,核电荷依次增多,原子半径逐渐减小,电离能增加,失电子能力降低,得电子能力增加,金属性减弱,非金属性增强;同一主族元素最外层电子数相同,但从上→下,电子层数增多,原子半径增大,电离能降低,失电子能力增加,得电子能力降低,金属性增加,非金属性降低。
2.试写出原子序数为11的钠与原子序数为20的钙原子的电子排列方式。
解:钠原子的原子序数为11,有11个电子。
电子首先进入能量最低的第一壳层,它只有s态一个亚壳层,可容纳2个电子,电子状态计作1s2。
然后逐渐填入能量较高的2s、2p,分别容纳2个和6个电子,电子状态计作2s2和2p6。
第11个电子进入第三壳层的s 态。
所以,钠原子的电子排列为:钙原子有20个电子,填入第一壳层和第一壳层电子的状态与钠原子相似。
当电子填入第三壳层s态和p态后仍有2个剩余电子。
因为4s态能量低于3d态,所以这两个剩余电子不是填入3d态,而是进入新的外壳层上的4s态。
所以,钙原子的电子排列为:。
答:原子的结合键有: (1)离子键。
其特点是:正负离子相互吸引;键合很强,无饱和性,无方向性;熔点、硬度高,固态不导电,导热性差。
(2)共价键。
其特点是:相邻原子通过共用电子对结合;键合强,有饱和性,有方向性;熔点、硬度高,不导电,导热性有好有差。
(3)金属键。
其特点是:金属正离子与自由电子相互吸引;键合较强,无饱和性,无方向性;熔点、硬度有高有低,导热导电性好。
(4)分子键。
其特点是:分子或分子团显弱电性,相互吸引;键合很弱,无方向性;熔点、硬度低,不导电,导热性差。
(5)氢键。
其特点是:类似分子键,但氢原子起关键作用;键合弱,有方向性;熔点、硬度低,不导电,导热性好。
二、计算题有铀和硼两种材料,若已知铀的密度为19.05g/cm 3,原子量为235.03,硼的密度为2.3g/cm 3,原子量为10.81,阿伏伽德罗常数为236.0210⨯,试分别计算这两种材料单位体积内的原子数。
材料科学导论课后习题答案第一章材料科学概论1.氧化铝既牢固又坚硬且耐磨,但为什么不能用来制造榔头?答:氧化铝脆性较高,且抗震性不佳。
2.将下列材料按金属、陶瓷、聚合物和复合材料进行分类:黄铜、环氧树脂、混泥土、镁合金、玻璃钢、沥青、碳化硅、铅锡焊料、橡胶、纸杯答:金属:黄铜、镁合金、铅锡焊料;陶瓷:碳化硅;聚合物:环氧树脂、沥青、橡胶、纸杯;复合材料:混泥土、玻璃钢3.下列用品选材时,哪些性能特别重要?答:汽车曲柄:强度,耐冲击韧度,耐磨性,抗疲劳强度;电灯泡灯丝:熔点高,耐高温,电阻大;剪刀:硬度和高耐磨性,足够的强度和冲击韧性;汽车挡风玻璃:透光性,硬度;电视机荧光屏:光学特性,足够的发光亮度。
第二章材料结构的基础知识1.下列电子排列方式中,哪一个是惰性元素、卤族元素、碱族、碱土族元素及过渡金属?(1) 1s2 2s2 2p6 3s2 3p6 3d7 4s2(2) 1s2 2s2 2p6 3s2 3p6(3) 1s2 2s2 2p5(4) 1s2 2s2 2p6 3s2(5) 1s2 2s2 2p6 3s2 3p6 3d2 4s2(6) 1s2 2s2 2p6 3s2 3p6 4s1答:惰性元素:(2);卤族元素:(3);碱族:(6);碱土族:(4);过渡金属:(1),(5)2.稀土族元素电子排列的特点是什么?为什么它们处于周期表的同一空格内?答:稀土族元素的电子在填满6s态后,先依次填入远离外壳层的4f、5d层,在此过程中,由于电子层最外层和次外层的电子分布没有变化,这些元素具有几乎相同的化学性质,故处于周期表的同一空格内。
3.描述氢键的本质,什么情况下容易形成氢键?答:氢键本质上与范德华键一样,是靠分子间的偶极吸引力结合在一起。
它是氢原子同时与两个电负性很强、原子半径较小的原子(或原子团)之间的结合所形成的物理键。
当氢原子与一个电负性很强的原子(或原子团)X结合成分子时,氢原子的一个电子转移至该原子壳层上;分子的氢变成一个裸露的质子,对另外一个电负性较大的原子Y表现出较强的吸引力,与Y之间形成氢键。
4.为什么金属键结合的固体材料的密度比离子键或共价键固体高?答:一是金属原子质量大;二是金属键的结合方式没有方向性,原子趋于紧密排列,得到简单的原子排列形态。
离子键和共价键结合的原子,相邻原子的个数受到共价键数目的限制,离子键结合还要满足正、负离子间电荷的平衡,原子不可能紧密堆积,而且存在孔洞缺陷,故金属键结合的固体材料的密度比离子键或共价键固体高。
5.应用公式计算Mg2+O2-离子对的结合键能,以及每摩尔MgO晶体的结合键能。
假设离子半径为r Mg2+=0.065nm;r O2-=0.140nm;n=7。
答:在平衡时,F吸引=F排斥故,解得晶体的结合键能:转换为每摩尔MgO晶体的结合键能:6.原子序数为12的Mg有三种同位素:78.70%的Mg原子由12个中子,10.13%的Mg原子由13个中子,11.17%的Mg原子由14个中子,试计算Mg的原子量。
答:7.试计算原子N壳层内的最大电子数。
若K,L,M和N壳层中所有能级都被填满,试确定该原子的原子数。
答:N壳层内最大电子数:1s22s22p63s23p63d104s24p64d104f145s25p66s2该原子的原子数是708.试写出Al原子13个电子的每个电子的全部量子数。
答:n l m m s1 0 02 0 02 1 02 1 12 1 -13 0 03 1 09.材料的三级和四级结构可以通过加工工艺来改变,那么材料的二级结构可以改变吗?为什么?答:原子的结合键是材料的二级结构。
对于单一的材料来说,其价键结构是不可以通过加工工艺来改变的。
但是实际工程应用中,通过一定的加工工艺来改变材料的二级结构,比如金刚石具有共价键,石墨具有共价键和物理键,而石墨等碳质原料和某些金属在高温高压下可以反应生成金刚石,即一定程度上改变了材料的二级结构。
第三章固体材料的晶体学基础1.回答下列问题:(1)在立方晶系的晶胞内画出具有下列密勒指数的晶面和晶向:(001)与[210],(111)与,与[111],与[123],与[236]。
(2)在立方晶系的一个晶胞中画出(111)和(112)晶面,并写出两晶面交线的晶向指数。
(3)在立方晶系的一个晶胞中画出同时位于(101),(011),(112)晶面上的晶向。
答:作图略。
(2)两晶面交线的晶向指数为。
2.有一正交点阵的a=b,c=a/2。
某晶面在三个晶轴上的截距分别为6个,2个,4个原子间距,求该晶面的密勒指数。
答:(263)3.写出六方晶系的晶面族中所有晶面的密勒指数,在六方晶胞中画出、晶向和晶面,并确定晶面与六方晶胞交线的晶向指数。
答:晶面族中所有晶面的密勒指数为:作图略,()晶面与六方晶胞交线的晶向指数为:4.根据刚性球模型回答下列问题:(1)以点阵常数为单位,计算体心立方、面心立方和密排六方晶体中的原子半径及四面体和八面体的间隙半径。
(2)计算体心立方、面心立方和密排六方晶胞中的原子数、致密度和配位数。
体心立方面心立方密排六方原子半径 a a a四面体间隙 a a a八面体间隙 a a a原子数 2 4 6致密度0.68 0.74 0.74配位数8 12 125.用密勒指数表示出体心立方、面心立方和密排六方结构中的原子密排面和原子密排方向,并分别计算这些晶面和晶向上的原子密度。
答:体心立方面心立方密排六方原子密排面{110} {111} {0001} 晶面的原子密度原子密排方向<111> <110> <>晶向的原子密度6.求下列晶面的晶面间距,并指出晶面间距最大的晶面。
(1)已知室温下α-Fe的点阵常数为0.286nm,分别求出(100)、(110)、(123)的晶面间距。
(2)已知916℃时γ-Fe的点阵常数为0.365nm,分别求出(100)、(111)、(112)的晶面间距。
(3)已知室温下Mg的点阵常数为a=0.321nm,c=0.521nm,分别求出的晶面间距。
答:(1)其中,晶面间距最大的晶面为(100)(2)其中,晶面间距最大的晶面为(110)(3)其中,晶面间距最大的晶面为7.已知Na+和Cl-的半径分别为0.097nm和0.181nm,请计算NaCl中钠离子中心到:(1)最近邻离子中心间的距离;(2)最近邻正离子中心间的距离;(3)第二个最近的氯离子中心间的距离;(4)第三个最近的氯离子中心间的距离;(5)它最近的等同位置间的距离。
答:(1) r=r++r-=0.278nm (2) r=(3) r=(4) r=(5) r=8.根据NaCl的晶体结构及Na+和Cl-的原子量,计算氯化钠的密度。
答:9.示意画出金刚石型结构的晶胞,说明其中包含有几个原子,并写出各个原子的坐标。
答:作图略,其中包含原子数:顶点坐标:(000),(100),(010),(001),(110),(101),(011),(111)(选填一个即可)面心坐标:(选填三个即可)晶胞内坐标:(),(),(),()10.何谓单体、聚合物和链节?它们相互之间有什么关系?请写出以下高分子链节的结构式:聚乙烯;聚氯乙烯;聚丙烯;聚苯乙烯;聚四氟乙烯。
答:单体是合成聚合物的起始原料,是化合物独立存在的基本单元,是单个分子存在的稳定状态。
聚合物是由一种或多种简单低分子化合物聚合而成的相对分子质量很大的化合物。
链节是组成大分子链的特定结构单元。
聚乙烯:[-CH2-CH2-]n; 聚氯乙烯:[-CHCl-CH2-]n; 聚丙烯:[-CHCH3-CH2-]n;聚苯乙烯:[-CHAr-CH2-]n; 聚四氟乙烯:[-CF2-CF2-]n第四章固体材料的晶体缺陷1.纯Cu的空位形成能为1.5aJ/atom,(1aJ=10-18J),将纯Cu加热至850℃后激冷至室温(20℃),若高温下的空位全部保留,试求过饱和空位浓度与室温平衡空位浓度的比值。
答:2.空位对材料行为的主要影响是什么?答:首先,材料中原子(或分子)的扩散机制与空位的运动有关。
其次,空位可以造成材料物理性能与力学性能的改变,如密度降低,体积膨胀,电阻增加,强度提高,脆性也更明显,晶体高温下发生蠕变等。
3.某晶体中有一条柏氏矢量为a[001]的位错线,位错线的一端露头于晶体表面,另一端与两条位错线相连接,其中一条柏氏矢量为,求另一条位错线的柏氏矢量。
答:a[001]=4.如附图a所示,试求某一晶格参数为2.5A0的立方金属刃型位错的burgers矢量的Miller指数及其长度。
答:柏氏矢量垂直于(220),故其Miller指数为[110]5.如附图b所示,写出在FCC金属的滑移方向的晶向指数。
答:第五章固体材料的凝固与结晶1.液体金属在凝固时必须过冷,而加热使其融化却毋需过热,即一旦加热到熔点就立即熔化,为什么?答:液体金属在凝固时必须克服表面能,形核时自由能变化大于零,故需要过冷。
固态金属在熔化时,液相与气相接触,当有少量液体金属在固相表面形成时,就会很快覆盖在整个表面(因为液体金属总是润湿同一种固体金属)。
表面能变化决定过程能否自发进行。
根据实验数据,在熔化过程中,表面自由能的变化小于零,即不存在表面能障碍,也就不必过热。
2.金属凝固时的形核率常桉下式做简化计算,即试计算液体Cu在过冷度为180K、200K和220K时的均匀形核率。
并将计算结果与书图6-4b 比较。
(已知)答:代入数据得,180K时N均=7.50;200K时N均=7.89;220K时N均=13.36与图6-4b相比,结果吻合,表明只有过冷度达到一定程度,使凝固温度接近有效成核温度时,形核率才会急剧增加。
3.试解释凝固与结晶、晶胚与形核的相互关系。
答:凝固是指物质从液态冷却成固态的一种转变过程,可以形成晶态或非晶态。
若冷却后成为晶体,这种凝固成为结晶。
根据热力学判断,在过冷液态金属中,短程规则排列的结构尺寸越大,就越稳定,只有尺寸较大的短程规则排列的结构,才能成为晶核。
晶胚即是过冷液态金属中短程规则排列尺寸较大的原子有序排列部分。
一定温度下,最大晶胚有一个极限值r max;而液态金属的过冷度越大,实际可能出现的最大晶胚尺寸也越大。
当液态金属中形成的晶胚尺寸大于或等于一定临界尺寸时,成为晶核,其有两种形成方式:均匀成核(依靠液态金属本身能量的变化获得驱动力并由晶胚直接成核的过程)和非均匀成核(晶胚是依附在其他物质表面上形核的过程)。
4.金属结晶的热力学条件和结构条件是什么?答:过冷度是金属结晶的热力学条件;结构起伏和能量起伏是结构条件。
5.哪些因素会影响金属结晶时的非均匀形核率?答:过冷度,固体杂质及其表面形貌,物理性能如液相宏观流动,外加电磁场,受机械作用等。