初三必记物质化学式
- 格式:doc
- 大小:28.00 KB
- 文档页数:2

初三化学常见物质的化学式固态:干冰Hg汞Fe铁Cu铜P氮气C碳磷S硫1、单质:H氢气O氧气N222苛性钠、火石灰石、大碳酸钙Ca CONaOH氢氧化钠2、化合物3理石碱、烧碱(1)氧化物:HO水CO二氧化碳CO一氧化碳SO三氧化硫二氧化硫SO3222NaCO碳酸钠纯碱、苏打CuSO·5HO硫酸铜晶体胆矾、蓝矾2324PO五氧化二磷FeO 氧化铁Fe氧化镁CaO氧化钙MgOO四氧化三铁423235碳酸氢钠、小苏打NaCl 氯化钠NaHCO食盐钠NaO氧化锰亚CuO氧化铜FeO氧化铁MnO二氧化322酸式碳酸钠KOH氢氧化钠CO(2)酸:HCl盐酸HSO硫酸HNO硝酸H碳酸(3)碱:NaOH醋酸32324乙酸 CHCOOH CHOH 乙醇酒精352氯氯化钙NaCl氢氧化钾Ca(OH)氢氧化钙(4)盐:氯化钠NaCO碳酸钠CaCl KCl2322HCl氢氯酸盐酸 HO 过氧化氢双氧水22化钾铜绿、孔雀(OH)CO 碱式碳酸铜 HO 氧化氢Cu 水FeSO硫酸亚铁氯化亚铁FeCl硫酸铜CuSO AgCl氯化银氯化铁FeCl22234342石高KClO 硫酸锌CaCO碳酸钙BaSO硫酸钡氯酸钾KMnO硫酸铁(SO Fe)ZnSO44433342CH 甲烷沼气、坑气 FeO 氧化铁铁红324锰酸钾锰酸钾KMnO42硫酸铝钾晶.)12HO明矾KAl(SOCO一氧化碳煤气葡萄糖:乙酸(醋酸)COCOOHOH C)有机物:(5CH甲烷H 乙醇(酒精)CH2243452体COH6126三、物质的溶解性:一、常见物质的颜色的状态1、气体:溶的:CO、HCl、SO、NH等。
322;铁、镁、无水CO、Ca(OH)NaOHCaOO、白色固体:1P、、、、KClONa、NaClCuSO4325232不溶(或不易溶):O、H、CH为银白色(汞为银白色液态)、CO、N等。
2422 OMnOCuO:石墨、炭粉、铁粉、、、Fe 为紫黑色KMnO▲黑色固体2、2、金属氧化物:除CaO、NaO、KO、BaO溶外,大多数不溶443222、:3、红色固体Cu FeO CuCO(OH)为绿色、红磷▲硫:淡黄色▲、HgO323223、酸:大多数溶2+溶:凡含、4溶液的颜色Cu的溶液呈CuClCu(NO溶液、)溶液、CuSO蓝色(如:22342+溶液);凡)溶液、FeCl溶液、(如:Fe液);凡含的溶液呈浅绿色FeSOFe (NO4、碱:除氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水溶外,其他碱不溶于水22343+溶液),其余溶溶液、)(Fe黄色含Fe的溶液呈棕(如:SO溶液、Fe (NOFeCl)-的盐只有AgCl含有钾、钠、硝酸根、铵根的盐都溶于水,含Cl不溶于水,5、盐:33433222液一般为无色。

化学式大全初三化学化学式大全化学式是描述化合物化学组成的一种化学标记方法,是化学反应和计算化学物质的重要工具。
初三化学学习中,我们常常需要掌握常见化合物的化学式,下面介绍一些基础的化学式大全。
一、单质的化学式单质是只含有一种原子的物质,常见的单质有氧气(O2)、氮气(N2)、碳(C)、氢气(H2)、氦气(He)等。
二、水的化学式水是最常见最重要的化合物之一,其化学式为H2O,其中“H”表示氢原子,“O”表示氧原子。
水是由两个氢原子和一个氧原子通过共价键相连而形成的。
三、酸的化学式酸是指在水溶液中能放出氢离子(H+)的化合物,常见的酸有硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、亚硝酸(HNO2)等。
其中,硫酸化学式为H2SO4,盐酸化学式为HCl,硝酸化学式为HNO3,亚硝酸化学式为HNO2。
四、碱的化学式碱是指在水溶液中能放出羟根离子(OH-)的化合物,常见的碱有氢氧化钠(NaOH)、氢氧化钾(KOH)、氨(NH3)等。
其中,氢氧化钠化学式为NaOH,氢氧化钾化学式为KOH,氨化学式为NH3。
五、盐的化学式盐是指由阳离子和阴离子通过离子键相连合而成的化合物,常见的盐有氯化钠(NaCl)、硫酸铜(CuSO4)、碘化铅(PbI2)、碳酸钙(CaCO3)等。
其中,氯化钠化学式为NaCl,硫酸铜化学式为CuSO4,碘化铅化学式为PbI2,碳酸钙化学式为CaCO3。
六、二元化合物的化学式在化学式中只包含两种元素的化合物称为二元化合物。
常见的二元化合物有硫化氢(H2S)、氯化氢(HCl)、氧化亚氮(NO)、氧化氮(N2O)等。
其中,硫化氢化学式为H2S,氯化氢化学式为HCl,氧化亚氮化学式为NO,氧化氮化学式为N2O。
七、水合物的化学式水合物是指在化合物分子中含有一定数量的结晶水的化合物。
常见的水合物有硫酸铜(II)五水合物(CuSO4·5H2O)、硫酸铜(II)七水合物(CuSO4·7H2O)、氯化铜二水合物(CuCl2·2H2O)等。

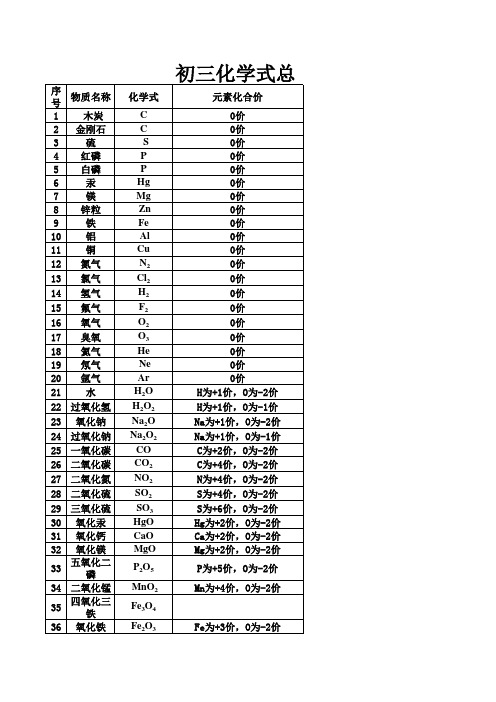
初三化学常有物质的化学式1、单质: H2氢气 O2氧气 N2氮气 C 碳 P 磷 S 硫 Fe 铁 Cu 铜 Hg 汞2、化合物( 1)氧化物: H2O 水 CO2二氧化碳CO 一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷Fe2O3氧化铁 Fe3O4四氧化三铁CaO 氧化钙 MgO 氧化镁CuO 氧化铜FeO 氧化亚铁MnO 2二氧化锰Na2O 氧化钠(2)酸: HCl 盐酸 H2SO4硫酸 HNO3硝酸 H2 CO3碳酸(3)碱: NaOH 氢氧化钠 KOH 氢氧化钾 Ca(OH)2氢氧化钙(4)盐: NaCl 氯化钠 Na2CO3碳酸钠 CaCl2氯化钙 KCl 氯化钾CuSO 硫酸铜 AgCl 氯化银 FeCl 氯化铁 FeCl 氯化亚铁 FeSO 硫酸亚铁4 3 2 4Fe (SO ) 硫酸铁 ZnSO 硫酸锌 CaCO 碳酸钙 BaSO 硫酸钡 KClO 氯酸钾 KMnO2 434 3 4 3 4高锰酸钾 K2 MnO 4锰酸钾( 5)有机物: CH4甲烷 2 5乙醇(酒精) 3COOH 乙酸(醋酸)CO 葡萄糖:CHOH CHC6H12O6一、常有物质的颜色的状态1、白色固体: P2O5、CaO、 NaOH、Ca(OH)2、 KClO3、Na2CO3、NaCl、无水 CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、 CuO、MnO、Fe O▲ KMnO为紫黑色2 3 4 43、红色固体:Cu、Fe2 O3 、HgO、红磷▲硫:淡黄色▲Cu2 (OH)2CO3为绿色4、溶液的颜色:凡含 Cu2+的溶液呈蓝色(如: CuSO4溶液、 CuCl2溶液、 Cu(NO3) 2溶液);2+ 溶液、 Fe (NO) 3+凡含 Fe 的溶液呈浅绿色(如: FeSO溶液、 FeCl 溶液);凡含 Fe 的溶4 2 3 2液呈棕黄色(如: Fe2( SO4)3溶液、 FeCl3溶液、 Fe (NO3) 3溶液),其余溶液一般为无色。

初三60个必背化学式化学是一门研究物质性质、组成以及变化的科学,它在现代社会中扮演着重要的角色。
为了更好地理解化学原理和应用,初三的学生应该掌握一些基本的化学式。
下面是60个初三必背的化学式,分为无机化学和有机化学两个部分。
一、无机化学1.水(H2O)2.氧气(O2)3.二氧化碳(CO2)4.氯化钠(NaCl)5.硫酸(H2SO4)6.硝酸(HNO3)7.苯酚(C6H5OH)8.硝化甘油(C3H5(NO3)3)10.氨(NH3)11.碳酸氢钠(NaHCO3)12.硝酸钾(KNO3)13.硫酸铜(CuSO4)14.亚硝酸钠(NaNO2)15.硫酸铁(Fe2(SO4)3)16.亚硫酸钠(Na2SO3)17.硝酸钠(NaNO3)18.氯化钾(KCl)19.碘化钾(KI)20.硫酸钠(Na2SO4)21.重铬酸钾(K2Cr2O7)22.氢氧化钠(NaOH)24.一氧化二氮(N2O)25.氟化钙(CaF2)26.氧化钙(CaO)27.氧化铜(CuO)28.五氧化二磷(P2O5)29.硝酸银(AgNO3)30.氮气(N2)31.二氧化硫(SO2)32.二氯甲烷(CH2Cl2)33.氯气(Cl2)34.氮氧化物(NOx)35.硝酸盐(NO3-)36.硫化氢(H2S)38.三氯甲烷(CHCl3)39.碳酸钙(CaCO3)40.二氯乙烯(C2H2Cl2)41.二硫化碳(CS2)42.碳酸亚铁(FeCO3)43.高锰酸钾(KMnO4)44.磷酸二氢钠(NaH2PO4)45.醋酸(CH3COOH)二、有机化学46.乙烯(C2H4)47.丙烷(C3H8)48.乙醇(C2H5OH)49.乙酸(CH3COOH)50.乙酸乙酯(C4H8O2)51.甲醇(CH3OH)52.甲酸(HCOOH)53.甲酸甲酯(HCOOCH3)54.甲酸乙酯(HCOOC2H5)55.乙酸丙酯(C5H10O2)56.丙酮(C3H6O)57.氯仿(CHCl3)58.苯(C6H6)59.甲苯(C7H8)60.醋酐(C4H6O3)这些化学式涵盖了初三学生需要了解的基本无机和有机化学化合物。

初三化学的所有必背化学式一、输记下列元素名称、符号:1、O氧H氢N氮Cl氯C碳P磷S硫2、K钾Ca钙Na钠Mg镁Al铝Zn锌Fe铁Cu铜Hg汞Ag银Mn锰Ba 钡二、熟记下列物质的化学式:1、单质:H2氢气O2氧气N2氮气C碳P磷S硫Fe铁Cu铜Hg汞2、化合物(1)氧化物:H2O水CO2二氧化碳CO一氧化碳SO2二氧化硫SO3三氧化硫P2O5五氧化二磷Fe2O3氧化铁Fe3O4四氧化三铁CaO氧化钙MgO氧化镁CuO氧化铜ZnO氧化锌FeO氧化亚铁MnO2二氧化锰(2)酸:HCl盐酸H2SO4硫酸HNO3硝酸H3PO4磷酸H2CO3碳酸H2SO3亚硫酸(3)碱:NaOH氢氧化钠KOH氢氧化钾Ca(OH)2氢氧化钙Ba(OH)2氢氧化钡Cu(OH)2氢氧化铜Fe(OH)3氢氧化铁Fe(OH)2氢氧化亚铁Al(OH)3氢氧化铝Mg(OH)2氢氧化镁(4)盐:NaCl氯化钠Na2CO3碳酸钠ZnCl2氯化锌CaCl2氯化钙KCl氯化钾Na2SO4硫酸钠CuSO4硫酸铜AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝FeSO4硫酸亚铁Fe2(SO4)3硫酸铁ZnSO4硫酸锌CaCO3碳酸钙BaCl2氯化钡BaSO4硫酸钡KClO3氯酸钾KMnO4高锰酸钾K2MnO4锰酸钾KNO3硝酸钾Cu(NO3)2硝酸铜Hg(NO3)2硝酸汞NH4Cl氯化铵NH4NO3硝酸铵(NH4)2SO4硫酸铵NH4HCO3碳酸氢铵NaHCO3碳酸氢钠(5)有机物:CH4甲烷C2H5OH乙醇(酒精)CH3OH甲醇CH3COOH乙酸(醋酸)CO(NH2)2尿素三、熟记下列元素在化合物中的化合价:(1)一价钾钠氯氢银二价钙镁钡锌+1 +1 +1 +1 +2 +2 +2 +2 +3H K Na Ag Ca Mg Zn Ba Al(2)-2 -1O Cl四、熟记下列化学方程式:(一)化合反应1、木炭在氧气中燃烧:C+O2 点燃CO22、硫在氧气中燃烧:S+O2点燃SO23、镁在空气中燃烧:2Mg+O2点燃2MgO4、铁在氧气中燃烧:3Fe+2O2点燃Fe3O45、磷在氧气中燃烧:4P+5O2点燃2P2O56、铜在空气中加热:2Cu+O2△2CuO7、氢气在氧气中燃烧:2H2+O2点燃2H2O8、一氧化碳在空气中燃烧:2CO+O2点燃2CO29、碳不充分燃烧:2C+O2(不充分)点燃2CO10、二氧化碳通过灼热的碳层:CO2+C高温2CO11、二氧化碳与水反应:CO2+H2O=H2CO311''、生石灰和水化合:CaO+H2O=Ca(OH)211'''、三氧化硫溶于水:SO3+H2O=H2SO4(二)分解反应:12、氯酸钾与二氧化锰共热(实验室制O2):2KClO3=(MnO2=△=2KCl+3O2↑13、加热高锰酸钾:2KMnO4=△=K2MnO4+MnO2+O2↑ 14、加热碱式碳酸铜:Cu2(OH)2CO3=△=2CuO+H2O+CO2↑15、电解水:2H2O通电2H2↑+O2↑16、碳酸不稳定分解:H2CO3=H2O+CO2↑17、高温煅烧石灰石:CaCO3高温CaO+CO2↑(三)置换反应19、锌和稀硫酸反应(实验室制H2):Zn+H2SO4=ZnSO4+H2↑20、锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑21、铁和盐酸:Fe+2HCl=FeCl2+H2↑22、铁和稀硫酸:Fe+H2SO4=FeSO4+H2↑23、氢气还原氧化铜:H2+CuO△Cu+H2O24、木炭还原氧化铜:C+2CuO高温2Cu+CO2↑25、碳还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑26、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO428、氢气还原氧化铁:3H2+Fe2O3△2Fe+2H2O29、铝和稀硫酸:2Al+3H2SO4=Al2(SO4)3+3H2↑(四)复分解反应31、大理石和稀盐酸(实验室制CO2):CaCO3+2HCl=CaCl2+H2O+CO2↑32、氢氧化钠和硫酸铜:2NaOH+CuSO4=Cu(OH)2↓+Na2SO433、碳酸钠和盐酸(灭火器原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑34、盐酸和氢氧化钠(中和反应):HCl+NaOH=NaCl+H2O35、硫酸和氢氧化钠溶液:H2SO4+2NaOH=Na2SO4+2H2O37、硫酸与氯化钡溶液:H2SO4+BaCl2=BaSO4↓+2HCl38、盐酸与硝酸银溶液:HCl+AgNO3=AgCl↓(白)+HNO339、氢氧化钠和氯化铁溶液:3NaOH+FeCl3=Fe(OH)3↓(红褐色)+3NaCl40、硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2NaCl41、氯化钠和硝酸银:NaCl+AgNO3=AgCl↓+NaNO342、碳酸钠和石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH43、氢氧化铝和盐酸:Al(OH)3+3HCl=AlCl3+3H2O44、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O(五)其他:45、二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O46、二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+H2O47、用氢氧化钠溶液吸收二氧化硫:SO2+2NaOH=Na2SO3+H2O48、一氧化碳还原氧化铜:CO+CuO△Cu+CO2 49、一氧化碳还原氧化铁(炼铁):3CO+Fe2O3高温2Fe+3CO250、甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O51、乙醇在空气中燃烧:C2H5OH+3O2=点燃=2CO2+3H2OⅡ、金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au ―――――――――――――――――――――――→金属活动性由强逐渐减弱小结:1、只有排在H前面的金属才能置换出酸里的氢2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来3、只有在H前面的才能从稀酸(如稀盐酸硫酸)中置换出氢气二、溶液的酸碱度――pH石蕊试液(紫色)红紫蓝―――――――――――――――――――――――――――――酚酞试液(无色)无无红0 1 2 3 4 5 6 7 8 9 10 11 12 13 14│└―┴―┴―┴―┴―┴―┴―┴―┴―┴―┴―┴―┴―┴―┘ ←――――――――――――中性――――――――――――――→pH越小酸性越强pH越大碱性增强三、常见物质的颜色、气味等:红色:红P、Cu、Fe2O3红褐色:Fe(OH)3浅绿色:Fe2+盐的溶液黄色:S、Fe3+盐的溶液绿色:Cu2(OH)2CO3紫黑色:KMnO4晶体蓝色:Cu(OH)2、CuCO3、CuSO4??5H2O、Cu2+盐的溶液紫红色:KMnO4溶液黑色:C、Fe粉、CuO、MnO2、Fe3O4白色:BaSO4、AgCl、MgO、P2O5、CaO、NaOH、Ca(OH)2、CaCO3、KClO3、KCl、NaCl、BaCO3、CuSO4、Na2CO3等无色气体:空气、O2、H2、CO2、CO、CH4、N2、SO2刺激性气味气体:SO2、HCl、HNO3等无色透明:金刚石、干冰以及大部分酸、碱、盐的溶液和酒精、乙酸的溶液四、熟记一些物质的学名、俗名及对应的化学式Hg汞(水银)CO2二氧化碳(干冰)CO一氧化碳(煤气)CH4甲烷(沼气天然气)CaO氧化钙(生石灰)Ca(OH)2氢氧化钙(熟石灰、消石灰)CaCO3碳酸钙(石灰石、大理石)NaCl氯化钠(食盐)KMnO4高锰酸钾(灰锰氧)C2H5OH乙醇(酒精)CH3COOH乙酸(醋酸)NaOH氢氧化钠(烧碱、苛性钠)Na2CO3碳酸钠(纯碱、苏打)NaHCO3碳酸氢钠(小苏打)HCl 氢氯酸(盐酸)CuSO4??5H2O五水硫酸铜(胆矾、蓝矾)(NH4)2SO4硫酸铵(硫铵)NH4HCO3碳酸氢铵(碳铵)Cu2(OH)2CO3碱式碳酸铜(铜绿)NH4NO3硝酸铵(硝铵)K2CO3碳酸钾(草木灰主要成分)五、化学反应类型1、化合反应:A+B→C2、分解反应:C→A+B3、置换反应:A+BC→B+AC4、复分解反应:AB+CD→AD+CB。
初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属:O 氧H 氢N 氮Cl 氯C 碳P 磷S 硫金属:K 钾Ca 钙Na 钠Mg 镁Al 铝Zn 锌Fe 铁Cu 铜Hg 汞Ag 银 Mn 锰 Ba 钡 原子团 ( 根) :氢氧根 硝酸根 碳酸根 硫酸根 铵根OH - NO - CO 2- SO 2- NH +3 3 44 2、(1)常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团 ( 根) 化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
3、必须熟记的常见物质的俗称、化学名称、化学式、用途俗称 化学名称 化学式 用途金刚石做钻头、切 金刚石、石墨、木炭等 碳单质 C割玻璃石墨做铅笔芯、电干冰 二氧化碳固 CO极 人工降雨,致冷剂2体H 2 O水水最常见溶剂铁锈氧化铁Fe O23生石灰氧化钙CaO食品干燥剂熟石灰、消石灰(澄清石 氢氧化钙 Ca(OH)2 改良酸性土壤灰水)碳酸钙CaCO建筑材料、工业制 石灰石、大理石(蛋壳、水垢等)3取 CO2火碱、烧碱、苛性钠氢氧化钠NaOH氢氧化钠固体作干燥剂、化工原料、清洁剂盐酸(氯化氢)HCl除铁锈、胃酸主要成分纯碱、苏打2 3玻璃、造纸、纺织、 碳酸钠NaCO洗涤小苏打3发酵粉、治疗胃酸 碳酸氢钠 NaHCO过多天然气、沼气、瓦斯 甲烷 4燃料CH酒精 乙醇C 2 H 5OH燃料、乙醇汽油4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3)实验室制取氧气三: 2KClO3 ===2KCl+3O↑(4)实验室制法 CO2: CaCO3+2HCl==CaCl+H2O+CO2↑(5)实验室制取氢气Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl = ZnCl 2 +H2↑(6)电解水制取氢气: 2H 2O===2H↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu(Fe 与盐、酸反应都生成的是 +2 价亚铁离子)(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO(Fe2O3与酸反应生成的是 +3 价铁离子)(9)熟灰水 [Ca(OH)2 ] 的制取方法: CaO+H2O==Ca(OH)2(10)生石灰 ( 氧化钙 ) 制取方法: CaCO3===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱:K Ca Na Mg Al,Zn Fe Sn Pb(H),Cu Hg Ag Pt Au。
精心整理常用物质的化学名称、化学式及反应的化学方程式:一、单质:1、常见气体:氧气:O2氢气:H2氯气:Cl2氮气:N22、稀有气体:氦气:He氖气:Ne氩气:Ar3、金属和非金属单质(1)金属单质:锂:Li铍:Be钠:Na镁:Mg铝:Al钾:K钙:Ca铜:Cu铁:Fe锌:Zn钡:Ba 银:Ag汞:Hg(2)非金属单质:碳:C硅:Si磷:P硫:S二、化合物二、制取气体的化学方程式:1(1)2KClO 3↑(2)2MnO 4+MnO 2+O 2↑(3)2H 2O 2(4)2H 22(1)(2)(3)2(4)3、制取氢气的化学方程式:(1)镁、铝、铁、锌与稀盐酸反应制取H 2:Mg +2HCl =MgCl 2+H 2↑2Al +6HC l =2AlCl 3+3H 2↑ (24(1(2Na 2注意:①往NaOH 溶液中通入CO 2,会发生反应2NaOH+CO 2=====Na 2CO 3+H 2O ;若继续通入Na 2CO 3+H 2O +CO 2===2NaHCO 3而2CO 3+H 2O +CO 2↑②往Ca(OH)2溶液中通入CO 2,会发生反应Ca(OH)2+CO 2====CaCO 3↓+H 2O 若继续通入CO 2,CaCO 3会逐渐溶解,则会发生反应CaCO 3+2===2Ca(HCO 3)2Ca(HCO 3)3↓+H 2O +CO 2↑形成钟乳石、石笋等5、生成陈定的化学方程式:(1)生成BaSO4白色沉淀,不溶于稀HNO3。
离子方程式:Ba2++SO42—=BaSO4↓Ba(OH)2+H2SO4=BaSO4↓+2H2OBa(NO3)2+H2SO4=BaSO4↓+2HNO3Ba(OH)2+Na2SO4=BaSO4↓+2NaOHBa(NO3)2+Na2SO4=BaSO4↓+2NaNO3Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓Ba(NO3)2+CuSO4=BaSO4↓+Cu(NO3)2Ba(OH)2+K2SO4=BaSO4↓+2KOHBa(NO3)2+K2SO4=BaSO4↓+2KNO3 BaCl2+H2SO4=BaSO4↓+2HClBaCl2+Na2SO4=BaSO4↓+2NaClBaCl2+CuSO4=BaSO4↓+CuCl2(2)生成AgCl白色沉淀,不溶于稀HNO3。
初三化学必背化学式化学作为一门自然科学,研究的是物质的组成、结构、性质、变化规律以及与能量的关系。
在初中化学学习中,有一些必背的化学式是我们必须要掌握的。
下面就让我们一起来学习一下这些必背的化学式吧!一、常见元素的符号和原子序数在化学中,元素是构成物质的基本单位,而元素的符号则是表示这个元素的简写。
下面是一些常见元素的符号和原子序数:1. 氢:H,原子序数为12. 氧:O,原子序数为83. 碳:C,原子序数为64. 氮:N,原子序数为75. 铁:Fe,原子序数为266. 铜:Cu,原子序数为297. 锌:Zn,原子序数为30二、常见化合物的化学式化合物是由两种或更多种元素组成的物质。
下面是一些常见化合物的化学式:1. 水:H2O2. 二氧化碳:CO23. 硫酸:H2SO44. 氯化钠:NaCl5. 硝酸:HNO36. 氨:NH37. 乙醇:C2H5OH三、常见离子的化学式离子是带电的原子或原子团,可以是正离子(阳离子)或负离子(阴离子)。
下面是一些常见离子的化学式:1. 氢离子:H+2. 氧离子:O2-3. 氯离子:Cl-4. 铵离子:NH4+5. 钠离子:Na+6. 铁离子:Fe2+、Fe3+7. 铜离子:Cu2+、Cu+四、常见化学反应的化学方程式化学方程式是用化学符号和化学式表示化学反应的式子。
下面是一些常见化学反应的化学方程式:1. 水的电离反应:H2O → H+ + OH-2. 燃烧反应:C3H8 + 5O2 → 3CO2 + 4H2O3. 酸与碱的中和反应:HCl + NaOH → NaCl + H2O4. 金属与非金属的反应:2Na + Cl2 → 2NaCl5. 酸与金属的反应:2HCl + Zn → ZnCl2 + H26. 酸与碳酸盐的反应:2HCl + Na2CO3 → 2NaCl + H2O + CO2五、常见物质的摩尔质量摩尔质量是指物质的质量与其摩尔数的比值。
下面是一些常见物质的摩尔质量:1. 氢气:H2,摩尔质量为2 g/mol2. 氧气:O2,摩尔质量为32 g/mol3. 二氧化碳:CO2,摩尔质量为44 g/mol4. 水:H2O,摩尔质量为18 g/mol5. 氯气:Cl2,摩尔质量为71 g/mol6. 硫酸:H2SO4,摩尔质量为98 g/mol7. 氨:NH3,摩尔质量为17 g/mol以上就是初三化学必背的化学式。
初中常见物质的化学式氢气碳氮气氧气磷硫氯气(非金属单质)H2、C 、N2、O2、P 、S 、Cl2钠镁铝钾钙铁锌铜钡钨汞(金属单质)Na 、Mg、Al 、K 、Ga、Fe、Zn 、Cu、Ba、W 、Hg水一氧化碳二氧化碳五氧化二磷氧化钠二氧化氮二氧化硅二氧化硫三氧化硫H2O 、CO、CO2、P2O5、Na2O 、NO2 、SiO2 、SO2 、SO3一氧化氮氧化镁氧化铜氧化钡氧化亚铜氧化亚铁三氧化二铁(铁红)NO 、MgO 、CuO 、BaO 、Cu2O 、FeO、Fe2O3四氧化三铁三氧化二铝三氧化钨氧化银氧化铅二氧化锰(常见氧化物)Fe3O4、Al2O3 、WO3、Ag2O 、PbO 、MnO2硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸(常见的酸)H2SO4、HCl 、HNO3、H3PO4、H2S 、HBr 、H2CO3氯化钾氯化钠(食盐) 氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝KCl 、NaCl 、MgCl2、CaCl2、CuCl2、ZnCl2、BaCl2 、AlCl3氯化亚铁氯化铁氯化银FeCl2、FeCl3、AgCl硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4、BaSO4、CaSO4 、K2SO4 、MgSO4 、FeSO4 、Fe2 (SO4)3硫酸铝硫酸氢钠硫酸氢钾亚硫酸钠硝酸钠硝酸钾硝酸银Al2(SO4)3 、NaHSO4 、KHSO4 、Na2SO3、NaNO3、KNO3、AgNO3硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁碳酸钾(常见的盐)Mg(NO3)2 、Cu(NO3)2、Ca(NO3)2、NaNO3、Na2CO3、CaCO3 、MgCO3 、K2CO3氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOH 、Ca(OH)2、Ba(OH)2、Mg(OH)2 、Cu(OH)2、KOH 、Al(OH)3氢氧化铁氢氧化亚铁(常见的碱)Fe(OH)3 、Fe(OH)2甲烷乙炔甲醇乙醇乙酸甲醛(常见有机物)CH4 、C2H2 、CH3OH 、C2H5OH 、CH3COOH 、CH2O碱式碳酸铜石膏熟石膏明矾绿矾Cu2(OH)2CO3、CaSO4.2H2O 、CaSO4.H2O 、KAl(SO4)2.12H2O 、FeSO4.7H2O蓝矾碳酸钠晶体(常见结晶水合物)CuSO4.5H2O 、Na2CO3.10H2O尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾硝酸钾(常见化肥)CO(NH2)2、NH4NO3、(NH4)2SO4、NH4HCO3、KH2PO4、KNO3沉淀:红褐色沉淀--------Fe(OH)3 浅绿色沉淀------------Fe(OH)2蓝色沉淀----------Cu(OH)2白色沉淀--------------CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Zn(OH)2、AgCl、BaSO4(其中仅BaSO4、AgCl 是不溶于HNO3的白色沉淀).淡黄色沉淀(水溶液中)----S 微溶于水------------Ca(OH)2 、CaSO4、Ag2SO4初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)点燃1. 镁在空气中燃烧:2Mg + O2 ====2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O2加热2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2点燃CO29. 碳在氧气中不充分燃烧:2C + O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2↑14.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2MnO2 2H2O+ O2↑(实验室制氧气原理2)16.加热氯酸钾:2KClO3加热(MnO2)2KCl + 3O2↑(实验室制氧气原理)二、自然界中的水:17.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑18.生石灰溶于水:CaO + H2O == Ca(OH)219.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:20.镁在空气中燃烧:2Mg + O2点燃2MgO21.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu22.氢气还原氧化铜:H2 + CuO 加热Cu + H2O碳酸钠与盐酸反应:Na2CO3 + 2HCl == 2NaCl + CO2↑+ H2O四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O2点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2点燃2H2O六、金属43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3 (铝耐腐蚀的原因)生成一层致密的氧化铝薄膜(2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg铜和硝酸银溶液反应:Cu +2AgNO3== Cu(NO3)2 +2Ag(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3↓+ H2O (2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓+ NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl一、物质的学名、俗名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)生石灰、氧化钙:CaO (4)干冰(固体二氧化碳):CO2 (5)盐酸、氢氯酸:HCl (6)亚硫酸:H2SO3 (7)氢硫酸:H2S (8)熟石灰、消石灰:Ca(OH)2 (9)苛性钠、火碱、烧碱:NaOH (10)纯碱、苏打:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3.10H2O (11)碳酸氢钠、酸式碳酸钠:NaHCO3(也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4.5H2O (13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡(15)酒精、乙醇:C2H5OH (16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(17)氨气:NH3(碱性气体)(18)氨水、一水合氨:NH3.H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(19)亚硝酸钠:NaNO2(工业用盐、有毒)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
一、输记下列元素名称、符号:
1、O氧 H氢 N氮 Cl氯 C碳 P磷 S硫
2、K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞
Ag银 Mn锰 Ba钡
二、熟记下列物质的化学式:
1、单质:
H2氢气O2氧气N2氮气
C碳P磷S硫Fe铁Cu铜Hg汞
2、化合物
(1)氧化物:
H2O CO2二氧化碳CO一氧化碳SO2二氧化硫
SO3三氧化硫P2O5五氧化二磷
Fe2O3氧化铁Fe3O4四氧化三铁CaO氧化钙(生石灰) MgO氧化镁CuO氧化铜ZnO氧化锌MnO2二氧化锰Na2O氧化钠
(2)酸:
HCl盐酸H2SO4硫酸H2CO3碳酸HNO3硝酸H3PO4磷酸(3)碱:
NaOH氢氧化钠(火碱,烧碱,苛性钠)KOH氢氧化钾Ca(OH)2氢氧化钙(熟石灰/消石灰)Ba(OH)2氢氧化钡
Cu(OH)2氢氧化铜 Al(OH)3氢氧化铝Mg(OH)2氢氧化镁(4)盐:
Na2SO4硫酸钠CuSO4硫酸铜FeSO4硫酸亚铁ZnSO4硫酸锌BaSO4硫酸钡(NH4)2SO4硫酸铵
Na2CO3碳酸钠(纯碱,苏打)CaCO3碳酸钙NH4HCO3碳酸氢铵NaHCO3碳酸氢钠(小苏打)KNO3硝酸钾Cu(NO3)2硝酸铜NH4NO3硝酸铵
KClO3氯酸钾K2MnO4锰酸钾KMnO4高锰酸钾
NaCl氯化钠(食盐)ZnCl2氯化锌CaCl2氯化钙KCl氯化钾AgCl氯化银FeCl3氯化铁FeCl2氯化亚铁AlCl3氯化铝NH4Cl氯化铵BaCl2氯化钡
(5)有机物:
CH4甲烷C2H5OH乙醇(酒精)CH3OH甲醇CH3COOH乙酸(醋酸)CO(NH2)2尿素葡萄糖:C6H12O6 淀粉:(C6H10O5)n 常见物质的颜色、气味等:
红色:红P、Cu、Fe2O3 红褐色:Fe(OH)3
浅绿色:Fe2+盐的溶液黄色:S、Fe3+盐的溶液
绿色:Cu2(OH)2CO3紫黑色:KMnO4晶体
蓝色:Cu(OH)2、CuCO3、CuSO4·5H2O、Cu2+盐的溶液紫红色:KMnO4溶液
黑色:C粉、Fe粉、CuO Fe3O4 MnO2。