07物化A卷09年上学期
- 格式:doc
- 大小:301.11 KB
- 文档页数:9

二OO七—二OO八学年第一学期期末考试物理化学(一)-2 A卷试题一.计算题。
请计算下列各题。
(本大题7 分)已知在-33.6℃时,CO(g)在活性炭上的吸附符合朗缪尔直线方程。
经测定知,该(p/V)~p直线的斜率为23.78 kg·m-3,截距为131 kPa·kg·m-3,试求朗缪尔方程中的常数V m及b。
二.计算题。
请计算下列各题。
(本大题9 分)某一级反应测得其半衰期在65℃时为2.50 min,在80℃时为0.50 min,在什么温度下方可使该一级反应1 min时转化率达到90% 。
三.计算题。
请计算下列各题。
(本大题9 分)已知25℃时,纯水的电导率κ=5.5×10-6S·m-1,纯水的体积质量(密度)为0.997 g·cm-3又H+,OH-的L分别为34.98×10-3S·m2·mol-1和19.83×10-3 S·m2·mol-1,求水在25℃的解离度及水的离子积。
(已知H2O的摩尔质量为18.02 g·mol-1。
)四.计算题。
请计算下列各题。
(本大题8 分)反应CuSO4+ 2FeSO4=== Cu + Fe2(SO4)3在水溶液中进行。
问在25℃标准状态下能否进行?其标准平衡常数为多少?(已知E (Cu2+|Cu) = 0.3402 V,E (Fe3+, Fe2+|Pt)=0.771 V。
)五.证明题。
(本大题6 分)气相反应 2A(g) Y(g) , 是二级反应 , 反应开始时无Y , 压力为p A,0,求反应系统的总压力p与时间t的关系。
六.选择题。
在题后括号内,填上正确答案代号。
(本大题共18 小题,总计61 分)1、本小题4分由两种不互溶的纯液体A和B相互接触形成两液相时,下面说法中最符合实际情况的是:()(1)界面是一个界限分明的几何平面;(2 )界面层有几个分子层的厚度,在界面层内,A和B 两种物质的浓度沿垂直于界面方向连续递变;(3)界面层的厚度可达几个分子层,在界面层中,A和B 两种物质的浓度处处都是均匀的。

2009年普通高等学校招生全国统一考试(山东卷)物理二、选择题(本题包括7小题,每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得4分,选对但不全的得2分,有选错的得0分)1、.如图所示,光滑半球形容器固定在水平面上,O 为球心,一质量为m 的小滑块,在水平力F 的作用下静止P 点。
设滑块所受支持力为F N 。
OF 与水平方向的夹角为0。
下列关系正确的是( )A .tan mgF =θ B .F =mgtan0 C .tan N mgF =θD .F N =mgtan02、.某物体做直线运动的v-t 图象如图甲所示,据此判断图乙(F 表示物体所受合力,x 表示物体的位移)四个选项中正确的是( )3、2008年9月25日至28日我国成功实施了“神舟”七号载入航天飞行并实现了航天员首次出舱。
飞船先沿椭圆轨道飞行,后在远地点343千米处点火加速,由椭圆轨道变成高度为343千米的圆轨道,在此圆轨道上飞船运行周期约为90分钟。
下列判断正确的是( )A .飞船变轨前后的机械能相等B .飞船在圆轨道上时航天员出舱前后都处于失重状态C .飞船在此圆轨道上运动的角度速度大于同步卫星运动的角速度D .飞船变轨前通过椭圆轨道远地点时的加速度大于变轨后沿圆轨道运动的加速度4、某小型水电站的电能输送示意图如下。
发电机的输出电压为200V ,输电线总电阻为r ,升压变压器原副线圈匝数分别为n ,n 2。
降压变压器原副线匝数分别为a 3、n 4(变压器均为理想变压器)。
要使额定电压为220V 的用电器正常工作,则( )vt/s图甲图乙A .3214n n n n >B .3214n n n n < C .升压变压器的输出电压等于降压变压器的输入电压 D .升压变压器的输出功率大于降压变压器的输入功率5、如图所示,在x 轴上关于原点O 对称的两点固定放置等量异种点电荷+Q 和-Q ,x 轴上的P 点位于的右侧。

泰山学院课程考试专用泰山学院材料与化学工程系2007级(3+2)专升本化学工程与工艺专业本科2007~2008学年第一学期《物理化学》试卷A(试卷共10页,答题时间120分钟)一、选择题(每小题 2 分,共 40分。
请将答案填在下面的表格内)1、压力升高时,单组分系统的熔点将如何变化--------------------------------( )A、升高B、降低C、不变D、不一定2、硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种----------------------------------------------------------------------------------( )A、3 种B、2 种C、1 种D、不可能有硫酸水合物与之平衡共存3、水蒸气蒸馏通常适用于某有机物与水组成的--------------------------------( )A、完全互溶双液系B、互不相溶双液系C、部分互溶双液系D、所有双液系:本试卷共10页第 1 页4、对恒沸混合物的描述,下列叙述哪一种是不正确的---------------------- ( )A、不具有确定的组成B、平衡时,气相和液相的组成相同C、其沸点随外压的改变而改变D、与化合物一样,具有确定的组成5、A与B是两种互不相溶的两种液体,A的正常沸点80℃,B的正常沸点120℃。
把A、B混合组成一个系统,那么这个混合物的正常沸点为----------------( )A、小于80℃B、大于120℃C、介于80℃与120℃之间D、无法确定范围下面关于6、如图,对于右边的步冷曲线对应是哪个物系点的冷却过程--------------( )A、a点物系点B、b点物系点C、c点物系点D、d点物系点7、如图,对于形成简单低共熔混合物的二元相图,当物系点的组成为x,冷却到t℃时,固液二相的重量之比是-------------------------------------------------( )A、w(s)∶w(l) = ac∶bcB、w(s)∶w(l) = ac∶abC、w(s)∶w(l) = bc∶abD、w(s)∶w(l) = bc∶ac8、如图A与B是两组分恒压下固相部分互溶凝聚系统相图,图中有几个两相区----------------- -------------- ( )A、1个B、2个C、3个D、4个9、H2O-KNO3-NaNO3物系的相图如下。

物化实验试卷中南⼤学考试试卷(A-D卷)2008 --2009 学年⼀学期物理化学实验研究⽅法课程24学时1学分考试形式:闭卷专业年级:冶⾦、环境类07级总分100分,占总评成绩50 % 注:此页不作答题纸,请将答案写在答题纸上考试内容分为笔试(30分钟)和操作考试(2.5⼩时),备有8套试题,学⽣抽签选择。
此处列举4套⽰例。
A卷试题和参考答案⼀、单项选择(每⼩题2分,共20分)1. “阴极极化曲线的测定”实验所测的是哪⼀种超电势?(A) 氢电极的电阻超电势(B) 氢电极的浓差超电势(C)氢电极的活化超电势(D) 氧电极的活化超电势2. 在⼄酸⼄酯皂化反应实验中, 若CH3COOC2H5和NaOH溶液的浓度均为0.010 mol·dm-3, 等体积混合后, 则反应终⽌时体系的电导率可⽤下列哪种溶液的电导值代替(A)0.010 mol·dm-3 NaOH (B) 0.005 mol·dm-3 NaOH(C)0.005 mol·dm-3 CH3COOH (D) 0.005 mol·dm-3 CH3COONa3. 在Fe(OH)3溶胶的纯化过程中, 不能透过半透膜的物质是:(A) Fe3+(B) Cl-(C) Fe(OH)3(D) H2O4. 福庭式⽓压计的读数校正不包含以下哪⼀种校正(A) 温度校正(B) 重⼒加速度校正(C)仪器校正(D)露茎校正5.电导率仪在⽤来测量电导率之前, 必须进⾏:(A) 零点校正(B) 满刻度校正(C) 定电导池常数(D) 以上三种都需要6. 在氧弹实验中, 若测得?c H m= -5140.7 kJ·mol-1, ?|?H|最⼤=25.47 kJ·mol-1, 则实验结果的正确表⽰应为:(A) ?c H m= -5140.7 kJ·mol-1(B) ?c H m= -5140.7±25.47 kJ·mol-1 (C) ?c H m= -(5.1407±0.02547)×103 kJ·mol-1(D) ?c H m= -5140.7±25.5 kJ·mol-17. 在测定纯⽔的饱和蒸⽓压的实验中, 我们是通过测定不同外压下纯⽔的沸点来进⾏的, 这种测定饱和蒸⽓压的⽅法是属于:(A) 静态法(B) 饱和⽓流法(C)动态法(D) 流动法8. ⽤差热分析仪测定固体样品的相变温度,选⽤哪种物质做基准物较合适:(A) ⽆⽔氯化钙(B)三氧化⼆铝(C) 苯甲酸(D) ⽔杨酸9. 测量溶液的电导时, 应使⽤:(A) ⽢汞电极(B)铂⿊电极(C) 银—氯化银电极(D) 玻璃电极10. 溶解热测定实验中,若试样吸潮和颗粒偏⼤,则将分别导致实验结果(A) 偏⼤和偏⼩(B) 都偏⼤(C)都偏⼩(D) 偏⼤和偏⼩⼆、判断题(每⼩题3分,共15分)1. B-Z振荡反应实验中所采⽤的参⽐电极是饱和⽢汞电极。

河北理工大学2006~2007学年第一学期物理化学A-11分,答案填入题后表格中)1、1mol 理想气体298K 向真空膨胀体积变为原来的10倍,则∆G 为 a 19.14J b 5703.7J c -5703.7J d 02、∆H=∆U+∆(PV)适用于a 恒压过程b 恒容过程c 恒温过程d 一切过程 3、1mol 单原子理想气体在300K 绝热压缩至500K,则其焓变∆H 为 a 4157J b 596J c 1255J d 994J 4、若体系与环境之间只有能量交换而无物质交换,该系统为: a. 封闭体系 b 隔离体系 c. 敞开体系 d. 混合体系 5、已知CO ( g) +1/2O 2(g) =CO 2(g) 的∆r H m 下列说法何者不正确: a. ∆r H m 是CO 2(g) 的生成热 b. ∆r H m 是CO (g) 的燃烧热 c. ∆r H m 是负值 d. ∆r H m 与反应的∆r U m 数值不相等 6、-20 ︒C 、101.325KPa 下1mol 过冷水结冰,放热为∆H ,则过程的熵变∆Sa. 等于253H ∆b. 大于253H ∆c. 小于253H∆ d. 不能确定7、B 物质从α相自发地向β相转移,则μB α 与μB β 的关系是:a. μB α >μB βb. μB α <μB βc. μB α =μB βd. 不能确定8、25︒C 有反应)(2)(2)(2)(6663217g l g l CO O H O H C +=+气体作为理想气体,则反应的❒H 与❒U 之差约为:a -3.7KJb 1.2KJc -1.2KJd 3.7KJ 9、H 2 和O 2以2:1的比例在绝热的钢瓶中反应生成水,在该反应过程中 a ∆H =0 b ∆T=0 c ∆P=0 d ∆U=0 10、任一反应的Q p,m 与Q v,ma Q p,m 总是大于Q v,mb Q p,m 总是小于Q v,mc Q p,m 等于Q v,md Q p,m 与Q v,m 的比较不能确定 11、100℃,101.325KPa 条件下,1mol 水向真空蒸发为100℃,101.325KPa 的水蒸汽,则:a ∆S=0b ∆U=0c ∆H=0d ∆G=0 12、任意不可逆循环的熵变a 大于零b 小于零c 等于零d 是温度的函数 13、绝热过程中,系统的∆S>0,表示过程a 自发的b 反自发的c 可逆的d 可能自发也可能反自发14、CaCO 3(s)装入真空容器中加热分解达平衡,则其自由度为a 1b 2c 0d 315、A 和B 形成理想溶液,已知100℃时P A *=1000mmHg ,P B *=500mmHg ,当溶液中X A =0.5时,与溶液平衡的蒸气中A 的摩尔分数为a 1b 43c 21d 32 16、已知1mol O 2在25℃,100KPa 的S m θ=205.14JK -1mol -1,则其在45℃,101.3KPa 的规定熵以J.mol -1.K -1表示值应为(C p,m =25J.K -1mol -1)a209.28 b 206.65 c 206.87 d 249分,每题1分,以"Y"、或"N"填入题后表格中) 1、沸点上升是稀溶液的依数性之一; 2、绝热过程熵值不变;3、理想液态混合物中某一组分化学势,μB =μB θ+RTlnX B ;4、系统在恒压过程中吸收的热等于焓变;5、过冷水结冰是一自发过程,∆S 系<0与熵增原理相矛盾;6、升高温度对平衡常数增加有利;7 、20℃时,1mol 纯理想气体从0.1Mpa 压缩到2.5MPa 时,化学势变化值为 - 9.845kJ ;8、物质处于临界状态时,Sm (l)=Sm (g);;9、理想气体化学反应等温方程式为-∆ r G m =∆ r G m θ+RTlnJp ; 10 、∆G<0的化学反应能自发向右进行;已知水在100℃、101325Pa 下蒸发热Δvap H m =40.64KJ ·mol -1,试求4mol 水在100℃、101325Pa 下变为水蒸气过程的Q 、W 、ΔU 、ΔH 、ΔS 、ΔG 各为若干?(水的体积与水蒸气体积相比较可忽略不计。
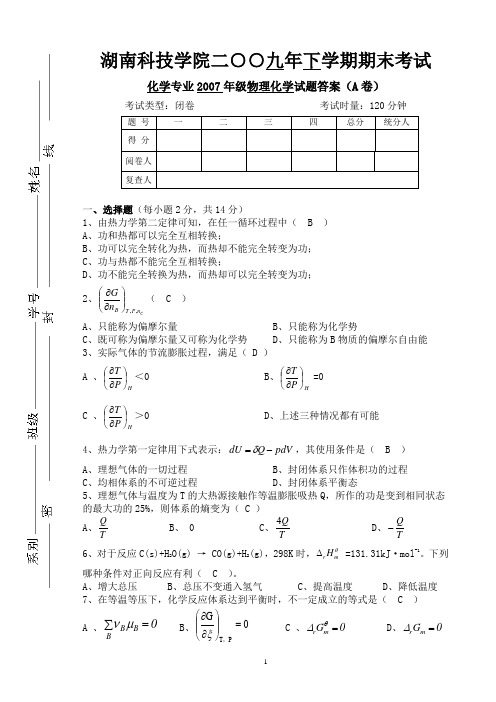
湖南科技学院二○○九年下学期期末考试化学专业2007年级物理化学试题答案(A 卷)一1、由热力学第二定律可知,在任一循环过程中( B ) A 、功和热都可以完全互相转换;B 、功可以完全转化为热,而热却不能完全转变为功;C 、功与热都不能完全互相转换;D 、功不能完全转换为热,而热却可以完全转变为功;2、Cn P T BnG ,,⎪⎪⎭⎫ ⎝⎛∂∂( C ) A 、只能称为偏摩尔量 B 、只能称为化学势C 、既可称为偏摩尔量又可称为化学势D 、只能称为B 物质的偏摩尔自由能 3、实际气体的节流膨胀过程,满足( D )A 、H P T ⎪⎭⎫ ⎝⎛∂∂<0B 、HP T ⎪⎭⎫⎝⎛∂∂ =0C 、HP T ⎪⎭⎫⎝⎛∂∂>0 D 、上述三种情况都有可能4、热力学第一定律用下式表示:pdV Q dU -=δ,其使用条件是( B ) A 、理想气体的一切过程 B 、封闭体系只作体积功的过程 C 、均相体系的不可逆过程 D 、封闭体系平衡态5、理想气体与温度为T 的大热源接触作等温膨胀吸热Q ,所作的功是变到相同状态的最大功的25%,则体系的熵变为( C )A 、T QB 、 0C 、TQ 4 D 、T Q -6、对于反应C(s)+H 2O(g) → CO(g)+H 2(g),298K 时,r m H θ∆ =131.31kJ ·mol -1。
下列哪种条件对正向反应有利( C )。
A 、增大总压B 、总压不变通入氢气C 、提高温度D 、降低温度 7、在等温等压下,化学反应体系达到平衡时,不一定成立的等式是( C ) A 、∑=BB B 0μν B 、0G PT =⎪⎪⎭⎫⎝⎛∂∂,ξ C 、0G m r =θ∆ D 、0G m r =∆二、填空题(每空1分,共30分)8、系统的诸性质不随时间而改变的状态称为热力学平衡态,热力学平衡态必须同时满足的四个条件是 热动平衡 、力学平衡、相平衡和化学平衡。
(勤奋、求是、创新、奉献)2008~ 2009学年第 二 学期考试试卷主考教师: 陈燕青学院 化学化工学院 班级 __________ 姓名 __________学号 ___________《物理化学(一)》课程试卷A 参考答案与评分标准一、选择题(本题共10小题,每小题2分,共20分)1、 若298 K 时,反应N O g N O g 2422()()=的-1r m 5398J mol G ∆=⋅$,则当p (N 2O 4)=p (NO 2)=1 kPa 时,反应将 ( A )(A)向生成N 2O 4方向进行 (B)向生成NO 2方向进行 (C)反应恰好达到平衡 (D)不能判断其进行的方向2、石墨的燃烧热 ( B )(A) 等于CO 生成热 (B) 等于CO 2生成热(C) 等于金刚石燃烧热 (D) 等于零3、 某绝热封闭体系在接受了环境所做的功之后,其温度: ( A )(A) 一定升高 (B) 一定降低 (C) 一定不变 (D) 不一定改变4、液态苯在一绝热刚性的氧弹中燃烧,其化学反应为:C 6H 6(l)+7.5O 2(g)=6CO 2(g)+3H 2O(g),则下面表示准确的是 ( B )(A )ΔU=0,ΔH<0,Q=0 (B )ΔU=0,ΔH>0,W=0 (C )ΔU=0,ΔH=0,Q=0 (D )ΔU ≠ 0,ΔH ≠ 0,Q=05、 在270K 和大气压力下,一定量的过冷水凝结为同温同压下的冰,则系统和环境的熵变分别为 ( B )(A) ΔS sys <0,ΔS sur <0 (B) ΔS sys <0,ΔS sur >0 (C) ΔS sys >0,ΔS sur <0 (D) ΔS sys >0,ΔS sur >0 6、下列偏微分中,能称为偏摩尔量的是 ( A )(A) )(,,B C n p T B C n V ≠⎪⎪⎭⎫⎝⎛∂∂ (B) )(,,B C n p S B C n H ≠⎪⎪⎭⎫⎝⎛∂∂ (C) )(,,B C n V p B C n G ≠⎪⎪⎭⎫⎝⎛∂∂ (D) )(,,B C n H T B C n S ≠⎪⎪⎭⎫⎝⎛∂∂7、已知反应3O 2(g)=2O 3(g),在298 K 时Θ∆m r H =-280 J·mol -1,则对该反应有利的条件是 ( C )(A) 升温、加压 (B) 升温、降压 (C) 降温、加压 (D) 降温、降压8、 在某反应条件下,反应)()(21)(322g SO g O g SO =+的标准平衡常数Θ1K =0.54。
衡阳师范学院2009年上学期2006级化学专业《化工基础》期末考试试题A卷参考答案一、填空题(每小题2分,共22分)1、某混合气体中含有体积分数为0.20的CO2,其余为空气。
在101.3 kPa及30 ℃下,用清水吸收其中CO2时,已知30 ℃时CO2水溶液的亨利常数E为1.884×105 kPa,则液相中CO2的最大浓度为 1.08×10-4。
2、在《传热综合实验》中,采用用饱和水蒸气加热空气,换热器壁面的温度更接近水蒸汽的温度,总传热系数近似等于空气的传热膜系数。
若要提高传热效率,应当改善空气一侧的传热条件。
3、在填料塔中进行逆流接触的吸收操作时,若液气比增大,其它操作条件不变,则溶液出口浓度将减小,气体出口浓度减小,吸收率增大。
4、离心泵在启动前灌泵是为了防止发生气缚现象;离心泵的安装高度应小于允许安装高度,否则会发生气蚀现象。
5、当温差较大的冷、热流体在刚性结构的管壳式换热器中进行热交换时, 从防止由于热应力造成设备损坏的角度考虑, 则其中传热膜系数较大的流体应走壳程。
6、物料衡算和能量衡算是化学工程学中极为重要的方法,例如,精馏过程的操作线方程是通过物料衡算建立起来的。
7、在研究流体流动规律时,要注意区分是定常(或称定态)流动和非定常(或称非定态)流动,稳定态和不稳定态。
如果所考察的流体流动过程或系统中任何一个部位或任何一个点上的流体性质和过程参数都不随时间而改变,则该过程为定态过程,反之,则为非定态过程。
8、停留时间分布的测定方法通常有脉冲输入法和阶跃输入法两种方法。
9、催化重整的目的是获得高辛烷值汽油或芳烃。
10、料吸收塔的流体力学性能实验中,单位高度干填料层压降——空塔气速曲线在双对数坐标中为直线。
11、在恒速干燥阶段,物料表面的温度接近空气的湿球温度。
二、选择题(每小题3分,共30分)1、实验中用U形管压差计测得某设备内的压力读数为零,说明该设备的绝对压为…………………………………………………………………( C)。
2009年普通高等学校招生全国统一考试(广东A卷)物理参考答案一、选择题:本大题共12小题,每小题4分,共48分。
在每小题给出的四个选项中,有一个或一个以上选项符合题目要求,全部选对的得4分,选不全的得2分,有选错或不答的得0分。
二、非选择题(一)选做题13、⑴做功机械能⑵热量升高增大14、⑴界面的传播速度⑵相等等于零等于原来声波振幅的2倍(二)必做题15、⑴①小车、砝码②然后释放小车③减少砝码⑵0.600 0.61016、⑴电路图略⑵③读出接入电路中的金属丝的长度⑶1.63 电源电动势的内阻与电阻箱⑷0.200mm 金属丝的电阻率 1.54×10-7Ω·m17解:⑴炸弹作平抛运动,设炸弹脱离飞机到击中目标所飞行的水平距离为x,0x v t = 212H gt =联立以上各式解得x v =设击中目标时的竖直速度大小为v y ,击中目标时的速度大小为vy v g t ==v =联立以上各式解得v =⑵①当筒不转动时,物块静止在筒壁A 点时受到的重力、摩擦力和支持力三力作用而平衡,由平衡条件得摩擦力的大小sin f mg θ==支持力的大小cos N mg θ==②当物块在A 点随筒做匀速转动,且其所受到的摩擦力为零时,物块在筒壁A 点时受到的重力和支持力作用,它们的合力提供向心力,设筒转动的角速度为ω有2t a n 2Rm g m θω=⋅由几何关系得 t a n HRθ=联立以上各式解得ω=18、解:⑴由图象分析可知,0至1t 时间内 0B B t t ∆=∆ 由法拉第电磁感应定律有 BE nn s t tφ∆∆==⋅∆∆ 而22s r π=由闭合电路欧姆定律有11E I R R=+联立以上各式解得 通过电阻1R 上的电流大小为202103nB r I Rt π=由愣次定律可判断通过电阻1R 上的电流方向为从b 到a⑵通过电阻1R 上的电量20211103nB r t q I t Rt π==通过电阻1R 上产生的热量22242021111229n B r t Q I R t Rt π== 19、解:⑴设AB 碰撞后的速度为v 1,AB 碰撞过程由动量守恒定律得 012mv mv =设与C 碰撞前瞬间AB 的速度为v 2,由动能定理得 22211122mgl mv mv μ-=- 联立以上各式解得24/v m s =⑵若AB 与C 发生完全非弹性碰撞,由动量守恒定律得22(2)m v k m v =+ 代入数据解得 2k = 此时AB 的运动方向与C 相同若AB 与C 发生弹性碰撞,由动量守恒和能量守恒得23222232211122222mv mv kmvmv mv kmv =+⋅=⋅+⋅ 联立以上两式解得3222242kv v kv v k-=+=+代入数据解得 6k =此时AB 的运动方向与C 相反若AB 与C 发生碰撞后AB 的速度为0,由动量守恒定律得22mv kmv =代入数据解得4k =总上所述得 当24k ≤<时,AB 的运动方向与C 相同 当4k =时,AB 的速度为0当46k <≤时,AB 的运动方向与C 相反 20、解:⑴由牛顿第二定律F ma =有A 刚开始运动时的加速度大小22.0/A AFa m s m == 方向水平向右 B 刚开始运动时受电场力和摩擦力作用 由牛顿第三定律得电场力'1.2F F N == 摩擦力()0.8A B f m m g N μ=+=B 刚开始运动时的加速度大小'22.0/B BF fa m s m +==方向水平向左⑵设B 从开始匀减速到零的时间为t 1,则有10.2BBv t s a == 此时间内B 运动的位移110.042B B v t s m == t 1时刻A 的速度11 1.2/0A A A v v a t m s =-=>,故此过程A 一直匀减速运动。
《物理化学》期末考试(A卷)班级学号姓名总分一、选择题(共10题,每题2分,共20分)请将正确答案写在题目后面的括号内。
1.当用压缩因子z = pV/(nRT) 来讨论实际气体时,如z >1,则表示该气体()。
A. 不易压缩B.易于压缩C.易于液化D.不易液化2.下列物理量中不属于强度性质的物理量为()。
A.摩尔体积B.热力学能C.压力D.密度3.已知CO2的T c=304.13 K,P c=7.375 MPa。
有一钢瓶中贮有302.15 K的CO2,则该CO2处于什么状态()。
A.液体B.气体C.气液共存D.数据不足,无法确定4.△H = Q p此式适用于下列那个过程(皆为封闭系统)()。
A.理想气体从1013250 Pa 反抗恒定的101325 Pa压力膨胀到101325PaB.气体从(298K, 101325 Pa) 可逆变化到(373K, 10132.5 Pa)C.101325 Pa压力下电解CuSO4水溶液D.0℃,101325 Pa下冰融化成水5.对于物理吸附的描述,以下说法中不正确的是()。
A.吸附力来源于范德华力B.吸附一般无选择性C.吸附可以是单分子层或多分子层D.吸附速度较小6.丁铎尔效应是光射到胶体粒子上引起的什么现象()。
A.透射B.反射C.散射D.衍射7.以下说法中,错误的是()。
A.催化剂的加入能改变反应机理B.催化剂的加入能改变反应速率第 1 页共8 页C.催化剂的加入能改变反应转化率D.催化剂的加入能改变反应活化能8.将少量表面活性剂溶入溶剂后,溶液的表面张力()。
A.降低B.显著降低C.增大D.先增大,后减小9.基元反应H + Cl2→ HCl + Cl 的反应的分子数为()。
A.1B.2C.3D.410.已知反应2A → P,A 的半衰期与其初始浓度成正比,则此反应为()。
A.零级反应B.一级反应C.二级反应D.三级反应二、填空题(共15题,每题2分,共30分)请将正确答案写在题目上的横线上。
《物理化学》课程试卷(A 卷)本试卷适用于生物与化学工程系2007级各专业本科学生(考试时间120分钟,总分100分)注意:1、答案必须填写在答题纸上,填写在试卷上的无效。
2、答卷必须写明题目序号,并依题号顺序答题。
3、请保持行距,保持卷面整洁。
一、选择题(每题只有一个正确答案,每题1.5分,共30分)1.实际气体全部液化应满足的条件是 ( )a. C C ,p p T T >>b. 1,1r r <<p Tc. *r ,1T p p T ><(*T p 为T 温度下的饱和蒸气压) d. 1,1r r <>p T2.理想气体经过焦-汤节流膨胀过程后,以下热力学函数的变化何者为零?( ) a. G ∆ b. U ∆ c. F ∆ d. S ∆3.某化学反应恒温恒压下在可逆电池中完成时从环境吸热,则 ( ) a. 0>∆G b. 0>∆U c. 0>∆H d. 0>∆S 4.化学反应O(s)Ag (g)O 21Ag(s)22=+的平衡体系中,可能平衡共存的相数最多有 ( ) a. 2相 b. 3相 c. 4相 d. 5相 5.一定温度、压力下,化学反应O(s)Ag (g)O 21Ag(s)22=+可能自动发生的条件是 ( ) a. 0>∆S b.反应体系的压力熵ϑp p K Q > c.0B B<∑μvd. 0m r <∆ϑG6.下列电解质溶液中平均活度系数最小的是 ( )a. 0.01mol ⋅kg -1LaCl 3 b. 0.01mol ⋅kg -1CaCl 2 c. 0.01mol ⋅kg -1KCl d. 0.001mol ⋅kg -1KCl7.隔离体系中发生下列过程,一定可逆的过程是: ( )a. 0=∆Gb. 0=∆Hc. 0=∆Sd. 0=∆U8.将少量的3AgNO溶液逐渐滴加到0.50dm 3、0.02mol ⋅dm -3的KCl 溶液中制成A gCl 溶胶,在外电场作用下胶粒将 ( )a. 静止不动b. 向负极移动c. 向正极移动d. 作自由热运动9.一定温度下,液体A 和B 饱和蒸气压的关系为*B *A 2p p =,已知A 和B 可形成理想溶液,则相同温度下当体系达气液平衡时,若A 在液相中的浓度50.0A =x 时, 则A 在气相中的浓度A y 为 ( )a. 1b. 0.33c. 0.67d. 0.5010.相同质量的A 与B 形成理想溶液,已知某温度下*B *A p p >,则体系在该温度下加压时 ( ) a. A y 增大,A x 增大 b. B y 增大,B x 增大 c. A y 增大,A x 减小 d. B y 增大,B x 减小11.对纯水进行恒温加压,则其化学势将 ( )a. 增大b. 减小c. 不变d. 变化方向不能确定12.某化学反应A 2A 2→的1m r molkJ 5.400)K 300(-⋅=∆ϑH ,1m r molkJ 5.305)K 400(-⋅=∆ϑH , 则有 ( )a. )A ()A (22m ,m ,p p C C >b. )A ()A (22m ,m ,p p C C <c. )A ()A (22m ,m ,p p C C =d. )A ()(A 2m ,m ,p p C C >13.第二类永动机的热机效率 ( ) a. 等于∞ b. 等于0 c. 小于0 d. 等于114.造成液体过热的主要原因是 ( )a. 气泡内压力下降b. 小气泡受曲界面压力差∆pc. 液柱静压力使气泡难以形成d. 过热时热力学上更稳定一些 15.下列各分散体系中丁铎尔(Tyndall )效应最强的是 ( )a. 食盐水溶液b. 大分子溶液c. 空气d. SiO 2溶胶16.电化学装置中常用饱和KCl 溶液做盐桥是因为 ( )a. KCl 不易和其它物质反应b. 受温度影响较小c. K +和Cl -离子运动速度相近d. KCl 是强电解质17.硬脂酸钠加入水中后,溶液表面将发生 ( )a. 正吸附b. 负吸附c. 不变化d. 不能确定18.真实气体化学反应的哪种平衡常数只与温度有关: ( )a. ϑp Kb. ϑc Kc. y Kd. ϑf K19.对于反应A →产物,如果A 的起始浓度减少一半,反应的半衰期缩短一半,则该反应的反应级数为 ( ) a. 1 b. 0 c. 2 d. 3 20.催化剂可以改变化学反应的 ( ) a. H ∆ b. G ∆ c. a E d. ϑK二、简答题(每题5分,共20分)21.简述什么是链反应及其一般特征,直链反应速率方程的建立一般采用什么近似方法? 22.试将反应 2HCl(m)2Ag(s)2AgCl(s))(H 2+=+ϑp 设计成原电池,说明需测定什么数据,怎样用所测数据计算该反应的平衡常数?23.兰谬尔(Langmuir)吸附等温式的基本假设是什么?写出该等温式并指出式中各项的物理意义。
24.A 与B 构成的溶液对拉乌尔定律产生最大正偏差,已知一定温度下*B *A p p >,试画出其T x y --相图的示意图,若想通过精馏得到纯A 组分,对溶液组成有什么要求?三、计算题(共44分)25.1mol 液态水在373K 、101325Pa 下向真空膨胀,成为相同温度压力下的水蒸气,试求该过程体系的∆S 、∆F 及∆G ,并应用合适的判据判断该过程的方向。
已知水的蒸发焓为1m vap molkJ 6.40-⋅=∆H 。
(12分) 26.反应P 2B A →+的速率方程为B A A d d c kc tc =-,25︒C 时1134smoldm 102---⋅⋅⨯=k 。
若将过量的反应物A 与B 的挥发性固体装入5dm 3的密闭容器中,并知道25︒C 时A 与B 的饱和蒸气压分别为10.133kPa 和2.072kPa ,试求:①A 与B 在气相的浓度c A 、c B ;②25︒C 下反应掉0.5molA 时所需要的时间t =? (12分)27.葡萄糖(不挥发)溶于水形成稀溶液,其凝固点为 -4︒C ,求此溶液在25︒C 时的蒸气压。
已知25︒C 纯水的饱和蒸气压为 3.167kPa ,水的凝固点降低常数kg molK 86.11f ⋅⋅=-K 。
(8分)28.298K 时,有一含Zn 2+和Cd 2+的浓度均为0.1mol·kg -1的中性溶液,用电解沉积法把它们分离,问:(1)哪种金属首先在阴极析出?用铂作阴极,2H 在铂上的超电势为0.6V ,在Cd 上的超电势为0.8V ,金属的超电势均为零,且不考虑析出金属引起的氢离子浓度的变化。
(2)第二种金属析出时,前一种金属剩下的浓度为多少? 已知,V 7630.0/Zn Zn 2-=+ϑϕ,V 4028.0/Cd Cd 2-=+ϑϕ设活度系数均为1。
(12分)四、综合题(6分)29.某气体的状态方程为nRT V p =+)(β ,其中β为常数项。
①试证明β=⎪⎭⎫⎝⎛∂∂TV U ; ② 求1dm 3、1mol 该气体经过恒温膨胀过程体积增加一倍时体系的∆U 、∆H 。
参考答案一.选择题1.c;2.b;3.d;4.c;5.c;6.a7.c;8.c;9.c; 10.a; 11.a; 12.b; 13.d; 14.b; 15.d; 16.c; 17.a; 18.d; 19.b; 20.c二. 简答题21.链反应:由大量的反复循环的连续反应(也包含一些对行和平行反应)组成的反应。
一般特征:链引发、传递、终止建立其速率方程常用的近似方法:稳态近似法、速控步近似法。
22. Ag(s)AgCl(s)|)HCl(|)(H Pt,2+b p ϑ)2HCl(2Ag(s)2AgCl(s))(H 2b p +=+ϑ±--=-=γF RT bb FRT E a F RT E E ln 2ln2ln 22HCl ϑϑϑb A FRT EγFRT E bb FRT E 303.22ln 2ln2+=-=+±ϑϑϑ令 ϑbb FRT E y ln2+= 则b c E y +=ϑ给出b ,测出E ,可求知y 。
做出y ~~b 图,外推至b →0,求出ϑE 。
yϑEbN则 αm r ln K K RT F zE G a −−→−-=-=∆求出ϑϑ。
23. Langmuir 吸附基本假定:(1)固体表面是均匀的;(2)被吸附分子间无相互作用力;(3)吸附是单分子层的;(4)吸附是动态平衡。
吸附等温式: apap +=1θ式中:θ——覆盖率;a ——吸附平衡常数;p ——吸附平衡压力。
24.T A *T B *Tz B pA Be欲得纯A 组分:总组成 B z z <。
三. 计算题25. 解: Pa101325,K 373O(l)mol.H12−−−→−=....0...外p 5P a373K ,10132O (g )1m o l.H 2定温定压可逆相变 (1分) 设计如上可逆过程,则113mvap K J 8.108K J 373106.401--⋅=⋅⎪⎪⎭⎫⎝⎛⨯⨯=∆=∆TH n S (2分) 0=∆-∆=∆S T H G (2分)S T pV H S T U F ∆-∆-∆=∆-∆=∆)(0J 3101J )373314.81(22<-=⨯⨯-=-=-≈nRT V p (2分)TpV H TU TQ TQ S )(∆-∆-=∆-=-==∆体外外13K J 373373314.81106.40-⋅⎥⎦⎤⎢⎣⎡⨯⨯-⨯-=-∆-=TnRTH 1K J 5.100-⋅-= (3分)0KJ 3.81iso >⋅=∆+∆=∆-外S S S 过程自发进行。
(2分)26.解: B A A d d c kc tc =-(1分) (1) 333AA0dm mol 1009.4m mol 298314.810133---*⋅⨯=⋅⎪⎭⎫ ⎝⎛⨯==RT p c333BB0dm mol 10836.0m mol 298314.82072---*⋅⨯=⋅⎪⎭⎫ ⎝⎛⨯==RT p c (2分)∵ A 、B 过量∴ 反应中A 、B 的浓度不改变 ∴ 33A0A dmmol 1009.4--⋅⨯==c c33B0B dmmol 10836.0--⋅⨯==c c (2分)(2) []13334B A A sdmmol 10836.01009.4102d d -----⋅⋅⨯⨯⨯⨯⨯==-c kc tc1310s dm mol 1084.6---⋅⋅⨯= (3分) 若反应掉A 的量:33A dmmol .1.0dm5mol 5.0-⋅==∆c (1分)则所需时间为: s e c 1046.1sec 1084.61.0810⨯=⎪⎭⎫⎝⎛⨯=∆-t (3分) 27.解: K 4f f f =-=∆*T T T (1分)B 1B f b kg molK .86.1⋅⋅⋅==-b k (2分)解之: 1B kg mol 15.2-⋅=b 963.015.218/100018/1000OH2=+=x (2分)由于溶质不挥发,则: k P a 05.3kPa )963.0167.3(O H O H OH222=⨯==≈*x p p p (3分)28.解: (1) ++++ϕ=ϕϑ222Zn ZnZn ZnZnln 2a FRTV 1.0ln 965002298314.87630.0⎥⎦⎤⎢⎣⎡⨯⨯+-=V 7926.0-= (2分)++++ϕ=ϕϑ222cd cdcd cdcd ln 2a FRTV 1.0ln 965002298314.84028.0⎥⎦⎤⎢⎣⎡⨯⨯+-=V 4324.0-= (2分)22H H Pt,1/2HHln η-=ϕ++a FRTV 6.010ln 96500298314.87⎥⎦⎤⎢⎣⎡-⨯=-V 014.1-= (2分) ∴ Cd 2eCd2→+-+首先反应析出。