【配套K12】高三化学二轮复习 强化训练 专题五 电解质溶液(含解析)
- 格式:doc
- 大小:190.50 KB
- 文档页数:9

电解质溶液【考情分析】一、考纲要求1.了解电解质的概念。
了解强电解质和弱电解质的概念。
2.了解电解质在水溶液中的电离,以及电解质溶液的导电性。
3.了解弱电解质在水溶液中的电离平衡。
4.了解水的电离,离子积常数。
5.了解溶液pH的定义。
了解测定溶液pH的方法,能进行pH的简单计算。
6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
7.了解离子反应的概念、离子反应发生的条件。
了解常见离子的检验方法。
8.了解难溶电解质的溶解平衡及沉淀转化的本质。
二、命题趋向电解质溶液部分内容与旧大纲相比有一定的变化,删除了“了解非电解质的概念”,增加了“了解难溶电解质的沉淀溶解平衡及沉淀转化的本质”,降低了弱电解质电离平衡的要求层次,对pH、盐的水解的知识进行了具体的要求,将原化学计算中的“pH的简单计算”放在这部分的要求之中。
弱电解质的电离平衡、溶液的酸碱性和pH的计算、盐类的水解及其应用等知识是高考化学中的热点内容,常见的题型是选择题,也有填空题和简答题。
题目的考查点基于基础知识突出能力要求,并与其他部分知识(如化学平衡、物质结构、元素及其化合物、化学计算等)联系。
【知识归纳】(一)强弱电解质及其电离1.电解质、非电解质的概念电解质:在水溶液中或熔融状态时能够导电的化合物。
非电解质:在水溶液中和熔融状态都不能导电的化合物。
注意:①单质和混合物既不是电解质也不是非电解质;②CO2、NH3等溶于水得到的水溶液能导电,但它们不是电解质,因为导电的物质不是其本身;③难溶的盐(BaSO4等)虽然水溶液不能导电,但是在融化时能导电,也是电解质。
2.电解质的电离(1)强电解质如NaCl、HCl、NaOH等在水溶液中是完全电离的,在溶液中不存在电解质分子,溶液中的离子浓度可根据电解质浓度计算出来。
(2)弱电解质在水溶液中是少部分发生电离的。
如25℃时0.1mol/L的CH3COOH溶液中,CH3COOH的电离度只有1.32%,溶液中存在较大量的H2O和CH3COOH分子,少量的H+、CH3COO-和极少量的OH-离子。

然顿市安民阳光实验学校电解质溶液1、某溶液中含有NO3-、S2-、AlO2-、SO32-四种阴离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的NaOH 溶液,则溶液中物质的量基本不变的阴离子是A .NO3-B .S2-C .AlO2-D .SO32- 【答案】C2、下列有关溶液中微粒的物质的量浓度关系正确的是( )A .在0.1mol·L -1NaHCO 3溶液中:c (Na +)>c (HCO 3-)> c (CO 32-)> c (H 2CO 3) B .在0.1mol·L -1Na 2CO 3溶液中:c (OH -)= c (HCO 3-)+c (H 2CO 3-)+ c (H +) C .向0.2 mol·L -1NaHCO 3溶液中加入等体积0.1mol·L -1NaOH 溶液: c (CO 32-)> c (HCO 3-)> c (OH -)> c (H +)D .常温下,CH 3COONa 和CH 3COOH 混合溶液呈中性, c (Na +)=0.1mol·L -1: c (Na +)= c (CH 3COO -)> c (CH 3COOH )> c (H +)= c (OH -) 【答案】D3、向两份a mL b mol/L 的稀盐酸中分别加入xmL 的水和ymLbmol/LBa(OH)2溶液,此时两溶液的pH 恰好相等,则x 、y 的关系符合(式中a 、b 均大于零,设两溶液混合时的体积有加和性)A. y=2ax+bB.y=ax/(2x+3a)C.a/2y-3a/2x=1D. x=2ay/(a+y) 【答案】BC4、下列图示与对应的叙述相符的是( )A .图1表示KNO 3的溶解度曲线,图中a 点所示的溶液是80℃时KNO 3的过饱和溶液B .图2表示某吸热反应分别在有、无催化剂的情况卞反应过程中的能量变化C .图3表示0.1 000mol ·L -1NaOH 溶液滴定20.00mL0.1 000mol ·L -1醋酸溶液得到滴定曲线 D .图4表示向NH 4Al (SO 4)2溶液中逐滴滴入Ba (OH )2溶液,随着Ba (OH )2溶液体积V 的变化,沉淀总物质的量n 的变化 【答案】D【解析】A 、KNO 3的溶解度随着温度的升高而升高,溶解度曲线上的点是饱和溶液,曲线以下的a 点是不饱和溶液,故A 错误;B 、反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,故B 错误;C 、强碱氢氧化钠滴定弱酸醋酸溶液时,恰好完全反应时,所得溶液为醋酸钠溶液显示碱性,pH 大于7,而不是等于7,故C 错误;D 、开始滴加同时发生反应为SO 42-+Ba 2+=BaSO 4↓,Al 3++3OH -=Al (OH )3↓,当Al 3+沉淀完全时需加入0.03molOH -,即加入0.015molBa (OH )2,加入的Ba2+为0.015mol ,SO 42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a )再滴加Ba (OH )2,生成BaSO 4沉淀,发生反应为SO 42-+Ba 2+=BaSO 4↓,NH 4++OH -=NH 3?H 2O ,所以沉淀质量继续增加;当SO 42-完全沉淀时,共需加入0.02molBa (OH )2,加入0.04molOH -,Al 3+反应掉0.03molOH -,生成Al (OH )30.01mol ,剩余0.01molOH -恰好与NH 4+完全反应,此时溶液中NH 4+完全反应,此时溶液为氨水溶液;(a 到b )继续滴加Ba (OH )2,Al (OH )3溶解,发生反应Al (OH )3+OH -=AlO 2-+2H 2O ,由方程式可知要使0.01molAl (OH )3完全溶解,需再加入0.005molBa (OH )2,此时溶液为氨水与偏铝酸钡溶液,(b到c),故D正确.故选D.5、下列有关电解质溶液的推理中正确的是()A.室温下,pH=4的醋酸和pH=10的氢氧化钠溶液等体积混合,其pH> 7 B.pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+)C.物质的量浓度相等的NH4Cl溶液和NH4HSO4溶液中,NH4+浓度相等D.在有AgI沉淀的上清液中滴加NaCl溶液,可以观察到白色沉淀产生【答案】B6、在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图6。
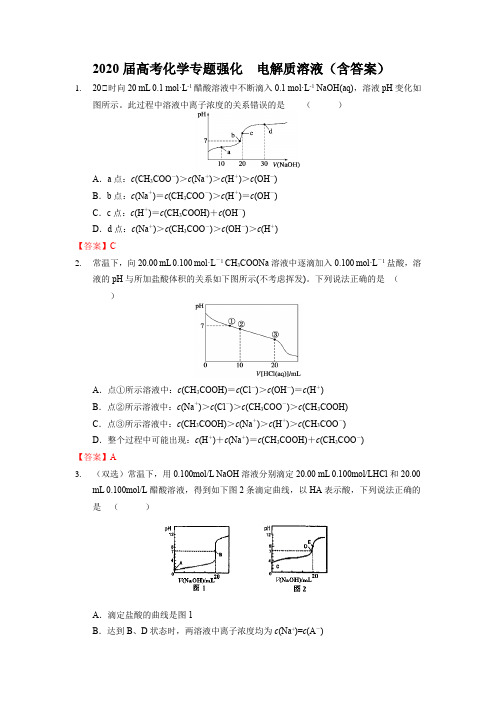
2020届高考化学专题强化电解质溶液(含答案)1.20℃时向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH(aq),溶液pH变化如图所示。
此过程中溶液中离子浓度的关系错误的是()A.a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)B.b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)C.c点:c(H+)=c(CH3COOH)+c(OH-)D.d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)【答案】C2.常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。
下列说法正确的是()A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+)B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-)D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-)【答案】A3.(双选)常温下,用0.100mol/L NaOH溶液分别滴定20.00 mL 0.100mol/LHCl和20.00mL 0.100mol/L醋酸溶液,得到如下图2条滴定曲线,以HA表示酸,下列说法正确的是()A.滴定盐酸的曲线是图1B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)C .达到B 、E 状态时,反应消耗的n(CH 3COOH)>n(HCl)D .当0 mL < V (NaOH) < 20.00mL 时,对应混合溶液中各离子浓度由大到小的顺序均为:c (A -)>c (Na +)>c (H +)>c (OH -)【答案】AB4. 常温下,向20 mL 0.1 mol/L 酒石酸(用H 2T 表示)溶液中逐滴滴加等物质的量浓度的NaOH 溶液。


第九讲 电解质溶液[最新考纲]1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.了解水的电离、离子积常数。
4.了解溶液pH 的含义及其测定方法,能进行pH 的简单计算。
5.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。
6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。
7.了解难溶电解质的沉淀溶解平衡。
理解溶度积(K sp )的含义,能进行相关的计算。
水的电离、溶液的酸碱性及pH [学生用书P47]1.(2017·高考全国卷Ⅰ,13,6分)常温下将NaOH 溶液滴加到己二酸(H 2X)溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是( )A. K a2(H 2X )的数量级为10-6B.曲线N 表示pH 与lg Ac (HX -)c (H 2X )的变化关系C .NaHX 溶液中c (H +)>c (OH -)D .当混合溶液呈中性时,c (Na +)>c (HX -)>c (X 2-)>c (OH -)=c (H +) 解析:选D 。
H 2X 的电离方程式为H 2XH ++HX -,HX-H ++X 2-。
当c (HX -)c (H 2X )=c (X 2-)c (HX -)=1时,即横坐标为0.0时,K a1=c (H +),K a2=c ′(H +),因为K a1>K a2,故c (H +)>c ′(H +),即pH<pH′,结合图像知,曲线N 代表第一步电离,曲线M 代表第二步电离。
K a2≈10-5.4,A 项正确;由上述分析知,B 项正确;选择曲线M 分析,当NaHX 、Na 2X 浓度相等时,溶液pH 约为5.4,溶液呈酸性,所以,NaHX 溶液中c (H +)>c (OH -),C 项正确;电荷守恒式为c (Na +)+c (H +)=c (OH -)+c (HX -)+2c (X 2-),中性溶液中存在c (H +)=c (OH -),故有c (Na+)=c(HX-)+2c(X2-),假设c(HX-)=c(X2-)或c(HX-)>c(X2-)(见C项分析),则溶液一定呈酸性,故中性溶液中c(HX-)<c(X2-),D项错误。

高中化学《电解质溶液》训练题 (2)一、单选题(本大题共34小题,共34.0分)1.下列说法正确的是()①稀豆浆、硅酸、氧化铁溶液都属于胶体②纯碱、氨水、蔗糖分别属于强电解质、弱电解质和非电解质③明矾、冰水混合物、四氧化三铁都不是混合物④Na2O、MgO、Al2O3均属于碱性氧化物⑤葡萄糖、油脂都不属于有机高分子⑥电解熔融的AlCl3可制得金属铝A. ①②B. ②④C. ③⑤D. ④⑥2.下列说法正确的是()A. 只有难溶电解质才存在沉淀溶解平衡B. 溶度积K sp与温度有关,温度越高,溶度积越大C. 难溶电解质的溶度积K sp越小,则它的溶解度越小D. 已知K sp(ZnS)>K sp(CuS),则ZnS沉淀在一定条件下可以转化为CuS 沉淀3.为证明某可溶性一元酸(HX)是弱酸.有如下实验方案,其中不合理的是()A. 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸B. 室温下,测1mol/L NaX溶液的pH,若pH>7,证明HX是弱酸C. 室温下,测0.1mol/L HX溶液的pH,若pH>1,证明HX是弱酸D. 相同条件下,对0.1mol/L的HCl和0.1mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸4.能证明苯酚具有弱酸性的方法是()①苯酚溶液加热变澄清②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水.③苯酚可与FeCl3反应④在苯酚溶液中加入浓溴水产生白色沉淀⑤苯酚不能使石蕊溶液变红色⑥苯酚能与Na2CO3溶液反应生成NaHCO3A. ⑤⑥B. ①②⑤C. ③④⑥D. ③④⑤5.下列物质分类正确的是()A. 胶体:分散质颗粒直径1−100mm的分散系B. 弱电解质:HClO、NH3⋅H2O、AgCl、NH4NO3C. 混合物:空气、盐酸、王水、氯水、水玻璃D. 有机物:丙醇、丙酸、1,2−二溴戊烷、碳酸钠6.下列图象不正确的是()A. 向100mL 0.1mol⋅L−1H2SO4溶液中滴加0.1mol⋅L−1Ba(OH)2溶液至过量B. 向100mL 0.1mol⋅L−1H2SO4溶液中加入NaOH固体C. 向一定浓度的氯化钠溶液中加水D. 向蒸馏水中通入HCl气体7.下列溶液中各微粒的浓度关系不正确的是()A. pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH−)+c(A−)B. 1L0.1mol⋅L−1(NH4)2Fe(SO4)2的溶液中:c(SO 42−)>c(NH 4+)>c(Fe2+)>c(H+)>c(OH−)C. 0.1mol⋅L−1NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO 32−)+c(OH−)D. 0.1mol⋅L−1的NaHA溶液,其pH=4:c(HA−)>c(H+)>c(H2A)>c(A2−)8.下列说法中正确的是()A. 常温下,pH均等于2的硫酸溶液与醋酸溶液,两种溶液中c(SO42−)与c(CH3COO−)之比为1:2B. 常温下,向pH=1.0的醋酸溶液中加入水稀释后,溶液中c(H+)和c(OH−)都将变小C. 常温下,0.1mol⋅L−1 NaHA溶液的pH=4,溶液中:c(HA−)>c(H+)>c(H2A)>c(A2−)D. 0.1mol⋅L−1的(NH4)2Fe(SO4)2溶液中:c(NH4+)=c(SO42−)>c(Fe2+)>c(H+)9.下列有关电解质溶液的说法正确的是()A. 向0.1mol⋅L−1CH3COOH溶液中加入少量水,溶液中c(H+)减小c(CH3COOH)B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO−)增大c(CH3COOH)⋅c(OH−)>1C. 向盐酸中加入氨水至中性,溶液中c(NH4+)c(Cl−)D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl−)不变c(Br−)10.下列图示与对应的叙述相符的是()A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化B. 图Ⅱ表示常温下,0.1000mol·L−1NaOH溶液滴定20.00mL0.1000mol·L−1CH3COOH溶液所得到的滴定曲线C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<cD. 图Ⅳ表示反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)△H<0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c 11.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是()酸电离平衡常数醋酸K=1.75×10−5次氯酸K=2.98×10−8K1=4.30×10−7碳酸K2=5.61×10−11K1=1.54×10−2亚硫酸K2=1.02×10−7A. 将0.1mol/L的醋酸加水不断稀释,c(CH3COO−)始终减小B. 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO−=CO32−+2HClOC. 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO−=CaSO3↓+2HClOD. 25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是NaClO12.常温下,H3PO4与 NaOH 溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与 pH 的关系如图所示[已知Ca3(PO4)2难溶于水].下列说法不正确的是()A. pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(PO43−)>c(HPO42−)>c(H+)B. Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性C. H3PO4的K a3=10−12.2,HPO42−的水解平衡常数为10−7.2D. 为获得尽可能纯的NaH2PO4,pH 应控制在4~5.5左右13.常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4−、C2O42−三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。
高考化学二轮复习 电解质溶液(配2013高考真题分类详解)1.(2013·高考新课标全国卷Ⅰ)已知K sp (AgCl)=1.56×10-10,K sp (AgBr)=7.7×10-13,K sp (Ag 2CrO 4)=9.0×10-12。
某溶液中含有Cl -、Br -和CrO 2-4,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L -1的AgNO 3溶液时,三种阴离子产生沉淀的先后顺序为( )A .Cl -、Br -、CrO 2-4B .CrO 2-4、Br -、Cl -C .Br -、Cl -、CrO 2-4D .Br -、CrO 2-4、Cl -解析:选C 。
利用沉淀溶解平衡原理,当Q c >K sp 时,有沉淀析出。
溶液中Cl -、Br -、CrO 2-4的浓度均为0.010 mol·L -1,向该溶液中逐滴加入0.010 mol·L -1的AgNO 3溶液时,溶解度小的先满足Q c >K sp ,有沉淀析出。
比较K sp ,AgBr 、AgCl 同类型,溶解度:AgBr<AgCl 。
比较AgCl 、Ag 2CrO 4的溶解度:从数量级看,AgCl 中c (Ag +)=K sp AgCl= 1.56×10-10,Ag 2CrO 4中,Ag 2CrO 4(s)2Ag ++CrO 2-4,设c (CrO 2-4)=x ,则K sp (Ag 2CrO 4)=c 2(Ag +)·c (CrO 2-4)=(2x )2·x =4x 3,则x =3K sp Ag 2CrO 44=39.0×10-124。
故Ag 2CrO 4中c (Ag +)=2x =2 39.0×10-124> 1.56×10-10,故溶解度顺序为AgBr<AgCl<Ag 2CrO 4,推知三种阴离子产生沉淀的先后顺序为Br -、Cl -、CrO 2-4。
2020届高考化学人教版第二轮专题复习选择题强化训练电解质溶液1、下列说法不正确的是( )A.常温下,在0.1 mol·L-1的HNO3溶液中,由水电离出的c(H+)<KwB.浓度为0.1 mol·L-1的NaHCO3溶液:c(H2CO3)>c(CO2-3)C.25 ℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同D.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小答案:D解析:在0.1 mol·L-1的HNO3溶液中,由水电离出的c(H+)为10-13mol·L-1<KA正确;浓度为0.1 mol·L-1的NaHCO3溶液中HCO-3 w,的水解程度大于其电离程度,c(H2CO3)>c(CO2-3),B正确;温度不变,AgCl的溶度积不变,C正确;冰醋酸中逐滴加水,溶液的导电性先增大后减小;醋酸的电离程度增大,溶液的pH先减小后增大,D错误。
2、常温下,向20 mL 0.1 mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示。
则下列说法正确的是( )A.b、d两点为恰好完全反应点B.c点溶液中c(NH+4)=c(Cl-)C.a、b之间的任意一点:c(Cl-)>c(NH+4),c(H+)>c(OH-) D.常温下,0.1 mol/L氨水的电离常数K约为1×10-5答案:D解析:b、d点溶液中c水(H+)=10-7 mol/L,常温下c水(H+)·c水(OH-)=K w=10-14,所以溶液呈中性,如果氨水和盐酸恰好完全反应生成氯化铵,氯化铵为强酸弱碱盐,其溶液呈酸性,故A错误;根据图知,c点c水(H+)最大,为恰好完全反应点,生成NH4Cl,因NH+4水解,所以c(NH+4)<c(Cl-),故B错误;a、b之间的任意一点,溶液都呈碱性,即c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH+4),故C错误;常温下,0.1 mol/L的氨水溶液中c水(H+)=10-11mol/L,则c(OH-)=10-1410-11mol/L=0.001 mol/L,K=c(NH+4)·c(OH-)c(NH3·H2O)=10-3×10-30.1=1×10-5,故D正确。
答案:A2.室温时,M(OH)2(s)M2+(aq)+2OH-(aq)K sp=a,c(M2+)=b mol·L-1时,溶液的pH等于()1b1a应:Na2CO3+H2SO4===Na2SO4+CO2↑+H2O,反应后溶质为Na2SO4,根据物料守恒反应结束后c(Na+)=2c(SO2-4);B项正确。
向溶液中加入0.05 mol CaO,则CaO+H2O=Ca(OH)2,则c(OH-)增大,且Ca2++CO2-3=CaCO3↓,使CO2-3+H2O HCO-3+OH-平衡向左移,c(HCO-3)减小,故c(OH-)c(HCO-3)增大;C项错误。
加水稀释有利于水解,CO2-3+H2O HCO-3+OH-水解平衡向右移动,水电离出的n(H+),n(OH-)均增大,但稀释后c(H+),c(OH -)均降低。
D项错误。
加入0.1 mol NaHSO4固体,NaHSO4===Na ++H++SO2-4,CO2-3+2H+===CO2↑+H2O,则反应后溶液为Na2SO4溶液,溶液呈中性,故溶液的pH减小,但引入了Na+,故c(Na+)增大。
答案:BB.0.1 mol·L-1的NaHCO3溶液中:c(OH-)+2c(CO2-3)=c(H +)+c(H2CO3)C.25℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO2-4)>c(NH+4)>c(OH-)=c(H+)D.25℃时,将pH均为3的醋酸溶液和盐酸分别加水稀释到pH均为5,则由水电离出的H+的浓度均减小为原来的100倍答案:C8.25℃时,在10 mL浓度均为0.1 mol·L-1的NaOH和NH3·H2O混合溶液中滴加0.1 mol·L-1盐酸,下列有关溶液中粒子浓度关系正确的是()A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)B.加入10 mL盐酸时:c(NH+4)+c(H+)=c(OH-)C.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)D.加入20 mL盐酸时:c(Cl-)=c(NH+4)+c(Na+)解析:A项,NH3·H2O是弱电解质,能微弱电离,溶液中c(Na +)>c(NH3·H2O)。
2017年高考化学题型揭秘(第01期)专题05 电解质溶液(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017年高考化学题型揭秘(第01期)专题05 电解质溶液(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017年高考化学题型揭秘(第01期)专题05 电解质溶液(含解析)的全部内容。
专题05 电解质溶液(第01期)1.已知:下表为25℃时某些弱酸的电离平衡常数.CH3COOH HClO H2CO3K a=1。
8×10-5K a=3.0×10-8K a1=4。
4×10-7 K a2=4。
7×10-11下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。
下列说法正确的是()A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)〉 c (ClO-)〉 c(CH3COO-)〉 c(OH-)〉 c(H+)B.向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-C.图像中a、c两点处的溶液中相等(HR代表CH3COOH或HClO)D.图像中a点酸的总浓度大于b点酸的总浓度【答案】C误;答案选C.【点睛】本题考查离子浓度大小比较、弱电解质在溶液中的电离平衡等知识,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键,注意掌握判断离子浓度大小常用方法。
2.室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。
下列说法正确的是()A.稀释前,c(A)= 10 c(B)B.稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/LC.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等D.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7【答案】C3.25℃,下列有关溶液中各微粒的物质的量浓度关系正确的是A.0.lmol/L的NH4Cl溶液:c(Cl—)>c(NH4+)>c(OH-)〉c(H+)B.0。
电解质溶液1、某溶液中含有NO3-、S2-、AlO2-、SO32-四种阴离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的NaOH溶液,则溶液中物质的量基本不变的阴离子是A.NO3- B.S2- C.AlO2- D.SO32- 【答案】C2、下列有关溶液中微粒的物质的量浓度关系正确的是()A.在0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)> c(CO32-)> c(H2CO3)B.在0.1mol·L-1Na2CO3溶液中:c(OH-)= c(HCO3-)+c(H2CO3-)+ c(H+)C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)> c(H+)D.常温下,CH3COONa和CH3COOH混合溶液呈中性, c(Na+)=0.1mol·L-1:c(Na+)= c(CH3COO-)> c(CH3COOH)> c(H+)= c(OH-)【答案】D3、向两份a mL b mol/L的稀盐酸中分别加入xmL的水和ymLbmol/LBa(OH)2溶液,此时两溶液的pH恰好相等,则x、y的关系符合(式中a、b均大于零,设两溶液混合时的体积有加和性)A. y=2ax+bB.y=ax/(2x+3a)C.a/2y-3a/2x=1D. x=2ay/(a+y)【答案】BC4、下列图示与对应的叙述相符的是()A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的过饱和溶液B.图2表示某吸热反应分别在有、无催化剂的情况卞反应过程中的能量变化C.图3表示0.1 000mol·L-1NaOH溶液滴定20.00mL0.1 000mol·L-1醋酸溶液得到滴定曲线D.图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化【答案】D【解析】A、KNO3的溶解度随着温度的升高而升高,溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,故A错误;B、反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,故B错误;C、强碱氢氧化钠滴定弱酸醋酸溶液时,恰好完全反应时,所得溶液为醋酸钠溶液显示碱性,pH大于7,而不是等于7,故C错误;D、开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al (OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)再滴加Ba(OH)2,生成BaSO 4沉淀,发生反应为SO 42-+Ba 2+=BaSO 4↓,NH 4++OH -=NH 3?H 2O ,所以沉淀质量继续增加;当SO 42-完全沉淀时,共需加入0.02molBa (OH )2,加入0.04molOH -,Al 3+反应掉0.03molOH -,生成Al (OH )30.01mol ,剩余0.01molOH -恰好与NH 4+完全反应,此时溶液中NH 4+完全反应,此时溶液为氨水溶液;(a 到b )继续滴加Ba (OH )2,Al (OH )3溶解,发生反应Al (OH )3+OH -=AlO 2-+2H 2O ,由方程式可知要使0.01molAl (OH )3完全溶解,需再加入0.005molBa (OH )2,此时溶液为氨水与偏铝酸钡溶液,(b 到c ),故D 正确.故选D . 5、下列有关电解质溶液的推理中正确的是( )A .室温下,pH =4的醋酸和pH =10的氢氧化钠溶液等体积混合,其pH> 7B .pH =3的盐酸与pH =11的氨水等体积混合后,溶液中:c (NH4+)>c (Cl-)>c (OH-)>c (H+)C .物质的量浓度相等的NH4Cl 溶液和NH4HSO4溶液中,NH4+浓度相等D .在有AgI 沉淀的上清液中滴加NaCl 溶液,可以观察到白色沉淀产生【答案】B6、在常温下,0.1000mol·L -1Na 2CO 3溶液25mL 用0.1000mol·L -1盐酸滴定,其滴定曲线如图6。
对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )A .a 点:c (CO 2-3)>c(HCO -3)>c(OH -)B .b 点:5c(Cl -)>4c(HCO -3)+4c(CO 2-3)C .c 点:c(OH -)=c(H +)+c(HCO -3)+2c(H 2CO 3)D .d 点:c(H +)=2c(CO 2-3)+c(HCO -3)+c(OH -)【答案】B7、下列说法正确的是( )A .某二元弱酸的酸式盐NaHA 溶液中:c (H +)+c (Na +)=c (OH -)+c (HA -)+c (A 2-)B .一定量的(NH 4)2SO 4溶液与NH 3·H 2O 混合所得的酸性溶液中:c (NH 4+)<2c (SO 42—)C .物质的量浓度均为0.01mol/L 的CH 3COOH 和CH 3COONa 的溶液等体积混合后所得溶液中:c (CH 3COOH)+c (CH 3COO -)=0.02mol/LD .物质的量浓度相等的①NH 4HSO 4溶液、②NH 4HCO 3溶液、③NH 4Cl 溶液中c (NH 4+)的大小关系:①>②>③【答案】B【解析】B 选项的电荷守恒表达式为c (NH 4+)+c (H +)=c (OH -)+2c (SO 42—),由于溶液呈酸性,即c (H +)>c (OH -),则c (NH 4+)<2c (SO 42—),故B 正确。
C 选项应为c (CH 3COO -)+c (CH 3COOH)=0.01mol/L 。
D 选项中,由于NH 4+与HCO 3—的水解互相促进,所以②中c (NH 4+)最小,故D 错误。
8、下列相关反应的离子方程式书写正确的是( )A.4molFe 在5molCl2中点燃反应:5Cl2+4Fe=2FeCl2+2FeCl3B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2OD.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-【答案】B试题分析:A、铁在氯气中燃烧都生成氯化铁,不会生成氯化亚铁,与量无关,错误;B、铁离子与硫化氢发生氧化还原反应,生成亚铁离子和单质硫,正确;C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀时氢氧根离子与铝离子反应生成氢氧化铝沉淀,同时和铵根离子反应生成氨气,错误;D、NaHCO3溶液中加入过量的Ba(OH)2溶液时溶液中有氢氧根离子剩余,而所给离子方程式表示碳酸氢钠过量,错误,答案选B。
9、下列说法正确的是( )A.溶度积小的物质一定比溶度积大的物质溶解度小B.对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小C.难溶物质的溶度积与温度无关D.难溶物的溶解度仅与温度有关【答案】B【解析】溶度积与溶解度必然联系,但对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小。
某一难溶物质的溶度积仅与温度有关,难溶物的溶解度不仅与温度有关,还与酸碱度和其它离子的浓度有关。
10、用已知浓度的盐酸来测定某个Na2CO3溶液的浓度时,若配制Na2CO3溶液时所用Na2CO3中分别含有:①NaOH②NaCl ③NaHCO3④K2CO3杂质,则所测结果偏小的是( )A.仅① B.仅② C.仅②③ D.②③④【答案】D【解析】中和1 mol HCl需Na2CO3的质量为53 g,需NaCl、NaOH、NaHCO3、K2CO3的质量分别为0 g、40 g、84 g、69 g,可见Na2CO3中若混有NaOH会使所测结果偏大,混有NaCl、NaHCO3、K2CO3时所测结果偏小。
11、温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是()A.③①④②⑤B.①③⑤④②C.③②①⑤④D.⑤②④①③【答案】A【解析】首先根据盐类水解规律将其按酸碱性分组,呈酸性的是①③④,呈中性的是②,呈碱性的是⑤。
在呈酸性的①③④中,NH4HSO4中的HSO42—电离出H+,其溶液的酸性最强,其pH最小,(NH4)2SO4溶液中的NH4+浓度大于NH4NO3溶液中的NH4+浓度,其达到水解平衡时,(NH4)2SO4溶液中的H+浓度大于NH4NO3溶液中的H+浓度。
CH3COONa溶液呈碱性,pH最大,综上所述,其pH 由小到大的排列顺序是③①④②⑤。
12、已知几种难溶电解质的溶度积常数Ksp(25℃)见下表:下列叙述不.正确的是()A.Ksp的大小与三种卤化银见光分解的难易无关B.将等体积的4×10-3mol·L-1的AgNO3溶液和4×10-3mol·L-1K2CrO4溶液混合,有Ag2CrO4沉淀产生C.向AgCl的悬浊液中滴加饱和Nal溶液可以得到黄色AgI悬浊液D.向100 mL 0.1mol·L-1的Na2SO4溶液中加入1 mL 0.1 mol·L-1的AgNO3溶液,有白色沉淀生成【答案】D13、下列关于等体积、等pH的NaOH和氨溶液的说法正确的是( )A.两种溶液中OH—溶浓度相同B.需要等浓度、等体积的盐酸中和C.温度升高10℃,两溶液的pH仍相等D.两种溶液中溶质的物质的量浓度相同【答案】A14、下列有关电解质溶液中微粒的物质的量浓度关系正确的是A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO-3)>c(CO2-3)>c(H2CO3)B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO-3)+c(H2CO3)C. 向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO2-3)>c(HCO-3)>c(OH-)>c(H+)D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)【答案】D15、25℃时,有下列四种溶液:①0.1mol/L 的CH3COOH溶液;②pH=13的NaOH溶液;③0.05mol/L的 H2SO4溶液;④0.1mol/L 的Na2CO3溶液。