常见阳离子的分离、鉴定
- 格式:pdf
- 大小:117.57 KB
- 文档页数:6


常见阳离子的分离与鉴定二实验报告一、实验目的1、了解常见阳离子的溶解特性;2、熟悉常见阳离子的分离与鉴定的方法;3、巩固常见阳离子的溶解特性,以便于进行实验中的鉴别、分离及分析;二、实验原理阳离子是指带有正电荷的离子,如钠离子(Na+)、钾离子(K+)、氯离子(Cl-)、铵离子(NH4+)等。
阳离子有着不同的电荷,溶解度和溶质的类型不同,因此,可以根据不同的溶解特性将其分离、鉴定出来。
本实验利用沉淀反应、氯化物气体滴定以及媒质对组成离子的影响,结合实验室常见阳离子的特性,在模拟实验中进行阳离子的分离与鉴定。
三、实验材料1、2.0 mol/L的NaCl溶液、KCl溶液、NH4Cl溶液、(NH4)2SO4溶液;2、2.0mol/L溴代乙酸溶液;3、分光光度计;4、蒸馏水;5、吸管、放大器、烧杯及烧瓶等实验用具;四、实验步骤1、将2.0mol/L NaCl溶液、KCl溶液、NH4Cl溶液、(NH4)2SO4溶液分别放入4个烧杯中;2、将2.0mol/L溴代乙酸溶液分别加入到4个烧杯中,观察气体的产生及沉淀反应;3、将沉淀反应结束后的物质加入蒸馏水中,然后充分搅拌;4、用分光光度计测定各烧杯中溶液的溶氧量;5、根据溶氧量的结果,鉴定出阳离子的种类;六、实验结果1、烧杯1中,溶质沉淀出白色晶体,添加溴代乙酸溶液可产生白色气体,同时溶氧量为0.4mg/L,可判定该溶液为等比例混合溶液,溶质为NaCl;2、烧杯2中,溶质沉淀出暗黄色晶体,添加溴代乙酸溶液可产生黄色气体,同时溶氧量为0.5mg/L,可判定该溶液为等比例混合溶液,溶质为KCl;3、烧杯3中,溶质沉淀出淡粉色晶体,添加溴代乙酸溶液可产生白色气体,同时溶氧量为0.7mg/L,可判定该溶液为等比例混合溶液,溶质为NH4Cl;4、烧杯4中,溶质沉淀出白色晶体,添加溴代乙酸溶液可产生淡黄色气体,同时溶氧量为3.5mg/L,可判定该溶液为等比例混合溶液,溶质为(NH4)2SO4。


无机化学常见阳离子分离与鉴定Ag+鉴定方法取2 滴试液,加入2 滴2molL HCl, 若产生沉淀,离心分离,在沉淀中加人6molL-1NH3H2O 使沉淀溶解,再加入6molL-1 HNO3 酸化,白色沉淀重又出现,说明Ag+离子存在。
反应如下:Ag+ +Cl-→AaCl↓ AgCl + 2NH3H2O → [Ag(NH3)2]+ + Cl- + H2O [Ag(NH3)2]+ + Cl- + 2H+ → AgCl↓+ NH4+ + Cl-1备注Al +3+2取试液2 滴,再加入2 滴铝试剂,微热,有红色沉淀,示有Al+3反应可在HAc-NH4Aa 缓冲溶液中进行。
Sr2+对Ba2+的鉴定有干扰,但SrCrO4 与BaCrO4 不同的是,SrCrO4 在乙酸中可溶解。
所以应在乙酸存在下进行反应。
离子。
-1Ba在试液中加入0.2 molL K2CrO4 溶液,生成黄色的BaCrO4 沉淀,示有B a+2 离子存在。
可用K2Cr2O4 溶液代替K2CrO4 溶液。
Bi+3①SnO2 离子将Bi 离子还原,生成金属铋(黑色沉淀), 示有Bi3+离子存在:2 Bi(OH) 3 + SnO22- →2Bi↓+ 3SnO32- + H2O 取2 滴试液,加入2 滴0.2 molL-1 SnCl2 溶液和数滴2molL-1 NaOH 溶液,溶液为碱性。
观察有无黑色金属铋沉淀出现。
②BiCl3 溶液稀释,生成白色BiOCl 沉淀,示有Bi+3 存在:Bi+3 + H2O + Cl- → BiOCl↓+ 2H+2-3+Ca2+试液中加入饱和(NH4)2C2O4 溶液,如有白色的Ca2Cr2O4 沉淀生成,示有Ca2+离子存在。
沉淀不溶于乙酸。
Sr2+、Ba2+离子也与(NH4)2C2O4 生成同样的沉淀,但在乙酸中可溶解。
Cd2+①取 5 滴示液,加入0.5mL 丙酮,然后加入1molL-1 NH4SCN 溶液,溶液显蓝色,表示有Co2+离子存在。
实验八常见阳离子的分离与鉴定(一)
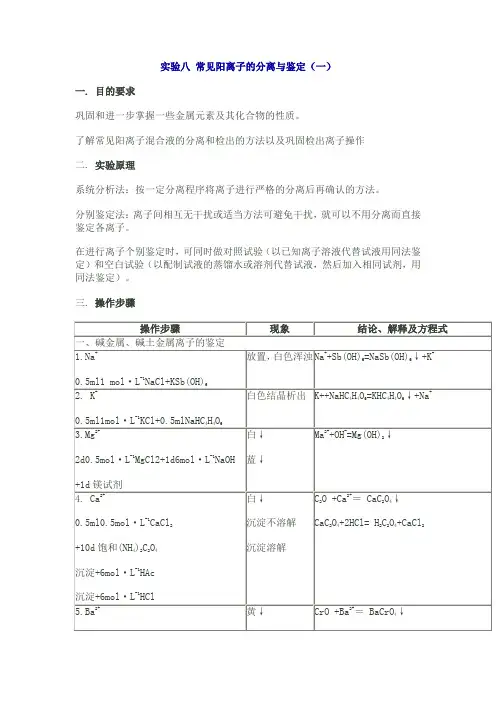
一. 目的要求
巩固和进一步掌握一些金属元素及其化合物的性质。
了解常见阳离子混合液的分离和检出的方法以及巩固检出离子操作
二. 实验原理
系统分析法:按一定分离程序将离子进行严格的分离后再确认的方法。
分别鉴定法:离子间相互无干扰或适当方法可避免干扰,就可以不用分离而直接鉴定各离子。
在进行离子个别鉴定时,可同时做对照试验(以已知离子溶液代替试液用同法鉴定)和空白试验(以配制试液的蒸馏水或溶剂代替试液,然后加入相同试剂,用同法鉴定)。
三. 操作步骤。




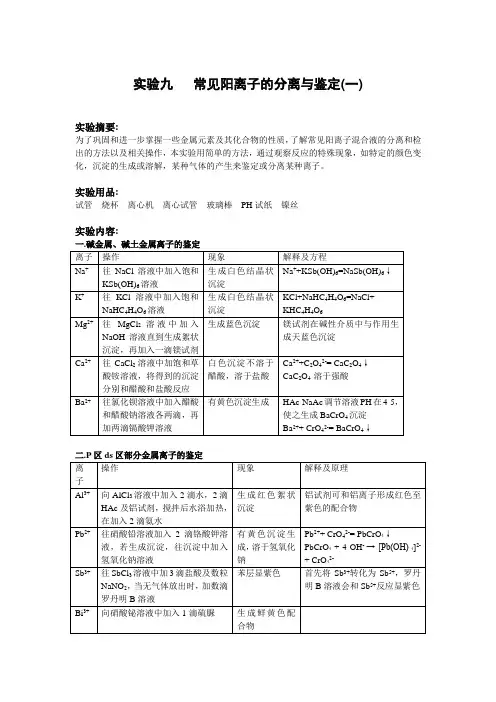
实验九常见阳离子的分离与鉴定(一)
实验摘要:
为了巩固和进一步掌握一些金属元素及其化合物的性质,了解常见阳离子混合液的分离和检出的方法以及相关操作,本实验用简单的方法,通过观察反应的特殊现象,如特定的颜色变化,沉淀的生成或溶解,某种气体的产生来鉴定或分离某种离子。
实验用品:
试管烧杯离心机离心试管玻璃棒PH试纸镍丝
实验内容:
一.碱金属、碱土金属离子的鉴定
三.部分混合离子的分离与鉴定
结果及讨论:
Ag+、Pb2+能和盐酸生成不同溶解性的沉淀;Ag+、Pb2+、Ba2+、Ca2+能和酸生成不同溶解性的硫酸盐沉淀;Al、Pb、Cu、Sb的氢氧化物具有两性,能溶于氢氧化钠;Cu2+、Ag+、Cd2+、Pb2+、Bi3+、Ca2+、Ba2+、Al3+能和碳酸铵生成沉淀;Ag+、Cu2+、Cd2+能和氨生成配合物;Ag+、Pb2+、Cu2+、Cd2+、Bi3+、Sb3+能和硫化氢或硫化铵生成各种颜色的硫化物沉淀。
参考文献:
[1] 北京师范大学等校编.《无机化学实验》[M](第三版),高等教育出版社,2004,167-172
[2] 周权. 《阳离子鉴定实验中异常现象的讨论》.《黄山学院学报》[J].2007(01)
[3]. 《微型无机化学实验》[M]. 科学出版社, 2000,。

实验27 常见阳离子的分离、鉴定一、实验目的1.了解常见阳离子的基本性质和重要反应。
2.掌握常见阳离子的分离原理及鉴定方法。
3.进一步练习分离、鉴定的基本操作。
二、实验原理离子的分离和鉴定是以各离子对试剂的不同反应为依据的,这种反应常伴随有特殊的现象,如沉淀的生成或溶解,特殊颜色的出现,气体的产生等等。
各离子对试剂作用的相似性和差异性都是构成离子分离与检出方法的基础,也就是说,离子的基本性质是进行分离鉴定的基础。
因而要想掌握阳离子的分离鉴定的方法,就要熟悉阳离子的基本性质。
离子的分离和鉴定只有在一定条件下才能进行。
所谓一定的条件主要指溶液的酸度、反应物的浓度、反应温度、促进或妨碍此反应的物质是否存在等。
为使反应向期望的方向进行,就必须选择适当的反应条件。
因此,除了要熟悉离子的有关性质外,还要学会运用离子平衡(酸碱、沉淀、氧化还原、配位等平衡)的规律控制反应条件,这对于我们进一步掌握离子分离条件和鉴定方法的选择将有很大帮助。
对于常见阳离子分离的性质是指常见阳离子与常用试剂的反应及其差异,重点在于应用这些差异性将离子分开。
常见阳离子与常用试剂的反应:1. 与HCl 溶液反应AgCl ↓ 白色,溶于氨水Hg 2Cl 2↓ 白色,溶于浓HNO 3及H 2SO 4 PbCl 2 ↓ 白色,溶于热水,NH 4A c 、NaOH Ba SrCa Ca 2+浓度很大时,才析出沉淀 Pb NaOH 、NH 4Ac(饱和)、热HCl 溶液、浓H 2SO 4,不溶于稀H 2SO 4 Ag3. 与NaOH 反应Al 2-或[Al(OH)4]-Zn ZnO 22-或[Zn(OH)4]2-Pb PbO 22-或[Pb(OH)4]2-Sb SbO 2-Sn 22-或[Sn(OH)4]2-Cu 2+ Cu(OH)42-4. 与NH 3反应Ag + [Ag(NH 3)2]+Cu 2+ 3)4]2+ (深蓝) Cd 2+ 3)4]2+浓NaOH △Zn[Zn(NH 3)4]2+Ni 2+3)4]2+ (蓝紫色)Co[Co(NH 3)6]4+ (土黄色) [Co(NH 3)6]3+(棕红色)5. 与(NH 4)2CO 3反应Cu Cu 2(OH)2CO 3 ↓ 浅蓝3)4]2+ 深蓝 Ag Ag 2CO 3 (Ag 2O)↓白色3)2]+ 无色 ZnZn 2(OH)2CO 3↓ 白色3)4]2+ 无色Cd Cd 2(OH)2CO 3↓ 白色[Cd(NH 3)4]2+ 无色 Hg Hg 2(OH) 2CO 3↓ 白色Hg 2 Hg 2CO 3(白)↓ → HgO ↓(黄) + Hg ↓(黑) +CO 2 ↑ Mg Mg 2(OH)2CO 3 ↓ 白色 Pb 2+Pb 2(OH)2CO 3 ↓ 白色 Bi (BiO)2CO 3 ↓ 白色 Ca 3 ↓ 白色 Sr SrCO 3 ↓ 白色 Ba 3 ↓ 白色 Al 3 ↓ 白色 Sn Sn(OH)2 ↓ 白色 Sn Sn(OH)4 ↓ 白色 Sb Sb(OH)3 ↓ 白色 6. 与H 2S 或(NH 4)2S 反应应当掌握各种阳离子生成硫化物沉淀的条件及其硫化物溶解度的差别,并用于阳离子分离。
【精品】无机化学常见阳离子分离与鉴定
无机化学中,阳离子分离与鉴定是非常重要的步骤, divide the steps into several parts on the basis of their functions,浏览以下:
- 预处理:预处理是分离各种有机和无机杂质和有效物质阳离子的第一步,可以使用加草酸、高氯酸、稀硫酸等剂量分离有机杂质和无机阳离子。
- 共析:用于分离有关的化合物的有机溶剂,在共析实验中,重要的是选择适当的溶剂,可以实现离子弱共析和离子强共析。
- 根据溶解度和萃取受体的选择:根据溶解度的不同,主要分为水溶和有机溶,而有机溶非水溶即萃取受体,常见萃取受体有醚、氯仿、氨和甲醇等。
- 重结晶和提取:溶剂提取技术非常重要,原料中的阳离子萃取到某种溶剂后,应收集溶解液,用新的溶剂萃取,以尽量的减少萃取回收的溶剂的数量。
- 结晶干燥:使用适当的溶剂对结晶结果进行结晶干燥。
在结晶过程中,有一些溶剂和添加剂被带出去,而结晶干燥可以有效地去除残留的溶剂。
- 多重梯度洗脱:多重梯度洗脱可以得到更纯的产品,常用的洗脱技术有多相洗脱、多极性洗脱、溶解度变洗脱、聚丙烯酰胺凝胶层析等。
- 鉴定技术:鉴定阳离子的技术常采用X波发射(EDX)、原子荧光光谱(AES)、原子质谱(MS)等技术,分析阳离子的精确性很重要,也可以利用热分析技术,如热重分析(TGA)、热分散光元仪(DSC)来确定其组成和特性。
以上是无机化学中阳离子分离与鉴定的步骤,然而,实际操作过程根据实际情况还可能需要中和、萃取、逆流色谱、粒子分离以及晶格弛豫技术等多项技术进行支持。
在操作分离与鉴定步骤时,需要掌握相关基础知识,并仔细审查操作过程,以确保工作效果。
无机化学常见阳离子分离与鉴定.doc一、分离1、氢氧根离子(OH^-)氢氧根离子与金属离子形成的沉淀可以通过NaOH沉淀法分离出来。
在水溶液中,氢氧根离子与金属离子结合形成相应的金属氢氧化物,这些氢氧化物可以形成沉淀,实现分离。
一些阳离子的氢氧化物沉淀的颜色也是它们鉴定的基础之一。
2、氟化物(F^-)氟化物结合度和其他类似的离子相比较小,因此可以和其他阴离子分离。
使用鸟巢法可以分离出氟化物,该方法使用的络合剂是季铵盐鸟巢环(NH4)3 [FeF6]。
3、碳酸盐(CO32-)在水中,CO32-可以形成与Ca2+、Ba2+、Pb2+、Ag+等阳离子结合的沉淀。
因此,通过观察生成的沉淀的颜色可以确定阳离子的存在。
氰化物形成的配合物稳定性很高,一些盐可以沉淀分离氰化物。
通过加入相应的酸可以分解盐的氰化物,若遇到硝酸银时,则可以生成白色的沉淀。
硫酸盐与Barium离子结合可以形成硫酸钡的沉淀。
可以用BaCl2试剂发生反应,观察生成的白色沉淀可以确认硫酸盐的存在。
氯化物可以通过加入AgNO3实现分离,生成白色的AgCl沉淀。
AgCl颜色淡黄色并且易溶于NH3溶液中。
二、鉴定1、铁离子(Fe3+)Fe3+可以通过与硝酸铵一起存在,在加热时生成棕黄色的Fe(OH)3沉淀。
此外,还可以借助Ti(III)还原Fe3+为Fe2+,并使用Fenton试剂检测Fe2+的产生。
2、铜离子(Cu2+)Cu2+可以通过和N,N-二乙基-1,6-二亚胺染料组成的溶液反应而呈现出深蓝色,且颜色随着浓度的增加而增加。
Zn2+可以通过向含有鞣酸的溶液中加入氢氧化钠而产生白色沉淀进行鉴定。
Mn2+可以通过加入氢氧化钠和汞齐试剂而鉴定。
试剂与汞齐反应,生成黑色沉淀,同时文中的Mn(OH)2也被沉淀。
Mg2+可以通过向可溶性的Phenolphthalein-indicator(溶于环己酮)溶液中添加MgCl2所生成的红色沉淀进行鉴定。
Al3+可通过加入含有增效剂的Eriochrome Black T试剂检测出来,试剂经络合反应后转变为紫红色,而Al3+呈现出浅紫色。
常见阳离子的分离与鉴定【实验目的】1. 巩固和进一步掌握一些金属元素及其化合物的化学性质。
2. 了解常见阳离子混合液的分离和检出的方法以及巩固检出离子的操作。
【预习作业】1. 查阅文献,找出镁试剂与铝试剂的结构式及鉴定镁离子、铝离子的方程式。
2. 以流程图方式表示,应包含试剂浓度,用量,分离手段,详细现象,最终结果。
对应的方程式在流程图上注上号码,另处写出化学反应方程式。
3. 试设计一分析流程图,分离和检出Ag+、Zn2+和Cu2+混合溶液。
【实验原理】离子的分离和鉴定是以各离子对试剂的不同反应为依据的。
这种反应常伴随着特殊的现象,如沉淀的生成或溶解,特殊颜色的出现,气体的产生等等。
各离子对试剂的作用的相似性和差异性都是构成离子分离与鉴定的基础。
也就是说,离子的基本性质是进行分离检出的基础。
因而要想掌握分离检出的方法就要熟悉离子的基本性质。
离子的分离和检出是在一定条件下进行。
所谓一定的条件主要是指溶液的酸度、反应物的浓度、反应温度、促进或妨碍反应的物质是否存在等。
为使反应向期望的方向进行,就必须选择适当的反应条件。
离子混合液中诸组分若对鉴定反应不产生干扰,便可以利用特效反应直接鉴定某种离子。
若共存的其他组分彼此干扰,就要选择适当方法消除干扰。
通常采用掩蔽剂消除干扰,通常采用遮掩剂消除干扰,这是一种比较简单、有效的方法。
但在很多情况下没有合适的遮掩剂,就需要将彼此干扰的组分分离。
沉淀分离是最经典的分离方法。
这种方法是向混合溶液中加入沉淀剂,利用形成的化合物溶解度的差异,使被分离组分与干扰组分分离。
常用的沉淀剂有HCl 、H2SO4、NaOH、NH3H2O、(NH4)2CO3及(NH4)2S。
由于元素周期表中的位置使相邻元素在化学性质上表现出相似性,因此一种沉淀剂往往可以使具有相似的元素同时产生沉淀。
这种沉淀剂称为产生沉淀的元素的组试剂。
组试剂将元素划分为不同的组,逐渐达到分离的目的(见图一)。
图一常见阳离子的分离及鉴定【仪器设备和试剂】仪器:试管、烧杯、离心机、离心试管、电热炉、点滴板、试管架液体药品:Ag+、Hg2+、Pb2+、Cu2+、Fe3+、Al3+、Ba2+混合溶液(七种离子均为硝酸盐,其浓度都为10 ng・mL-1)、HCl (2 mol ・L-1、6 mol ・L-1、浓)、H2SO4-1 -1 -1 -1 -1(2 mol - L、6 mol - L-1)、HNO3 (6 mol - L )、HAc (2 mol - L、6 mol - L-1)、-1 -1 -1 -1NaOH (2 mol - L、6 mol - L-1)、KOH (2 mol - L )、NH3 -出0 (6 mol - L )、-1 -1 -1 -1 NaCl (1 mol - L )、KCl (1 mol - L )、KI (1 mol - L )、MgCl2 (0.5 mol - L )、-1 -1 -1 -1 CaCl2(0.5 mol -L 1)、BaCb(0.5 mol •L1)> AlCl 3(0.5 mol -L1)、SnCb(0.5 mol • L )、-1 -1 -1Pb(NO3)2(O.5 mol - L )、HgCb(0.2 mol - L )、CuCb (0.5 mol - L )、CuSO4 (0.2-1 -1 -1 -1 mol - L )、AgNO3 (0.1 mol - L 1)、ZnSO4(O.2 mol - L 1)、Al(NO 3)3 (0.5 mol - L 1)>-1 -1 -1 -1 NaNO3 (0.5 mol - L )、Ba(NO3)2 (0.5 mol - L )、Na2S (0.5 mol - L、1 mol - L )、-1 -1 H2S (饱和)、KSb(OH)6 (饱和)、NaHC4H4O6 (饱和)、NaAc (0.2 mol -L-、1 mol -L-)、-1 -1K2CrO4 (1 mol • L-、2 mol - L-)、Na2CO3 (12%、饱和)、NH4CI (饱和)、NH4Ac (2 mol - L-1)、(NH4)2C2O4 (饱和)、K4 [Fe(CN)6] (0.25 mol - L-1、0.5 mol - L-1)、硫代乙酰胺(5%)、对氨基苯磺酸、镁试剂、0.1%铝试剂、罗丹明B、苯、2.5%硫脲、(NH4) 2[H g(SCN)4] 试剂固体药品:亚硝酸钠、亚硫酸钠、锌粉、碳酸钠材料:pH 试纸、玻璃棒、镍丝【实验步骤】一、碱金属和碱土金属离子的鉴定1. Na+的鉴定-1在盛有0.5 mL 1 mol •_ NaCI溶液的试管中,加入0.5 mL饱和六羟基锑(v)酸钾溶液,即有白色沉淀生成。
实验27 常见阳离子的分离、鉴定一、实验目的1.了解常见阳离子的基本性质和重要反应。
2.掌握常见阳离子的分离原理及鉴定方法。
3.进一步练习分离、鉴定的基本操作。
二、实验原理离子的分离和鉴定是以各离子对试剂的不同反应为依据的,这种反应常伴随有特殊的现象,如沉淀的生成或溶解,特殊颜色的出现,气体的产生等等。
各离子对试剂作用的相似性和差异性都是构成离子分离与检出方法的基础,也就是说,离子的基本性质是进行分离鉴定的基础。
因而要想掌握阳离子的分离鉴定的方法,就要熟悉阳离子的基本性质。
离子的分离和鉴定只有在一定条件下才能进行。
所谓一定的条件主要指溶液的酸度、反应物的浓度、反应温度、促进或妨碍此反应的物质是否存在等。
为使反应向期望的方向进行,就必须选择适当的反应条件。
因此,除了要熟悉离子的有关性质外,还要学会运用离子平衡(酸碱、沉淀、氧化还原、配位等平衡)的规律控制反应条件,这对于我们进一步掌握离子分离条件和鉴定方法的选择将有很大帮助。
对于常见阳离子分离的性质是指常见阳离子与常用试剂的反应及其差异,重点在于应用这些差异性将离子分开。
常见阳离子与常用试剂的反应:1. 与HCl 溶液反应AgCl ↓ 白色,溶于氨水Hg 2Cl 2↓ 白色,溶于浓HNO 3及H 2SO 4 PbCl 2 ↓ 白色,溶于热水,NH 4A c 、NaOH Ba SrCa Ca 2+浓度很大时,才析出沉淀 Pb NaOH 、NH 4Ac(饱和)、热HCl 溶液、浓H 2SO 4,不溶于稀H 2SO 4 Ag3. 与NaOH 反应Al 2-或[Al(OH)4]-Zn ZnO 22-或[Zn(OH)4]2-Pb PbO 22-或[Pb(OH)4]2-Sb SbO 2-Sn 22-或[Sn(OH)4]2-Cu 2+ Cu(OH)42-4. 与NH 3反应Ag + [Ag(NH 3)2]+Cu 2+ 3)4]2+ (深蓝) Cd 2+ 3)4]2+浓NaOH △Zn[Zn(NH 3)4]2+Ni 2+3)4]2+ (蓝紫色)Co[Co(NH 3)6]4+ (土黄色) [Co(NH 3)6]3+(棕红色)5. 与(NH 4)2CO 3反应Cu Cu 2(OH)2CO 3 ↓ 浅蓝3)4]2+ 深蓝 Ag Ag 2CO 3 (Ag 2O)↓白色3)2]+ 无色 ZnZn 2(OH)2CO 3↓ 白色3)4]2+ 无色Cd Cd 2(OH)2CO 3↓ 白色[Cd(NH 3)4]2+ 无色 Hg Hg 2(OH) 2CO 3↓ 白色Hg 2 Hg 2CO 3(白)↓ → HgO ↓(黄) + Hg ↓(黑) +CO 2 ↑ Mg Mg 2(OH)2CO 3 ↓ 白色 Pb 2+Pb 2(OH)2CO 3 ↓ 白色 Bi (BiO)2CO 3 ↓ 白色 Ca 3 ↓ 白色 Sr SrCO 3 ↓ 白色 Ba 3 ↓ 白色 Al 3 ↓ 白色 Sn Sn(OH)2 ↓ 白色 Sn Sn(OH)4 ↓ 白色 Sb Sb(OH)3 ↓ 白色 6. 与H 2S 或(NH 4)2S 反应应当掌握各种阳离子生成硫化物沉淀的条件及其硫化物溶解度的差别,并用于阳离子分离。
除黑色硫化物以外,可利用颜色进行离子鉴别。
(1)在0.3 mol·L -1HCl 溶液中通入H 2S 气体生成沉淀的离子:Ag +)Pb 2+HCl ,硝酸) Cu 2+) Cd 2+HCl) Bi 3HCl) Hg 22+Hg 2+ Sb(Ⅲ溶于浓HCl, NaOH, Na 2SSn(ⅣSn(Ⅱ溶于浓HCl 、(NH 4)2S x ,不溶于NaOH (2)在0.3 mol·L -1HCl 溶液中通入H 2S 气体不生成沉淀,但在氨性介质通入H 2S 气体(或加入(NH 4)2S )产生沉淀的离子:Zn ↓ 白色,溶于稀HCl 溶液,不溶于HAc 溶液 Co ↓ 黑色,溶于稀HCl 溶液,不溶于HAc 溶液 Ni NiS ↓ 黑色,溶于稀HCl 溶液,不溶于HAc 溶液O 2溶于王水,Na 2SMn2+MnS↓肉色,溶于稀HCl溶液Al3+Al(OH)3↓白色,溶于强碱及稀HCl溶液Cr3+Cr(OH)3↓灰绿色,溶于强碱及稀HCl溶液三、实验用品仪器与材料:离心机、试管、离心试管、酒精灯、烧杯、pH试纸、玻璃棒。
固体试剂:亚硝酸钠(AR)、NaBiO3(AR)。
酸碱溶液:HCl(2 mol·L-1,6 mol·L-1,浓)、H2SO4(2 mol·L-1)、HNO3(6 mol·L-1)、HAc(2 mol·L-1,6 mol·L-1)、NaOH(2 mol·L-1,6 mol·L-1)、KOH(2 mol·L-1)、NH3·H2O(2 mol·L-1,6 mol·L-1)。
盐溶液:NH4Ac (2 mol·L-1)、(NH4)2C2O4(饱和)、NaAc(2 mol·L-1)、NaCl(1mol·L-1)、Na2S(0.5mol·L -1)、NaHC4H4O6(饱和)、KCl (1mol·L-1)、K2CrO4 (1mol·L-1)、K4[Fe(CN)6] (0.1mol·L-1,0.5mol·L-1)、K3[Fe(CN)6] (0.1mol·L-1)、KSb(OH)6(饱和)、MgCl2(0.5mol·L-1)、CaCl2(0.5mol·L-1)、BaCl2 (0.5mol·L-1)、Ba(NO3)2 (0.1mol·L-1)、SnCl2(0.1mol·L-1)、AlCl3(0.1mol·L-1)、Al(NO3)3(0.1mol·L-1)、Pb(NO3)2(0.1mol·L-1)、SbCl3(0.1mol·L-1)、HgCl2(0.1mol·L-1)、Bi(NO3)3 (0.1mol·L-1)、AgNO3 (0.1mol·L-1)、CuCl2 (0.1mol·L-1)、ZnSO4(0.1mol·L-1)、Cd(NO3)2 (0.1mol·L-1)、MnSO4(0.1mol·L-1)、CrCl3(0.1mol·L-1)、FeCl3(0.1mol·L-1)、FeSO4(0.1mol·L-1)、NiSO4(0.1mol·L-1)、CoCl2(0.1mol·L-1)、NaNO3(0.5mol·L-1)、Na2CO3 (饱和)、NH4SCN(饱和)。
其它试剂:镁试剂、0.1%铝试剂、罗丹明B、苯、邻二氮菲1%、2.5%硫脲、H2O2(3%)、乙醚、1%丁二酮肟、丙酮、奈斯勒试剂、(NH4)2[Hg(SCN)4试剂。
四、实验内容1. 常见阳离子的个别鉴定(1)Na+的鉴定在盛有0.5 mL 1mol·L-1NaCl溶液的试管中,加入0.5 mL饱和六羟基锑(V)酸钾KSb(OH)6溶液,观察白色结晶状沉淀的产生。
如无沉淀产生,可以用玻璃棒摩擦试管内壁,放置片刻,再观察,写出反应方程式。
(2)K+的鉴定在盛有0.5 mL 1mol·L-1KCl溶液的试管中,加入0.5 mL饱和酒石酸氢钠NaHC4H4O6溶液,如有白色结晶状沉淀的产生,示有K+存在。
如无沉淀产生,可用玻璃棒摩擦试管内壁,再观察,写出反应方程式。
(3)Mg2+的鉴定在试管中加2滴0.5 mol·L-1 MgCl2溶液,再滴加6 mol.L-1NaOH溶液,直到生成絮状的Mg(OH)2沉淀为止;然后加入1滴镁试剂,搅拌,生成蓝色沉淀,示有Mg2+存在。
(4)Ca2+的鉴定取0.5 mL 0.5 mol·L-1CaCl2溶液于离心试管中,加10滴饱和草酸铵溶液,有白色沉淀产生,离心分离,弃去清液。
若白色沉淀不溶于6 mol·L-1HAc溶液而溶于2 mol·L-1HCl,示有Ca2+存在。
写出反应方程式。
(5)Ba2+的鉴定在试管中加2滴0.5 mol·L-1 BaCl2溶液,加入2 mol·L-1HAc和2 mol·L-1NaAc各2 滴,然后加2滴1mol·L-1K2CrO4,有黄色沉淀生成,示有Ba2+存在,写出反应方程式。
(6)Al3+的鉴定取2滴0.1 mol·L-1AlCl3溶液于试管中,加2滴2 mol·L-1HAc及2滴0.1% 铝试剂,振荡后,置水浴上加热片刻,再加入1滴6 mol·L-1氨水,有红色絮状沉淀产生,示有Al3+存在。
(7)Sn2+的鉴定取5滴0.1mol·L-1SnCl2溶液于试管中,加入2滴0.1mol·L-1HgCl2溶液,轻轻摇动,若产生的沉淀很快由白色变为灰色,然后变为黑色,示有Sn2+存在(该方法也可用于Hg2+的定性鉴定)。
写出反应方程式。
(8)Pb2+的鉴定在离心试管中加5滴0.1mol·L-1Pb(NO3)2溶液,加入2滴1mol·L-1K2CrO4溶液,有黄色沉淀生成,离心分离,弃去清液。
在沉淀上加数滴2 mol·L-1NaOH溶液,沉淀溶解,示有Pb2+存在。
写出反应方程式。
(9)Sb3+的鉴定在离心试管中加5滴0.1mol.L-1SbCl3溶液,加入3滴浓盐酸及少许亚硝酸钠,将Sb(III)氧化为Sb(V),当无气体放出时,加数滴苯及2滴罗丹明B溶液,苯层显紫色,示有Sb3+存在。
(10)Bi3+的鉴定取1滴0.1mol·L-1Bi(NO3)3溶液于试管中,加1滴2.5%的硫脲,生成鲜黄色配合物,示有Bi3+存在。
(11)Cu2+的鉴定取1滴0.5 mol·L-1CuCl2溶液于试管中,加1滴6 mol·L-1HAc溶液酸化,再加入1滴0.5 mol·L-1亚铁氰化钾K4[Fe(CN)6]溶液,生成红棕色Cu2[Fe(CN)6]沉淀,示有Cu2+存在。
写出反应方程式。
(12)Ag+的鉴定取5滴0.1mol·L-1AgNO3溶液于试管中, 加5滴2 mol·L-1盐酸,产生白色沉淀,在沉淀上滴加2 mol·L-1氨水至沉淀完全溶解,再用6 mol·L-1硝酸酸化,生成白色沉淀,示有Ag+存在。