实验六、常见非金属阴离子的分离与鉴定
- 格式:doc
- 大小:42.13 KB
- 文档页数:3


常见非金属阴离子的分离与鉴定实验报告实验目的,通过实验,掌握非金属阴离子的分离与鉴定方法,加深对化学反应原理的理解。
实验仪器与试剂,试管、试管架、酒精灯、试剂瓶、氢氧化钠溶液、盐酸溶液、碳酸氢铵溶液、氢氧化铵溶液、氢氧化铜溶液、氯化银溶液。
实验原理,非金属阴离子在化学反应中会产生不同的沉淀,通过观察沉淀的形成情况,可以进行分离与鉴定。
实验步骤:1. 取一小部分氢氧化钠溶液,加入盐酸溶液,观察是否产生气体或沉淀的变化。
2. 取一小部分氢氧化钠溶液,加入碳酸氢铵溶液,观察是否产生气体或沉淀的变化。
3. 取一小部分氢氧化铵溶液,加入氢氧化铜溶液,观察是否产生气体或沉淀的变化。
4. 取一小部分氯化银溶液,加入氯化铵溶液,观察是否产生气体或沉淀的变化。
实验结果与分析:1. 当氢氧化钠溶液与盐酸溶液反应时,产生白色沉淀,表明产生了氯化铅。
2. 当氢氧化钠溶液与碳酸氢铵溶液反应时,产生气体,表明产生了二氧化碳。
3. 当氢氧化铵溶液与氢氧化铜溶液反应时,产生蓝色沉淀,表明产生了氢氧化铜。
4. 当氯化银溶液与氯化铵溶液反应时,产生白色沉淀,表明产生了氯化银。
结论,通过实验,我们成功地分离并鉴定了氯化铅、二氧化碳、氢氧化铜和氯化银这几种常见非金属阴离子。
实验结果与预期一致,验证了实验原理的正确性。
实验总结,通过本次实验,我们掌握了非金属阴离子的分离与鉴定方法,加深了对化学反应原理的理解。
同时,实验中我们也注意到了实验操作的细节对结果的影响,对实验操作的严谨性有了更深的认识。
实验存在的不足,在实验过程中,我们发现了一些实验操作上的不足之处,例如溶液的配制和实验仪器的使用等,这些都需要我们在以后的实验中加以改进和注意。
实验的意义,本次实验不仅加深了我们对非金属阴离子分离与鉴定方法的理解,也提高了我们的实验操作能力,为以后的实验打下了良好的基础。
通过本次实验,我们对非金属阴离子的分离与鉴定有了更深入的了解,同时也提高了我们的实验操作技能,为今后的学习和研究打下了坚实的基础。


分离与鉴定常见非金属阴离子的实验报告实验目的:通过实验分离和鉴定常见的非金属阴离子,并研究它们在不同试剂下的化学反应特性。
实验原理:阴离子是电荷为负的离子,而非金属阴离子是在化合物中没有金属阳离子的阴离子。
常见的非金属阴离子包括:氯离子(Cl-)、溴离子(Br-)、碘离子(I-)、硝酸根离子(NO3-)、硫酸根离子(SO42-)、碳酸根离子(CO32-)、氢碳酸根离子(HCO3-)和硫代硫酸根离子(S2O32-)等。
在实验中,我们将使用一些常见的化学试剂来鉴定这些非金属阴离子的存在。
实验步骤:1. 溴苯试剂鉴定溴离子:- 取少量待鉴定溴离子的溶液,加入溴苯试剂。
- 若反应产生橙红色的沉淀,则表明溴离子存在。
2. 银镜反应鉴定碘离子:- 取少量待鉴定碘离子的溶液,加入碘化钾试剂。
- 加入稀硝酸,再滴加少量银氨溶液。
- 若出现镜面反应(镜面变黑),则表明碘离子存在。
3. 巴特利特试剂鉴定硝酸根离子:- 取少量待鉴定硝酸根离子的溶液,加入巴特利特试剂。
- 若反应产生红色的沉淀,则表明硝酸根离子存在。
4. 钡盐鉴定硫酸根离子:- 取少量待鉴定硫酸根离子的溶液,加入硝酸钡试剂。
- 若反应产生白色的沉淀,则表明硫酸根离子存在。
5. 盐酸鉴定碳酸根离子:- 取少量待鉴定碳酸根离子的溶液,加入盐酸。
- 若反应产生气泡,并放置数分钟后仍有气泡释放,则表明碳酸根离子存在。
6. 碳酸氢钠鉴定氢碳酸根离子:- 取少量待鉴定氢碳酸根离子的溶液,加入碳酸氢钠试剂。
- 若反应产生气泡,并用湿润的红色石蕊试纸测试,变蓝色或紫色,则表明氢碳酸根离子存在。
7. 亚铁离子鉴定硫代硫酸根离子:- 取少量待鉴定硫代硫酸根离子的溶液,加入氨水和一滴亚铁离子溶液。
- 若反应产生深红色或棕褐色的沉淀,则表明硫代硫酸根离子存在。
实验结果与讨论:根据实验步骤所描述的反应过程,我们可以鉴定出待测溶液中是否存在特定的非金属阴离子。
通过溴苯试剂鉴定,若反应产生橙红色沉淀,我们可以确认溴离子的存在。

常见非金属阴离子的分离与鉴定实验报告一、实验目的本实验旨在通过分离和鉴定常见非金属阴离子,掌握阴离子分离的基本方法和鉴定非金属离子的常规实验方法。
二、实验原理1. 阴离子分离原理阴离子分离是利用不同阴离子与某些阳离子形成难溶沉淀或络合物的特点,将不同的阴离子分开。
例如,硝酸根、氯根和碘根可以与银离子形成沉淀,而硫酸根则可以与钡盐形成沉淀。
2. 非金属阴离子的化学性质(1)硝酸根:具有强氧化性,能够被还原为一氧化氮或氮气。
(2)氯根:具有强还原性,在酸性条件下可以被还原为氯气。
(3)碘根:具有较强的还原性,在碱性条件下可以被还原为碘。
(4)硫酸根:在稀酸中无明显反应,但在浓硫酸中会发生脱水反应。
3. 非金属阴离子的鉴定方法(1)硝酸根:加入硝酸银试剂,产生白色沉淀。
(2)氯根:加入硝酸银试剂,产生白色沉淀,加入氨水可以溶解沉淀。
(3)碘根:加入氯化铁(III)试剂,产生紫色溶液。
(4)硫酸根:加入氯化钡试剂,产生白色沉淀。
三、实验步骤1. 阴离子分离取4个试管,分别加入0.5mL的NaCl、NaNO3、NaI和Na2SO4溶液。
分别滴加2-3滴AgNO3溶液,并观察是否出现沉淀。
将出现沉淀的试管标记好。
2. 硝酸根的鉴定将标记好的含有AgCl和AgI的试管分别滴加NH3·H2O溶液。
观察是否出现溶解现象。
然后将含有AgNO3的试管中滴加Ba(NO3)2溶液,观察是否出现白色沉淀。
3. 氯根的鉴定将标记好的含有AgNO3和AgI的试管中滴加NH3·H2O溶液,观察是否出现溶解现象。
然后将含有AgCl的试管中滴加FeCl3溶液,观察是否出现棕色沉淀。
4. 碘根的鉴定将含有AgNO3和AgCl的试管中加入NaOH溶液,使其呈弱碱性。
然后将其中一支试管中滴加FeCl3溶液,观察是否出现紫色溶液。
5. 硫酸根的鉴定将含有BaSO4沉淀的试管中滴加HCl溶液,观察是否出现气泡。
然后将其中一支试管中滴加FeCl3溶液,观察是否出现红褐色沉淀。
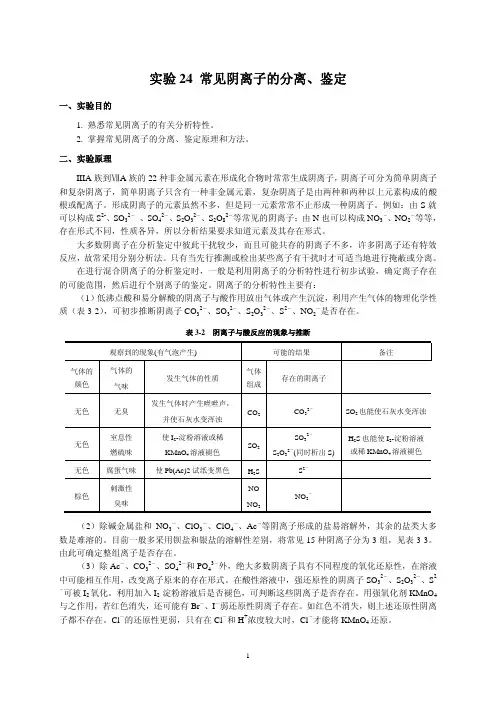

实验:常见11种非金属阴离子的分离与鉴定[实验目的] 学习和掌握常见11种非金属阴离子的分离与鉴定方法11种常见非金属阴离子:CO32-、SO42-、SO32-、S2O32-、S2-、PO43-、Cl-、Br-、I-、NO2-、NO3-一、初步试验(或消去试验)——完成教材P155表10-41.酸碱性试验——测定阴离子钠盐溶液的pH值阴离子试液一般呈中性或碱性。
若阴离子试液呈酸性,则S2O32-不存在,NO2-和I-、S2-不能共存。
2.挥发性试验——CO32-、SO32-、S2O32-、S2-、NO2-在适当较大浓度的阴离子溶液中加入稀硫酸或盐酸,CO32-、SO32-、S2O32-、S2-、NO2-均有气泡现象。
其中:S2O32- + 2H+→ SO2↑ + S↓ + H2O ,溶液变乳白色浑浊,放置变黄,这是S2O32-的一个重要特征。
但S x2-存在干扰。
3.氧化性阴离子试验——NO2-2I- + 2 NO2- + 4H+(HAc酸化) → 2NO↑ + I2 + 2H2OCCl4层呈紫红色,这是NO2-存在的特征。
4.还原性阴离子试验——S2-、SO32-、S2O32-、I-、NO2-、Br-,Cl-(∆)①试样用硫酸酸化,滴加1~2D KMnO4(aq),褪色,则上述6种阴离子存在,Cl-需加热。
②试样用硫酸酸化,滴加I2+淀粉溶液,褪色,则S2-、SO32-、S2O32-离子存在。
③试样用硫酸酸化,滴加氯水和CCl4,CCl4层呈紫红色,则I-存在。
5.分组试验——难溶盐分组①BaCl2分组——CO32-、SO42-、SO32-、S2O32-、PO43-在中性或弱碱性条件下,于阴离子试液中加入BaCl2溶液,有沉淀生成,则CO32-、SO42-、SO32-、S2O32-、PO43-可能存在。
在盐酸酸化条件下,于阴离子试液中加入BaCl2溶液,仅SO42-、S2O32-有沉淀生成,但S2O32-产生的是乳白色浑浊,而SO42-为细晶。

常见非金属阴离子的分离与鉴定非金属阴离子是指没有金属离子的离子,它们在化学实验中是非常重要的。
分离和鉴定非金属阴离子是化学分析的一个重要方面,因为它们在水质分析、环境分析、生物化学和食品化学等方面都是重要的组成部分。
1. 氯离子(Cl-)氯离子是被发现最早和最广泛使用的离子之一。
它通常存在于自然水体中,例如河流、湖泊和海洋。
氯离子的分离方法包括溶液酸化、加入银盐等试剂,形成氯化银沉淀进行检测。
鉴定方法包括氯化银沉淀颜色变化、AgNO3溶液滴定等。
2. 硝酸盐离子(NO3-)硝酸盐离子在自然界中广泛存在,尤其是在土壤和植物中。
硝酸盐离子的分离方法包括反应试样与五氧化二钒的反应,有钒氧化物形成。
鉴定方法包括金属离子还原法和碳酸气体的检测。
硫酸盐离子在自然界中存在于地下水中、矿物中和硫酸盐矿物中。
分离硫酸盐离子通常使用钡离子或钙离子沉淀,检测沉淀的颜色变化或灼烧残渣化学元素分析。
鉴定方法包括加入水溶性盐类,如盐酸、氯化钡等,然后通过色谱法、气相色谱法、电导法等进行检测。
4. 氢氧化物离子(OH-)氢氧化物离子在水中存在,它是酸碱反应的碱性部分。
分离氢氧化物离子的方法包括通过加酸滴定进行酸碱反应,以及通过加盐酸加热蒸发测定沉淀重量等。
鉴定方法包括使用电极电势寻找中和点、用指示剂观察颜色变化、用漏斗检测氢氧根离子的滤液沉淀等。
磷酸盐离子在自然界中广泛存在,通常被认为是主要的污染因素之一。
分离磷酸盐离子的方法包括加入酒石酸钾等化合物,形成分离的沉淀检测。
鉴定方法包括吸附光谱法、原子荧光光谱法等物理和化学方法。
以上列举的几种方法只是分离和鉴定非金属离子的一小部分。
在实际分析中,需要选择适当的方法,以保证结果的准确性和可靠性。

【精品PDF】常见非金属阴离子的分离与鉴定摘要:本文介绍了常见的非金属阴离子的分离和鉴定方法,包括硫酸根、硝酸根、氯离子、碘离子和氢氧根等。
其中,硫酸根的分离与鉴定利用了巴斯德试剂可以产生白色沉淀的特点,硝酸根的分离与鉴定利用了Fe2+和Fe3+的还原性不同的特点,氯、碘离子的分离与鉴定利用了氯银和碘化钾的作用,而氢氧根的分离与鉴定则是利用pH的调节及加入钙离子反应所产生的沉淀。
关键词:硫酸根;硝酸根;氯离子;碘离子;氢氧根;分离;鉴定一、硫酸根离子的分离与鉴定硫酸根离子在无机化学中具有较为重要的地位,因其存在于许多常用物质中,如硫酸、硫酸铜、硫酸锌等。
硫酸根离子的分离与鉴定方法较为简便,可以利用巴斯德试剂(BaCl2)与硫酸根离子的化学反应进行鉴定。
实验操作:1. 取待测物样品0.1g,加入100mL锥形瓶中,加入100mL去离子水,用超声波溶解。
2. 加入10mL浓盐酸(HCl)溶液,使硫酸根离子转化为氯化离子(Cl-)。
3. 加入5mL 5%巴斯德试剂(BaCl2)溶液,观察是否生成白色沉淀,如出现白色沉淀,则说明经过上述化学反应,生成了硫酸根离子和巴斯德试剂形成的杂质。
4. 将溶液过滤,用滤纸捏干后,在光源下观察沉淀的色泽,白色沉淀即为硫酸钡(BaSO4)。
反应方程式:BaCl2 + H2SO4 → BaSO4↓ + 2HCl2. 加入10mL 2mol/L的硫酸亚铁(FeSO4)溶液,充分摇匀。
3. 加入1mL硫酸(H2SO4)使溶液酸化,再加入1mL碘化钾(KI)溶液,徐徐地混合后观察有无颜色生成。
4. 如出现深蓝色,则表示样品中存在硝酸根离子,色深程度代表其含量大小。
HNO3 + 3FeSO4 + 4H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O氯离子和碘离子是常见的两种阴离子,化学反应中可以利用氯银(AgNO3)与氯离子的反应生成白色沉淀进行鉴定,利用碘化钾(KI)与碘离子的作用能够产生深蓝色的反应物进行鉴定。

常见非金属阴离子的分离与鉴定实验报告常见非金属阴离子的分离与鉴定实验报告实验目的:通过实验,了解常见非金属阴离子的分离与鉴定方法,掌握实验操作技巧,并能正确判断不同阴离子的存在与否。
实验原理:常见非金属阴离子包括氯离子、溴离子、碘离子、硫酸根离子、硝酸根离子、碳酸根离子等。
本实验通过一系列化学反应,利用各个阴离子的特性进行分离与鉴定。
实验器材与试剂:实验器材:试管、滴管、烧杯、玻璃棒等。
试剂:氯化银溶液、溴化银溶液、碘化银溶液、硫酸银溶液、硝酸银溶液、盐酸、硫酸、硝酸、碳酸钠溶液等。
实验步骤:1. 氯离子的鉴定取一小部分待测溶液,加入少量氯化银溶液。
若产生白色沉淀,则表示存在氯离子。
2. 溴离子的鉴定取一小部分待测溶液,加入少量溴化银溶液。
若产生黄色沉淀,则表示存在溴离子。
3. 碘离子的鉴定取一小部分待测溶液,加入少量碘化银溶液。
若产生红褐色沉淀,则表示存在碘离子。
4. 硫酸根离子的鉴定取一小部分待测溶液,加入少量硫酸银溶液。
若产生白色沉淀,则表示存在硫酸根离子。
5. 硝酸根离子的鉴定取一小部分待测溶液,加入少量硝酸银溶液。
若产生白色沉淀,则表示存在硝酸根离子。
6. 碳酸根离子的鉴定取一小部分待测溶液,加入少量盐酸。
若产生气泡,且气泡通入饱和石灰水中产生白色沉淀,则表示存在碳酸根离子。
实验结果与分析:根据实验步骤所述,通过观察产生的沉淀或气泡,可以判断待测溶液中是否存在氯离子、溴离子、碘离子、硫酸根离子、硝酸根离子和碳酸根离子。
实验注意事项:1. 实验操作时要小心,避免溶液溅出或溅入眼睛。
2. 实验过程中要保持实验器材的干净,避免交叉污染。
3. 实验结束后,要彻底清洗实验器材,保持实验室的整洁。
实验总结:通过本次实验,我了解了常见非金属阴离子的分离与鉴定方法,并掌握了实验操作技巧。
实验结果表明,通过一系列化学反应,我们可以准确判断不同阴离子的存在与否。
这对于化学分析和实际应用具有重要意义。
在今后的学习和实验中,我将继续加强对化学实验操作的掌握,提高自己的实验技能。
实验25 常见非金属阴离子的分离与鉴定一、实验目的1. 掌握常见非金属阴离子的分离与鉴定方法;2. 熟练掌握常见非金属阴离子的反应特点,从而确定其存在性质;3. 加强实验操作技能和实验数据的处理分析。
二、实验原理常见的非金属阴离子有硝酸根离子(NO3-)、氯离子(Cl-)、碳酸根离子(CO32-)、氢碳酸根离子(HCO3-)、硫酸根离子(SO42-)、亚硝酸根离子(NO2-)、亚硫酸根离子(HSO3-)和硫代硫酸盐离子(S2O32-)等。
分离和鉴定这些非金属阴离子的方法有以下几种:1. 氯离子(Cl-)的分离和鉴定方法氯离子和溴离子(Br-)属于同一族元素,它们的化学性质相似,常用的方法是:(1)银镜法:将待测溶液与氢氧化钠溶液混合,在加入几滴稀盐酸,加入银镜试剂(含有氢氧化银),观察是否生成白色沉淀。
AgNO3 + NaOH → AgOH↓ + NaNO3AgOH + 2HNO3 = AgNO3 + H2O + NO↑(2)烧杯法:将待测溶液加入硫酸银溶液,观察是否生成白色沉淀。
Ag2SO4 + 2NaCl = 2AgCl↓ + Na2SO42. 硝酸根离子(NO3-)的分离和鉴定方法氯化铁(FeCl3)试剂检定硝酸根离子:将待测溶液加入少量氯化铁试剂(FeCl3溶液),观察是否生成棕褐色沉淀。
FeCl3 + 3NaNO3 → Fe(NO3)3 + 3NaCl3. 碳酸根离子(CO32-)和氢碳酸根离子(HCO3-)的分离和鉴定方法碳酸根离子和氢碳酸根离子都具有两性质,加入盐酸或氢氧化钠溶液可以区别它们的存在性质,其适用条件如下:(1)盐酸法区别:将待测溶液加入盐酸,若生成气泡,则为碳酸根离子;若无反应,则为氢碳酸根离子。
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2OHCO3- + HCl = CO2↑ + H2O + Cl-(2)碱法区别:将待测溶液滴加氢氧化钠溶液,观察有无溶液变色现象。
常见非金属阴离子的分离与鉴定实验报告常见非金属阴离子的分离与鉴定实验报告在化学领域中,非金属阴离子是一类不带正电荷的离子。
它们广泛存在于日常生活中的各种物质中,并对环境和人体健康产生不同程度的影响。
了解如何准确分离和鉴定常见非金属阴离子成为了化学实验的重要内容之一。
本实验旨在通过合适的试剂和方法,对常见非金属阴离子进行分离和鉴定。
(一)实验目的通过本实验,我们的目的是学习并掌握常见非金属阴离子的分离与鉴定方法,并且了解它们在实际应用中的意义。
(二)实验原理常见非金属阴离子的分离与鉴定主要借助于溶液中离子间的化学反应特性。
在相应的鉴定试剂作用下,可以观察到特定的颜色变化、沉淀形成或气体释放等现象,从而推断出离子的存在。
本实验中涉及的常见非金属阴离子有:氯离子(Cl-)、溴离子(Br-)、碘离子(I-)、碳酸根离子(CO32-)、硫酸根离子(SO42-)、硝酸根离子(NO3-)、硼酸根离子(BO33-)、亚硝酸根离子(NO2-)等。
(三)实验步骤1. 制备所需试剂:包括氯化银铵溶液、氯化铵铜溶液、硝酸铅溶液、硫酸铅溶液、碳酸钠溶液、大量蒸馏水等。
2. 分离氯离子、溴离子和碘离子:a. 取少量待鉴定物质溶解于蒸馏水中;b. 依次滴加氯化铵铜溶液、氯化银铵溶液;c. 观察颜色变化,根据生成的沉淀颜色可以初步确定阴离子的存在。
3. 分离硫酸根离子和硝酸根离子:a. 取待鉴定物质溶解于蒸馏水中;b. 分别滴加硝酸铅溶液和硫酸铅溶液;c. 观察是否生成白色的沉淀,判断有无硫酸根离子和硝酸根离子存在。
4. 分离碳酸根离子:a. 取待鉴定物质溶解于蒸馏水中;b. 酸化溶液,滴加少量盐酸,观察是否产生气泡释放CO2气体,即可判断是否存在碳酸根离子。
5. 分离亚硝酸根离子:a. 取待鉴定物质溶解于蒸馏水中;b. 分别滴加硝酸银溶液和稀硝酸溶液;c. 观察是否生成白色的沉淀,判断有无亚硝酸根离子存在。
(四)实验结果与讨论通过上述实验步骤,我们可以根据观察到的现象初步确定待鉴定物质中是否存在特定的非金属阴离子。
实验六、常见非金属阴离子的分离与鉴定
一、实验目的:学习和掌握常见阴离子的分离与鉴定方法,以及离子检出的基本操作。
总结说明:从IIIA族到VIIIA族的22种非金属元素在形成化合物时常常生成阴离子。
形成阴离子的元素虽不多,但是同一元素常常不止一种阴离子。
阴离子多数是由两种和两种以上元素构成的酸根或碱离子,同一种元素的中心原子能形成多种阴离子在非金属阴离子中,有的与酸作用生成挥发性的物质,有的与试剂作用生成沉淀,也有的呈现氧化还原性。
利用这些特点,根据溶液中离子共存情况,应先通过初步试验或进行分组应产生气体的试验,各种阴离子的沉淀性质,氧化还原性质。
预先做初步检验,可以排除某些离子存在的可解性,从而简化分析步骤,初步检验包括以下内容:
(一)、试液的酸碱性试验。
若试液呈强酸性,则易被分解的离子如:CO32-、NO2-、S2O32-等。
(二)、是否产生气体的试验。
若在试液中加入稀H2SO4或稀HCL溶液,有气体产生,表示可能存在CO32-、SO32-、
S2O32-、S2-、NO2-等离子。
根据生成气体的颜色和气味以及生成气体具有某些特征反应,确证其含有的阴离子,如由NO2-被酸分解生成红棕色NO2气体,能将湿润的碘化钾淀粉试纸变蓝;由S2-被酸分解产生H2S气体,可使醋酸铅试纸变黑,可判断NO2-和S2-离子分别存在于各自反应溶液中。
(三)、还原性阴离子的试验。
在酸化的溶液中,加入KMnO4稀溶液,若紫色褪去,则可能存在S2-、SO32-、S2O32-、BR-、I-、NO2-等离子,若紫色不褪去,则上述离子都不存在。
试液经酸化后,加入I2-淀粉溶液,蓝色褪去,则可能存在SO32-、S2O32-、S2-等离子。
(四)、氧化性阴离子的试验。
在酸化的试液中加入KI溶液和Ccl4,振荡后Ccl4层呈紫色,则有氧化性阴离子存在,如NO2-离子。
(五)、难溶盐阴离子试验。
①钡组阴离子。
在中性或弱碱性试液中,用Bacl2能沉淀SO42-、SO32-、S2O32-、CO32-、PO42-、等阴离子。
②用AgNO3能溶液Cl-、Br-、I-、S2-、S2O32-等阴离子,然后用稀HNO3酸化,沉淀不
溶解。
可以根据Ba2+和Ag+相应盐类的溶解性,区分易溶盐和风化溶盐。
加入一种阳离子可以试验整组阴离子是否存在,这种试剂就是相应的组试剂。
二、实验用品:
①仪器:试管(离心)、点滴板、离心机。
②固体药品:硫酸亚铁。
③液体药品:Na2S(0.1mol/L)、Na2SO3(0.1mol/L)、Na2S2O3(0.1mol/L)、Na3PO4
(0.1mol/L)、Nacl(0.1mol/L)、NaBr(0.1mol/L)、NaI(0.1mol/L)、NaNO3(0.1mol/L)、
Na2CO3(0.1mol/L)、NaNO2(0.1mol/L)、(NH4)2MoO4(0.1mol/L)、Bacl2(0.1mol/L)、
KMnO4(0.1mol/L)、ZnSO4(饱和)、K4[Fe(CN)6](0.5mol/L)、AgNO3(0.1mol/L)、
H2SO4(浓1mol/L)、HNO3(6mol/L)、HCL(6mol/L)、NaOH(2mol/L)、Ba(OH)2
(饱和氨水)或新配制的石灰水(氨水6mol/L)、H2O2(3%)、氯水、Ccl4、对氨
基苯碘酸(1%)、2-苯胺(0.4%)、亚硝酸铁氰化钠(9%)。
④材料:Pb(AC)2试纸、玻璃棒。
三、实验内容:
二、混合离子的分离。
1.Cl-、Br-、I-的混合物分离
溶液
HNO
Zn
Ccl4层显紫红色,示有I-
继续加氯水
Ccl4层显棕黄色,示有Br-
2.S2-、SO32-、S2O32-混合物的分离和鉴定。
3
3
红色沉淀
示有SO32-
Zn2++K4[Fe(CN)6]===KZn3[Fe(CN)6]↓
白色,亚铁氰化锌钾。