药物合成反应第三章烷基化反应
- 格式:ppt
- 大小:575.51 KB
- 文档页数:67

烷基化反应的名词解释烷基化反应是有机化学中重要的一类转化反应,它指的是将一个氢原子替换为烷基基团的化学过程。
在烷基化反应中,烷基基团可以是直链、分支链或环状结构。
这种反应广泛应用于有机合成、材料科学和药物化学领域,极大地丰富了化学品种和化学反应的范围。
烷基化反应的基本原理可以通过傅-科瑞特垂直攻击机制和自由基取代反应机制来解释。
在傅-科瑞特垂直攻击机制中,烷基化反应的反应底物通常是一个酸或碱。
在酸性介质中,酸性催化剂(如质子酸)可将底物分子上的氢离子去除,形成一个烷基离子。
接下来,该烷基离子可以与亲电试剂(如烯烃或芳香族化合物)发生亲电加成反应,形成新的碳碳键。
在碱性介质中,碱性催化剂(如碱金属)可使用相同的原理将酸性底物(如卤代烷)中的氯离子取代为烷基离子。
自由基取代反应机制是烷基化反应的另一种常见形式。
在这种机制下,反应底物通常是卤代烷或炔烃。
通过热、光或化学活化剂的作用,卤代烷会发生一个氯离子的替代,生成烷基自由基。
接下来,烷基自由基可以与另一个分子中的自由基反应,形成新的碳碳键。
这种自由基取代反应通常用来合成烷烃、脂肪族化合物和芳香族化合物。
烷基化反应的应用非常广泛,例如在有机合成中,它常用于构建碳链或引入特定的基团。
通过选择不同的反应底物和催化剂,可以将烷基化反应用于合成各种有机物,从而实现天然产物合成、药物合成和材料合成。
此外,烷基化反应还可应用于构建大分子化合物,例如聚合物的合成过程中,可以利用烷基化反应进行分支支链修饰,调控聚合物的结构和性质。
除了有机合成外,烷基化反应在环境科学和工业领域也起着重要作用。
例如,在环境科学中,烷基化反应可用于土壤和水体中有机物的生物降解研究,帮助我们理解有机污染物的降解机理和环境行为。
在工业领域,烷基化反应常用于催化剂的制备和表面修饰,以改善催化剂的活性和选择性。
总的来说,烷基化反应是一类重要的有机化学反应,通过将氢原子替换为烷基基团,为有机合成、材料科学和药物化学等领域提供了广阔的应用空间。


烷基化反应的重要性及应用烷基化反应是化学中一种重要的反应,它是有机化学的基础之一。
烷基化反应指的是将一种化合物中的一种或多种氢原子取代为烷基基团的反应,常用的烷基化试剂有硫酸、亚硫酸、醇和羰基化合物等。
烷基化反应在有机合成、药物合成等领域都有着广泛的应用。
1. 烷基化反应在有机合成中的应用烷基化反应是有机合成中最为基础和重要的反应之一,它能够构建出复杂的碳链和不同类型的碳碳、碳氧、碳氮键,是合成天然产物、药物以及高分子化合物的重要步骤。
例如, 将芳香酮与有机硫化合物反应可以合成各类烷基硫醇衍生物,是制备植物激素、农药、生物碱、天然香料等的重要途径。
此外,烷基化反应还常常被用来合成复杂的天然产物,比如土霉素、紫杉烷等。
2. 烷基化反应在药物合成中的应用烷基化反应在药物合成领域也有着广泛的应用。
例如,苯地酸经由烷基化反应可以得到壬二酸,后者是制备高血压和高胆固醇的药物的原料;烷基化反应还可以用于合成止痛剂、退烧药、镇静剂等。
此外,烷基化反应在开发新药物中也有着重要的作用,因为大量的新型药物分子中都含有具有特殊功能的碳链结构,因此烷基化反应是设计新型药物的基础。
3. 烷基化反应在高分子化学中的应用烷基化反应在高分子化学中也有着重要应用。
例如,用烷基化反应合成不同长度的板栗糖醇,从而探索其在高分子领域中的应用;烷基化反应也可以用于聚合物的修饰,引入不同的官能团,从而改变聚合物的性质和应用。
总的来说,烷基化反应是有机化学中一种非常重要的反应,它在有机合成、药物合成、高分子化学等领域都有着广泛的应用。
新的烷基化试剂和新反应的开发将推动烷基化反应在各个领域中的应用更加广泛深入。
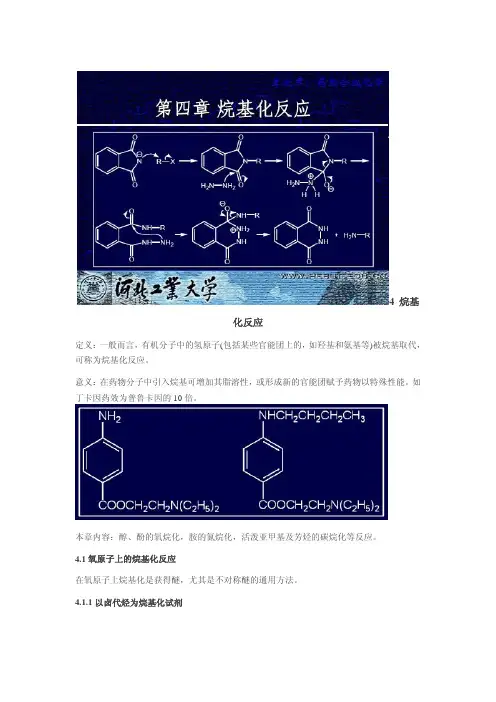
4 烷基化反应定义:一般而言,有机分子中的氢原子(包括某些官能团上的,如羟基和氨基等)被烷基取代,可称为烷基化反应。
意义:在药物分子中引入烷基可增加其脂溶性,或形成新的官能团赋予药物以特殊性能。
如丁卡因药效为普鲁卡因的10倍。
本章内容:醇、酚的氧烷化,胺的氮烷化,活泼亚甲基及芳烃的碳烷化等反应。
4.1 氧原子上的烷基化反应在氧原子上烷基化是获得醚,尤其是不对称醚的通用方法。
4.1.1 以卤代烃为烷基化试剂醇、酚的钠盐或醇、酚在碱(钠、氢氧化钠以及氢氧化钾等)的存在下与卤代烷生成醚的反应称为Williamson反应,是合成不对称醚的最常用方法。
(1) 反应机理Williamson反应是典型的SN2反应。
此外,醇、酚与卤代烷的反应也可按SN1机理进行。
(2) 影响因素底物的影响:①伯卤代烷一般为SN2机理;叔卤代烷一般为SN1机理;而仲卤代烷可SN1也可SN2。
②由于芳环的吸电子作用,使得酚的活性一般弱于醇。
③底物的空间位阻对反应速率影响较大。
溶剂的影响:极性溶剂可促进反应。
SN2反应一般在碱性条件下进行;而SN1反应一般在酸性或近中性(可为弱碱性)条件下进行。
(3) 反应示例①苯海拉明的合成反应机理:双分子亲核取代(SN2)。
②糖环6-伯羟基的保护在极性溶剂中,Ph3CCl可形成非常稳定的碳正离子Ph3C+,此步为控制步骤,该碳正离子形成后迅速与伯羟基结合,生成醚。
反应机理:碳正离子历程(SN1)。
③卤代烃为芳卤的情况:对硝基苯乙醚(非那西丁中间体)的合成反应机理:加成-消除机理。
反应活性:I<Br<Cl<F;芳环上一定要有吸电子基。
4.1.2 以芳磺酸酯为烷基化试剂氧原子的吸电子作用使得芳磺酸酯成为很好的离去基团,当与其相连的碳原子受到醇的进攻时,芳磺酸基很容易离去。
常见的芳磺酸酯包括苯磺酸酯、对甲苯磺酸酯、对硝基苯磺酸酯、对卤苯磺酸酯以及对三氟甲基苯磺酸酯等。
反应示例:鲨肝醇的合成(SN2反应)。



《药物合成技术》习题集适用于制药技术类专业第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,B r 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应C CH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH32.CH 3SO 2ClCl /AIBN3.OH4CH 3CH 35.2OC O CH 3OHI 2/CaOAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2C CHCH 3CHCH 2Br(CH 3)2C 1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.O2CH 2OH CH 2CH 2OHOCH 2CH 2CH 2CH 2ClCl 6.CH 2OH3CH2Cl37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 32CH 2C(COOC 2H 5)NHCOCH 3CH 2Br2CH 2C(COOC 2H 5)39.CH 2NO 2CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH 2CH 2NO 2CH 2N(CH 2CH 2Cl)2C(COOC 2H 5)310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。


#2.11打卡# 完成学习目标第三章酰化反应Acylation Reaction1 定义:有机物分子中O、N、C原子上导入酰基的反应.2 分类:根据接受酰基原子的不同可分为:氧酰化、氮酰化、碳酰化3 用途:药物本身有酰基活性化合物的必要官能团结构修饰和前体药物羟基、胺基等基团的保护。
酰化机理:加成-消除机理加成阶段反应是否易于进行决定于羰基的活性:若L的电子效应是吸电子的,不仅有利于亲核试剂的进攻,而且使中间体稳定;若是给电子的作用相反。
根据上述的反应机理可以看出,作为被酰化物质来讲,无疑其亲核性越强越容易被酰化。
具有不同结构的被酰化物的亲核能力一般规律为;RCH2->R—NH->R—O->R—NH2>R—OH。
在消除阶段反应是否易于进行主要取决于L的离去倾向:L-碱性越强,越不容易离去,Cl- 是很弱的碱,-OCOR的碱性较强些,OH-、OR-是相当强的碱,NH2-是更强的碱。
RCOCl>(RCO)2O>RCOOH 、RCOOR′ >RCONH2>RCONR2′R: R为吸电子基团利于进行反应;R为给电子基团不利于反应R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行酸碱催化碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的亲核试剂Nu-,从而加速反应。
酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
氧原子的酰化反应是一类形成羧酸酯的反应,是羧酸和醇的酯化反应,是羧酸衍生物的醇解反应醇的结构对酰化反应的影响伯醇(苄醇、烯丙醇除外)>仲醇>叔醇1) 羧酸为酰化剂:提高收率:(1)增加反应物浓度(2)不断蒸出反应产物之一(3)共沸除水、添加脱水剂或分子筛除水。
(无水CuSO4,无水Al2(SO4)3,(CF3CO)2O,DCC。
)加快反应速率:(1)提高温度(2)催化剂(降低活化能)催化剂(1)质子酸催化法: 无机酸:浓硫酸,氯化氢气体,有机酸:苯磺酸,对甲苯磺酸等。


化学药物合成揭示药物研发中的化学过程药物合成是药物研发的关键步骤之一。
通过化学合成,研究人员可以合成出新型化合物,并通过进一步的药物评估和优化,最终得到有效的药物。
本文将深入探讨药物合成的基本原理和常见的合成方法,以及该过程在药物研发中的重要性。
一、药物合成的基本原理在药物合成过程中,研究人员首先确定目标化合物的结构,然后设计合成路线,即确定连续的化学反应,将起始原料转化为目标化合物。
合成路线的制定需要考虑各种因素,包括反应步骤、反应条件、原料选择、反应速度等。
通过有机合成化学的基本原理,研究人员可以选择适当的化学反应和合成策略,实现目标化合物的高产率和高纯度合成。
二、常见的药物合成方法1. 羟基化反应:羟基化反应是一种常见的药物合成方法,可以将芳香化合物中的氢原子取代为羟基。
这种反应通常使用强碱性催化剂和氧化剂,如酚醛法和遥控羟基化反应等。
2. 氨基化反应:氨基化反应是向有机分子中引入氨基基团的方法之一,通常通过亲核取代反应实现。
亲核取代反应的常用试剂包括胺类化合物、碳酸酯等。
3. 烷基化反应:烷基化反应是向有机分子中引入烷基基团的方法之一,可以使用醇类或卤代烃等试剂进行。
这种反应常用于合成长链化合物或脂类药物。
4. 置换反应:置换反应是一种常见的药物合成方法,通常通过取代试剂与底物反应来实现。
常见的取代试剂包括卤代烃、芳香化合物等。
5. 光化学反应:光化学反应利用光能激发化学反应,是一种绿色环保的合成方法。
该方法可以在较温和的条件下实现目标化合物的选择性合成。
三、药物合成在研发中的重要性药物合成作为药物研发的核心环节,对于新药物的发现和开发具有重要作用。
通过合理的合成路线设计和合成条件优化,可以大大提高药物的产率和纯度,从而有效降低药物的生产成本。
此外,药物合成还可以根据药物结构进行结构活性关系的研究,为药物设计和优化提供重要依据。
药物合成的研究也为合成化学领域提供了新的挑战和机遇。
通过对药物合成的研究,可以发现新的合成方法和策略,推动合成化学的发展。
烷基化反应实例分析例题和知识点总结在有机化学领域,烷基化反应是一类非常重要的反应,它在合成各种有机化合物方面有着广泛的应用。
接下来,我们将通过一些具体的实例来深入分析烷基化反应,并对相关的知识点进行总结。
一、烷基化反应的基本概念烷基化反应是指在有机化合物分子中的某个原子(通常是氮、氧或碳原子)上引入烷基(通常是甲基、乙基等)的过程。
这个反应通常需要在一定的条件下进行,例如在催化剂的存在下,或者在特定的溶剂中。
二、烷基化反应的类型1、碳烷基化反应FriedelCrafts 烷基化反应:这是最常见的碳烷基化反应之一。
它是在路易斯酸(如氯化铝)的催化下,芳烃与卤代烷发生反应,生成烷基芳烃。
例如,苯与氯乙烷在氯化铝的催化下反应,生成乙苯。
羰基化合物的烷基化反应:醛、酮等羰基化合物在碱性条件下与卤代烷反应,发生烷基化。
例如,丙酮在氢氧化钠存在下与碘甲烷反应,生成 2-甲基-2-甲氧基丙烷。
2、氮烷基化反应胺的烷基化反应:胺类化合物与卤代烷在碱性条件下反应,生成烷基胺。
例如,苯胺与碘甲烷反应,生成 N甲基苯胺。
3、氧烷基化反应醇的烷基化反应:醇与卤代烷在碱性条件下反应,生成醚。
例如,乙醇与溴乙烷在氢氧化钠存在下反应,生成乙醚。
三、烷基化反应的实例分析例 1:苯与氯乙烷的 FriedelCrafts 烷基化反应反应式:```C6H6 +CH3CH2Cl → C6H5CH2CH3 + HCl```反应条件:通常在无水氯化铝作为催化剂,在惰性溶剂(如二氯甲烷)中进行。
反应机理:首先,氯化铝与氯乙烷作用,形成碳正离子:```CH3CH2Cl +AlCl3 → CH3CH2+ + AlCl4-```然后,碳正离子进攻苯环,形成共振稳定的碳正离子中间体:```C6H6 +CH3CH2+ → C6H5CH2CH3+```最后,质子从碳正离子中间体上脱去,生成乙苯:```C6H5CH2CH3+ → C6H5CH2CH3 + H+```例 2:苯胺与碘甲烷的氮烷基化反应反应式:```C6H5NH2 +CH3I → C6H5N(CH3)H + HI```反应条件:在碱性条件(如氢氧化钠)下进行。
烷基化反应实例分析例题和知识点总结在有机化学领域,烷基化反应是一类非常重要的反应,它在合成各种有机化合物中发挥着关键作用。
本文将通过一些实例分析,深入探讨烷基化反应的相关知识点。
一、烷基化反应的基本概念烷基化反应是指将烷基(通常是甲基、乙基等)引入有机分子中的反应。
这个过程通常涉及亲电试剂与亲核试剂之间的相互作用。
常见的亲电试剂包括卤代烷、醇、烯烃等,而亲核试剂则通常是芳香族化合物、含氮或含氧的杂环化合物等。
二、烷基化反应的机理以卤代烷与芳香族化合物的反应为例,其反应机理通常包括以下步骤:首先,卤代烷在路易斯酸(如氯化铝)的作用下形成碳正离子。
然后,碳正离子作为亲电试剂进攻芳香族化合物的π电子体系,形成σ络合物。
最后,σ络合物失去一个质子,得到烷基化产物。
三、烷基化反应的实例分析1、苯与氯乙烷的烷基化反应在氯化铝的催化下,苯与氯乙烷发生反应,生成乙苯。
化学方程式为:C₆H₆+ CH₃CH₂Cl → C₆H₅CH₂CH₃+ HCl这个反应中,氯乙烷在氯化铝的作用下产生乙基碳正离子,然后乙基碳正离子进攻苯环,形成乙苯。
2、苯胺与卤代烷的烷基化反应苯胺是一种含氮的芳香族化合物,它可以与卤代烷发生烷基化反应。
例如,苯胺与碘甲烷反应生成 N甲基苯胺。
反应式为:C₆H₅NH₂+ CH₃I → C₆H₅N(CH₃)H + HI在这个反应中,碘甲烷在适当条件下形成甲基碳正离子,与苯胺的氮原子发生亲电取代反应。
3、吡啶与卤代烷的烷基化反应吡啶是一种含氮的杂环化合物,也能进行烷基化反应。
以吡啶与氯乙烷的反应为例,生成 N乙基吡啶。
反应方程式为:C₅H₅N + CH₃CH₂Cl → C₅H₄N(CH₂CH₃) + HCl四、烷基化反应的影响因素1、试剂的活性卤代烷的活性通常与卤素的种类有关,碘代烷的活性最高,氯代烷的活性相对较低。
2、催化剂常用的催化剂如氯化铝、氯化锌等,其用量和性质会影响反应的进行。
3、溶剂溶剂的选择对反应也有重要影响,有些溶剂可以促进反应,而有些可能会抑制反应。
有机化学基础知识点整理烷基化和芳基化反应有机化学基础知识点整理:烷基化和芳基化反应有机化学是研究有机物性质和变化的科学分支,其中烷基化和芳基化反应是有机化合物中的重要转化过程。
本文将对这两种反应进行整理,帮助读者理解其基本原理和应用。
一、烷基化反应烷基化反应是指在有机化合物中引入烷基基团的反应。
常见的烷基化反应有烷基卤化反应、烷基金属试剂反应和格氏试剂反应等。
以下将分别介绍这些反应的机理和应用。
1. 烷基卤化反应烷基卤化反应是指通过处理烃或醇与卤素化合物反应生成烷基卤化物的过程。
该反应通常涉及亲电取代机制,其中卤素离子(X-)作为亲电试剂攻击醇或烃的反应中心,生成相应的烷基卤化物。
烷基卤化反应在有机合成中有广泛的应用,如制备烃类物质、药物和表面活性剂等。
此外,还可用于合成其他有机化合物的中间体。
2. 烷基金属试剂反应烷基金属试剂反应是指通过烷基金属试剂与化合物发生加成反应生成含烷基的产物。
常用的烷基金属试剂有格氏试剂(有机锂、有机镁卤化物等)和有机铜试剂等。
烷基金属试剂反应通常涉及亲核加成机制,其中烷基金属试剂攻击有机化合物中的亲电中心,形成碳-碳键。
该反应在有机合成中常用于构建碳-碳键和引入功能基团。
3. 格氏试剂反应格氏试剂反应是指通过格氏试剂与含有亲电中心的化合物发生加成反应生成含烷基的产物。
常见的格氏试剂有有机锂、有机镁卤化物等。
格氏试剂反应中,格氏试剂中的亲核试剂攻击有机化合物中的亲电中心,形成碳-碳键。
该反应常被用于有机合成中的烷基化反应和碳-碳键的构建。
二、芳基化反应芳基化反应是指在有机化合物中引入芳香环基团的反应。
常见的芳基化反应有氟化芳基反应、芳香取代反应和酯化反应等。
以下将分别介绍这些反应的机理和应用。
1. 氟化芳基反应氟化芳基反应是指通过处理芳香化合物与氟化试剂反应生成含芳香环的氟化物。
该反应通常涉及芳烃与氟化试剂之间的亲电取代机制,其中氟离子(F-)作为亲电试剂攻击芳香化合物中的反应中心。
药物化学简答题判断合成药物的反应类型及建议药物化学是一门研究药物的结构、形态、性能和功能之间关系的学科,广泛应用于合成新药研究、药物合成、药物材料开发以及药物安全性测评等。
一、在合成药物过程中,反应类型及建议如下:1、氢化反应:氢化反应是最常用的合成药物方法之一,是指使用氢原子与碳氢化合物互换反应,在反应中氢原子可以通过氢氧来节约,减少反应的污染和提高反应的效率,但也存在一些风险,如不宜使用过量的甲醇对反应物进行氢化,以防止碳氢化合物的过分氢化等。
2、缩合反应:缩合反应是一种常见的合成药物方法,通常用来将多个有机物缩合成药物分子,也可用于将药物与其他宿主体结合起来形成新分子。
在进行缩合反应时,应注意控制比例以及反应条件,如控制反应温度及时间,以确保反应进行稳定有序,使反应得到最优的效果。
3、羟基化反应:羟基化反应是一种非常有效的药物合成方法,是将羟基与不同的有机物反应,以得到新的化合物。
这种反应通常采用溶剂来促进反应,此外,还可使用氧化剂以促进反应,以改善反应的效率和改性反应产物。
4、缩合羧基化反应:缩合羧基化反应是指将羧基与另一个活性基结合以形成新的化合物,常用于甲氧基化等合成药物。
在进行缩合羧基化反应时,应考虑加入可与羧基相协调的催化剂,以改善反应的效率和稳定性,并且要注意把握活性基及羧基的比例,以防止反应发生失控等。
二、除了上述的反应类型外,在合成药物的过程中,还有一些其他的反应类型及建议:1、氧化硫醚活化反应:氧化硫醚活化反应是一种用于去除药物中不必要羧基或氧化物等杂质的有效反应,具有避免药物意外活化的优点,可以有效提高药物合成的效率。
在使用氧化硫醚活化反应时,应选择尽可能有效的硫醚,注意释放以及控制反应温度,并且保持一定的pH 值,以确保反应达到最佳效率。
2、烷基化反应:烷基化反应是指将烷基与活性中心进行反应,使得药物的特定化合物具有良好的生物活性。
在进行烷基化反应时,应避免使用过量的烷基,以防止有一些副反应发生,并且应考虑加入催化剂,以增加反应的效率,同时要控制反应温度,以避免有残存原料影响新产物的质量。
化学反应中的烷基化反应机理解析烷基化反应是一种常见的有机化学反应,其中烷烃与其他原料发生反应,生成含有碳链较长的烷基化产物。
本文将对烷基化反应的机理进行解析,并探讨其在有机合成中的应用。
一、烷基化反应的机理烷基化反应通常在碳-碳键断裂和碳-氢键形成之间进行。
下面以烷基化反应中最常见的卤代烷基化反应为例,来分析其机理。
在卤代烷基化反应中,通常使用卤代烷作为烷基化的底物。
该反应的机理主要分为四个步骤:亲核攻击、离去基团离去、质子转移和亲核加成。
首先,在溶剂的作用下,亲核试剂(如醇、胺等)的亲核攻击发生。
亲核试剂中的亲核基团通过空间取向和电子云密度差异作用于卤代烷基的碳原子上,形成一个新的碳-亲核键。
其次,在亲核攻击之后,离去基团(通常为卤素)发生离去,断裂最初的碳-卤素键。
该离去过程的速率决定了整个反应的速率。
然后,质子转移发生。
在离去基团单独离去后,质子会从溶剂中移动到离去基团原来的位置上,修饰亲核试剂中的亲核基团。
这一步骤的目的是使亲核试剂成为更好的离去基团,以促进下一步的亲核加成。
最后,亲核试剂中的亲核基团与离去基团断裂的碳原子进行亲核加成。
该步骤形成了新的碳-亲核键,生成烷基化产物。
反应的速率和选择性主要取决于亲核试剂的性质和反应条件。
二、烷基化反应的应用烷基化反应在有机合成中有着广泛的应用。
具体而言,它可以用来合成复杂的有机分子、改变分子的溶解性和活性,以及在药物和材料领域进行结构修饰。
首先,烷基化反应可以用来合成复杂的有机分子。
例如,通过选择不同的底物和亲核试剂,可以在不同的位置和方向上引入烷基,实现多样的化学转化。
这对于制备药物和天然产物中的生物活性基团非常重要。
其次,烷基化反应可以改变分子的溶解性和活性。
通过在分子结构中引入烷基,可以增加分子的亲疏水性,从而改变其在溶液中的行为。
这对于药物分子的溶解度和生物可利用性有着重要的影响。
最后,烷基化反应在药物和材料领域中进行结构修饰具有重要意义。