分子间的作用力和氢键
- 格式:ppt
- 大小:693.00 KB
- 文档页数:25

一化学键分子间作用力氢键的比较化学键、分子间作用力和氢键是化学中常见的不同类型的相互作用力。
它们在分子之间产生不同程度的相互作用,并且对物质的性质和行为产生不同的影响。
首先,化学键是不同原子之间的原子核间互相吸引的结果,是由共价键、离子键和金属键等不同类型的键组成。
化学键的形成需要原子之间的电子重新排列以使得各个原子达到稳定的电子构型。
这种电子排列可以通过元素之间的电子共享、电子转移或者电子扩散的方式来实现。
化学键的强度取决于键的类型和原子之间的电负性差异。
通常来说,离子键的强度最大,共价键次之,金属键则较为弱。
分子间作用力是分子之间的非共价相互作用力。
分子间作用力较化学键弱,力程短,主要体现在物质的液体和固体状态中。
分子间作用力分为范德华力、静电吸引力和氢键等。
范德华力是非极性分子间的引力作用,主要由浓度偶极矩产生。
而静电吸引力是极性分子之间的互相吸引作用。
在分子中含有电荷不均匀分布的原子时,会产生局部正负电荷区,进而引发有偶极矩。
这些偶极矩可以相互作用,产生静电吸引力。
相较于化学键,分子间作用力是非常弱的力。
氢键是分子间作用力的一种特殊形式,通常发生在含有氢原子的电负性较高的原子(如氮、氧和氟)与电负性较低的原子(如氮、氧和碳)之间。
氢键形成时,氢原子与更电负的原子的部分正电荷相互作用,形成一个虚拟的氢原子。
这种相互作用力是静电吸引的一种特例,是由于电负性差异导致的分子间较强的极性相互作用力。
相比于其他分子间作用力,氢键的强度较大,能够影响物质的物理化学性质,如沸点、气相结构、溶解度和凝聚态等。
总结来说,化学键是原子之间的强有力的相互作用,通过共价键、离子键和金属键等形式存在于化合物中。
而分子间作用力是相对弱的非共价作用力,包括范德华力和静电吸引力。
氢键则是分子间作用力中的一种特殊形式,发生在含有氢原子的分子与电负性较高的原子之间。
这些相互作用力的不同特性和强度决定了物质在不同条件下的性质和行为。


考点49 分子间作用力和氢键聚焦与凝萃1.掌握分子间作用力的本质及分子间作用力与化学键的区别;2.掌握影响分子间作用力的因素,了解分子间作用力对物质性质的影响;3.了解氢键及氢键对物质性质的影响。
解读与打通常规考点1.化学键分类化学键⎩⎪⎨⎪⎧离子键共价键⎩⎪⎨⎪⎧极性(共价)键:X —Y 非极性(共价)键:X —X 2.化学反应的本质反应物分子内化学键的断裂和生成物分子内化学键的形成。
3.分子间作用力(1)定义:把分子聚集在一起的作用力,又称范德华力。
(2)特点①分子间作用力比化学键弱得多;②影响物质的物理性质,如熔点、沸点、溶解度,而化学键影响物质的化学性质和物理性质;③存在于由共价键形成的多数共价化合物和绝大多数非金属单质及稀有气体之间,如CH 4、O 2、Ne 等。
(3)规律一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。
例如:熔、沸点:HCl<HBr<HI ,I 2>Br 2>Cl 2>F 2,Rn >Xe >Kr >Ar >Ne >He 。
4.氢键(1)定义:分子间存在的一种比分子间作用力稍强的相互作用。
(2)形成条件:除H 外,形成氢键的原子通常是O 、F 、N 。
(3)存在:氢键存在广泛,如蛋白质分子、醇、羧酸分子、H 2O 、NH 3、HF 等分子之间。
分子间氢键会使物质的熔点和沸点升高。
特别提醒:(1)氢键不是化学键,是介于分子间作用力和化学键之间的一种作用力。
(2)氢键、分子间作用力的大小主要影响物质的物理性质,如熔点、沸点等。
隐性考点氢键对物质性质的影响(1)对物质熔沸点的影响①某些氢化物分子存在氢键,如H 2O 、NH 3,HF 等,会使同族氢化物沸点反常,如H 2O>H 2Te>H 2Se>H 2S 。
②当氢键存在于分子内时,它对物质性质的影响与分子间氢键对物质性质产生的影响是不同的。

分子间的力范德华力和氢键分子间的力:范德华力和氢键分子间的力是指分子之间相互作用的力,其中范德华力和氢键是两种常见的分子间力。
本文将对这两种力进行介绍和解析。
一、范德华力范德华力(van der Waals force)是一种相互吸引的力,起因于分子内部电荷分布的不均匀性。
它可以分为三种类型:弱的分散力(London力)、较强的取向力和最强的诱导力。
1. 分散力(London力)分散力是最弱的一种范德华力,主要存在于非极性分子之间。
分子内由于电子云的运动造成瞬时偶极矩的形成,进而引发相邻分子的极化作用,使它们之间发生吸引。
这种吸引力是瞬时性的,范德华力是由于瞬时偶极矩之间相互作用而形成的。
2. 取向力取向力是存在于极性分子之间的范德华力,是由于分子内的极性键引起的。
它是根据分子极性键的方向而产生的相互作用,类似于磁铁的N极和S极之间的吸引力。
3. 诱导力诱导力是范德华力中最强的一种类型,是由于一种分子的极化而诱发另一种分子的极化。
当一个非极性分子接近一个由极性键组成的分子时,它会被诱导成有临时极性,这样会引发两种分子之间的相互吸引。
总结:范德华力是一种微弱但广泛存在的分子间作用力,它对物质的性质和相互作用具有重要影响。
二、氢键氢键(hydrogen bond)是分子间的一种特殊强力相互作用,主要存在于带有氢原子的分子中。
氢键可以发生在分子中的氢与另一个带有电负性原子(如氮、氧和氟)之间的相互作用。
氢键的形成是通过氢原子与接受者原子形成一个氢和一个共价键,同时将电子密度极大地转移到接受者原子上。
氢键通常是可逆的,并且在分子之间形成临时的化学键,类似于范德华力的诱导力。
氢键的强度通常比较大,可以影响物质的性质和化学反应。
三、范德华力与氢键的区别范德华力和氢键虽然都属于分子间作用力,但是它们有一些明显的区别。
1. 强度不同:范德华力相对较弱,而氢键相对较强。
2. 形成条件不同:范德华力主要由于分子内电荷的不均匀性形成,而氢键则是通过氢原子和电负性原子之间的相互作用形成。


分子间作用力包括静电、氢键、离子偶极
分子间作用力是指分子之间的相互作用力,它们是维持分子结构和化学反应的基础。
分子间作用力包括静电、氢键、离子偶极等多种类型,下面我们将分别介绍它们的特点和作用。
静电作用力是指由于电荷之间的相互作用而产生的力。
当两个分子中的电荷不平衡时,它们之间就会产生静电作用力。
例如,当两个分子中一个带正电荷,一个带负电荷时,它们之间就会产生吸引力。
静电作用力在分子间的相互作用中起着重要的作用,它可以影响分子的构象和化学反应。
氢键是一种特殊的分子间作用力,它是由于氢原子与氮、氧、氟等元素形成的强电负性差而产生的。
氢键的作用力比静电作用力弱,但是它在生物分子的结构和功能中起着重要的作用。
例如,DNA分子中的氢键可以保持DNA的双螺旋结构,从而维持DNA的稳定性。
离子偶极是指分子中存在正负电荷分布不均的情况。
当分子中的正负电荷分布不均时,就会形成离子偶极。
离子偶极的作用力比静电作用力弱,但是它在分子间的相互作用中也起着重要的作用。
例如,当两个分子中一个带正电荷,一个带负电荷时,它们之间就会产生离子偶极作用力。
分子间作用力是维持分子结构和化学反应的基础,它们包括静电、氢键、离子偶极等多种类型。
这些作用力在分子间的相互作用中起
着重要的作用,它们可以影响分子的构象和化学反应,从而影响生物分子的结构和功能。
因此,研究分子间作用力对于理解生物分子的结构和功能具有重要的意义。


分子间内氢键作用力与分子间氢键作用力分子间内氢键作用力与分子间氢键作用力是化学中重要的概念。
它们是分子之间相互作用的一种形式,对于分子的稳定性和物理性质都具有重要的影响。
本文将从两种作用力的定义、基本特征、形成机制、应用等方面进行详细的解释和探讨。
一、分子间内氢键作用力1.定义:内氢键是指同一分子内的氢原子与其他原子间的氢键作用力。
2.基本特征:内氢键是一种分子内的相互作用,其特征包括:氢键通常由含有活性氢的官能基团所产生,如甲基羰基、羧基等;内氢键的键能很小,一般为1-3 kcal/mol;内氢键能够影响分子的构象、化学反应和物理性质。
3.形成机制:内氢键作用力的形成机制主要涉及到氢键中氢原子的偏移。
在某些分子中,由于原子的电负性产生分子内电荷分离,它们之间的差异会导致H-C、H-O、H-N之间的偏移,因此建立了内氢键。
4.应用:内氢键作用力是药物分子设计中需要考虑的因素之一。
例如,内氢键的存在可以增加分子的稳定性和药效,同时也有助于解释某些药物的药效和副作用。
二、分子间氢键作用力1.定义:分子间氢键是指不同分子之间,氢原子与非金属原子之间的氢键作用力。
2.基本特征:分子间氢键是分子间的相互作用,其特征包括:分子间氢键通常由含氢官能团的一种分子与其他原子含有氧、氮、氯等原子的另一种分子之间产生氢键;分子间氢键的键能相对较强,一般为5-10 kcal/mol;分子间氢键能够影响分子的物理和化学性质。
3.形成机制:分子间氢键的形成主要涉及到两个分子中的氢键原子之间的相互作用。
一般来说,氢键原子所在的分子通常是具有高电负性的分子,如氨、水、醇等;而另一种分子则具有较强的电正性原子或键合电子云的位置,如含氧化合物、含氮化合物等。
两者之间的相互作用导致氢键的形成。
4.应用:分子间氢键作用力在生物大分子和有机化合物的结构中具有重要的作用。
许多生物大分子,如DNA、蛋白质等,都是由分子间氢键所组成的稳定结构;同时,许多有机物,如醇、醛、酮等,也是通过分子间氢键增加其稳定性和改变其物理性质。

高中化学:分子间作用力和氢键知识点[知识详解]一.分子间作用力1.定义:分子间存在着将分子聚集在一起的作用力,称分子间作用力。
分子间作用力也叫范德华力.2.实质:一种电性的吸引力.3.影响因素:分子间作用力随着分子极性.相对分子质量的增大而增大.分子间作用力的大小对物质的熔点.沸点和溶解度都有影响.一般来说.对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力越强,物质的熔沸点也越高.4.只存在于由共价键形成的多数化合物,绝大多数非金属单质分子和分子之间. 化学键是分子中原子和原子之间的一种强烈的作用力,它是决定物质化学性质的主要因素。
但对处于一定聚集状态的物质而言,单凭化学键,还不足以说明它的整体性质,分子和分子之间还存在较弱的作用力。
物质熔化或汽化要克服分子间的作用力,气体凝结成液体和固体也是靠这种作用力。
除此以外,分子间的作用力还是影响物质的汽化热、熔化热、溶解黏度等物理性质的主要因素。
分子间的作用力包括分子间作用力(俗称范德华力)和氢键(一种特殊的分子间作用力)。
分子间作用力约为十几至几十千焦,比化学键小得多。
分子间作用力包括三个部分:取向力、诱导力和色散力。
其中色散力随分子间的距离增大而急剧减小一般说来,组成和结构相似的物质,分子量越大,分子间距越大,分子间作用力减小,物质熔化或汽化所克服的分子间作用力减小,所以物质的溶沸点升高温度止200 150 100, 50 0 -50 -100 -150 -200熔温度尺200 150叫0 -50 -100 -150 -200熔叫相对分子质■筑卤化碳的熔.沸点与相对分子质量的关系化学键与分子间作用力比较化学键分子间作用力概念 相邻的原子间强烈的相互作用 物质分子间存在的微弱的相互作用能量 较大很弱性质影响主要影响物质的化学性质主要影响物质的物理性质.氢键一特殊的分子间作用力1.概念:氢键是指与非金属性很强的元素(主要指N 、O 、F )相结合的氢原子与另一个分子中非金属性极强的原子间所产生的引力而形成的.必须是含氢 化合物,否则就谈不上氢键。

分子间作用力的四种形成方式分子间作用力是分子之间相互作用的力量,它是物质存在和物质性质产生的基础。
分子间作用力的形成方式有四种,分别是范德华力、氢键、离子键和共价键。
一、范德华力范德华力是分子间最常见的一种作用力,它是由于分子内部电子的运动导致的。
分子中的电子在空间中的运动会引起电荷分布的不均匀,从而形成一种瞬时的偶极矩。
这种偶极矩会与附近的分子偶极矩相互作用,产生吸引力,即范德华力。
范德华力的大小与分子的极性有关,极性越大,范德华力越强。
二、氢键氢键是指分子中氢原子与氧、氮、氟等高电负性原子之间的相互作用。
氢键的形成需要具备三个条件:①氢原子与较电负的原子之间的键能较强,如氢原子与氮原子之间的键能;②氢原子与较电负的原子之间的距离适当,一般在1.5-2.5埃之间;③氢键的形成需要在分子中存在较为稳定的空间构型。
氢键的强度介于共价键和离子键之间,它对物质的性质起到重要的影响。
三、离子键离子键是指由正离子和负离子之间的静电作用力形成的化学键。
在离子键中,正离子和负离子之间相互吸引,形成离子晶体的结构。
离子键的强度较大,使离子晶体具有高熔点、高硬度和良好的导电性等性质。
离子键的形成需要具备两个条件:①正离子和负离子之间的电荷差异较大;②正离子和负离子之间的距离较近。
四、共价键共价键是指由两个非金属原子共享电子而形成的化学键。
在共价键中,原子之间通过电子的共享而相互吸引。
共价键的强度较大,使得共价化合物具有较高的熔点和沸点。
共价键的形成需要满足两个条件:①原子之间的电负性差异较小;②原子之间的距离适当。
共价键的形成可以是单一共价键、双键或者三键,共价键的类型决定了化合物的性质。
分子间作用力的四种形成方式分别是范德华力、氢键、离子键和共价键。
这些作用力对物质的结构和性质具有重要的影响,深入了解分子间作用力的形成方式有助于我们更好地理解物质的性质和相互作用。
必修2第一章第三节化学键第三课时【学习目的】1、掌握分子间作用力含义与氢键的判断2、强化离子键和共价键的知识【学习重点】分子间作用力、氢键的应用【学习难点】氢键的判断【新知学习】一、化学键:1、定义:使离子或原子相结合的作用力称为化学键。
2、分类:、、3、离子键和共价键的比较:4、化学反应的实质:旧键的和新键的。
二、分子间作用力①概念:分子之间存在着一种把分子叫做分子间作用力,又称。
②强弱:分子间作用力比化学键,它主要影响物质的、等物理性质,化学键属分子内作用力,主要影响物质的化学性质。
③规律:一般来说,对于组成和结构相似的物质,越大,分子间作用力,物质的熔点、沸点也越。
④存在:分子间作用力只存在于由分子组成的共价化合物、共价单质和稀有气体的分子之间。
在离子化合物、金属单质、金刚石、晶体硅、二氧化硅等物质中只有化学键,没有分子间作用力。
三、氢键①概念:像、、这样分子之间存在着一种比的相互作用,使它们只能在较高的温度下才能汽化,这种相互作用叫做氢键。
②对物质性质的影响:分子间形成的氢键会使物质的熔点和沸点,这是因为固体熔化或液体汽化时必须破坏分子间的氢键,消耗更多的能量。
【注意】分子间作用力和氢键由于作用力较弱,都不属于化学键!四、知识整理1、离子键:使阴、阳离子结合成化合物的静电作用叫做离子键由离子键结合在一起的化合物叫离子化合物【离子键的存在范围】(1)、活泼金属与活泼非金属形成的化合物;(2)、活泼金属阳离子(或NH4+)与酸根离子之间;(3)、活泼金属阳离子与OH—之间;2、电子式:在元素符号周围用小黑点或小叉表示最外层电子数的式子叫电子式掌握NaCl/MgO/K2O/CaCl2/Na2O2/NH4Cl/NaOH 电子式的写法3、共价键:原子之间通过共用电子对所形成的相互作用,叫做共价键掌握NH3,CH4,CO2,N2,O2,HClO,H2O2电子式的写法4、极性键与非极性键同种非金属元素原子之间形成非极性共价键(非极性键,可存在于非金属单质和化合物中)不同种非金属元素原子之间形成极性共价键(极性键,只存在与化合物中)(1)、含有离子键的化合物一定是离子化合物(2)、含有共价键的化合物不一定是共价化合物注意离子化合物的形成过程与共价化合物的形成过程写法的不同。
分子间作用力和氢键我们已讨论了三类化学键(离子键、共价键、金属键),它们都是分子内部原子间的作用力。
原子通过这些化学键组合成各种分子和晶体。
除此之外,分子与分子之间还存在着一种较弱的相互作用,大约只有几个到几十个KJ·mol-1,比化学键小一、二个数量级,这种分子间的作用力称为范德华尔力。
它是决定物质熔点、沸点、溶解度等物理化学性质的一个重要因素。
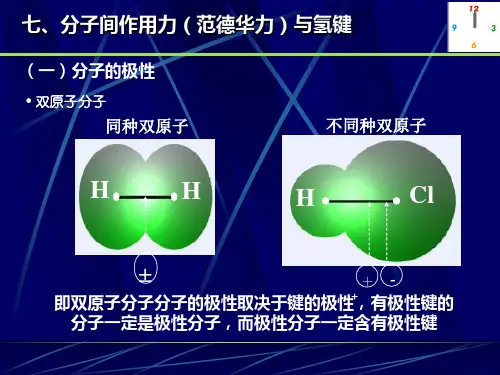
【分子的极性】分子极性的强弱,可以用偶极矩(μ)表示。
分子偶极矩定义为:偶极长(极性分子正负电荷之重心间的距离d与偶极电荷q的乘积,即:μ=q ×d◆分子的偶极矩是个矢量,正偶极子指向负偶极子。
对双原子分子而言,分子偶极矩等于键的偶极矩;对多原子分子而言,分子偶极矩则等于各个键的偶极矩的矢量和。
◆多原子分子的极性不但取决于键的极性,而且取决于分子的几何形状,例如:SO2、CO2中S=O键、C=O都是极性键,但因为CO2是直线型结构,键的极性相互抵消,正负电荷重心重叠,所以,CO2是非极性分子。
相反,SO2为V 型结构,正负电荷重心不能重合,因而SO2是极性分子。
◆具有对称结构(直线型、平面三角形、正四面体)的多原子分子,偶极矩为零,为非极性分子;结构不对称(V型、四面体、三角锥型)的多原子分子,偶极矩不为零,为极性分子◆单质分子的偶极距不一定为0,如O3◆键的偶极长不是核间距,HF、HCl、HBr、HI的偶极长降低(两原子电负性差值越大,键的偶极长越大)◆CO分子中,C原子有一个空的2p z轨道,接受了O原子的一对电子,从而使分子的负电重心移向了C原子因为一个电子所带电量为4.8×10-10静电单位,而偶极长d相当于原子间距离,其数量级为10-8 cm。
通常把10-18厘米·静电单位作为偶极矩μ的单位,称为“德拜”(Debye)用D表示。
偶极矩是一个矢量,可以通过实验测得。
偶极矩越大,分子极性越大,偶极矩μ=0,它是非极性分子。