鸡胚成纤维细胞制备PPT课件
- 格式:ppt
- 大小:553.00 KB
- 文档页数:16

鸡胚成纤维细胞单层培养一、原理离体的器官、组织、细胞短时间并不死亡。
对机体的器官、组织、细胞提供适当的环境条件和营养物质,可使其在离体情况下继续生长和繁殖,这种技术方法分别称之为器官培养、组织培养、细胞培养,一般统称为组织培养,而在病毒学研究中通常指的是细胞培养。
原代细胞单层培养就是在无菌条件下,直接从机体取出器官和组织的全部或一部分,用机械方法或适当的组织分散剂(一般用胰蛋白酶)消化处理,使组织快分散成单个细胞悬液。
经洗涤和细胞计数,定量分装到一定的容器内,提供该细胞生长所必须的环境条件和营养物质,促使细胞贴壁并不断分裂生长繁殖,直至成均匀致密的细胞单成。
多种动物、植物、人的组织都可以用来进行细胞培养。
在实际工作中,对细胞来源的选择主要是根据细胞对病毒的易感性,细胞来源难易来决定的。
二、目的和要求了解细胞培养的一般原理,掌握原代细胞单成培养的操作技术。
三、实验材料1、孵育10日龄发育良好的鸡胚。
2、抗菌素溶液(每ml含青霉素10000单位、链霉素10000微克);碳酸氢钠液。
3、洗涤液:Hank’s液(经碳酸氢钠液调节PH为7.0~7.2);无钙、镁离子磷酸缓冲液(CMF-PBS)。
4、细胞分散剂:0.25%胰蛋白霉溶液。
5、营养液:0.5%水解乳蛋白-Hank’s液(LH液,也称乳汉液),加入1%抗菌素溶液,5%小牛血清,用碳酸氢钠调节PH为7.0~7.2。
6、实验器械:卵架、碘酒和酒精消毒棉球、酒精灯、镊子、血球计数板、显微镜、水浴锅、温箱、吸球、灭菌眼科镊和剪、培养瓶、橡皮塞、吸管、平皿、三角瓶、烧杯、带有过滤纱布(四层)的漏斗。
四、操作方法1、鸡胚的获得及处理:(1)去10日龄发育良好的鸡胚,照蛋标出气室。
气室向上直立于卵架上,依次用碘酒和酒精棉球由中央及四周涂抹卵壳除菌消毒。
无菌操作下,用镊子去除气室部卵壳;换无菌镊子去处壳膜,穿破绒毛尿囊膜夹住鸡胚胎颈部,取出鸡胚放于灭菌平皿中。
(2)除去鸡胚头、翅、肢体,清除内脏,用Hank’s液冲洗鸡胚三次。

鸡胚成纤维细胞培养1、准备:取各种已消毒的培养用品置于净化台面,紫外线消毒20分钟。
开始工作前先洗手、75%酒精擦拭手至肘部。
2、布局:点燃酒精灯,安装吸管帽。
3、选胚:取9-10日龄鸡胚,(注:鸡胚日龄越小,形成细胞活力越好,但产量较低)用新洁尔灭消毒蛋壳10分钟后放净化台。
用碘酒、酒精消毒蛋壳。
用镊子打开气室。
4、用另一套镊子将壳膜打开将鸡胚夹起去头、爪、眼,放灭菌生理盐水中。
5、把组织块置于烧杯中,用Hanks液漂洗2~3次,去除血污;如怀疑组织可能污染,可先置于含有青链霉素的混合液中30~60分钟。
6、剪切:用眼科剪把组织切成1~2毫米大小的块,以便于消化。
7、处理组织:将已剪碎的组织碎片倒入一个带玻璃珠的灭菌三角瓶中,其中加入0.25%的胰酶,10个胚约7ml,或加组织消化液,一个胚1ml(组织消化液以及胰酶的配置见微生物指导)结扎瓶口或塞以胶塞。
8、消化:将其置入37℃水浴箱中或用恒温水浴,消化中应不停摇动,如用电磁恒温搅拌器消化更好。
消化时间依组织块的大小和组织的硬度而定。
消化10-15分钟。
一般约12分钟。
视鸡胚日龄大小而定。
越小消化时间越短。
见组织松软即可。
一般不可消化时间太长否则容易导致细胞活力不足。
9、分离:在消化过程中见消化液发混浊时,可用吸管吸出少许消化液在镜下观察,如组织已分散成细胞团或单个细胞,立即终止消化,加入0.5%的含5%犊牛血清双抗的的水解乳蛋白Hank,s液少许。
(制法见微生物试验实习指导),用力震摇,或用吸管吹打。
使细胞分散,脱落。
然后用纱布过滤或随即通过适宜不锈钢筛,滤掉尚未充分消化开的组织块。
低速(500~1000转/分)离心消化液5分钟,吸出上清(可以不离心吸掉上清),加入适量含有血清的培养液。
10、计数:用计数板计数,如细胞悬液细胞密度过大,再补加培养液调整后,分装入培养瓶中。
对大多数细胞来说,pH要求在7.2~7.4范围,培养液呈微红色,如颜色偏黄,说明液体变酸,可用NaHCO3调整。



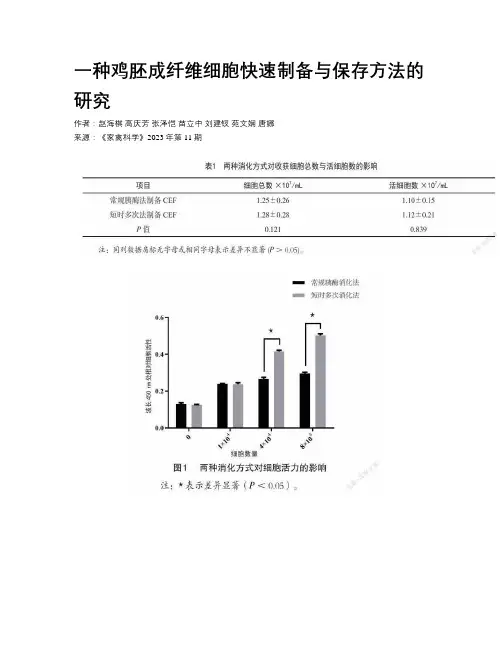
一种鸡胚成纤维细胞快速制备与保存方法的研究作者:赵海棋高庆芳张泽恺苗立中刘建钗苑文娴唐娜来源:《家禽科学》2023年第11期摘要:为了进一步提高鸡胚成纤维细胞(Chicken embryo fibroblast,CEF)的制备效率和活力,试验以短时多次消化法缩短胰酶消化时间,提高细胞活力。
同时,通过优化血清、胰酶、培养基等保存条件,增加细胞4 ℃保存时间。
经CCK-8细胞活性检测、活细胞计数、传代培养等方法比较验证,结果表明,所建立的制备方法简易、快速、细胞活力高;细胞在4 ℃、不添加血清和胰酶的DMEM培养基中保存96 h内仍保有良好的贴壁生长能力。
该方法的建立为实验室内快速制备CEF细胞提供候选方案,可有效减少鸡胚的使用。
关键词:鸡胚成纤维细胞;细胞制备;细胞保存; 原代细胞;细胞培养作为细胞生物学试验研究中的一个重要环节,细胞培养技术被广泛应用于现代生物工程、生命科学和药物研发等领域,原代细胞也已成为基本的细胞生物学试验研究样品,在生理学、细胞生物化学、药学、毒理学等研究领域广泛应用。
其中,鸡胚成纤维细胞(Chicken embryo fibroblast,CEF)因具有适应性强、繁殖速度快、来源广、成本低等优势,被大量应用于生物工程研究与疫苗生产中,多种常见的病毒如禽马立克病毒(Marek’s disease virus,MDV)[1]、传染性法氏囊病毒(Infectious bursal disease,IBDV)[2]、火鸡疱疹病毒(Herpesvirus of turkey,HVT)[3]等的研究都以CEF为重要材料。
目前,实验室制备CEF需要现用现制,大量使用鸡胚,既增加受污染的风险,也不利于动物福利,还给试验研究带来额外的工作量。
因此,通过多次试验,本研究尝试建立一种快速、小量制备鸡胚成纤维细胞的候选方案,在保障细胞活力、提高制备效率的同时,能够降低受污染风险,且可短期保存细胞,从而减少制备次数和鸡胚使用量。

鸡胚成纤维细胞(CEF)、鸭胚成纤维细胞(DEF)培养一、材料9¬10日龄鸡胚13¬14日龄鸭胚眼科剪、镊、外科镊、巴氏吸管、蛋架、灭菌平皿 25ml小三角瓶Hanks'液 0.25%胰酶液 Versene液灭菌纱布、玻璃漏斗、0.1% 结晶柠檬酸(0.1M)或0.4%台盼兰,血球计数板、60ML培养瓶或60ML培养皿、灭菌盖玻片、营养液。
二方法(CEF为例)鸡胚理:取9¬10日龄鸡胚直于蛋架,在气室部用于5%碘酊棉消毒,再用洒精棉脱色,用外科镊击破蛋壳用眼科镊取出胚体放于平皿内,去喙瓜眼和内脏,用Hank's液洗两次,用弯头眼科剪剪胚剪成1-2mm的碎块,加Hank’s液20ml,略加摇振,静置使组织块下沉,将混有红血球及碎片的上悬液吸去,重复洗2—3次,直至上悬液不混浊为止。
2、消化:将0.25%胰蛋白酶溶液用5、6%NaHCO2滴定至PH7、6—7、8,加热至37度,按组织块量3—5倍加于装有鸡胚碎块的三角瓶中,每个鸡胚约需胰酶5ml,30分钟取出,静置1—2分钟,吸去胰液,再加HanK’s 液20ml,轻轻摇动后吸去,如此反复两三次,目的是洗去残余的胰酶。
第三次加入营养液,每胚3ml左右,用粗口吸管吹吸数次,使细胞脱落分散。
静置1—2分钟,候组织下沉后,细心将细胞悬液吸出,另置一只25ml三角瓶,如此反复数次,使细胞尽量自组织块脱落,将多次取得的悬液合并一处,纱布过滤悬液。
必须注意每次吹吸一般6—7次为宜,太多则细胞受损,消化时间要灵活掌握,不足细胞不易掊落,太久则细胞破碎。
在消化过程中,摇动时组织不易下沉即立即停止,消化后如组织粘连如涕,证明消化过度。
二、细胞计数:取细胞悬液0.1(100ul)置盛有0.9ml10.4%台盼蓝的试管中混合,用血球计数板计数。
计算方法:4大方格细胞数每ml细胞数=——————————————X10(5)45中格细胞数或每ml细胞数=——————————X10(4)三:接种以营养液配成每ml10(6)细胞(最终稀释度)接种链霉素瓶(1ml)、60ml瓶(8—10ml),100mm dish(10ml),60mm dish(4ml),37度孵育48小进后形成单层,接种病毒或作次代培养。




室温消化法制备鸡胚成纤维细胞的试验研究鸡胚组织是组织培养最早被利用的对象。
早年组织培养工作者,如Carrel等曾用鸡胚做过大量研究工作。
目前,鸡胚成纤维细胞已被广泛应用于细胞和分子生物学研究的许多方面,这主要是由于成纤维细胞是最易培养的细胞,其良好的耐受性使之易于进行从基因转染到微注射等较多领域的研究。
本试验经长期摸索、比较、找到一种制备鸡胚成纤维细胞的优化方法——室温消化法。
1材料与方法1.1材料1013龄SPF鸡胚由广东省永顺兽医厂提供。
DMEM原粉购自美国GIBCO公司,按说明书添加双蒸水、NaHCO,,调pH值至7.0,正压滤过除菌,4~C保存。
使用前添加10%~b牛血清、1%双抗。
小牛血清购自上海实生细胞生物技术有限公司,一20~C保存,使用前56℃水溶30min,再用孔径0.22m的滤膜滤过除菌。
Hanks液用江苏宜兴市赛尔生物化工厂生产的Hanks液干粉,按说明书添加双蒸水正压滤过除菌,用前调pH值至7.2—7.6,4℃保存。
2.5g/L胰蛋白液由胰蛋白酶(东方科学仪器进出口公司分装,活性1:250)加Hanks液、双抗液配制而成,一20%保存用前调pH值至7.6—7.8。
%10000U/mL青霉素和10000g /mL链霉素的双抗及7.5%碳酸氢钠液按常规方法制备。
1.2鸡胚成纤维细胞的制备取1013龄鸡胚2个,用无菌方法将胚提出放入无菌平皿中,去喙、爪、翅和内脏,剪成小块以Hanks液洗2~3次,移入无菌内含磁力搅拌棒的50mL锥形瓶中,再用Hanks搅拌洗涤23次,然后以每个鸡胚10mL 的量加入2.5g/L胰蛋白酶液,室温低速磁力搅拌消化10~15min。
消化完毕,以8层灭菌纱布滤过,将滤液离心去除胰蛋白酶消化液,再用DMEM细胞培养液将细胞悬起计数分装于细胞培养瓶中,置37~C含5%CO的培养箱中培养24h。
2结果每个鸡胚可以制备出约1.8X10个细胞。
培养4h即先贴壁生长,20~22h细胞能至70%~80%贴壁长满单层,细胞团块及少、死亡未贴壁的悬浮细胞少且整体贴壁细胞长势旺盛,这种细胞最易于进行转染等应的基因工程操作如图所示,如果应用于病毒分离培养等操作,应延长培养细胞至24h为宜。
鸡胚成纤维细胞的原代培养171850044生拔钱诗晨一、背景知识1.1原代培养与传代培养1.1.1原代培养是指直接从生物体取材(细胞、组织或器官)进行的第一次培养(中途不分割培养物、不更换培养物的生长器皿)。
1.1.2传代细胞培养分割细胞培养物进行的再配养注:细胞培养的代不是指细胞分裂次数,而是指培养的次数1.2细胞体外培养要求的条件✓无菌✓适宜温度:哺乳动物细胞36.5℃ 0.5℃,植物细胞原生质体25℃左右✓生理渗透压✓适宜酸碱度:7.2-7.4✓气体:95%空气+5%二氧化碳✓培养基:提供水、各种有机营养(糖、氨基酸、维生素等)及无机盐、生长调节因子等1.3培养细胞生长类型悬浮型:培养时不黏附于支持物之上。
而呈现悬浮生长的细胞。
贴壁型:培养时需要黏附于一定固相支持物表面才能很好生长的细胞。
又称黏附依赖型细胞(分如下四类)✧成纤维细胞:胞体呈梭形或不规则三角形,中央有卵圆形核,胞质突起,生长时呈放射状。
✧上皮型:细胞呈扁平不规则多角形,中央有圆形核,细胞彼此紧密相连成单层膜。
✧游走型:呈散在生长,一般不连成片,胞质常突起,呈活跃游走或变形运动,方向不规则。
此型细胞不稳定,有时难以和其他细胞相区别。
在一定条件下,如培养基化学性质变动等,它们也可能成纤维细胞形态。
✧多形型:是一些形态上不规则的细胞。
细胞一般分胞体和胞突两部分,胞体呈不规则多边形,胞突呈细长丝状。
如神经元和神经胶质细胞1.4原代细胞培养的一般办法1.4.1植块培养法直接将组织块接入培养皿底部,待组织块贴牢在底部后再加入培养基培养的方法1.4.2离散细胞培养法用酶消化组织,使细胞之间连接破坏,将组织离散成单细胞悬液进行培养的方法注:原代培养中的植块培养法与组织培养不是一回事;植物组织培养又叫离体培养,指从植物体分离出符合需要的组织、器官或细胞、原生质体等,通过无菌操作,在人工控制条件下进行培养以获得再生的完整植株或生产具有经济价值的其他产品的技术。
一、鸡胚成纤维细胞的体外培养鸡胚成纤维细胞在病毒学研究中十分常用。
孵化8-12d的鸡胚可用作培养的材料来源。
(一)实验材料1. 鸡胚:孵化10d的受精蛋数个。
孵化方法是将受精蛋放到38.5℃孵卵箱或恒温箱中,静置。
每日翻动1—2次,以防止鸡胚粘连到蛋壳上影响发育。
箱内湿度(40~70%)可通过在箱底放一盛水盘来维持。
鸡胚的孵化期为2ld。
孵化前,如遇蛋壳表面污物较多,可用刀片等器具刮除,不要用湿布擦拭,更不能用酒精棉球消毒或者用水洗蛋。
孵育前可将受精蛋保存在10℃左右,保存期一般不超过10d。
也有人将受精蛋保存在4℃冰箱中。
2. 消化液:含0.25%胰蛋白酶、青霉素100 1U/ml、链霉素100 μg/ml混合消化液。
用Hanks 液或HEPES液配制。
3. 培养液:DMEM培养液,添加10%-20%的胎牛血清(FCS)、青霉素100 IU/ml、链霉素100 μg/mL。
4. 其它培养用品:手术器械、平皿、三角瓶或15ml血清瓶、离心管、100目不锈钢筛网、培养瓶或培养板、振荡水浴箱、离心机等。
(二)操作步骤1)取孵化10d的鸡胚,分别用碘酒与酒精棉球擦拭消毒,晾干。
用一已消毒金属器具将受精蛋大头端击破,用镊子小心夹去破碎蛋壳,然后撕去气室外面的膜,暴露出尿囊绒膜及附着的血管。
开口大小以受精蛋内容物不溢出为宜,但不宜太小。
用镊子轻轻夹住鸡胚的颈部,小心取出鸡胚,放于无菌培养皿中,除去头部、四肢、内脏和皮肤。
2)胚体用Hanks液或生理盐水清洗3次,切成1-2 mm3的小块,然后转移到容积适中的三角瓶或15ml血清瓶内。
3)加入适量消化液,一般每10个鸡胚加20 m1消化液,用胶塞密封瓶口。
4)在振荡水浴箱上37℃慢速搅拌5-10 min。
加入少量血清钝化胰蛋白酶。
然后通过100目不锈钢筛网,制备细胞悬液,将细胞悬液转移到离心管中。
5)离心(800 rpm,10 min),弃上清液,将细胞沉淀用培养液洗2次。