化学计算题单元测试题(含答案)经典 (3)
- 格式:doc
- 大小:241.50 KB
- 文档页数:8

化学单元测试题及答案一、选择题(每题2分,共20分)1. 以下哪种物质属于混合物?A. 纯水B. 空气C. 纯金D. 纯银2. 化学变化和物理变化的根本区别在于:A. 是否有新物质生成B. 是否有颜色变化C. 是否有能量变化D. 是否有状态变化3. 根据质量守恒定律,下列说法正确的是:A. 化学反应前后元素的种类不会改变B. 化学反应前后原子的种类不会改变C. 化学反应前后原子的数目不会改变D. 化学反应前后原子的质量不会改变4. 以下哪种物质属于化合物?A. 氧气B. 二氧化碳C. 氢气D. 铁5. 根据化学方程式,下列说法正确的是:A. 化学方程式表示了反应物和生成物之间的质量关系B. 化学方程式表示了反应物和生成物之间的体积关系C. 化学方程式表示了反应物和生成物之间的数量关系D. 化学方程式表示了反应物和生成物之间的能量关系6. 以下哪种物质属于单质?A. 氧气B. 二氧化碳C. 氢气D. 铁7. 根据化学方程式,下列说法正确的是:A. 化学方程式中的系数表示了反应物和生成物之间的质量比B. 化学方程式中的系数表示了反应物和生成物之间的体积比C. 化学方程式中的系数表示了反应物和生成物之间的数量比D. 化学方程式中的系数表示了反应物和生成物之间的能量比8. 以下哪种物质属于氧化物?A. 氧气B. 二氧化碳C. 氢气D. 铁9. 根据化学方程式,下列说法正确的是:A. 化学方程式中的系数表示了反应物和生成物之间的质量比B. 化学方程式中的系数表示了反应物和生成物之间的体积比C. 化学方程式中的系数表示了反应物和生成物之间的数量比D. 化学方程式中的系数表示了反应物和生成物之间的能量比10. 以下哪种物质属于酸?A. 硫酸B. 氢氧化钠C. 氯化钠D. 碳酸氢钠二、填空题(每空1分,共20分)1. 化学变化的特征是:有新物质生成,同时伴随着能量的变化,如放热或吸热。
2. 化学反应的实质是:原子的重新组合。
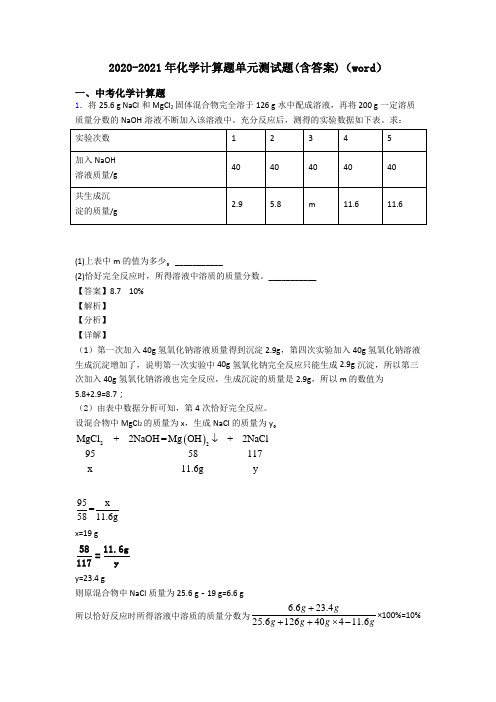
2020-2021年化学计算题单元测试题(含答案)(word )一、中考化学计算题1.将25.6 g NaCl 和MgCl 2固体混合物完全溶于126 g 水中配成溶液,再将200 g 一定溶质质量分数的NaOH 溶液不断加入该溶液中。
充分反应后,测得的实验数据如下表。
求:(1)上表中m 的值为多少。
___________(2)恰好完全反应时,所得溶液中溶质的质量分数。
___________ 【答案】8.7 10% 【解析】 【分析】 【详解】(1)第一次加入40g 氢氧化钠溶液质量得到沉淀2.9g ,第四次实验加入40g 氢氧化钠溶液生成沉淀增加了,说明第一次实验中40g 氢氧化钠完全反应只能生成2.9g 沉淀,所以第三次加入40g 氢氧化钠溶液也完全反应,生成沉淀的质量是2.9g ,所以m 的数值为5.8+2.9=8.7;(2)由表中数据分析可知,第4次恰好完全反应。
设混合物中MgCl 2的质量为x ,生成NaCl 的质量为y 。
()22MgC +=+l 2NaOH Mg OH 29558117NaC x yl11.6g↓95x=5811.6gx=19 g5811.6g=117yy=23.4 g则原混合物中NaCl 质量为25.6 g -19 g=6.6 g 所以恰好反应时所得溶液中溶质的质量分数为6.623.425.612640411.6g gg g g g+++⨯-×100%=10%答:恰好完全反应时,所得溶液中溶质质量分数为10%。
2.将14.06g 粗还原铁粉(假设粗还原铁粉中杂质仅含少量Fe x C )与足量稀硫酸反应,得到0.48gH 2 (Fe x C 与稀硫酸反应不产生H 2)。
若将相同质量的粗还原铁粉在氧气流中完全反应,得到0.22gCO 2.试通过计算确定: (1)此粗还原铁粉中单质铁的质量_____ (2)此粗还原铁粉中杂质Fe x C 的化学式。
_____ 【答案】13.44g Fe 2C 【解析】 【分析】 【详解】若将14.06g 还原铁粉(含少量Fe x C )在氧气流中加热,得到0.22gCO 2,碳元素的质量=0.22g ×1244=0.06g (1)将相同质量的还原铁粉与足量硫酸反应,得到0.48gH 2,设消耗铁的质量为x 。

化学前四单元测试题及答案一、选择题(每题2分,共20分)1. 化学变化和物理变化的根本区别在于:A. 是否有新物质生成B. 是否有颜色变化C. 是否有状态变化D. 是否有能量变化2. 原子核中质子数和中子数之和称为:A. 原子量B. 原子序数C. 相对原子质量D. 核电荷数3. 根据元素周期表,下列元素中原子半径最大的是:A. 氢B. 氧C. 钠D. 氯4. 金属元素的原子最外层电子数一般:A. 大于4B. 小于4C. 等于4D. 等于85. 以下哪个是单质?A. O₂B. CO₂C. H₂OD. NaCl二、填空题(每空2分,共20分)6. 化学方程式表示的意义包括_________、_________和_________。
7. 根据题目1中的选项,化学变化和物理变化的根本区别在于是否有_________生成。
8. 原子的核外电子排布遵循_________规则。
9. 元素周期表中,元素按照_________递增的顺序排列。
10. 根据题目5中的选项,单质是由_________元素组成的纯净物。
三、简答题(每题10分,共20分)11. 请简述质量守恒定律的内容及其在化学反应中的应用。
12. 什么是化学键?请举例说明离子键和共价键的区别。
四、计算题(每题15分,共30分)13. 某化学反应的化学方程式为:2H₂ + O₂ → 2H₂O。
若反应物中有6摩尔的氢气和3摩尔的氧气,问反应后生成水的摩尔数是多少?14. 已知某化合物的相对分子质量为60,其中碳元素的质量分数为40%,求该化合物的化学式。
答案一、选择题1. A2. C3. C4. B5. A二、填空题6. 反应物和生成物的种类、反应物和生成物的质量关系、化学反应的条件7. 新物质8. 能量最低9. 原子序数10. 单一三、简答题11. 质量守恒定律指出,在化学反应中,反应前后物质的总质量保持不变。
这一定律是进行化学反应计算的基础,可以帮助我们确定反应物和生成物的质量关系。

九上化学第三单元测试题(rj)及答案一、选择题1. 下列物质中,属于混合物的是:A. 氧气B. 矿泉水C. 铁D. 氢气2. 纯净物和混合物的区别在于:A. 颜色B. 状态C. 组成是否单一D. 是否可燃3. 根据题目1的选项,矿泉水属于混合物,因为:A. 含有多种矿物质B. 颜色多样C. 状态多变D. 可燃性4. 纯净物的特点是:A. 只由一种物质组成B. 可以燃烧C. 颜色单一D. 状态单一二、填空题5. 纯净物可以分为______和______。
6. 混合物的特点是由______组成。
7. 氧气是一种______,因为它只由氧元素组成。
三、简答题8. 请简述纯净物和混合物的区别。
四、实验题9. 如果要验证一种物质是否为纯净物,可以采用哪些实验方法?五、计算题10. 某工厂生产了一种化合物,其化学式为H2O,已知该化合物的相对分子质量为18,求该化合物中氢元素和氧元素的质量比。
答案:一、选择题1. B2. C3. A4. A二、填空题5. 单质化合物6. 不同种物质7. 纯净物三、简答题8. 纯净物和混合物的区别在于纯净物只由一种物质组成,而混合物由两种或两种以上的物质组成。
四、实验题9. 验证一种物质是否为纯净物的实验方法包括:化学分析法、物理分离法、光谱分析法等。
五、计算题10. 氢元素的相对原子质量为1,氧元素的相对原子质量为16。
H2O中氢元素的质量为2×1=2,氧元素的质量为16。
因此,氢元素和氧元素的质量比为2:16,简化后为1:8。

沪教版初三化学中考化学复习:计算题单元达标测试题一、选择题1.工业上用煅烧石灰石(主要成分为CaCO3)制取生石灰,其生产流程图如下:(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是t.(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)答案:(1)9 (2)8.04t【解析】【分析】【详解】(1)碳酸钙的质量=12t×75%=9t;故填:9;(2)设生成氧化钙的质量为x.则解之得:x=5.04t因为生成的生石灰中解析:(1)9 (2)8.04t【解析】【分析】【详解】(1)碳酸钙的质量=12t×75%=9t;故填:9;(2)设生成氧化钙的质量为x.则32 CaCO CaO+CO 100569t x高温10056=9t x解之得:x=5.04t因为生成的生石灰中含有未参与反应的杂质,杂质的质量=12t×(1﹣75%)=3t所以最终可以生产生石灰的质量=5.04t+3t=8.04t答:可生产生石灰8.04t.2.鱼缸中每升水溶解氧气的质量低于0.003g时,鱼就会死亡。
过氧化钙(CaO2)是一种化学增氧剂,反应的化学方程式为: 2CaO2+aH2O===2Ca(OH) 2+O2↑。
现将2.88g过氧化钙放入盛有200L水的鱼缸中。
请回答:(1)化学方程式中化学计量数a的数值为。
(2)通过计算分析:充分反应后,鱼缸中水的溶氧量是否符合最低要求(假设产生的氧气完全溶于水,其他因素忽略不计)。
答案:(1)2;(2)鱼缸中水的溶氧量符合最低要求【解析】(1)根据质量守恒定律,反应前后原子的种类和数目不变,H原子的数目2a=2×2,a=2;(2)设生成O2的质量为x,2CaO2+2H2O═解析:(1)2;(2)鱼缸中水的溶氧量符合最低要求【解析】(1)根据质量守恒定律,反应前后原子的种类和数目不变,H原子的数目2a=2×2,a=2;(2)设生成O2的质量为x,2CaO2+2H2O═2Ca(OH)2+O2↑,144 322.88g x144322.88g xx= 0.64g,200L水的鱼缸中最低溶解氧气的质量为:200L×0.003g/L=0.6g,因为反应生成的氧气质量大于最低需氧量,因此符合最低要求。

人教版九年级上册化学第三单元测试题一、单选题1.氯化钠由什么粒子构成?四位同学分别给出以下答案,你认为正确的是( )A.离子B.分子C.原子D.中子2.下列关于干冰升华过程的说法正确的是( )A.二氧化碳分子的体积变大B.二氧化碳分子的质量变小C.二氧化碳分子的种类改变D.二氧化碳分子间的间隔变大3.下列符号表示两个氢原子的是( )A.H+B.2H C.H2D.2H24.下列各组元素中,元素符号的第一字母相同的一组是A.氯、碳、钙、铜B.氢、汞、铁、银C.钠、镁、氧、氮D.锰、硫、锌、钡5.铈(Ce)是一种常见的稀土元素,已知一种铈原子的原子核内有58个质子和82个中子,该原子的核外电子数为A.24 B.58 C.82 D.1406.下列关于原子、分子的说法错误的是( )A.分子可以构成物质,而原子只能构成分子B.在化学变化中,分子可以分成原子,而原子不能再分C.在原子中,质子数等于核外电子数D.分子是保持物质化学性质的最小粒子7.下列原子结构示意图:按金属原子、非金属原子、稀有气体原子的顺序排列的是( )A.③②①B.②①③C.①②③D.③①②8.2017年5月,中科院、国家语委和全国科技名词委正式定名118号元素为“”,其部分信息如图所示。
则下列关于的说法正确的是( )A.元素符号为OgB.相对原子质量为118C.原子的核电荷数为179D.原子的核外电子数为2979.下列关于二氧化碳组成的说法中,正确的是( )A.二氧化碳是由碳原子和氧原子组成的B.二氧化碳是由碳原子和氧分子组成的C.二氧化碳是由碳元素和氧元素组成的D.二氧化碳是由碳和氧气组成的10.对Fe3+、Fe2+、Fe三种粒子的判断中,正确的是( )①核电荷数相同②核外电子数相等③电子层结构完全相同④质量几乎相等⑤等质量的三种微粒含有的质子数相等A.①④⑤B.①③⑤C.①②③④⑤D.②③④11.下列关于四种粒子的结构示意图说法正确的是( )A.①、②的化学性质相似B.②的粒子符号为NaC.③在化学反应中易失去电子D.④中x可能为812.下列一定属于纯净物的是()A.由同种分子构成的物质B.由不同种分子构成的物质C.由同种元素组成的物质D.由不同种元素组成的物质13.近年,我国科学家首次拍摄到水分子团簇图像,模型如下图。
【化学】化学计算题单元测试题含答案一、中考化学计算题1.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。
现称取只含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g。
试求:(1)该纯碱样品的纯度_________________。
(2)所得溶液中溶质的质量分数_________。
【答案】96.4% l0%【解析】【分析】纯碱中碳酸钠与稀盐酸反应放出二氧化碳,根据质量守恒定律,利用反应前后物质总质量差即反应放出二氧化碳的质量;根据反应的化学方程式,计算出纯碱中碳酸钠的质量和反应后溶液中溶质氯化钠的质量。
【详解】反应放出的CO2的质量为:64.4g+50g+11g-121g=4.4g设参加反应的Na2CO3质量为x,生成NaCl的质量为yNa2CO3+2HCl=2NaCl+H2O+CO2↑106 117 44x y 4.4g10611744==x y 4.4g解之得 x=10.6g,y=11.7g(1)碳酸钠纯度=10.6g100%11g≈96.4%;(2)纯碱样品中NaCl的质量=11g-10.6g=0.4g反应后溶液中NaCl的质量为=11.7g+0.4g=12.1g反应后溶液中NaCl的质量分数=12.1g121g×100%=10%答:(1)该纯碱样品的纯度约为96.4%;(2)所得溶液中溶质的质量分数为10%。
2.某化学兴趣小组同学对含有Na2SO4杂质的Na2CO3固体样品进行了以下实验探究。
请根据下图所示的实验过程和提供的数据,回答以下问题。
(1)过程②中产生气体的原因是______。
(2)计算溶液A的质量(写出计算过程,结果保留一位小数)。
______【答案】①中加入过量的稀硫酸,稀硫酸与碳酸钠反应产生CO2 106.2g【解析】【分析】【详解】(1)在过程②中加入一定量的Na2CO3固体恰好完全反应,说明过程①加入的稀硫酸是过量,所以过程②中产生气体的原因是:①中加入过量的稀硫酸,稀硫酸与碳酸钠反应产生CO2(2)根据化学反应方程式:Na2CO3+ H2SO4= Na2SO4+ H2O + CO2↑中Na2CO3与CO2的质量关系,可求出所加的Na2CO3固体质量,进而算出溶液A的质量设②中加入的碳酸钠的质量为x23242422Na CO+H SO=Na SO+H O+CO10644x 4.4g10644 =x 4.4gx =10.6 gm(溶液A) =100g + 10.6 g – 4.4 g =106.2 g答:溶液A的质量为106.2 g。
九年级化学上册第三单元测试题一、选择题(每题3分,共30分)1. 保持水的化学性质的最小粒子是()A. 氢原子和氧原子B. 水分子C. 氢分子D. 氧分子解析:分子是保持物质化学性质的最小粒子,水是由水分子构成的,所以保持水的化学性质的最小粒子是水分子。
答案为B。
2. 下列关于分子和原子的说法,错误的是()A. 分子和原子都可以直接构成物质B. 由分子构成的物质,分子是保持其化学性质的最小粒子C. 在化学变化中,分子可以分成原子,原子又可以结合成新的分子D. 分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小解析:分子和原子之间都有间隔,分子间的间隔与原子间的间隔不能简单比较大小,不同状态下间隔情况不同,D选项错误。
A选项,像水由水分子构成,铁由铁原子构成,所以分子和原子都可直接构成物质,正确;B选项是分子的定义,正确;C选项描述了化学变化的实质,正确。
答案为D。
3. 下列物质中含有氧分子的是()A. 过氧化氢(H₂O₂)B. 二氧化锰(MnO₂)C. 二氧化碳(CO₂)D. 空气解析:氧分子构成氧气。
过氧化氢由过氧化氢分子构成,不含氧分子;二氧化锰由二氧化锰分子构成,不含氧分子;二氧化碳由二氧化碳分子构成,不含氧分子;空气中含有氧气,氧气由氧分子构成,所以空气中含有氧分子。
答案为D。
4. 原子的质量主要集中在()A. 质子B. 中子C. 电子D. 原子核解析:原子是由原子核和核外电子构成的,电子的质量很小,原子的质量主要集中在原子核上,原子核是由质子和中子构成的。
答案为D。
5. 一种元素与另一种元素的本质区别是()A. 质子数不同B. 中子数不同C. 相对原子质量不同D. 电子数不同解析:元素是具有相同质子数(即核电荷数)的一类原子的总称,所以一种元素与另一种元素的本质区别是质子数不同。
答案为A。
6. 下列粒子结构示意图中,表示阳离子的是()A. 公式B. 公式C. 公式D. 公式解析:阳离子是原子失去电子后形成的,质子数大于核外电子数。
九年级化学单元测试题第三单元自然界的水(测试时间45分钟满分100分)班级学号姓名成绩一、选择题:(本题有10小题,每小题3分,共30分。
每小题只有一净化B.硬水易生水垢,常用肥皂水来鉴别硬水和软水C.利用活性炭净化水的过程属于化学变化D.净化水的方法有多种,如吸附、沉淀、过滤和蒸馏等页脚内容4.保持过氧化氢的化学性质的最小粒子是()A.氧气分子和氢气分子B.水分子C.过氧化氢分子D.氢原子和氧原子7①将工业冷却水进行循环利用②用未经处理的工业污水灌溉农田③用洗菜、淘米的水浇花、冲厕所④用喷淋节水龙头代替用水较多的旧式龙头⑤用大量的水冲洗汽车代替人工擦洗A.②③④B.①③④C.③④⑤D.①②⑤页脚内容8.下列物质中,前者是化合物,后者是单质的是( )A .空气、氧气B .水、二氧化硫C .氧化铁、 氢气D .碳、二氧化碳9C .它要求水从下进,从上出是为了操作方便D .它可以杀灭所有的细菌和吸收有毒重金属二、填空题:(本题有4小题,共36分)11.(6属于混合物的有(填序号,下同);属于化合物的有,它们的共同特点是;属于单质的是,它们的共同特点页脚内容是;可以将(4)(5)(6)(9)(11)称做氧化物,它们在组成上的共同特点是。
13.(8分)电解水实验:负极产生的是,正极产生的是,负极产生的气体与正极产生的气体的体积比为,质量比为;电解水的实验说明水是由和两种元素组成,每个水分子中由个氢原子和氧原子构成,水是(填混合物或纯净物)。
14.(6分)构成物质的粒子有、、等,如二氧化碳是由二氧化碳分子构成,金由构成,氯化钠由离子和离子构成。
15.(4分)写出下列反应的文字表达式:(1)通电分解水;(2)氢气在空气中燃烧。
三、简答题(本题有2小题,共8分)16.(5分)自来水厂一般采用氯气消毒。
氯气可以杀灭许多的细菌、病毒以及一些寄生虫,但同时氯气的剧毒对人体也有危险。
2001年4月24日,成都市双流县白家镇自来水厂发生氯气泄漏,村内2000多人都闻到一股刺激性的怪味,同时出现头痛、胸闷、甚至晕倒的情况。
初三化学第一单元测试题及答案一、选择题(每题3分,共30分)1. 化学变化的特征是()A. 有新物质生成B. 有能量变化C. 有颜色变化D. 有气体生成答案:A2. 下列物质中属于混合物的是()A. 空气B. 氧气C. 氮气D. 二氧化碳答案:A3. 根据质量守恒定律,下列说法正确的是()A. 反应前后物质的总质量不变B. 反应前后元素的种类不变C. 反应前后原子的种类不变D. 反应前后分子的个数不变答案:B4. 下列物质属于单质的是()A. 氧气B. 二氧化碳C. 水D. 空气答案:A5. 根据化学方程式,下列说法正确的是()A. 化学方程式表示了反应的条件B. 化学方程式表示了反应物和生成物的种类C. 化学方程式表示了反应物和生成物的微观粒子个数比D. 化学方程式表示了反应物和生成物的质量比答案:B6. 下列物质中属于化合物的是()A. 氧气B. 氮气C. 二氧化碳D. 空气答案:C7. 下列物质中属于氧化物的是()A. 氧气B. 氮气C. 二氧化碳D. 空气答案:C8. 根据化学方程式,下列说法正确的是()A. 化学方程式表示了反应的条件B. 化学方程式表示了反应物和生成物的种类C. 化学方程式表示了反应物和生成物的微观粒子个数比D. 化学方程式表示了反应物和生成物的质量比答案:D9. 下列物质中属于纯净物的是()A. 氧气B. 氮气C. 二氧化碳D. 空气答案:A10. 下列物质中属于酸的是()A. 盐酸B. 氢氧化钠C. 硫酸D. 碳酸钠答案:A二、填空题(每题4分,共20分)11. 化学变化的本质特征是:有新物质生成。
12. 单质是由同种元素组成的纯净物。
13. 化合物是由不同种元素组成的纯净物。
14. 氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素。
15. 酸是指在电离时产生的阳离子全部是氢离子的化合物。
三、实验题(每题5分,共20分)16. 实验名称:氧气的制取和性质实验。
化学计算题单元测试题(含答案)经典一、中考化学计算题1.某化学兴趣小组的同学在实验室配制溶质质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
下图表示用该氢氧化钠溶液与10g某稀盐酸发生反应时溶液温度的变化情况。
试计算稀盐酸中溶质的质量分数。
【答案】14.6%【解析】试题分析:由于中和反应放热,故随着反应的进行,溶液的温度逐渐升高,直至反应恰好完全,溶液温度达到最高,故根据图示可判断,当加入氢氧化钠那溶液的质量为20g时,反应恰好完全解:分析图知与10g稀盐酸恰好完全反应的氢氧化钠质量为:20g×8%=1.6g设稀盐酸中溶质的质量为xNaOH+HCl=NaCl+H2O40 36.51.6g x40:1.6g=36.5:xx=1.46g稀盐酸中溶质的质量分数为:1.46g/10g=14.6%答:稀盐酸中溶质的质量分数为14.6%考点:根据化学方程式计算2.某粗盐样品仅含NaCl和MgCl2,为探究粗盐中NaCl的质量分数,某研究性小组取了10g样品,加适量水使其完全溶解后,加入20g 5%的氢氧化钠溶液,测得相关数据如图。
(1)请列式计算该粗盐样品中NaCl的质量分数为____________。
(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量是____________?【答案】90.5% 10.22g【解析】(1)根据氯化镁与氢氧化钠反应的化学方程式,由氢氧化镁的质量求出氯化镁的质量即可求出氯化钠的质量,再计算出粗盐样品中NaCl的质量分数;(2)根据图像分析解答。
(1)设样品中氯化镁的质量为x,反应生成氯化钠的质量为y。
MgCl2+ 2NaOH=Mg(OH) 2↓+2NaCl95 58 117x 0.58g y95581170.58x g y==x=0.95gy=1.17g样品中氯化钠的质量为10g-0.95g=9.05g该粗盐样品中NaCl的质量分数为9.0510gg×100%=90.5%(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量为10g-0.95g+1.17g=10.22g 答:(1)该粗盐样品中NaCl的质量分数90.5%;(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量10.22g。
3.某化学兴趣小组对某铜锌合金样品进行探究实验,称取样品10.0 g,再用100.0 g稀硫酸溶液逐滴滴入,实验情况如图所示。
求:(1)铜锌合金中,Zn的质量分数是________。
(2)所用稀硫酸溶液中溶质的质量分数是__________?【答案】65% 19.6%【解析】试题分析:(1)铜锌合金与稀硫酸反应,其中只有锌与硫酸反应,故固体减少的量即为锌的质量=10g-3.5g=6.5g,则Zn%=6.5g/10g×100%=65%(2)解:设所用稀硫酸中溶质的质量分数为xZn+H2SO4=ZnSO4+H2↑65 986.5g 50gx65/98=6.5g/50gxx=19.6%答:锌的质量是65%;所用稀硫酸中溶质的质量分数为19.6%考点:合金、化学方程式计算4.取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配成溶液,然后向其中滴加溶质质量分数为7.3%稀盐酸,直至恰好反应,共消耗稀盐酸50g 。
反应后得到83.5g 质量分数为10%的溶液。
求: (1)加水的的质量。
(2)混合物中氯化钠的质量分数。
【答案】27.0g ;38.5% 【解析】 【详解】(1)设参加反应的氢氧化钠的质量为x ,生成氯化钠的质量为y 。
200NaOH +HCl =NaCl +H O4036.558.5507.3x g y⨯ 004036.558.5==x 50g 7.3y⨯ x=4.0g y=5.85g反应后得到氯化钠的质量为:83.5g ×10%=8.35g 混合物中氯化钠的质量为:8.35g-5.85g=2.5g 需要加水的质量为:83.5g-50g-4.0g-2.5g=27.0g (2)混合物中氯化钠的质量分数=2.5g100%4.0g+2.5g⨯≈38.5%%答:(1)加水的的质量为27.0g ;(2)混合物中氯化钠的质量分数为38.5%。
5.食盐是维持人体正常生理活动必不可少的物质.人体细胞中约含有NaCl 0.9%,一般成年人每日需NaCl 的量为4.5g ~9g .(1)某病人因食盐摄入量不足,需要补充溶质质量分数约为0.9%的生理盐水,医生通过诊断需为他注射200g 生理盐水,则该病人每天可补充食盐约___g .(2)若用50g 溶质质量分数为18%的氯化钠溶液配制溶质质量分数为0.9%的生理盐水,需加水___g .(3)小明想检验某瓶生理盐水的氯化钠含量是否合格,他从该瓶生理盐水中取出65g 溶液,然后加入足量硝酸银溶液,充分反应后过滤、洗涤、干燥,得到1.435g 沉淀.请你通过计算帮助小明判断这瓶生理盐水的氯化钠含量是否合格____. 【答案】⑴1.8 ⑵950⑶设该生理盐水的溶质质量分数为0.9%,故此生理盐水的氯化钠含量合格。
【解析】试题分析:(1)根据溶质质量分数的表达式,可以推知:溶质的质量=溶液的质量×溶质的质量分数,所以补充食盐约="200g×0.9%" = 1.8g(2)溶质质量分数为18%的氯化钠溶液配制溶质质量分数为0.9 %,很明显是溶液的稀释,在加水的前后,溶液中的溶质质量不变,所以可设需加水质量为x50g×18%=(50g+x )×0.9% ∴ x =950g(3)在生理盐水中加入足量硝酸银溶液,发生反应:NaCl + AgNO 3= AgCl ↓+ NaNO 3,充分反应后过滤、洗涤、干燥,得到1.435 g 沉淀,可以确定沉淀质量就是AgCl 的质量,再根据AgCl 与NaCl 的质量比,即可算出65 g NaCl 溶液中的溶质NaCl 的质量,在根据溶质质量分数的表达式即可算出该NaCl 溶液的质量分数,再与0.9%相比较,便可判断是否合格(3)设该生理盐水的溶质质量为x NaCl + AgNO 3= AgCl ↓+ NaNO 3 58.5 143.5 X 1.435 g=x = 5.85 g生理盐水的溶质质量分数=5.85 g÷65 g×100%=0.9% 故此生理盐水的氯化钠含量合格考点:溶质质量分数的计算,根据化学方程式进行的计算6.向盛有28g 氯化钡和氯化钠固体混合物的烧杯中加入273.3g 水,待固体完全溶解后,再逐滴加入一定质量分数的硫酸钠溶液,反应过程中生成沉淀的质量与所加硫酸钠溶液的质量关系如图所示。
试计算(1)恰好完全反应时,生成沉淀的质量是___g ; (2)恰好完全反应时,所得溶液中溶质的质量分数____。
【答案】23.3 5% 【解析】 【详解】(1)由图可知生成的硫酸钡的质量为23.3g (2)设氯化钡的质量为x ,生成的氯化钠的质量为y2424Na SO BaCl BaSO +=+208233117x23.2NaCl3gy208233117==x 23.3g y解得:x =20.8g y=11.7g恰好完全反应时,所得溶液中溶质的质量分数为28g-20.8g+11.7g100%=5%28g+273.3g+100g-23.3g⨯ 答:(1)恰好完全反应时,生成沉淀的质量是23.3g ; (2)恰好完全反应时,所得溶液中溶质的质量分数为5%。
7.现有两种稀溶液,标记为A 的0.40%的氢氧化钠溶液和标记为B 的3.65%的盐酸溶液.假设本题所涉及的各种稀溶液的密度均为1.00g/mL ,且毎滴溶液的体积近似为0.05mL .在盛有40mLA 溶液的锥形瓶中滴加2滴酚酞试液,再向瓶中缓缓倒入5mLB 溶液,边倒边振荡,充分混合后溶液呈无色.若取该无色混合液5mL 于一支试管内,再向试管内滴加40滴A 溶液.求:此时试管内溶液呈现的颜色. 【答案】溶液显红色 【解析】 【详解】解:设恰好完全中和40.0gA 溶液,需加入B 溶液的质量为x2NaOH +HCl =NaCl +H O4036.540g 0.4%x 3.65%4036.5=40g 0.4%x 3.65%⨯⨯⨯⨯x =4g因为中和40g 氢氧化钠溶液需要3.65%的稀盐酸4g ,因此B 溶液过量,倒入的5mLB 溶液还有1mL (约为1g )剩余,混合后溶液总体积为45mL , 45mL 混合液中剩余氯化氢的质量为:3.65%×1g =0.0365g , 则5mL 混合液中剩余氯化氢的质量为:0.0365g ×5÷45≈0.004g , 设1滴A 溶液中的氢氧化钠能够中和氯化氢的质量为y ,2NaOH +HCl =NaCl +H O4036.50.05g 0.4%y4036.5=0.05g 0.4%y⨯⨯y =0.0001825g则40滴A 溶液中和氯化氢的质量为:0.0001825×40=0.0073g >0.004g 所以氢氧化钠有剩余,溶液显红色.8.我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu -Zn ),它可以用来制造电器零件及日用品。
小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑铜中的其它杂质)。
将30ml稀盐酸分别加入到10g黄铜粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:(1)从上表数据分析,小华用10g合金粉末共收集到氢气 g;(2)求该合金中铜的质量分数。
【答案】(1)0.2 (2)35%【解析】(1)因三次产生的氢气的质量和为10g合金粉末总共收集到氢气的质量,则0.08g+0.08g+0.04g═0.2g,(2)解:设该合金中锌的质量为x,Zn+2HCl═ZnCl2+H2↑65 2x 0.2g652x0.2g解得x=6.5g合金中铜的质量为10g-6.5g═3.5g该合金中铜的质量分数为:3.510gg×100%=35%答:该合金中铜的质量分数为35%。
9.烧碱是一种重要的化工原料,用碳酸钠溶液与熟石灰发生反应,之后将生成物进行一系列处理得到固体烧碱,同学们在实验室制取少量烧碱固体.实验过程中向200g碳酸钠溶液中不断加入澄清石灰水,所加澄清石灰水的质量与生成沉淀的质量关系如图所示.请回答下列问题.(1)a点时反应混合液中的阳离子主要是(填化学式);(2)通过计算回答,此碳酸钠溶液中溶质的质量分数是多少?【答案】Na+;5.3%.【解析】(1)a点为反应的过程中,此时碳酸钠没有完全反应,而碳酸钠和氢氧化钙反应生成了氢氧化钠和碳酸钙,所以此时溶液中的溶质是碳酸钠和氢氧化钠,所以溶液含有的阳离子主要是钠离子;故填:Na+;(2)由图中可以知道生成沉淀的质量为10g设碳酸钠的质量为xNa2CO3+Ca(OH)2═CaCO3↓+2NaOH106 100x 10g解得:x=10.6g碳酸钠溶液中溶质的质量分数为:×100%=5.3%答:碳酸钠溶液中溶质的质量分数为5.3%.【点评】在对反应图象中曲线进行分析时,曲线的折点的意味着曲线所表示的反应在此时恰好完全反应,解答时要理清反应指所发生的反应,并正确的书写化学方程式.10.某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。