高二化学等效平衡的应用
- 格式:pdf
- 大小:2.83 MB
- 文档页数:10

等效平衡的建立及应用1.等效平衡的含义在一定条件下(恒温恒容或恒温恒压),对同一可逆反应体系,起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同,这样的平衡称为等效平衡。
理解:(1)平衡的建立和条件有关,和反应的方向无关。
(2)一定条件下,一次投料和分批次投料,最终建立的平衡是等效。
2.等效平衡的分类根据反应条件(恒温、恒压或恒温、恒容)以及可逆反应的特点(反应前后气体分子数是否相等),可将等效平衡问题分成两类:(1)恒温、恒容条件下,反应前后气体分子数不相等的可逆反应,如果按方程式的化学计量关系转化为方程式同一半边的物质,其物质的量与对应组分的起始加入量相同,则建立的化学平衡状态是等效的。
这种等效平衡是绝对等效(包括浓度、密度、相对分子质量等都相等),各种物质的百分含量相同,物质的量、浓度都相同。
(2)恒温、恒容条件下,反应前后气体分子数相等的可逆反应与恒温、恒压条件下,反应前后气体分子数任意类型的可逆反应,如果按方程式的化学计量关系转化为方程式同一半边的物质,其物质的量之比与对应组分的起始加入量之比相同,则建立的化学平衡是等效的。
这种等效平衡是相对等效,各种物质的百分含量相同,物质的量、浓度等存在倍数关系。
(2)恒温、恒压条件下,任意类型的可逆反应,如果按方程式的化学计量关系转化为方程式同一半边的物质,其物质的量之比与对应组分的起始加入量之比相同,则建立的化学平衡是等效的。
这种等效平衡是相对等效,各种物质的百分含量、浓度相同,物质的量等存在倍数关系。
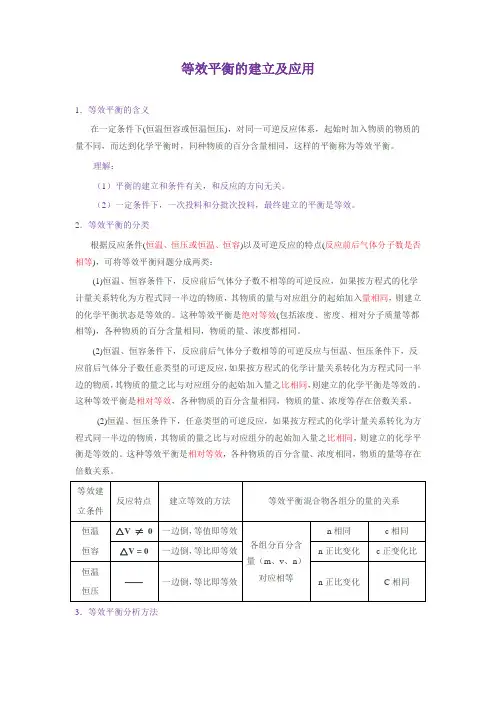
等效建立条件反应特点建立等效的方法等效平衡混合物各组分的量的关系恒温恒容△V ≠0一边倒,等值即等效各组分百分含量(m、v、n)对应相等n相同c相同△V= 0一边倒,等比即等效n正比变化c正变化比恒温恒压——一边倒,等比即等效n正比变化C相同3.等效平衡分析方法按照化学方程式的化学计量数关系,把起始物转化为方程式同一半边的物质,通过对比两种情况下对应组分的起始量是相等,还是等比,来判断化学平衡是否等效。




等效平衡的应用一、等效平衡的应用:主要比较两个不同的平衡状态方法:将其中一个平衡看作由另外一个平衡或另外一个平衡的等效平衡通过加料或扩大、缩小容器的体积转化过来的,在转化过程中比较两个平衡的差别。
理论依据:平衡状态(终态)只与始态有关,而与途径无关,即:①投料是一次还是分成几次②反应容器经过扩大—缩小或缩小—扩大的过程,而最终容器体积不变。
【例1】在温度、催化剂不变的情况下,向一固定体积的密闭容器中加入H 2、N 2、NH 3初始的物 质的量(单位mol )如下表格,反应达到平衡时,氨气浓度最大的一组是( )【例2】在一个一定容积的密闭容器中在某温度下发生如下反应: CO(g)+H 2O(气) CO 2(g)+H 2(g)开始时充入容器中的起始物质是①0.1molCO ,0.1molH 2O ;②0.1molCO ,0.2molH 2O ;③0.1molCO ,0.1molH 2O ,0.1molCO 2;④0.1molCO ,0.5molH 2O ,0.1molH 2;⑤0.1molCO ,0.1molH 2O ,0.1molH 2,0.1molCO 2,达平衡时容器中H 2浓度由小到大排列顺序是【例3】(双选)已知298K 时,2SO 2(g )+O 2(g )2SO 3(g );△H=-197kJ/mol 。
在相同的温度下,向密闭容器中通入2molSO 2和2molO 2,达到平衡时放出热量Q 1,向另一体积相同的密闭容器中加入1molSO 2和1molO 2,达到平衡时放出热量Q 2,则下列关系正确的是( )A 、Q 2=Q 1/2B 、Q 2<Q 1/2C 、Q 2<Q 1<197kJD 、Q 2=Q 1<197kJ【例4】在一定条件下, 2NO 2N 2O 4 ;△H<0可逆反应达到平衡,当分别改变下列条件时,填入NO 2百分含量与原百分含量的比较情况(增大、减小、不变)。


等效平衡的应用摘要:化学平衡是高中化学教学中的难点和重点,特别是向平衡体系中再加入参与反应的物质,又达到新的平衡。
分析从原平衡到新平衡,各物质的百分数(体积分数和质量分数)和转化率、浓度、压强的变化时,对学生来说是个很难的问题,如果利用等效平衡原理建立等效平衡过程进行分析,问题就会变得很简单。
关键词:等效平衡百分数转化率1.等效平衡的概念在同一温度下,对同一个可逆反应,起始时加入方法不同,只加反应物、只加生产物或反应物和生成物同时加入,达到平衡时,每种物质的百分数(体积分数和质量分数)相等。
则这几种不同的加入达到的平衡互为等效平衡。
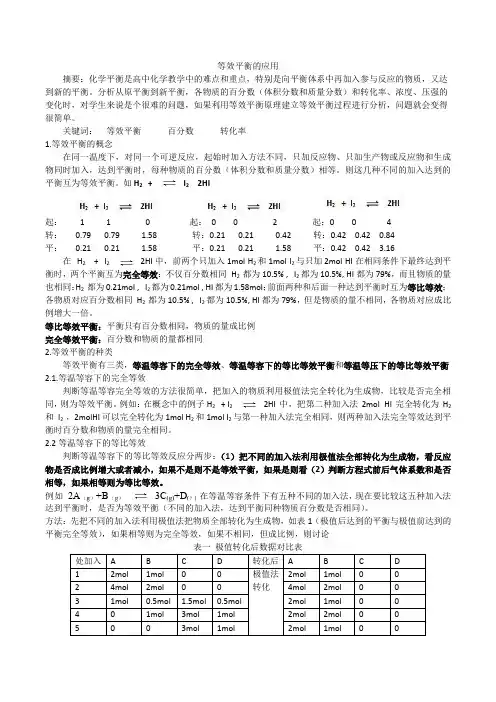
如H2+I22HI起: 1 1 0 起:0 0 2 起:0 0 4转:0.79 0.79 1.58 转:0.21 0.21 0.42 转:0.42 0.42 0.84平:0.21 0.21 1.58 平:0.21 0.21 1.58 平:0.42 0.42 3.16在H2+I22HI中,前两个只加入1molH2和1mol I2与只加2mol HI在相同条件下最终达到平衡时,两个平衡互为完全等效:不仅百分数相同H2都为10.5% ,I2都为10.5%, HI都为79%,而且物质的量也相同:H2都为0.21mol ,I2都为0.21mol, HI都为1.58mol;前面两种和后面一种达到平衡时互为等比等效:各物质对应百分数相同H2都为10.5% ,I2都为10.5%, HI都为79%,但是物质的量不相同,各物质对应成比例增大一倍。
等比等效平衡:平衡只有百分数相同,物质的量成比例完全等效平衡:百分数和物质的量都相同2.等效平衡的种类等效平衡有三类,等温等容下的完全等效、等温等容下的等比等效平衡和等温等压下的等比等效平衡2.1.等温等容下的完全等效判断等温等容完全等效的方法很简单,把加入的物质利用极值法完全转化为生成物,比较是否完全相同,则为等效平衡。
例如:在概念中的例子H2+I22HI中,把第二种加入法2mol HI完全转化为H2和I2,2molHI可以完全转化为1molH2和1mol I2与第一种加入法完全相同,则两种加入法完全等效达到平衡时百分数和物质的量完全相同。


剖析等效平衡及其应用举例化学平衡是中学化学中重要理论内容,而等效平衡是化学平衡的难点部分,学生往往在理论学习中,很容易接受等效平衡,但在解决相关问题时,困难重重,有时甚至无从下手,下文将从各方面对等效平衡总结归纳,并列举出相关的例题,希望能给大家带来帮助。
一、建立等效平衡的依据——一定条件下化学平衡的建立,与途径无关,只与条件和起始物质的量有关。
二、等效率平衡的定义——在一定条件(同温同容或同温同压)下,同一可逆反应,不管起始物是全部反应物还是全部生成物,或部分生成物和全部反应物或部分反应物和全部生成物,只要达到平衡时,各组分的量(包括体积,物质的量,或质量等)或含量(包括,体积分数,物质的量分数,或质量分数等)或浓度保持不变的状态,均互为等效平衡。
三、几种规律一、同温同容下1、反应前后气体系数有变化的可逆反应,如222SO O32SO 改变起始量,若平衡时各组分的量或含量对应相等,也能互为等效平衡。
解题方法——按化学方程式计算,完全换算到同一方向各组分的量对应相等。
例2006年汕头一模,在一定温度下,把2mol 2SO 和21molO 通入一个一定容积的密闭容器里,发生如下反应. 22322SO O SO + 当此反应进行到一定程度时,反应混合物就处于化学平衡状态,现在该容器中维持温度不变,令分别代表初始加入的2SO 、2O 和3SO 的物质的量a 、b 、c mol ,如a 、b 、c 取不同的数值,它们必须满足一定的相互关系,都能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同。
请填写下列空白。
(1)若a=0,b=0则c= 。
(2)若a=0.5,b= 和c=(3)a 、b 、c 必须满足的一般条件是(请用两个方程式表示,其中一个只含a 和c ,另一个只含b 和c 。
)答案:(1)2 (2)0.25、1.5 (3)a+c=2, b+2c =1 2、反应前后气体系数不变的可逆反应,如改变起始量,达到等效平衡有两种可能。
化学反应等效平衡
化学反应等效平衡是化学反应中一种重要的平衡状态。
在这种平
衡状态下,化学反应的反应物和生成物之间数量上的关系被保持不变。
这种平衡状态有助于我们深入理解化学反应的本质,并为化学反应的
可控性提供了指导意义。
在化学反应等效平衡中,反应物之间的化学反应速率与生成物之
间的化学反应速率之间存在一个平衡。
这种平衡在不同的反应物场合
下具有不同的表现。
比如在溶液中,溶解度反应等效平衡可以描述晶
体与溶液之间的化学反应速率。
而在气态反应中,化学反应等效平衡
可以用于描述气态分子与离子之间的反应速率。
化学反应等效平衡在化学反应的可控性方面也有很大意义。
如果
我们能够控制化学反应等效平衡状态,则可以准确地控制反应物和生
成物之间的比例。
这使得我们能够更好地了解化学反应的机制,并且
能够更好地控制化学反应的过程和结果。
除此之外,了解化学反应等效平衡还有助于推导出许多有用的化
学方程式和化学结构式。
这有助于我们更好地理解化学分子与化学反
应之间的本质关系,并且有助于我们在实际应用中更好地控制化学反
应的过程。
总的来说,化学反应等效平衡是化学反应中一个非常重要的概念。
它不仅能够描述化学反应速率和化学反应过程的本质关系,还能够用
于控制化学反应的过程和结果。
因此,在学习和应用化学反应时,清
楚地了解化学反应等效平衡对我们进行科学研究和工程应用都具有重要意义。
等效平衡定义一定条件(温度体积一定或温度压强一定)下的同一可逆反应,只要起始组分的量相当,无论经过何种途径,达到平衡后,任何相同组分的百分含量(体积分数,物质的量分数,质量分数等)均相同,这样的化学平衡互称等效平衡注意:①一定条件:同温同体积或同温度同压强②平衡状态:只与始态有关,与途径无关,无论反应从什么方向开始,投料时一次还是多次,只要起始浓度相当,就达到等效平衡状态。
③体积分数相同:平衡混合物各组分的百分含量对应相同,但各组分的物质的量、浓度可能不同,反应的速率、压强等可以不同。
分类1、完全等同相同组分的百分含量、物质的量、物质的量浓度都相同(等量等效)2、比例相同相同组分的百分海量相同,但物质的量、物质的量浓度等不懂(等比等效)解题方法:极值转化法无论反应平衡从哪个方向建立,在判断时都可以根据题目条件和反应计量数把生成物全部推算为反应物或把反应物全部推算为生成物,在于原平衡加入的物质的量比较,若两者相当,则为等效平衡。
等效平衡解题规律1、反应前后体积改变的反应(m+n≠p+q)①恒温恒容条件下(容器体积不变)时, m+n≠p+q只要将各初始态物质的量设定‘回归’至与题给已知条件分别对应相等,则可使反应达平衡时与题给已知平衡等效。
这一方法即为:“回归定值“法。
即极值等量及等效例如:2SO2(g) +O2(g) ==== 2SO3(g)①2mol 1mol 0②002mol③ 0.5mol 0.25mol 1.5mol④ a mol b mol c mol上述①②③三种配比,按化学方程式的化学计量关系均转化为反应物,则SO2均为2mol,O2均为1mol,三者建立的平衡状态完全相同.④中当题目条件中三者物质的量为a、b、c时。
三者的关系满足化学计量数的相互关系,将cmol的SO3完全转化为SO2和O2的物质的量按照反应方程式计算得出最后计算出n(SO2)=(c/2*2)+amol=cmol+amol n(O2)=c/2mol+bmol。
“等效平衡”的应用1、等价变换思想(完全转化或部分转化)反应体系中生成物和反应物的物质的量,通过可逆反应方程式中化学计量数比,换算成反应物(生成物)物质的量,换算后的物料关系与原物料关系等价,该过程谓之等价变换。
如2SO 2+O 2≒2SO 3的反应体系中,SO 2、O 2、SO 3的物质的量分别为a 、b 、c,等价转换后SO 2、O 2、SO 3物质的量分别为a +c 、b +c/2、0,前后两种物料关系等价。
2、等效平衡同一可逆反应在相同条件下,起始投料情况不同所达成的平衡,只要任何相同组分的分数(体积、物质的量)对应相等,这样的平衡互称等效平衡。
例1:某温度下在1L 密闭容器中加入1molN 2和3molH 2,使反应N 2+3H 2≒2NH 3达平衡。
如果温度不变,改变初始的投料量,达平衡后各气体分数与原平衡相同,则N 2、H 2、NH 3的投料量分别用X 、Y 、Zmol 表示时,应满足的条件:(1)若X =0、Y =0,则Z=___。
(2)若X =0.75,则Y =___,Z =___。
(3)X 、Y 、Z 应满足的条件是______(用含X 、Y 、Z 的方程式表示)。
解析:(1)利用完全转化法1molN 2,3molH 2与2molNH 3等价,所以Z =2;(2)因为是“容积固定、左≠右且要求含量相同”,所以必为等值投入, 等价变换得:0.75+Z/2=1 解得Y =2.25,Z =0.5; Y+3Z/2=3 (3)利用完全转化法等价变换可得:X +Z/2=1 解得 3X =YY +3Z/2=3 X +Y +2 Z =4例2:H 2(气)+I 2(气)≒2HI (气)等温等容下加入1mol H 2、2 mol I 2与加入2mol H 2、4 mol I 2所建立的平衡为等效平衡。
可用“等效假设法”说明。
T 、V 、P T 、2V 、P T 、V 、2P等效 压缩 ←→ ←→ 平衡Ⅰ 平衡Ⅱ 平衡Ⅲ因为Ⅰ与Ⅱ等效,Ⅱ与Ⅲ等效,所以Ⅰ与Ⅲ等效。