高中化学之等效平衡完整版
- 格式:doc
- 大小:203.00 KB
- 文档页数:5


高考总复习等效平衡(基础)【考纲要求】1.理解等效平衡的含义、类型、规律;2.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,并能用相关理论解决实际问题。
【考点梳理】考点一、等效平衡的含义:在相同条件下,对同一可逆反应,不论从正反应方向开始,还是从逆反应方向开始,或从正、逆两个方向同时开始;投料是一次还是分成几次,只要起始浓度相当(即按方程式中的计量系数转换成同一半边满足对应相等或对应成比例),均可能达到同一平衡状态,即平衡时相应组分的含量(体积分数、物质的量分数、质量分数)相同,这样的化学平衡称为等效平衡。
即在满足质量(原子)守恒定律的前提下,一定条件下的同一个平衡状态可以对应无数个起始状态。
如果将两种不同方式的起始投料按方程式中的计量系数转换成同一半边满足对应相等,这样最终达到的等效平衡不仅各组分的物质的量分数对应相等,而且其物质的量也对应相等,则两平衡互为等同平衡。
等同平衡可视为等效平衡的一种特殊情况。
遇到等效平衡问题时,特别注意以下几点:一看外界条件①恒温、恒容,②恒温、恒压;二看反应前后气体体积变化与否;三看“等效平衡”中的“等效”要求:一般指“物质的量分数相等”,但有些题目中要求达到的等效平衡是“等物质的量”或“等浓度”等,应格外注意题目的要求。
解题时要分清类别,用相应的方法求解。
我们常采用“等价转换”的方法,分析和解决等效平衡问题。
考点二、等效平衡的类型和规律:注:n表示各物质的物质的量、ω%表示质量分数、C表示物质的量浓度、Δn(g) =0表示反应前后气体的总物质的量不变要点诠释:等效平衡的解题方法与技巧是:明确等效平衡的种类:一是恒温恒容下的等效平衡,它再细分成二种情况,①是反应前后气体的体积不相等的的反应,只要按照化学计量数换算到一边即“一边倒”,与原平衡的初始量相同,则建立的平衡与原平衡视为等效;②是反应前后气体的体积相等,只要按照化学计量数换算到一边即“一边倒”,与原平衡物质的初始量的比值相同,则建立的平衡与原平衡视为等效。

PART 33 等效平衡一.等效平衡的含义在一定条件下(恒温恒容或恒温恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,还是正、逆反应同时投料,达到化学平衡状态时,任何相同组分的百分含量(物质的量分数或体积分数等)均相同。
二.等效平衡的判断方法(一)1 恒温、恒容条件下反应前后体积改变的反应判断方法:极值等量即等效(“一边倒”)。
恒温、恒容条件下,对于化学反应前后气体分子数改变的可逆反应,只改变起始加入物质的物质的量,如果通过可逆反应的化学计量数之比换算成化学方程式的同一边物质的物质的量与原平衡相同,则两平衡等效。
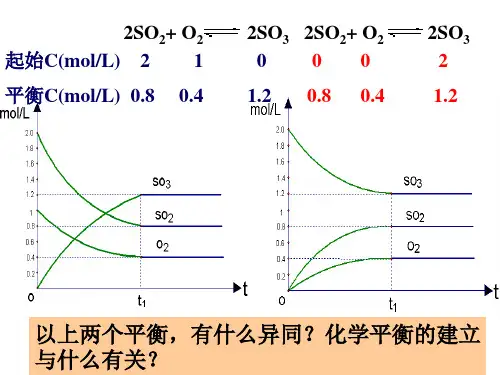
例如:2SO 2(g)+O 2(g)2SO 3(g)① 2 mol 1 mol 0 ② 0 0 2 mol ③ 0.5 mol 0.25 mol 1.5 mol ④ a mol b mol c mol上述①②③三种配比,按化学方程式的化学计量关系均转化为反应物,则SO 2均为2 mol ,O 2均为1 mol ,三者建立的平衡状态完全相同。
④中a 、b 、c 三者的关系满足:c +a =2,c2+b =1,即与上述平衡等效。
注意:“全等效平衡”:浓度c 相同,物质的量n 相同。
(一)2 恒温、恒容条件下反应前后体积不变的反应判断方法:极值等比即等效(“一边倒”)恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量之比与原平衡相同,则两平衡等效。
例如:H 2(g)+I 2(g)2HI(g)① 1 mol 1 mol 0 ② 2 mol 2 mol 1 mol ③ a mol b mol c mol①②两种情况下,n (H 2)∶n (I 2)=1∶1,故互为等效平衡。
③中a 、b 、c 三者关系满足⎝⎛⎭⎫c 2+a ∶⎝⎛⎭⎫c2+b =1∶1或a ∶b =1∶1,c ≥0,即与①②平衡等效。
注意:“相似等效平衡”:浓度c 成比例,物质的量n 成比例,体积分数相同。

高中化学专题等效平衡详解The document was prepared on January 2, 2021高中化学专题—等效平衡详解一、概念.在一定条件恒温恒容或恒温恒压下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,在达到化学平衡状态时,任何相同组分的百分含量....体积分数、物质的量分数等均相同,这样的化学平衡互称等效平衡包括“全等等效和相似等效”. 理解:1只要是等效平衡,平衡时同一物质的百分含量....体积分数、物质的量分数等一定相同 2外界条件相同:通常可以是①恒温、恒容,②恒温、恒压.3平衡状态只与始态有关,而与途径无关,如:①无论反应从正反应方向开始,还是从逆反应方向开始②投料是一次还是分成几次③反应容器经过扩大—缩小或缩小—扩大的过程,比较时都运用“一边...倒”倒回到起始的状态..........进行比较.二、分类一全等等效和相似等效1、全等等效:一边倒后要和标准状态数值完全相同才能等效,达到平衡后,w%百分含量,如质量分数、体积分数、物质的量分数等、n 物质的量、m 质量、V 体积等量完全相同.2、相似等效:一边倒后和标准状态数值成比例就可以等效,达到平衡后,w%一定相同,但n 、m 、V 等量不一定相同但一定成比例.二具体分析方法针对反应mAg +n Bg pCg + qDg,1、若m + n = p + q,则无论恒温恒容还是恒温恒压,都满足相似等效.例:对于反应H 2g+ I 2g 2HIg,在某温度下,向某一密闭容器中加入1molH 2和1molI 2,平衡时HI 的浓度为a,HI 的物质的量为b,则1若保持恒温恒容,开始时投入_______molHI,与上述情况等效2若保持恒温恒压,开始时投入_______molHI,与上述情况等效3若保持恒温恒容,开始时投入,还需要加入_______mol I 2和_______molHI,与上述情况等效 4若保持恒温恒压,开始时投入4molHI,则平衡时,HI 的浓度为_______,物质的量为_______2、若m + n ≠ p + q,1若恒温恒容,则满足全等等效;2若恒温恒压,则满足相似等效.例:对于反应H 2g+ 3N 2g 2NH 3g,在某温度下,向某一密闭容器中加入1molH 2和3molN 2,平衡时NH 3的浓度为a,NH 3的物质的量为b,则1若保持恒温恒容,开始时投入_______mol NH 3,与上述情况等效,平衡时NH 3的浓度为_______,NH 3的物质的量为_______;若保持恒温恒容,开始时投入,还需要加入_______mol N 2和_______mol NH 3与上述情况等效,平衡时NH 3的浓度为_______,NH 3的物质的量为_______;若保持恒温恒容,为了达到与上述情况等效,NH 3的物质的量的取值范围为_________________,平衡时NH 3的浓度为_______,NH 3的物质的量为_______2若保持恒温恒压,开始时投入_______mol NH 3,与上述情况等效;若保持恒温恒容,开始时投入,还需要加入_______mol N 2和_______mol NH 3与上述情况等效;若保持恒温恒压,开始时投入4molNH 3,平衡时NH 3的浓度为_______,NH 3的物质的量为_______三、典型例题例1、将6molX 和3molY 的混合气体置于密闭容器中,发生如下反应:2X g+Yg 2Z g,反应达到平衡状态A 时,测得X 、Y 、Z 气体的物质的量分别为、和.若X 、Y 、Z 的起始物质的量分别可用a 、b 、c 表示,请回答下列问题:1若保持恒温恒容,且起始时a=,且达到平衡后各气体的体积分数与平衡状态A 相同,则起始时b 、c 的取值分别为 , .2若保持恒温恒压,并要使反应开始时向逆反应方向进行,且达到平衡后各气体的物质的量与平衡A 相同,则起始时c 的取值范围是 .例2、将6molX 和3molY 的混合气体置于容积可变的密闭容器中,在恒温恒压发生如下反应:2Xg+Yg 2Z g,反应达到平衡状态A 时,测得X 、Y 、Z 气体的物质的量分别为、和.若X 、Y 、Z 的起始物质的量分别可用a 、b 、c 表示,若起始时a=,且达到平衡后各气体的体积分数与平衡状态A 相同,则起始时b 、c 的取值分别为 , .四、巩固练习1、在1L 的密闭容器中通入2molNH 3,在一定温度下发生下列反应:2NH 3N 2+3H 2,达到平衡时,容器内N 2的百分含量为a%.若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N 2的百分含量也为a %的是A .3molH 2+1molN 2B .2molNH 3+1molN 2C .2molN 2+3molH 2D .++2、在密闭容器中发生反应2SO 2+O 2 2SO 3g,起始时SO 2和O 2分别为20mol 和 10mol,达到平衡时,SO 2的转化率为80%.若从SO 3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO 3的物质的量及SO 3的转化率分别为A 、10mol 10%B 、20mol 20%C 、20mol 40%D 、30mol 80%3、在一密闭的容器中充入2 mol A 和1 mol B 发生反应:2Ag +Bg== x Cg,达到平衡后,C 的体积分数为w %;若维持容器的容积和温度不变,按起始物质的量A : mol 、B : mol 、C : mol 充入容器,达到平衡后,C 的体积分数仍为w %,则x 的值为A .只能为2B .只能为3C .可能为2,也可能为3D .无法确定 4、在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下已知223N (g)3H (g)2NH (g)+= 92.4H ∆=-kJ·mol 1-:容器甲 乙 丙 反应物投入量1mol N 2、3mol H 2 2mol NH 3 4mol NH 3 平衡时NH 3的浓度mol·L 1-c 1 c 2 c 3 反应的能量变化放出a kJ 吸收b kJ 吸收c kJ 体系压强Pap 1 p 2 p 3反应物转化率下列说法正确的是A .132c c >B .92.4a b +=C .232p p <D .13αα1+<5、在一定温度下,把2mol SO 2和1mol O 2通入一定容积的密闭容器中,发生如下反应,22O SO 2+3SO 2,当此反应进行到一定程度时反应混合物就处于化学平衡状态.现在该容器中维持温度不变,令a 、b 、c 分别代表初始时加入的322SO O SO 、、的物质的量mol,如果a 、b 、c 取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同.请填空:1若a=0,b=0,则c=___________.2若a=,则b=___________,c=___________.3a 、b 、c 的取值必须满足的一般条件是___________,___________.请用两个方程式表示,其中一个只含a 和c,另一个只含b 和c6、如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应:22H 3N +3NH 2正反应放热,若反应达到平衡后,测得混合气体的体积为7体积.据此回答下列问题:1保持上述反应温度不变,设a 、b 、c 分别代表初始加入的N 2、H 2和NH 3的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:①若a=1,c=2,则b=_________.在此情况下,反应起始时将向_________填“正”或“逆”反应方向进行.②若需规定起始时反应向逆反应方向进行,则c 的取值范围是_________.2在上述装置中,若需控制平衡后混合气体为体积,则可采取的措施是_____,原因是_______.7、一恒温、恒压下,在一个容积可变的容器中发生如下反应:)g (B )g (A +)g (C 1若开始时放入1mol A 和1mol B,达到平衡后,生成a mol C,这时A 的物质的量为_____ mol. 2若开始时放入3mol A 和3mol B,达到平衡后,生成C 的物质的量为________mol.3若开始时放入x mol A 、2mol B 和1mol C,达到平衡后,A 和C 的物质的量分别为y mol 和3a mol,则x=________,y=________.平衡时,B 的物质的量________填编号.甲大于2mol 乙等于2mol 丙小于2mol 丁可能大于、等于或小于2mol4若在3的平衡混合物中再加入3mol C,待再次达到平衡后,C 的物质的量分数是___________.二若维持温度不变,在一个与一反应前起始体积相同,且容积固定的容器中发生上述反应.5开始时放入1mol A 和1mol B 到达平衡后生成b mol C.将b 与1小题中的a 进行比较__________填编号.甲a>b 乙a<b 丙a=b 丁不能比较a 和b 的大小作出此判断的理由是____________.。



高中化学之等效平衡相同条件下,同一可逆反应体系中,不管从正反应开始,还是从逆反应开始,达到平衡时,任何物质的百分含量(浓度、质量分数、体积分数等)都保持不变的化学平衡互称等效平衡。
说明:1、判断方法:使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的数量是否相当。
2、恒温恒容条件下的等效平衡:①对反应前后气体分子数改变的可逆反应:换算成方程式同一半边所含物质的物质的量与原平衡相同,则两平衡等效;②对反应前后气体分子数不变的可逆反应:换算成方程式同一半边所含物质的物质的量比例关系与原平衡相同,则两平衡等效;3、恒温恒压条件下的等效平衡:在温度、压强不变的条件下,改变起始加入物质的物质的量,只要通过可逆反应化学计量数之比换算成方程式左右两边同一半边的物质的量之比与原平衡相同,则容器内各组分的百分含量相同,各指定物质的物质的量浓度也相同。
两平衡等效。
此时的等效平衡与反应前后气体的分子数变化没有关系。
练习Ⅰ.在一定温度下,把2mol SO2和1mol O2通入一定容积的密闭容器中,发生如下反应,,当此反应进行到一定程度时反应混合物就处于化学平衡状态。
现在该容器中维持温度不变,令a、b、c分别代表初始时加入的的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。
请填空:(1)若a=0,b=0,则c=___________。
(2)若a=0.5,则b=___________,c=___________。
(3)a、b、c的取值必须满足的一般条件是___________,___________。
(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)解析:(1)c=2 (2)b=0.25,c=1.5 (3)a+c=2 b+c/2=1(或2b+c=2)。
Ⅱ.在一个固定体积的密闭容器中加入2molA、1molB发生反应:2A(g)+B(g)3C(g)+D(g),达到平衡时生成C的物质的量浓度为Wmol·L-1。
若维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的物质的量浓度仍为W mol·L-1的是①4molA+2molB②2molA+1molB+3molC+1molD③3molC+1molD④1molA+0.5molB+1.5molC+0.5molD⑤3molA+1molBA、①②B、②③C、③④D、④⑤解析:恒温恒容条件下的等效平衡:对于反应前后气体分子总数发生变化的可逆反应,等效平衡的条件是:换算成方程式同一半边,所含物质的物质的量与原平衡相同。
则按照以上原则,把①②③④⑤中的C、D换算成另一半边的A、B并与原有的A、B相加后与起始值相比,若相同,则两平衡等效,即③④属于等效平衡。
答案:CⅢ. 在固定体积的密闭容器中,一定温度下,加入2molBr2,1molH2,发生反应:Br2(g)+H2(g)2HBr,达到平衡时,HBr的质量分数为w%。
在相同条件下,按下列情况充入物质,达到平衡时,HBr的质量分数仍为w%的是A、2molHBrB、3molHBrC、4molBr2+2molH2D、1molBr2+2molHBr解析:恒温恒容条件下的等效平衡:对于反应前后气体分子总数没有变化的可逆反应,等效平衡的条件是:换算成方程式同一半边,所含物质的物质的量比例关系与原平衡相同。
则按照上述原则,原平衡时:Br2和H2的比例关系为2:1,则换算成同一半边时比例关系应仍为2:1,则两平衡等效,则符合题意的有:CD答案:CDⅣ.在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气)xC(气),达到平衡后,C的体积分数为W%。
若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为A、1B、2C、3D、4解析:恒温恒容条件下的等效平衡有两种情况:对于反应前后气体分子总数没有变化的可逆反应,只要换算成方程式同一半边,所含物质的物质的量比例关系与原平衡相同即可,由于所给物质的比例关系与原平衡相同,则符合题意的是x=3;反应前后气体分子总数发生变化的可逆反应,等效平衡的条件是:换算成方程式同一半边,所含物质的物质的量与原平衡相同,则将1.4molC换算成A、B后所得A、B的物质的量与原平衡一致即可,则此时x=2。
综上所述,本题答案为BC答案:BCⅤ.某恒温恒压下,向可变容积的密闭容器中充入3L A和2L B,发生如下反应:3A(g)+2B(g)x C(g)+y D(g)达到平衡时,C的体积分数为m%,若维持温度、压强不变,将0.6L A、0.4L B,4L C、0.8L D作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x,y 的值分别为A、x=3,y=1B、x=4,y=1C、x=5,y=1D、x=2,y=3解析:本题是恒温、恒压条件下的等效平衡判断。
根据阿伏加德罗定律及推论可知:同温同压下任何气体的体积比等于物质的量之比,则把4L C、0.8L D换算成A、B时可得:A为12/x或2.4/y,B为8/x 或1.6/y,则A的总量为:0.6+12/x或0.6+2.4/y,B的总量为:0.4+8/x或:0.4+1.6/y,再根据A:B=3:2可得,x=5,y=1答案:CⅥ. 某温度下,在1L的密闭容器中加入1mol N2、3mol H2,使反应N2+3H2 2NH3达到平衡,测得平衡混合气中N2、H2、NH3分别为0.6 mol、1.8 mol、0.8 mol,如果温度不变,只改变初始加入的物质的量而要求达到平衡时N2、H2、NH3的物质的量仍分别为0.6 mol、1.8mol、0.8 mol,则N2、H2、NH3的加入量用X、Y、Z表示时应满足的条件:(1)若X=0,Y=0,则Z=______________________。
(2)若X=0.75,则Y=__________________。
(3)若X=0.45,则Y=_____(4)X、Y、Z应满足的一般条件是(用含X、Y、Z的关系式表示)______。
解析很显然,本题是求解T、V恒定时,达到同一平衡时,初始态的物料条件。
假若此反应为不可逆反应,那么1mol N2和3 molH2能完全生成2 mol NH3,即从图中A能达到C 但由于该反应可逆,故实际上只反应到B点,这就好比一条线路,从A地经过B地能达到C地,那么从A地正向出发能达到B地,自然从C地逆向出发也能达到B地。
故(1)中若X=0,Y=0,则 Z=2 mol。
从(1)的结果我们可以得以下的关系:N2+3H 22NH3从始1到平衡需要一个时间过程,在这个过程中任意一个时刻各物质都有一个相应的量,那么以这个过程中任意一个时刻作初始状态,当然也能达到平衡状态的结果,这就好比上图中从A地能达到B地,那么以A、B两地间任意一点作出发点保持方向不变自然能达到B地。
当X=0.75时,很明显是始1至平衡过程中的一点,根据化学方程式可知:N2:1→0.75,H2∶3→2.25,NH3∶0→0.5故当X=0.75,则Y=2.25、Z=0.5当X=0.45时,很明显是始2至平衡过程中的一点,同理知:Y=1.35、Z=1.1。
当我们抛开平衡状态时,也可将X=0.45、Y=1.35、Z=1.1看作从始1一直正向反应过程中达到的一个点,所以当我们不知道平衡时具体的数值,我们仍能据此求出Y和Z的值。
同理可得:说明这类同一平衡所具备的物料关系,我们可以形象地记为过程与结果的关系,即将原初始状态至原平衡状态过程中任意一点作为初始状态,达到的平衡与原平衡互为同一平衡。
2.在恒温恒压下,对于同一可逆反应,若两初始状态具有相当的物料关系,则达到平衡后,两平衡互为等效平衡。
此处的相当是指按化学计量数换算成左右两边中同一边物质的量之比相同。
例如:N2O(g)+2O2(g )N2O5(g)①中n(N2O)∶n(O2)=2∶3②中n(N2O)∶n(O2)=3∶4.5=2∶3③n(N2O)∶(O2)=(2.5+1.5)∶(3+3)=2∶3则①②③的量相当。
那么又如何形象地理解这一类等效平衡呢?这里仍以例题进行说明。
Ⅶ. 在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H 22NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号②~④的状态,填写表中空白。
已知编号始态的物质的量/mol平衡时NH3的物质的量/mol N2H2 NH3① 1 4 0 a② 1 0.5a③ 1.5 6 0④m g(g≥4m)解析由题意知②与①的平衡状态互为等效平衡,②中平衡时NH3的物质的量为①的一半,设①达到平衡的过程如下图。
设想我们可以用隔板将①中平衡状态均分为A、B两部分,那么A(B)与整体当然处于等效平衡且A(B)中NH3的量为0.5a mol,所以我们可认为A(B)部分为②的平衡态,那么达到B平衡态的初始状态当然也为达到①平衡态的初始状态的一半,即可用下图表示:即达到②的平衡的初始的物质的量为:n(N2)=0.5mol、n(H2)=2mol、n(NH3)=0 mol而经过等量互换,当n(NH3)=1mol时,n(N2)=0mol n(H2)=1.5mol同理知①为③这个整体的2/3,故③达到平衡时n(NH3)=同理,设始态NH3为x,平衡时NH3为y,则得x=2(g-4m) y=(g-3m)a说明这类等效平衡可形象地理解为整体与局部的关系。
即在恒温恒压下,当两初始状态符合局部与整体的关系时,那么相对应的平衡态也就符合局部与整体的关系。
反之亦然。
Ⅷ.在一定温度下,把2.0体积N2和6.0体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,如图20—2所示。
容器中发生的反应如下:N2+3H22NH3(正反应放热) 图20—2若反应达到平衡后,测得混合气体为7.0体积。
试回答:(1)保持上述反应温度不变,设a、b、c(a∶b=1∶3)分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后,混合气体中各物质的体积分数仍与上述平衡完全相同。
那么:①若a=1.0,c=2.0,则b=___________。
在此情况下,反应起始时将向___________方向进行(填“正”或“逆)。
②若规定起始时反应向逆方向进行,则c的范围是__________________。
(用含a、b的式子表示)。
(2)在上述装置中,若需控制平衡后混合气体为 6.5体积,则可采取的措施是__________,原因是___________________________________。