苏教版(2019)高一必修第一册专题2第一单元课时3物质的检验
- 格式:docx
- 大小:73.58 KB
- 文档页数:6

第2课时物质的检验物质性质和变化的探究教学目标1. 学会铵根离子、氯离子、硫酸根、钾离子检验的实验技能。
2. 能用焰色反应、离子检验法设计简单的实验方案探究某些常见物质的组成成分。
3. 了解一些现代化学的分析方法。
教学重点1. 铵根离子、氯离子、硫酸根、钾离子的检验。
2. 焰色反应。
教学难点检验方案的设计和分析。
课前准备1. 教师的教学准备:搜集相关图片、资料并结合教学设计制作成多媒体课件。
2. 教学用具、实验的设计和准备。
3. 实验药品,实验用具等。
教学过程【课程导入】以物质检验在日常生活、生产、科研的应用来导入,让学生意识到物质检验的重要性,从而调动学生主动学习的积极性。
再以初中学过的检验知识过渡,学生与教师共同讨论,概括出物质检验的依据与一些常用检验方法。
【活动与探究】在掌握检验依据与一般检验方法之后,设计实验方案检验氯化铵、硫酸铵、氯化钾、硫酸钾这几种盐中所含的离子检验方法。
让学生在活动中加深对物质检验的认识,初步学会物质检验的一般方法。
活动结束后,针对学生设计检验方案中的不足教师点出检验的注意事项,这样能使学生加深印象。
(讲述)在生产、生活和科学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行检验,以确定物质的组成。
那该如何鉴定呢?我们这节课就来学习,同学们翻开课本P33。
(提问)1. 怎么知道两瓶失去标签的食用醋和酱油哪一瓶是醋?2. 如何辨别是否是全毛毛衣?3. 氯化钠溶液与硫酸铜溶液,怎么区别开来?(学生回答)1. 闻气味 2. 燃烧,闻气味 3. 看颜色(讲述)总结上面提到的,我们发现,物质的气味、颜色等属于物质的物理性质,只能对物质进行粗略的区分,假如我们要知道物质的组成,就要利用物质的化学性质了。
【板书】一、物质的检验(讲述)结合初中的知识,我们来回顾一下,如何检验某物质中是否含有碳酸盐?其依据是什么?(学生回答)加入盐酸,反应放出无色气体,将该气体通入澄清石灰水,若石灰水变浑浊则说明存在CO2-3。





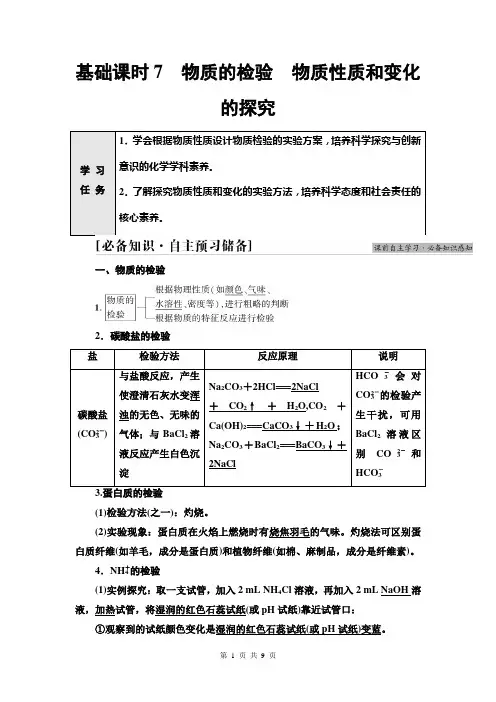
基础课时7物质的检验物质性质和变化的探究学习任务1.学会根据物质性质设计物质检验的实验方案,培养科学探究与创新意识的化学学科素养。
2.了解探究物质性质和变化的实验方法,培养科学态度和社会责任的核心素养。
一、物质的检验2.碳酸盐的检验盐检验方法反应原理说明碳酸盐(CO2-3) 与盐酸反应,产生使澄清石灰水变浑浊的无色、无味的气体;与BaCl2溶液反应产生白色沉淀Na2CO3+2HCl===2NaCl+CO2↑+H2O,CO2+Ca(OH)2===CaCO3↓+H2O;Na2CO3+BaCl2===BaCO3↓+2NaClHCO-3会对CO2-3的检验产生干扰,可用BaCl2溶液区别CO2-3和HCO-3(1)检验方法(之一):灼烧。
(2)实验现象:蛋白质在火焰上燃烧时有烧焦羽毛的气味。
灼烧法可区别蛋白质纤维(如羊毛,成分是蛋白质)和植物纤维(如棉、麻制品,成分是纤维素)。
4.NH+4的检验(1)实例探究:取一支试管,加入2 mL NH4Cl溶液,再加入2 mL NaOH溶液,加热试管,将湿润的红色石蕊试纸(或pH试纸)靠近试管口:①观察到的试纸颜色变化是湿润的红色石蕊试纸(或pH试纸)变蓝。
②反应的化学方程式是NH 4Cl +NaOH=====△NaCl +NH 3↑+H 2O 。
(2)方法总结:取少量待测液,加入NaOH 溶液,并加热,若产生使湿润的红色石蕊试纸(或pH 试纸)变蓝的气体,则原溶液中含有NH +4。
5.氯离子的检验(1)在5支试管中分别加入2~3 mL 稀盐酸、NaCl 溶液、Na 2CO 3溶液、自来水、蒸馏水,然后各滴入几滴AgNO 3溶液,观察现象。
然后再分别加入少量稀硝酸,观察现象。
实验现象如下表:实验现象有关化学方程式加入AgNO 3 溶液后加入稀 硝酸后 ①稀盐酸 有白色沉 淀生成 沉淀 不溶解 HCl +AgNO 3===AgCl ↓+HNO 3 ②NaCl 溶液有白色沉 淀生成沉淀不 溶解NaCl +AgNO 3===AgCl ↓+NaNO 3③Na 2CO 3 溶液有白色沉 淀生成沉淀溶解, 有气泡产生Na 2CO 3+2AgNO 3===Ag 2CO 3↓+2NaNO 3Ag 2CO 3+2HNO 3===CO 2↑+H 2O +2AgNO 3④自来水 有少量白色 沉淀生成 沉淀 不溶解 Cl 2+H 2OHCl +HClOHCl +AgNO 3===AgCl ↓+HNO 3⑤蒸馏水无明显变化无明显变化-取少量待测样放入试管中,滴加适量用稀硝酸酸化的AgNO 3溶液,若产生白色沉淀,则说明溶液中含有Cl -。




高一必修第一册(苏教2019)专题2第一单元研究物质的实验方法学校:___________姓名:___________班级:___________考号:___________一、单选题1.物质的性质不同,其存放的方法也不同。
下列物质的存放方法正确的是( ) A.浓硫酸可敞口保存在细口瓶中B.浓盐酸可保存在广口瓶中C.NaOH溶液可保存在带有玻璃塞的细口瓶中D.白磷可保存在装有冷水的试剂瓶中2.在危险化学品的外包装标签上印有警示性标识。
下列化学品名称与警示识标识名称不对应的是( )A.烧碱——剧毒品B.氯酸钾——爆炸品C.浓硫酸——腐蚀品D.白磷——自燃物品3.下列说法错误的是( )A.不慎将燃着的酒精灯打翻失火,应立即用湿抹布或沙子盖灭B.不慎将酸溶液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛C.用滴管向试管中滴加液体时,滴管下端应紧贴试管内壁D.稀释浓硫酸时,将浓硫酸沿烧杯内壁缓缓加入盛水的烧杯中,并用玻璃棒不断搅拌4.下列实验操作正确的是( )A.当某实验没有明确的药品用量说明时,为观察到明显现象,取用药品越多越好B.取用细口瓶里的试剂时,应先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管中C.用胶头滴管取完一种试剂后,可直接取另一种不与其反应的试剂D.取用粉末状固体时,应用药匙,取用块状固体时,应用镊子夹取5.下列化学实验操作正确的是A.点燃酒精灯B.称量10.05g固体C.加热液体D.量取9.5mL的液体6.从KClO3分解制O2后的剩余物中,回收MnO2的操作正确的是()A.溶解、过滤、蒸发、加热B.溶解、过滤、洗涤、加热C.溶解、蒸发、洗涤、过滤D.溶解、洗涤、过滤、加热7.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为()A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸8.下列除去杂质的方法中,正确的是A.A B.B C.C D.D9.下列说法正确的是( )A.过滤、蒸发、溶解都要用到玻璃棒,其作用相同B.过滤完成后洗涤沉淀时,应向漏斗中加入适量蒸馏水并搅拌滤干C.蒸发操作中,应使混合物中的水分完全蒸干后才能停止加热D.可用蒸发结晶法从饱和食盐水中提取食盐10.NaCl和KNO3的溶解度与温度的关系如图所示。
苏教版(2019)高一必修第一册专题2第一单元课时3物质
的检验
学校:___________姓名:___________班级:___________考号:___________
1.为了检验某固体物质中是否含有4NH +,你认为下列试纸或试剂一定用不到的是( )
①蒸馏水 ②NaOH 溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀盐酸
A .①⑤
B .④⑤
C .①③
D .①④⑤ 2.下列检验Cl -的方法正确的是( )
A .向某溶液中滴加AgNO 3溶液,若产生白色沉淀说明该溶液中有Cl -
B .向某溶液中先滴加盐酸,再滴加AgNO 3溶液,若产生白色沉淀,说明溶液中有Cl -
C .向某溶液中先滴加AgNO 3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有Cl -
D .向某溶液中滴加用HNO 3酸化的AgNO 3溶液,若产生白色沉淀,说明溶液中有Cl - 3.下列说法正确的是( )
A .向某溶液中滴加硝酸酸化的()32Ba
NO 溶液,有白色沉淀生成,该溶液一定含有
2
4SO - B .向某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清石灰水中,产生白色沉淀,则该溶液中一定有23CO -
C .向某溶液中滴加NaOH 溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有4NH +
D .向某溶液中滴加3AgNO 溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl -
4.在未知液中加入3AgNO 溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断未知液中含有
( )
A .Cl -、24SO -
B .Cl -、3NO -
C .Cl -、23CO -
D .Cl -、OH - 5.有一包白色固体,可能含有Na 2CO 3、KNO 3、KCl 、BaCl 2和CuSO 4,按下列步骤做实验。
①将该固体溶于水得无色溶液。
②向溶液中加入AgNO 3溶液,得到白色沉淀,再加稀HNO 3,
白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊。
根据现象判断:
(1)一定存在的物质是________。
(2)一定不存在的物质是________。
(3)可能存在的物质是________。
6.人们利用焰色反应制造了绚丽多彩的烟花,下列物质的焰色为黄色的是
A.Na2CO3B.KCl C.CaCl2D.CuSO4
7.下列关于焰色反应的说法不正确的是
A.金属单质无焰色反应
B.很多金属或它们的化合物灼烧时有焰色反应
C.透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色
D.每次焰色反应实验后都要将铂丝用稀盐酸洗净并灼烧
8.下列离子检验的方法正确的是
A.向某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.向某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42-
C.向某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.向某溶液中加稀硫酸生成白色沉淀,说明原溶液中有CO32-
9.某溶液中含有较大量的Cl-、CO2-
、OH-三种阴离子,如果只取一次该溶液就能够分
3
别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是()
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②③②①
C.①②③②④D.④②①②③
参考答案
1.B
【解析】
【分析】
【详解】
NH+检验一般是取少量样品与碱液混合于试管中,加热,将用蒸馏水润湿的红色石蕊试纸4
靠近试管口,看试纸是否变蓝;也可将蘸有浓盐酸的玻璃棒靠近试管口,看是否有白烟生成;因此④、⑤一定用不到,答案选B。
2.D
【解析】
【分析】
【详解】
A. 可能生成碳酸银、硫酸银等沉淀,不能说明该溶液中有Cl−,故A错误;
B. 先滴加盐酸,引入Cl−,不能说明该溶液中有Cl−,故B错误;
C. 加入盐酸,不能排除Cl−的干扰,故C错误;
D. 因氯化银不能溶解于硝酸,滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,可说明溶液中有Cl−,故D正确;
故选D。
【点睛】
氯离子的特征离子反应是可以和银离子反应生成白色不溶于硝酸的白色沉淀,注意排除其它离子的干扰,以此解答该题。
3.C
【解析】
【分析】
【详解】
Ba NO溶液,有白色沉淀生成,则该溶液也可能含有A.向某溶液中滴加硝酸酸化的()32
2
SO-,A错误;
3
B.向某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清石灰水中产生白色沉淀,
HCO-,B错误;
则该气体是二氧化碳,因此该溶液也可能含有
3
C .向某溶液中滴加NaOH 溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,该气体是氨气,则该溶液中一定有4NH +
,C 正确;
D .向某溶液中滴加3AgNO 溶液,生成白色沉淀,再加稀盐酸沉淀不消失,由于引入了Cl -,故原溶液中不一定有Cl -,应该选用硝酸检验沉淀是否消失,D 错误;
答案选C 。
4.C
【解析】
【分析】
【详解】
能使澄清石灰水变浑浊的无色无味气体应是2CO ,又因为加入稀3HNO 后沉淀部分溶解,
故原溶液中一定有Cl -,故未知液中除含有 23CO -外,还有Cl -,答案选C 。
5.Na 2CO 3、KCl BaCl 2、CuSO 4 KNO 3
【解析】
【分析】
根据CO 32-、Cl -、Ba 2+、SO 42-的性质及检验方法分析解答。
【详解】
该固体溶于水得无色溶液,说明固体中不含CuSO 4,由②中,向溶液中加入AgNO 3溶液,得到白色沉淀可以被稀硝酸部分溶解且生成可以使澄清石灰水变浑浊的气体,可知白色固体中一定含有含Na 2CO 3,则一定不含BaCl 2,生成的不溶于稀硝酸的白色沉淀为AgCl ,则原白色固体中一定含KCl ,KNO 3则无法确定;
故答案为 (1). Na 2CO 3、KCl (2). BaCl 2、CuSO 4 (3). KNO 3。
6.A
【解析】
【分析】
【详解】
A .含有钠元素的物质的焰色反应为黄色,A 正确;
B .含有钾元素的物质的焰色反应为紫色(透过蓝色钴玻璃),B 错误;
C .含有钙元素的物质的焰色反应为砖红色,C 错误;
D.含有铜元素的物质的焰色反应为绿色,D错误;
答案选A。
7.A
【解析】
【分析】
A、焰色反应是含有某些金属元素的物质在火焰上灼烧时呈现特殊的颜色;
B、焰色反应是含有某些金属元素的物质在火焰上灼烧时呈现特殊的颜色;
C、钾元素的焰色反应的颜色为紫色,但要透过蓝色钴玻璃;
D、用盐酸来洗涤铂丝更容易将铂丝上的物质洗去。
【详解】
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应;
A.根据定义可知,无论某金属元素的单质还是化合物在灼烧时都呈现相同的特殊颜色,体现的是元素的性质,故A错误;
B.根据定义可知,某些金属或它们的化合物灼烧时有焰色反应,故B正确;
C.钾元素的焰色反应的颜色为紫色,但要透过蓝色钴玻璃滤去火焰的黄光才能观察到,故C
正确;
D.铂丝要用盐酸来洗涤,更容易将铂丝上的物质洗去,且盐酸易挥发不会干扰实验,故D正确;综上所述,本题选A。
8.C
【解析】
【分析】
【详解】
A.能与Ag+沉淀的离子有很多,未滴加稀硝酸酸化,不能排除CO32-等离子的干扰,A错误;B.未先滴加稀盐酸酸化,不能排除Ag+、CO32-等离子的干扰,B错误;
C.Cu2+能与NaOH溶液反应生成蓝色的Cu(OH)2沉淀,C正确;
D.H2SO4与CO32-反应,会生成CO2,现象是有气泡冒出,不会有沉淀,D错误;
故选C。
【点睛】
本题的易错选项为B,BaCl2溶液中既有Ba2+又有Cl-,若原溶液中有Ag+,会生成AgCl沉
淀。
因此检验SO42-时需要先加HCl酸化,排除Ag+、CO32-等离子的干扰。
这里一定要注意,先加BaCl2再加HCl也是不行的,依然不能排除Ag+干扰。
9.D
【解析】
【分析】
检验氯离子用AgNO3溶液;检验氢氧根离子可用Mg(NO3)2溶液;检验碳酸根离子可用
Ba(NO3)2溶液;
【详解】
由于碳酸根离子能与AgNO3溶液、Mg(NO3)2溶液反应,分别生成Ag2CO3沉淀、MgCO3沉淀,故要先检验碳酸根离子,再检验氢氧根离子、氯离子,由于氢氧根离子与银离子结合成的AgOH极不稳定,故要先检验氢氧根离子。
仅用一份样品溶液,可先滴加Ba(NO3)2溶液产生白色沉淀,说明含有碳酸根离子;过滤,向滤液中再滴加Mg(NO3)2溶液产生白色沉淀,说明含有氢氧根离子;过滤,再向滤液中再滴加AgNO3溶液,产生白色沉淀,说明含有氯离子;综上所述,正确的实验操作顺序是④②①②③。