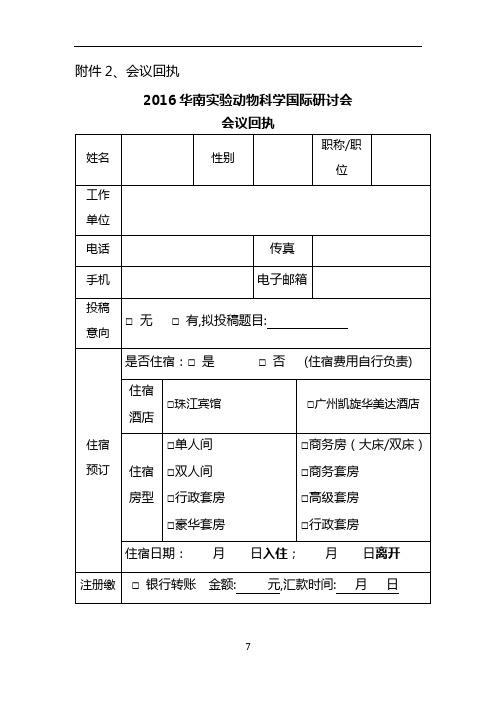
实验室规范研讨培训暨GLP技术交流会议报名回执
- 格式:doc
- 大小:35.00 KB
- 文档页数:1

安徽省食品药品监督管理局关于举办药物临床试验质量管理培训班的通知文章属性•【制定机关】安徽省食品药品监督管理局•【公布日期】2016.10.26•【字号】•【施行日期】2016.10.26•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】药政管理正文安徽省食品药品监督管理局关于举办药物临床试验质量管理培训班的通知合肥、芜湖、蚌埠、安庆市局,各药物临床试验机构:为加强药物临床试验机构质量管理工作,省局定于2016年11月26-27日在蚌埠举办全省药物临床试验质量管理培训班,现将有关事宜通知如下:一、培训主要内容(一)药物临床试验管理法规及修订思路解读;(二)药物临床试验管理制度及SOP的制订与执行;(三)药物临床试验机构建设及质量管理(四)仿制药一致性评价及生物等效性研究注意事项;(五)药物临床试验稽查;(六)伦理委员会在药物临床试验中的作用二、培训时间及地点(一)培训时间:11月25日下午报到,26日至27日全天培训。
(二)培训地点:蚌埠市利事环球酒店(蚌埠市淮上大道3000号)三、参训人员(一)合肥、芜湖、蚌埠及安庆市食品药品监督管理局负责药物临床试验管理人员各2名;(二)全省获得药物临床试验资格认证的7家药物临床试验机构、伦理委员会及专业科室负责人及相关研究人员,每家机构5人。
四、其它事项(一)本次培训班依托蚌埠医学院第一附属医院继续教育平台举办,本通知所列参训人员培训费由会议安排,交通、住宿费自理。
(二)请各单位参训人员于2016年11月10日前将培训班报名回执(附件)发送至蚌埠医学院第一附属医院。
如需安排住宿,请于回执中注明,以便提前预定,统一安排。
安徽省食品药品监督管理局联系人:陈咏梅、赵元勋联系电话及传真:*************、62999254蚌埠医学院第一附属医院联系人:万巍、张茜联系电话:135****0910,139****3751报名邮箱:****************(三)其它非药物临床试验机构的医院,包括各合同研究组织、药品生产企业和药物研究机构参训人员请直接与蚌埠医学院第一附属医院联系。

认监委良好实验室规范(GLP)标识使用及管理规定1. 目的及范围1.1 为保证认监委(CNCA)GLP标识的正确使用,防止误用、滥用GLP标识和误导性宣传,维护CNCA的信誉,特制定本规定。
1.2 本规定适用于GLP标识的使用及管理,规范获认监委GLP检查合格的机构对GLP标识的使用及合格状态的宣传。
2. GLP标识的使用2.1 取得认监委良好实验室规范(GLP)符合性检查合格的机构,可在其报告、文件、办公用品、宣传品、网页上使用GLP标识声明其GLP符合性状态,表明该机构通过认监委良好实验室规范符合性检查。
2.2 获认监委GLP检查合格的机构只能在检查证书有效期内做出GLP符合状态声明,并在检查合格的领域正确使用GLP标识,不得与其母体组织的其他活动有关。
2.3 获GLP检查合格的机构在使用GLP标识时不应产生误导,使客户误认为CNCA 和中国合格评定国家认可委员会(CNAS)对检查合格的机构出具的安全性评价报告及其意见或解释负责。
3. GLP标识的管理3.1 CNCA将根据获检查合格的机构误用或滥用GLP标识以及误导宣传GLP符合性状态的情节做出轻重处理,包括:警告、暂停、撤销或提起法律诉讼。
如果由于误用或滥用引起不良的影响,CNCA将发布澄清声明。
3.2 必要时,CNCA将与CNAS和获GLP检查合格的机构协商制定对GLP标识使用的其他要求,并形成相关文件。
4. GLP标识的格式4.1 良好实验室规范标识为GLP。
中文标识的整个图形由字母GLP和汉字“认监委良好实验室规范”组成,呈椭圆形,LP在G内上下居中,汉字位于图标下方。
英文标识的整个图形由字母GLP和英文字母“CNCA GOOD LABORATORY PRACTICE”组成,GLP位于“CNCA GOOD LABORATORY PRACTICE”上方。
4.2 GLP标识使用时可按设计尺寸成比例放大或缩小,应清晰可辨。
其基本颜色成蓝色或黑色。

glp培训计划GLP培训计划的目的是通过学习和训练,使科研人员了解GLP的重要性、内容和要求,掌握GLP的实施方法和技巧,提高实验室管理水平,确保科学研究成果的可靠性和可信度。
本文将介绍一个完整的GLP培训计划,包括培训的内容、形式、方法和评估等方面,以供参考。
一、培训目标1.了解GLP的基本概念和原则,认识GLP对科学研究的重要性和作用;2.掌握GLP的实施要求和技巧,了解GLP的具体内容和标准;3.提高实验室管理水平,确保实验结果的可靠性和可信度;4.培养科研人员的实验室管理意识和能力,推动GLP的实施和推广。
二、培训内容1.GLP的基本概念和原则(1)GLP的定义和历史(2)GLP的原则和基本要求(3)GLP对科学研究的作用和意义2.GLP的实施要求和技巧(1)实验室设备和环境的管理(2)实验室安全和危险废物处理(3)实验操作流程和记录要求(4)实验数据的管理和分析3.GLP的具体内容和标准(1)实验室管理制度和规章制度(2)实验室标准操作程序(SOP)的制定和执行(3)质量控制和质量保证体系(4)内部审核和外部审核要求4.实验室管理意识和能力培养(1)培养科研人员的实验室管理意识(2)提高科研人员的实验室管理能力(3)推动GLP的实施和推广三、培训形式1.理论培训通过讲座、讲解和讨论等形式,向科研人员介绍GLP的基本概念和原则,讲解GLP的实施要求和技巧,介绍GLP的具体内容和标准。
2.实践培训通过实验操作、模拟演练和实际案例分析等形式,向科研人员演示GLP的实施方法和技巧,让科研人员亲自操作和实践,掌握GLP的具体内容和标准。
3.案例研究通过分析实验室管理中的典型案例和问题,向科研人员介绍实验室管理的实际挑战和应对策略,让科研人员学会运用GLP的原则和方法解决实际问题。
四、培训方法1.专家讲座邀请GLP领域的专家学者,通过讲座和讲解的形式向科研人员介绍GLP的基本概念和原则,讲解GLP的实施要求和技巧。

glp认证解读-回复初步理解,"glp认证"指的是"Good Laboratory Practice"(良好实验室规范)认证。
良好实验室规范是一种国际公认的实验室质量管理体系,主要确保实验室在科学研究和测试中遵循一系列指导原则和标准。
本文将分步解析glp认证的内涵、流程和作用。
第一步:基本概念与原则1.1 定义:glp认证是一种确保实验室遵循良好实验室规范的认证机制。
1.2 原则:1.2.1 可追溯性:实验室的每个过程和操作都应有明确的文档记录,以确保结果的可追溯性。
1.2.2 质量控制:实验室应建立和维护适当的质量控制措施,以确保测试结果的准确性和可靠性。
1.2.3 培训和教育:实验室应提供必要的培训和教育,确保实验人员具备必要的技能和知识。
1.2.4 仪器和设备:实验室应使用经过校准和维护的仪器设备,以保证实验结果的准确性。
1.2.5 文件管理:实验室应建立恰当的文件管理系统,确保记录和报告的准确性和完整性。
第二步:认证流程2.1 审核申请:实验室首先向认证机构提交申请,包括组织机构信息、实验室设施和仪器设备清单、质量管理计划等。
2.2 认证准备:实验室进行内部评估,以确定是否符合glp认证标准。
若不符合,需要进行改进和调整。
2.3 外部审核:认证机构派遣专业审核团队对实验室进行现场审核,包括检查设备、记录和操作程序等。
2.4 报告和建议:审核团队提交审核报告,并给出改善建议和意见。
2.5 认证决定:认证机构基于审核报告和实验室的改善措施,决定是否颁发glp认证证书。
第三步:作用与价值3.1 维护科学研究的可靠性:glp认证确保实验室在科学研究中遵循标准和程序,提高研究结果的可靠性和准确性。
3.2 促进国际合作与交流:glp认证是国际公认的质量管理体系,使得实验室能够在国际合作和交流中获得更多机会与认可。
3.3 提升实验室竞争力:glp认证是实验室质量管理的重要证明,能够提升实验室的竞争力,获得更多合作伙伴与资金支持。