基因检测案例6-Usher综合征
- 格式:docx
- 大小:302.22 KB
- 文档页数:5


Evans综合征的临床研究案例患者为一名40岁的女性,她因为持续性的疲劳、反复感染和皮肤紫癜就诊。
患者的病史显示,她过去曾有过类似的症状,但直到最近才被确诊为 Evans综合征。
在临床研究中,医生对患者进行了详细的检查,包括血液检查、骨髓穿刺和免疫学检查。
血液检查显示患者有严重的贫血和白细胞减少。
骨髓穿刺结果显示患者的骨髓造血功能受损,但未发现明显的肿瘤细胞。
免疫学检查发现患者存在自身免疫性抗体,这些抗体对她的红细胞和白细胞产生了破坏作用。
在治疗过程中,患者的主治医生定期监测了她的病情变化。
经过几个月的药物治疗,患者的贫血和白细胞减少得到了明显的改善。
同时,她的感染症状也逐渐减轻。
然而,患者在治疗过程中出现了严重的副作用,包括肝功能异常和骨质疏松。
这些副作用使得医生不得不调整了她的治疗方案,减少了一些药物的剂量。
在治疗了一段时间后,患者的病情得到了进一步的改善。
她的疲劳感减轻,皮肤紫癜也消失了。
然而,医生发现患者体内的自身免疫性抗体仍然存在,这使得她的病情容易反复。
为了巩固治疗效果,医生建议患者进行骨髓移植。
骨髓移植是 Evans综合征治疗的一种有效手段。
通过移植健康的造血干细胞,可以重建患者的免疫系统,并消除自身免疫反应。
在骨髓移植过程中,患者需要接受抗排斥治疗,以防止移植物被排斥。
医生选择了患者的一位亲缘亲属作为供者,进行了骨髓移植手术。
然而,骨髓移植也带来了一些并发症。
患者出现了移植后排斥反应,导致她的肝脏功能受到了影响。
医生立即采取了相应的治疗措施,包括抗排斥治疗和肝功能支持治疗。
经过一段时间的努力,患者的肝功能得到了改善。
重点和难点解析在上述案例中,有几个关键的细节需要重点关注。
患者的确诊过程和疾病诊断是一个复杂而耗时的过程。
我在就诊初期,因为症状的多样性,曾一度被误诊。
这导致了我在得到正确诊断前,浪费了很多时间和精力。
这提醒了医生和患者,对于疑似自身免疫性疾病的患者,需要进行全面的检查和评估,以确保尽早确诊。

基因检测案例7|BBS综合征疾病简介Bardet-Biedl 综合症 (Bardet-Biedl Syndrome; BBS) 是一种常染色体隐性遗传病。
临床典型特征包括视网膜色素变性、先天性肥胖、多指趾畸形、性腺功能障碍、智力发育迟缓及肾脏异常等。
该病发病率位于1:59000至1:60000之间。
BBS的诊断主要依据上述6个典型的临床表现。
此外还有11个次要特征,包括语言表达能力缺陷、斜视或散光或白内障、短指趾或并指趾畸形、发育迟缓、多尿或多饮、共济失调或协调平衡能力差、下肢痉挛、糖尿病、牙齿排列过挤或缺齿或高弓形腭、右心室肥大或先天性心脏病、肝纤维化。
具有以上6个主要特征中4项或具有3个主要特征加2个次要特征者即可诊断为BBS。
经典的BBS呈常染色体隐性遗传,但近年的研究发现BBS还以三等位基因遗传及复杂的非孟德尔方式遗传。
BBS综合征的发病原因随着遗传学技术的发展,目前研究发现至少18个致病基因 (BBS1-BBS18)与 BBS发病有关,BBS基因编码的蛋白参与了机体细胞纤毛的形成和信号传导功能.BBS基因发生突变或缺失都将导致纤毛相关性疾病如智力低下、多指 (趾 )、视网膜细胞萎缩、性器官发育不全等.BBS基因突变或缺失导致了原生纤毛功能缺失。
原生纤毛在人体多数细胞中存在,可通过调控目的基因的表达而左右多种组织和器官的发育。
BBS患者中膜联蛋白A1(nnexiaA1,ANXA1)表达显著下降.而ANXA1 可能参与了精子的钙依赖事件。
因此 BBS性器官发育不良可能与ANXA1下降有关。
有学者利用基因芯片筛选 BBS患者差异基因发现细胞因子诱导的含SH2结构蛋白作为负性调控因子参与了瘦素信号系统,通过抑制STAT3 磷酸化使瘦素受体不能接受信号而产生瘦素抵抗,导致患者出现肥胖。
纤毛还具有调控细胞分裂的作用,当其功能受损后细胞分裂出现失控可发生发育畸形。
BBS综合征的表型视网膜退化是BBS患者的典型表型。

【案例分享】Gilbert综合征疾病概述Gilbert综合征(Gilbert Syndrome,GS)⼜称为体质性肝功能不良性黄疸,是由于肝组织摄取⾮结合胆红素障碍或微粒体内葡萄糖醛酸转移酶不⾜,致使⾎液中⾮结合胆红素显著增⾼⽽发⽣黄疸的⼀类较常见的遗传性代谢疾病,1901年Gilbert⾸先报告。
Gilbert综合征临床表现特点为长期间歇性轻度黄疸,多⽆明显症状,在临床中易被误诊为肝炎。
发病率⼤约为5%左右,男性多见,男⼥发病⽐例1.5 :1到7 :1,以青年期(15~20岁)发病最多见,可因紧张、劳累、饮酒、感染、受凉、腹泻、便秘、饥饿、或合并其他疾病⽽加重或诱发。
⼀般情况良好,黄疸加重可有乏⼒、消化不良、肝区不适等症状。
⽪肤和巩膜轻中度黄染是唯⼀的体征。
⾎胆红素波动在1~3mg/dl,⾼或低于此值也常看到。
轻型⼀般不超过5mg/dl,重型可超过5mg/dl。
发病机制在肝脏中⾮结合胆红素的葡萄糖醛酸化是胆红素转化、分泌、排泄的重要条件,GS患者有胆红素的⽣成、摄取、转运和结合的障碍,主要表现为尿苷⼆磷酸葡萄糖醛酸转移酶(UDP2glucuronosyltransferase,UGT)活⼒明显下降,仅及正常⼈的30%。
UGT主要集中在肝内质⽹和核膜。
UGT的活性依赖于⼤量同⼯酶的存在,它以尿苷-5⼆磷酸葡萄糖醛酸(UGA)为糖基供应体与底物结合,增加内源性和外源性物质的亲⽔性,使其更易于随尿与胆汁排出体外。
该酶催化UDP2葡萄糖醛酸酶分⼦中的葡萄糖醛酸向游离胆红素的丙酸基转移,游离胆红素进⼊肝细胞后,被肝细胞浆内的两种低分⼦可溶性“受体蛋⽩”(Y,Z蛋⽩接受)带到滑⾯内质⽹,在酶的作⽤下进⾏结合,形成胆红素单葡萄糖醛酸和胆红素双葡萄糖醛酸。
根据其cDNA序列的同源性将UGT超基因家族分为四个亚族:UGTl、UGT2、UGT4、UGT8。
⼈类UGTl基因定位于染⾊体2q37,包括5个外显⼦,第l外显⼦区域5’端由13个可替换的第1外显⼦(UGTlA)组成。

Evans综合征的遗传因素研究Evans综合征是一种罕见的自身免疫性疾病,它同时具备系统性红斑狼疮和原发性免疫缺陷病的特点。
在研究 Evans 综合征的遗传因素时,我发现了一些有趣的案例和现象。
我的家族中,有几位亲属都患有 Evans 综合征。
这让我开始思考,是否有可能存在遗传因素的影响。
为了验证这个想法,我咨询了医生并进行了基因检测。
结果显示,我携带了与 Evans 综合征相关的基因突变。
这进一步证实了我的猜测, Evans 综合征确实与遗传因素有关。
除了家族遗传外,我还发现了一些其他有趣的案例。
例如,一些Evans 综合征患者出现了家族聚集现象,他们的亲属中也患有类似的免疫系统疾病。
这表明, Evans 综合征可能由一种或多种遗传因素所影响。
目前,科学家们已经发现了一些与 Evans 综合征相关的基因突变。
例如,研究发现, FAS 基因的突变可能导致 Evans 综合征。
FAS 基因编码的是一种重要的凋亡蛋白,它参与调节免疫系统的功能。
当FAS 基因发生突变时,可能会导致免疫系统出现异常,从而引发Evans 综合征。
一些研究还发现, TNF 家族基因的突变也可能与 Evans 综合征有关。
TNF 家族基因编码的是一类炎症因子,它们在调节免疫反应中起着重要作用。
当 TNF 家族基因发生突变时,可能会导致免疫系统出现异常,从而增加患 Evans 综合征的风险。
然而, Evans 综合征的遗传因素研究仍然面临着一些挑战。
由于Evans 综合征是一种罕见的疾病,相关的研究样本数量有限。
这使得研究结果的普遍性和可靠性受到一定程度的影响。
Evans 综合征的病因复杂,除了遗传因素外,还可能受到环境因素、免疫系统的异常等多种因素的影响。
因此,要想全面揭示 Evans 综合征的遗传因素,还需要进行更多大规模、多中心的研究。
Evans 综合征的遗传因素研究取得了一定的进展。
研究发现,Evans 综合征可能由 FAS 基因、 TNF 家族基因等遗传因素所影响。


案例分享基因检测辅助诊断罕见病——Joubert综合征展开全文临床信息:受检者,女性,4岁。
先心病:自幼智力运动发育落后,站立不稳,不能行走,共济失调,眼外肌麻痹。
检测内容:全外显子测序本全外显子组基因检测针对人类基因组的外显子组的全部区域,覆盖20000多个基因,涵盖85%以上的人类遗传性疾病。
检测范围包括基因编码区单核苷酸位点变异(SNV)、小片段插入/缺失(INDEL)等突变类型。
检出1个匹配受检者临床表型的可能致病性的基因变异:KIAA0556基因IVS25+1G>A纯合变异。
变异基因解读:注:“.”:未提示;“D”:可能有害;人群频率:gnomAD_exome_EAS;dbscsnv11_AdaBoost、dbscsnv11_RandomForest评分大于0.6表示可能影响剪接1. KIAA0556基因关联疾病表型简介KIAA0556基因编码微管相关的纤毛基底蛋白,可能与微管的稳定性相关。
匹配受检者临床表现,OMIM收录该基因变异关联疾病表型为:注:“AR”:常染色体隐性遗传;信息参见:/entry/6167842. 变异位点解析①本样本中检出KIAA0556基因IVS25+1G>A纯合变异,为剪接突变,目前未被ClinVar数据库收录。
该变异位于经典剪接位点区,位于25号内含子剪接供体区域,可能影响mRNA正常剪接进而影响编码蛋白质功能,在多个人群数据库中未发现或频率极低,多种生物信息软件预测其有害。
②家系一代测序验证提示,在受检者父母样本中检出该位点杂合变异,符合常染色体隐性遗传模式,根据ACMG遗传变异分类标准与指南,上述变异注释为可能致病性的变异。
3. 遗传咨询建议①受检者父母再生育,其下一代有25%概率为纯合变异而导致相关疾病表现(纯合变异);50%概率为无症状的致病变异携带者(杂合变异);25%概率为无症状非携带者(无变异)。
②受检者将来婚育,其下一代有100%概率遗传到上述两个变异之一,为携带者,一般无疾病表现(杂合变异)。

・短篇报道・气囊扩张治疗食管胃吻合口狭窄38例福建省人民医院肿瘤科(350004)余养生 方公贤 严 宏 食管胃吻合口狭窄为外科常见的并发症之一,其发生率达0.3~9.5%,且随着吻合器的广泛应用而不断提高,给病人带来不少的痛苦,我科自1996年起,应用气囊扩张治疗38例,现报告如下。
1 临床资料本组男30例,女8例;年龄36~72岁。
原发病为食管癌10例,贲门癌28例;弓上吻合6例,弓下吻合32例,均为良性狭窄。
进食吞咽困难按St oo ler分级:0级,能进食各种食物, 0例;Ⅰ级,能进食软食,0例;Ⅱ级,能进食半流饮食,10例;Ⅲ级,能进食流质饮食,26例;Ⅳ级,不能进食,2例。
狭窄发生于术后3周至30个月,平均为9个月。
均行G I检查,吻合口直径0.5~1.0cm16例,0.3~0.5cm20例,小于0.3cm 2例,内镜均证实为良性狭窄。
2 方法术前禁食6h,肌注654-210m g。
同时行咽部表面麻醉,在内镜及监视系统下,将气囊充压至0.15~0.2mPa,哑铃型气囊扩张,均匀膨胀的气囊将吻合口撑大,保持压力约10分钟,放出气体退出扩张器,术后1h后进食,同时予以消炎治疗。
3 结果本组38例,共扩张58次,均未出现食管穿孔、出血,仅有1例出现胸痛,3h后自行消退。
38例病人均能进食普食或半流质,未出现Ⅲ级以上狭窄症状。
4 讨论吻合口狭窄的治疗方法较多,手术治疗不仅创伤大,且易再发生狭窄,费用过高,现基本已淘汰。
硬性食管镜即置入金属扩张器,患者较痛苦,易发生穿孔、出血,且有纵隔炎发生。
行胃镜扩张,易损伤胃镜,若吻合口小于0.3cm则无法通过,未有达到扩张目的,用高频电刀局部电切亦容易穿孔及灼伤食管。
我们采用哑铃型气囊扩张,因管柔软,易弯曲,且前头有一塑料引子(直径仅1.5mm)极易通过狭窄的吻合口,无一扩张失败,扩张器定位充气后呈哑铃型,狭窄部管腔直径增大具有良好的耐受性、自限性、可复性,易退出。

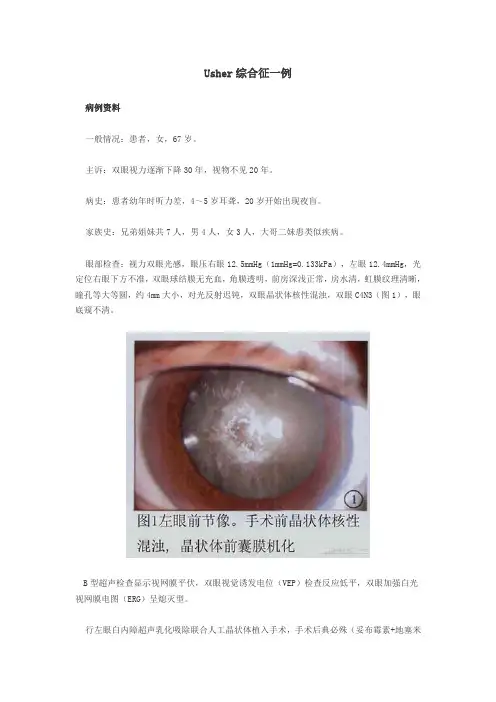
Usher综合征一例病例资料一般情况:患者,女,67岁。
主诉:双眼视力逐渐下降30年,视物不见20年。
病史:患者幼年时听力差,4~5岁耳聋,20岁开始出现夜盲。
家族史:兄弟姐妹共7人,男4人,女3人,大哥二妹患类似疾病。
眼部检查:视力双眼光感,眼压右眼12.5mmHg(1mmHg=0.133kPa),左眼12.4mmHg,光定位右眼下方不准,双眼球结膜无充血,角膜透明,前房深浅正常,房水清,虹膜纹理清晰,瞳孔等大等圆,约4mm大小,对光反射迟钝,双眼晶状体核性混浊,双眼C4N3(图1),眼底窥不清。
B型超声检查显示视网膜平伏,双眼视觉诱发电位(VEP)检查反应低平,双眼加强白光视网膜电图(ERG)呈熄灭型。
行左眼白内障超声乳化吸除联合人工晶状体植入手术,手术后典必殊(妥布霉素+地塞米松)和氧氟沙星眼液滴眼,每天4次共1个月。
手术后1周左眼视力手动/眼前,左眼角膜透明,前房深浅正常,房水清,瞳孔圆,对光反射迟钝,人工晶状体位置正,眼底视盘边界清楚,色蜡黄,视网膜血管纤细,视网膜见大量色素沉着(图2,3)。
病例讨论Usher综合征(Usher syndrome)又称遗传性耳聋-色素性视网膜炎综合征,视网膜色素变性-感音神经性耳聋综合征,聋哑伴视网膜色素变性综合征等。
是以先天性感音神经性聋、渐进性视网膜色素变性而致视野缩小、视力障碍为主要表现的一种常染色体隐性遗传性疾病,具有遗传异质性。
1858年vonGraefe首先发现聋哑合并视网膜色素变性病例。
1914年英国眼科学家CharlesUsher调查了视网膜色素变性人群中耳聋的发病率,首次提出耳聋-视网膜色素变性与遗传因素有关。
1972年Smith等将该病正式命名为Usher综合征。
国内也有个案报道。
近年来根据听力和前庭功能的检查情况一般将Usher综合征分为三型Ⅰ型:先天性重深度感音神经性聋,前庭反应消失;Ⅱ型:先天性中重度感音神经性聋,前庭反应正常;Ⅲ型:进行性感音神经性聋,前庭反应正常。

严提珍1,2,3 黄钧1,2,3 袁德健1,2,3 唐向荣4 韦笑宝1,2,3 罗世强1,2,3YAN Ti-zhen, HUANG Jun, YUAN De-jian, TANG Xiong-rong, WEI Xiao-bao, LUO Shi-qiangUsher综合征Ⅰ型家系的MYO7A 基因变异分析基金项目:广西自然科学资金(2020GXNSFAA297059);广西壮族自治区卫生健康委员会科研课题(Z20200018); 柳州市科技创新能力与条件建设项目(2018AF10501) 作者单位:1 柳州市妇幼保健院医学遗传科 柳州 5450012 柳州市出生缺陷预防与控制重点实验室 柳州 5450013 柳州市生殖医学重点实验室 柳州 5450014 柳州市妇幼保健院耳鼻喉科、听力诊断中心 柳州 5450015 柳州市妇幼保健院眼科 柳州 545001作者简介:严提珍 博士 副研究员;研究方向:遗传病的分子基础与基因诊断通讯作者:罗世强,E-mail:****************Usher综合征(Usher syndrome,USH)是一组以先天性感音神经性耳聋、渐进性视网膜色素变性引起视力障碍、视野缩小为主要临床表现的常染色体隐性遗传性疾病,发病率约为3.3~16.6/100000[1]。
依据临床表现的严重程度,可分为I型、II型和III型,其中I型症状最为严重,主要表现为先天性重度或极重度感音神经性耳聋,前庭功能障碍,在青少年时期可引发不同程度的视网膜色素变性[1]。
Usher综合征具有高度临床表型和遗传异质性,目前明确可与Usher综合征I型相关的基因有5个(MYO7A 、CDH23、USH1C 、USH1G 、PCDH15)[1],其中MYO7A 基因变异发生率最高[2];与Usher综合征II型相关基因有3个(USH2A 、GPR98和DFNB31);CLRN1基因Analysis of MYO7A Gene Variant in a Usher Syndrome Family【摘要】 目的 分析一个Usher综合征I型家系的MYO7A 基因变异情况,并分析其临床表型与基因型关系。
.236 •中华耳鼻咽喉头颈外科杂志202丨年 3 月第56 卷第3 期Chin J Otorhinolaryngol Head Neck Surg,March 2021,Vol. 56, No. 3•论著•136个耳聋家庭Usher综合征1型相关基因变异情况分析任淑敏吴庆华陈义兵焦智慧孔祥东郑州大学第一附属医院妇产科遗传与产前诊断中心,郑州450052通信作者:孔祥东,Email:kongxd@【摘要】目的探讨Usher综合征1型(Usher syndrome丨ype 1,USH丨)相关基因在136例中国河南籍耳聋家庭中的变异情况方法总结2016年I I月至2019年12月在郑州大学第一附属医院遗传与产前诊断中心应用二代测序(next-generation sequencing,NGS)技术进行耳聋基因检测的136个耳聋家庭的临床资料和测序数据,统计分析USH丨相关基因(/im)Z4、t/SW C、C£W23、PCLW75、G、C/S2)的变异情况。
结果共有5个耳聋家庭检测到USH1相关基因的9个致病或可能致病变异,占所有耳聋家庭的3.7%(5/136),其中4个耳聋家庭致病基因为《707/1,1个耳聋家庭致病基因为CO//2夂9个变异中的7个变异为首次报道,包括MTOZ4基因的c.313delG、c.5257dupA、c.5435A>T、c.5636G>C、c.5722T>G变异,以及CD//23基因的c. 155_丨66del、c.4802delA变异。
其中家庭2和家庭3的患者视力目前无异常,但根据基因诊断及行走延迟考虑为USH1的可能性大。
结论在本组河南籍耳聋患者中,MF0Z4为USH1相关基因中最常见的致病基因。
应用NGS技术可以在视觉症状出现之前对USH1患者进行初步诊断。
【关键词】Usher综合征;序列分析;My〇7/l; CD//23Variation analysis of genes associated with Usher syndrome type 1 in 136 Chinese deafnessfamiliesRen Shumin, Wu Qinghua, Chen Yibing,Jiao Zhihui, Kong XiangdongGenetic and Prenatal Diagnosis Center, Department of Obstetrics and Gynecology, the First AffiliatedHospital of Z hengzhou University, Zhengzhou 450052, ChinaCorrespondingauthor:KongXiangdong,Email:**************【Abstract 】Objective To i n v e s ti g a t e t h e v a r i a t i o n o f g e n e s a s s o c i a t e d w i t h U s h e rs y n d r o m e t y p e l(U S H l]i n136C h in e s e d e a f n e s s f a m ilie s f r o m H e n a n p r o v i n c e. Methods T h e d a t ao f 136d e a f n e s s f a m ilie s t e s t e d b y n e x t-g e n e r a t i o n s e q u e n c in g(N G S)w h i c h i d e n t i f i e d in t h e c e n t e r o fg e n e t i c s a n d p r e n a t a l d i a g n o s is o f t h e F i r s t A f filia te d H o s p ita l o f Z h e n g z h o u U n iv e r s ity f r o mN o v e m b e r2016to D e c e m b e r2019w e r e a n a l y s i z e d a n d t h e v a r i a t i o n f r e q u e n c y o f s ix g e n e s r e l a t e dt o U s h e r s y n d r o m e t y p e1(MY07A, USH1C, CDH23, PCDH15, USH1G, C1B2)w e r e s u m m a r i z e d.Results F iv e d e a f n e s s f a m ilie s w e r e d e t e c t e d n i n e p a t h o g e n i c o r lik e ly p a t h o g e n i c v a r i a t i o n s int w o g e n e s, a c c o u n t i n g f o r 3.7%o f a ll f a m ilie s. A m o n g t h e m, f o u r f a m ilie s w e r e c a u s e d b y MY07Av a r i a t i o n s a n d o n e f a m ily w a s c a u s e d b y CDH23v a r i a t i o n. M e a n w h ile, s e v e n v a r i a t i o n s o f tw o g e n e sw e r e r e p o r t e d f o r t h e f i r s t tim e. T h e y w e r e c. 313d e lG; c. 5257d u p A, c. 5435A>T, c. 5636G>C,c.5722T>G of MY07A,a n d c. 155_166d e l, c.4802d e l A of CDH23.T h e p a t i e n t s' v i s io n o f f a m ily 2 a n df a m ily 3 h a d n o o b v i o u s a b n o r m a l i t y a t p r e s e n t,b u t a c c o r d i ng t o g e n e t i c d i a g n o s is a n d w a lk in gd e a ly, t h e y w e r e c o n s i d e r e d t o b e U S H1. Conclusions MY07A is t h e m o s t c o m m o n c a u s t i v e g e n ea s s o c i a t e d w i t h U S H1in H e n a n d e a f n e s s p a t i e n t s,t h e a p p l i c a t i o n o f n e x t-g e n e r a t i o n s e q u e n c i n gDOI:10.3760/l 15330-20200407-00273收稿日期2020-04-07 本文编辑金昕引用本文:任淑敏,吴庆华,陈义兵,等.136个耳聋家庭Usher■综合征1型相关基因变异情况分析[J].中华耳鼻咽喉头颈外科杂志,2021, 56(3): 236-241. DOI: 10.3760/l 15330-20200407-00273.中平鼻咽喉头颈外科H;2021 年 3 jj 第56 卷%3 明Chin J Otorhinoluryn^ol Head Nrck Surg. March 2021. V O I. 56. No. 3•237 •t e c h n o l o g y c a n m a k e U S H1p a t i e n t s d i a g n o s e d e a r l i e r b e f o r e t h e v i s u a l s y m p t o m s a p p e a r.【Keywords】U s h e r s y n d r o m e s;S e q u e n c e a n a ly s is; MY07A; CDH23Usher综合征(Usher syndrome,USH)是一'种集听力损失、色素性视网膜炎和/或前庭功能障碍的 综合征型耳聋,呈常染色体隐性遗传:该综合征包 含3个亚型:USH 1型(USH1)症状最为严重,表现 为严重的听力损失、前庭反应缺失和青春期前出现 色素性视网膜炎;USH 2型(USH2)表现为先天性 中至重度的高频听力损失和正常的前庭功能,色素 性视网膜炎出现在生命的第一个十年或第二个十 年;U S H 3型⑴S H3)表现为典型的进展性听力损 失和色素性视网膜炎,前庭功能可正常或缺失1到目前为止,已经确定了 10个致病基W与USH有 关,包含 USH1 相关的MF0Z4、CIW23、P C D H15. U S H1G,C1B2;USH2 ^A'J U SH2A. C/火财、W>7/2/)以及USH3相关的C/A/W基W (),其中MF07/1、/C、C/)W23、C/B2基因还可导致非综合征型常 染色体隐性遗传性耳聋,基因还可导致常染 色体隐性遗传视网膜色素变性因为这些目标基 W很大,若使用传统的Sanger测序需要大量的人T.和成本,而应用近几年发展的二代测序技术(next-generation sequencing,NGS)能够同吋分析所 有已知的致病基因变异_USH患者在儿童期通常 只表现为听力异常,后期才会出现色素性视网膜炎 的相关症状,故在儿童期仅基于临床表型对USH 进行诊断存在巨大挑战:本研究中,我们使用NG S 技术在136个中国河南籍耳聋家庭中对USH1相关 基因变异情况进行筛查并做遗传分析资料与方法一、研究对象回顾性分析2016年丨1月至2019年】2月因耳 聋就诊于郑州大学第一附属医院遗传与产前诊断 中心的136个耳聋家庭的临床资料。
遗传学诊断在遗传性耳聋中的应用-医学遗传学论文-基础医学论文-医学论文——文章均为WORD文档,下载后可直接编辑使用亦可打印——遗传学应用论文(8篇核心期刊范文)之第四篇摘要:1990年运用胚胎移植前遗传学诊断技术(Pre-implantation Genetic Diagnosis, PGD) 的首例女婴的成功诞生[1], 标志着PGD正式从实验室转化到临床应用。
PGD是采用辅助生殖医学方法, 通过遗传学的诊断技术, 挑选健康的胚胎进行子宫移植, 它可以对携带遗传性致病基因的夫妇或者患者夫妇进行孕前诊断, 从而获得表型正常的后代, 且避免因产前诊断为致病胚胎而带来的是否选择终止妊娠的痛苦及反复流产对孕妇的心身伤害。
目前PGD已广泛运用于单基因遗传性疾病和染色体异常性疾病。
近20多年来, 随着辅助生殖技术和胚胎检测技术的飞跃发展, PGD已应用于近200种单基因遗传性病, 包括一些特殊单基因遗传性疾病的人类白细胞抗原配型, 遗传性癌症和线粒体疾病等。
遗传性耳聋绝大部分为单基因变异, 具有PGD适应症。
随着新一代测序技术广泛应用, 胚胎诊断技术准确性及效率均有很大提高。
本文通过文献复习, 综述PGD的新进展以及其在遗传性耳聋疾病的应用。
关键词:胚胎移植,遗传学应用,遗传性耳聋,应用1PGD应用范畴1.1单基因遗传性疾病单基因遗传性疾病即孟德尔遗传病, 是按照孟德尔方式传递的疾病, 一般由一对等位基因控制单个基因突变引起, 涉及单个核苷酸改变到整个基因改变。
单基因遗传性疾病致病单基因及致病突变点的确定, 是PGD的基础。
根据欧洲人类生殖和胚胎学协会(the European Society of Human Reproduction and Embryology, ESHRE) -PGD 协作组2014年[2]发表的运用于PGD的单基因遗传性疾病谱:目前有近200种单基因遗传性疾病已采用PGD的方法来避免垂直传递, 其中-地中海贫血(beta-thalassemia) 、囊性纤维化(cystic fibrosis) 、舞蹈病(Huntingtondis-ease) 、强直性肌营养不良症(myotonic dystrophy) 、脆性X染色体综合征(fragile X syndrome) 在临床周期中排前5名;有耳聋表型的疾病中包括常染色体显性遗传的综合征(Waardenburg syndrome, Neurofibromatosis type 2, Treacher Collins syndrome, Branchio-oto-renal syn-drome) , 常染色体隐性遗传的综合征(Usher syndrome) 以及非综合征遗传性耳聋(具体基因型不详) 。
Usher综合征致病基因的鉴定研究及Usher综合征流行病学文献meta分析摘要:Usher综合征是一种罕见的遗传性听力障碍伴随视网膜病变的疾病,目前已发现至少16种致病基因。
本文旨在系统性地筛选和鉴定Usher综合征致病基因,并对Usher综合征的流行病学进行meta分析。
通过对其流行病学特征、表现形式、临床诊断和治疗进行分析,有助于提高诊断和治疗水平,为遗传性听力障碍伴随视网膜病变的研究提供参考。
关键词:Usher综合征;致病基因鉴定;流行病学;meta分析;遗传性听力障碍1. 概述Usher综合征是一种罕见的遗传性听力障碍伴随视网膜病变的疾病,属于感觉性神经性耳聋和網膜色素变性的遗传性疾病之一。
其特点是在儿童时期发生症状,而后导致进行性视力下降和聋哑。
目前已发现至少16种致病基因,包括USH1A、USH1B、USH1C、USH1D、USH1F、USH2A、USH2B、USH2C、USH3A、CDH23、CLRN1、DFNB31、PCDH15、SANS、CIB2和 ADGRV1。
其中,USH1和USH2是最常见的类型,而USH3较少见。
2. 致病基因鉴定研究本文对Usher综合征的致病基因进行了系统的筛选和鉴定研究。
首先通过查阅多个数据库和文献,收集了有关Usher综合征的已知致病基因。
然后针对这些基因进行进一步分析和鉴定,以确定其在疾病发生和发展中的具体作用。
最后结合临床表现和家系调查等多方面信息,进行基因诊断和遗传咨询。
3. 流行病学meta分析在对Usher综合征的流行病学进行meta分析时,本文主要从以下几个方面进行了分析:首先,对其全球分布情况进行统计,并比较各地区的发病率。
其次,对其发病的年龄分布、性别比例、家族史等方面进行统计和分析。
最后,对临床表现、诊断和治疗进行总结,并提出相关建议,以提高Usher综合征的防治水平。
4. 结论通过对Usher综合征致病基因的鉴定研究和其流行病学的meta分析,可以更深入地了解Usher综合征疾病的本质,有助于提高其诊断和治疗水平,并为未来的研究提供参考。
Usher综合征的分子遗传学及治疗梁小芳;睢瑞芳;董方田【期刊名称】《协和医学杂志》【年(卷),期】2013(004)004【总页数】5页(P446-450)【关键词】Usher综合征;视网膜色素变性;耳聋【作者】梁小芳;睢瑞芳;董方田【作者单位】中国医学科学院北京协和医学院北京协和医院眼科,北京100730;中国医学科学院北京协和医学院北京协和医院眼科,北京100730;中国医学科学院北京协和医学院北京协和医院眼科,北京100730【正文语种】中文【中图分类】R774.1+3Usher综合征又称遗传性视网膜色素变性- 感音神经性耳聋综合征,主要表现为不同程度的视网膜色素变性(retinitis pigmentosa, RP)和感音神经性耳聋(sensorineural hearing loss, SNHL),伴或不伴前庭功能障碍。
RP以夜盲为首发症状,视野向心性缩小进展为管状视,最终中心视力受损。
该综合征在1858年由德国眼科学家Von Graefe[1]首先报道,1914年英国眼科学家Usher[2]首次提出该病与遗传因素有关。
根据临床表现、发病时间和病变程度,该病可以分为3型:Ⅰ型为先天性双侧重度SNHL,前庭反应消失,青少年时期出现RP;Ⅱ型为中重度SNHL,前庭反应正常,RP发生较晚;Ⅲ型为进行性SNHL,前庭反应不确定,RP发生时间不确定。
其中Ⅰ型最为严重,Ⅱ型最为常见,约占70%。
Usher综合征大多数为常染色体隐性遗传,极少数为常染色体显性遗传和X连锁隐性遗传,患病率为1/23 000[3]。
Usher综合征是致盲和致聋的主要疾病:在同时患有盲和聋的患者中,50%以上为Usher综合征;在所有RP患者中,约18%为Usher综合征;在所有先天聋的患者中,约5%为Usher综合征[4]。
随着分子生物学技术的发展,关于Usher综合征的分子遗传学研究愈加深入,目前已经鉴定出13个致病位点和10个致病基因,本文对该病的遗传学研究现状及治疗进行综述。
A Thesis Submitted in Partial Fulfillment of the Requirementsfor the Degree of Master of ScienceIdentification of the Genetic basis for a Chinese Families associated with Usher SyndromeCandidate : Li WeiRongMajor : GeneticsSupervisor : Prof. Liu MuGenHuazhong University of Science & TechnologyWuhan 430074, P.R.ChinaJanary,2013独创性声明本人声明所呈交的学位论文是我个人在导师指导下进行的研究工作及取得的研究成果。
尽我所知,除文中已经标明引用的内容外,本论文不包含任何其他个人或集体已经发表或撰写过的研究成果。
对本文的研究做出贡献的个人和集体,均已在文中以明确方式标明。
本人完全意识到本声明的法律结果由本人承担。
学位论文作者签名:日期:年月日学位论文版权使用授权书本学位论文作者完全了解学校有关保留、使用学位论文的规定,即:学校有权保留并向国家有关部门或机构送交论文的复印件和电子版,允许论文被查阅和借阅。
本人授权华中科技大学可以将本学位论文的全部或部分内容编入有关数据库进行检索,可以采用影印、缩印或扫描等复制手段保存和汇编本学位论文。
保密□,在年解密后适用本授权书。
本论文属于不保密□。
(请在以上方框内打“√”)学位论文作者签名:指导教师签名:日期:年月日日期:年月日华中科技大学硕士学位论文摘要Usher综合征(Usher syndrome, USH),又称为感音神经性耳聋-视网膜色素变性综合征,其主要表现为不同程度的感音神经性耳聋和视网膜色素变性(retinitis pigmentosa, RP),间或有前庭功能障碍出现。
基因检测案例6|Usher综合征
疾病简介
Usher 综合征是一种以耳聋和进展性视力丧失为特征的常染色体隐性遗传病,是最常见的引起耳聋伴眼盲的疾病,人群患病率是1/5000~1/16000。
Usher 综合征分为3型:Usher 综合征Ⅰ型、Ⅱ型和Ⅲ型。
USH Ⅰ型在幼年时即出现近乎全聋和前庭功能障碍,通常在成年前出现RP症状;Ⅱ型患者听力损害呈中到重度,没有前庭功能障碍,成年后出现RP
症状;Ⅲ型患者出生时听力正常,逐渐出现RP和听力丧失。
USH2A基因简介及遗传方式
USH2A基因位于染色体的1q41,具有长短两个剪切转录本,一种是由21个外显子编码的Usherin蛋白亚型a,共有1546个氨基酸,另一种是在USH2A基因3’发现的51个外显子,即共含有72个外显子编码的Usherin蛋白亚型b,编码5202个氨基酸。
USH2A基因编码Usherin蛋白,主要在耳蜗和视网膜中表达。
USH2A基因突变常引起Usher综合征或非综合征型视网膜色素变性,以常染色体隐性的方式遗传。
USH2A基因变异类型
HGMD数据库中收录的USH2A基因变异有1300余种,90%以上为点突变或小片段缺失/插入,10%为大片段插入缺失,USH2A基因被认为是引起USH2型最常见的致病基因,大约70%USH2型患者是由USH2A基因突变引起的。
目前,已知的大部分突变位于USH2A基因的1-21外显子,即Usherin蛋白亚型a。
USH2A基因突变引起的疾病表型
除了引起Usher综合征以外,USH2A基因突变还能引起视网膜色素变性等疾病,以下表格是HGMD数据库中收录的相关文章报道的疾病表型。
案例分享
临床症状
先证者,女,32岁,临床诊断为Usher综合征,先证者亲属无相关症状,为散发病例。
检测项目
眼科遗传病基因检测(441个基因)。
检测方法
从受检者外周血中提取基因组DNA,构建基因组文库,通过探针杂交捕获相关的目的基因外显子及相邻内含子部分区域,进行富集。
富集的目的基因片段通过高通量测序平台测序,对明确的致病性变异,采用Sanger测序进行验证。
检测结果
检出一个与受检者临床表型匹配的致病性基因变异。
备注:按照美国医学遗传学与基因组学学会(ACMG)制定的遗传变异分类标准,变异分为以下5种类型,Pathogenic表示致病的变异;Likely pathogenic 表示可能致病的变异;Benign 表示良性的变异;Likely benign 表示可能良性的变异;Uncertain significance 表示意义不明确的变异。
AD 表示常染色体显性遗传;AR 表示常染色体隐性遗传;X-linked 表示X连锁遗传。
遗传解析
H2A (OMIM 608400)基因突变常引起Usher综合征或视网膜色素变性,以常染色体隐性的方式遗传。
2.被检先证者携带以下杂合突变:
(1).USH2A c.1000C>T; p.Arg334Trp,此突变已被HGMD数据库收录,已有文献报道【见参考文献1-2】为致病突变;
(2).USH2A c.1876C>T; p.Arg626* ,此突变已被HGMD数据库收录,已有文献报道【见参考文献3-4】为致病突变。
3. 受检者基因诊断与临床表型相符,为致病变异。
遗传咨询建议
(1) 受检父亲未进行该变异位点的验证。
建议家系遗传咨询。
(2) 受检者及家系内其他患者将来生育,与携带USH2A基因变异的配偶与不携带USH2A基因变异的配偶进行婚配,后代携带该基因的情况不一致,建议进行遗传咨询。
金标准验证
参考文献
1.Adato (2000) Hum Mutat 15, 388
2.Bravo-Gil (2016) Sci Rep 6: 23910 [Additional phenotype]
3.Weston (2000) Am J Hum Genet 66, 1199
4.Xiong (2015) Science 347: 1254806 [Additional report]
5.Fernández-Martínez (2011) Eur J Hum Genet 19, 445。