芬顿法处理工艺及其影响因素
- 格式:docx
- 大小:1.84 MB
- 文档页数:3

芬顿法处理工艺及其影响因素1 处理工艺1。
1 芬顿氧化法概述芬顿法的实质是二价铁离子(Fe2+)、和双氧水之间的链反应催化生成羟基自由基,具有较强的氧化能力,其氧化电位仅次于氟,高达2。
80V。
无机化学反应过程是,过氧化氢(H2O2)与二价铁离子(Fe2+)的混合溶液将很多已知的有机化合物如羧酸、醇、酯类氧化为无机态。
另外, 羟基自由基具有很高的电负性或亲电性,其电子亲和能高达 569。
3kJ具有很强的加成反应特性,因而 Fenton反应具有去除难降解有机污染物的高能力,在印染废水、含油废水、含酚废水、焦化废水、含硝基苯废水、二苯胺废水等废水处理中体现了很广泛的应用。
1.2氧化机理芬顿氧化法是在酸性条件下,H2O2在Fe2+存在下生成强氧化能力的羟基自由基(·OH),并引发更多的其他活性氧,以实现对有机物的降解,其氧化过程为链式反应。
其中以·OH产生为链的开始,而其他活性氧和反应中间体构成了链的节点,各活性氧被消耗,反应链终止。
其反应机理较为复杂,这些活性氧仅供有机分子并使其矿化为CO2和H2O等无机物。
从而使Fenton氧化法成为重要的高级氧化技术之一。
当芬顿发现芬顿试剂时,尚不清楚过氧化氢与二价铁离子反应到底生成了什么氧化剂具有如此强的氧化能力。
二十多年后,有人假设可能反应中产生了羟基自由基,否则,氧化性不会有如此强。
因此,以后人们采用了一个较广泛引用的化学反应方程式来描述芬顿试剂中发生的化学反应: Fe2++H2O2→Fe3++OH—+ OH•①从上式可以看出,1mol的H2O2与1mol的Fe2+反应后生成1mol的Fe3+,同时伴随生成1mol的OH-外加1mol的羟基自由基。
正是羟基自由基的存在,使得芬顿试剂具有强的氧化能力。
据计算在pH = 4 的溶液中,•OH自由基的氧化电势高达2.73 V。
在自然界中,氧化能力在溶液中仅次于氟气.因此,持久性有机物,特别是通常的试剂难以氧化的芳香类化合物及一些杂环类化合物,在芬顿试剂面前全部被无选择氧化降解掉。

芬顿工艺的影响因素及其在难降解工业废水处理中的应用张一鸣【摘要】芬顿试剂能够在短时间内将工业废水中的难降解有机物氧化分解,具有氧化率高、无选择性以及无二次污染的特点.本文重点分析了影响芬顿工艺处理效率的主要因素,综述了芬顿工艺难降解工业废水处理中的应用.本文对芬顿工艺应用于难降解工业废水的处理与实践具有一定的借鉴意义.【期刊名称】《资源节约与环保》【年(卷),期】2015(000)011【总页数】2页(P39-40)【关键词】芬顿工艺;影响因素;工业废水【作者】张一鸣【作者单位】同济大学环境科学与工程学院上海200092【正文语种】中文目前工业废水处理的主流及热点技术包括厌氧生物处理技术、膜处理技术、高级氧化技术、脱氮除磷技术、生态处理技术等。
基于技术经济成本,高级氧化过程与传统工艺结合是目前技术应用方向。
芬顿工艺具有基建投资低、运行费用低、操作工艺简单等优点,近年来在难降解工业废水处理中得到了广泛应用。
与其他传统的水处理方法相比,Fenton氧化法具有以下特点[1]:(1)反应速率高,在Fe2+离子的作用下,H2O2能够迅速分解产生·OH,·OH具有极强的得电子能力也就是氧化能力,氧化电位2.8V,其氧化能力仅次于氟;(2)·OH可以直接与废水中的污染物反应将其降解为二氧化碳、水和无害物;(3)由于羟基自由基的氧化能力很强,所以反应速度快,可以在较短的反应时间内达到处理要求;(4)芬顿反应可以作为单独处理工艺,又可与其他处理工艺相结合,提供处理效率且能够降低处理成本。
1 芬顿反应影响因素1.1 温度温度是芬顿反应的重要影响因素之一。
一般化学反应随着温度的升高会加快反应速度,芬顿反应也不例外,温度升高会加快·OH的生成速度,有助于·OH与有机物反应,提高氧化效果和CODCr的去除率;但是,温度升高也会加速H2O2的分解,分解为O2和H2O,不利于·OH的生成。

收藏!芬顿工艺11种异常情况的原因及处理方法!一、芬顿反应的原理过氧化氢(H2O2) 与二价铁离子Fe的混合溶液把大分子氧化成小分子把小分子氧化成二氧化碳和水,同时FeSO4可以被氧化成3价铁离子,有一定的絮凝的作用,3价铁离子变成氢氧化铁,有一定的网捕作用,从而达到处理水的目的。
其化学反应机制如下:H2O2+Fe2+→OH·+OH-+Fe3+→Fe(OH)3↓二、Fenton试剂法的优缺点1、Fenton法的优点①对环境友善:处理后不像其它的化学药品,如漂白水(次氯酸钠),易产生氯化有机物等毒性物质,对环境造成伤害。
②占地空间小:有机物氧化的速度相当快,所需的停留时间短,约0.5~2小时即可,不像一般的生物处理约需12~24小时,因时间短,相对反应槽容积不需太大,可节省空间。
③操作弹性大:可依进流水水质的好坏来改变操作条件,提高处理量。
而一般的生物处理难以弹性操作。
针对较高的污染量只需提高亚铁及H2O2加药量及适当的pH控制即可。
④初设成本低:与一般的生物处理系统相较,约只须其投资成本1/3~1/4。
⑤氧化能力强:所产生的氢氧自由基(OH)氧化能力相当强。
可处理多种毒性物质,如氯乙烯、BTEX、氯苯、1,4Dioxane,酚、多氯联苯、TCE、DCE、PCE等,另EDTA和酮类MTBE、MEK等亦有效。
2、传统Fenton法缺点①瓶颈1:Fe2+为催化剂,使H2O2产生成OH及OH-,但同时也伴随着大量污泥,Fe(OH)3的产生成为应用中的一大缺点。
②瓶颈2:COD达一定的去除率后,无法再继续去除有机物,易造成H2O2用药的消耗。
三、 Fenton系统工艺流程简述在二沉池出水井用Fenton供料泵送至Fenton氧化塔,将废水中难以降解的污染物氧化降解,Fenton氧化塔出水自流至中和池,在中和池投加液碱,将废水中和至中性;中和池废水自流至脱气池中,通过鼓风搅拌,将废水中的少量气泡脱除;脱气池出水自流至混凝反应池中,在该池中投加絮凝剂PAM并进行充分反应,使废水中铁泥絮凝;混凝反应后的废水自流至终沉池,将其中的铁泥沉淀,上清液达标排放。
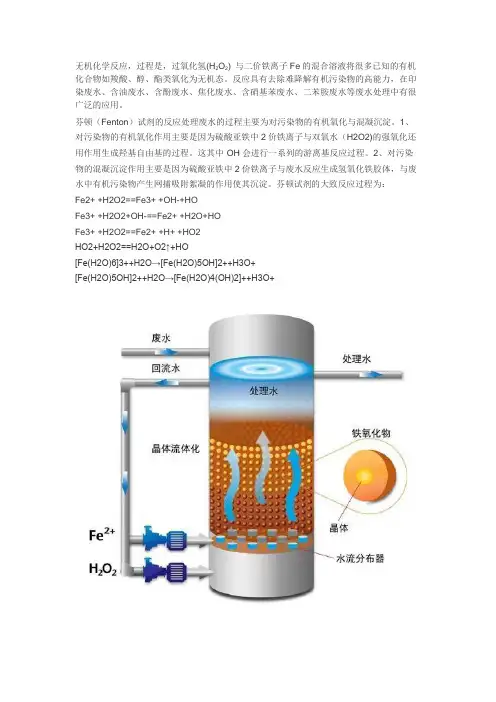
无机化学反应,过程是,过氧化氢(H2O2) 与二价铁离子Fe的混合溶液将很多已知的有机化合物如羧酸、醇、酯类氧化为无机态。
反应具有去除难降解有机污染物的高能力,在印染废水、含油废水、含酚废水、焦化废水、含硝基苯废水、二苯胺废水等废水处理中有很广泛的应用。
芬顿(Fenton)试剂的反应处理废水的过程主要为对污染物的有机氧化与混凝沉淀。
1、对污染物的有机氧化作用主要是因为硫酸亚铁中2价铁离子与双氧水(H2O2)的强氧化还用作用生成羟基自由基的过程。
这其中·OH会进行一系列的游离基反应过程。
2、对污染物的混凝沉淀作用主要是因为硫酸亚铁中2价铁离子与废水反应生成氢氧化铁胶体,与废水中有机污染物产生网捕吸附絮凝的作用使其沉淀。
芬顿试剂的大致反应过程为:Fe2+ +H2O2==Fe3+ +OH-+HO·Fe3+ +H2O2+OH-==Fe2+ +H2O+HO·Fe3+ +H2O2==Fe2+ +H+ +HO2HO2+H2O2==H2O+O2↑+HO[Fe(H2O)6]3++H2O→[Fe(H2O)5OH]2++H3O+[Fe(H2O)5OH]2++H2O→[Fe(H2O)4(OH)2]++H3O+一、芬顿氧化工艺简介芬顿(Fenton)试剂是一种化学催化氧化反应,因其具有很强的氧化能力且对反应条件要求较低、产物无二次污染常被用作一些含高浓度、难降解有机物废水的处理工艺,业界也称之为芬顿氧化法。
芬顿试剂的原理是二价铁离子(Fe2+)和过氧化氢(H2O2)的链反应生成烃基自由基(OH),OH自由基的氧化电位为2.8V,仅次于氟,具有超强的氧化能力,同时还具有很高的电负性或亲电性,其电子亲和力约为570KJ具有很强的加成反应特性,所以芬顿试剂可以毫无选择性的对绝大多数的有机物进行氧化分解反应,尤其是一些含有生物难降解或一般化学氧化难以分解的有机物废水的处理,芬顿试剂可以有效的氧化分解此类有机物,提高废水的可生化性,同时还具有非常明显的脱色除味效果。

芬顿工艺的影响因素及应用!一般情况下水处理需要经过厌氧、好氧以及絮凝三个环节。
多年来,我国的污水处理都是使用传统的工艺进行。
近年来,随着国家污水排放标准的提高,对废水处理的要求和力度逐渐提高,于是很多企业就会采用深度处理的工艺对废水进行处理,如臭氧处理、膜处理等,目前市场上最为认可的是利用芬顿工艺进行废水处理。
本文就芬顿工艺在工业废水处理中的应用进行分析和研究。
利用芬顿工艺对工业废水进行处理,能够在极短的时间内将工业废水中的有机物进行氧化分解,氧化率比较高,不会出现二次污染。
并且这种工艺的基建投资比较少,运用过程中不需要花费大量的费用,操作工艺比较简单。
芬顿工艺在近年来的工业废水处理中被广泛的应用,取得了良好的效果。
一、影响芬顿反应的因素1、温度因素在芬顿反应中,温度是影响其效果的重要因素,温度不断升高,芬顿反应的速度会逐渐加快,随着温度的提高,OH的生成速度会提高,能够促进OH与有机物发生反应,使氧化效果得到提升,提高CODCr 的去除率。
温度的升高也会使H2O2的分解速度加快,分解成O2与H2O,这对于OH的生成是不利的[1]。
不同类型的工业废水中,芬顿反应的最合适温度也是不同的,2、pH值通常情况下,在酸性环境下,芬顿试剂才会发生反应,pH的提高会使OH得出现受到限制,并且会出现氢氧化铁沉淀,催化能力丧失。
如果溶液中有浓度较高的H+,Fe3+不能被还原为Fe2+,催化反应就会受到阻碍[2]。
有研究结果表明在酸性环境下,尤其是pH在3-5之间时,芬顿试剂有很强的氧化能力,这时有机物的降解速度比较快,能够在几分钟内降解。
同时有机物的反应速率与Fe2+以及过氧化氢的初始浓度成正比例关系。
在工业处理中使用芬顿工艺,需要将废水的pH调到3.5左右为最佳。
3、有机物对于不同类型的工业废水,芬顿试剂的使用量以及氧化效果是存在差异的,主要是由于不同类型的工业废水中,存在着不同类型的有机物。
对于糖类等碳水化合物,由于受到羟基自由基的作用,分子会出现脱氢反应,C-C键断链;对于具有水溶性的高分子和乙烯化合物,羟基自由基会使C=C键断裂。

芬顿法(Fenton)处理难降解污水原理及案例分析芬顿的实质是二价铁离子和双氧水之间的链反应催化生成羟基自由基。
羟基自由基具有较强的氧化能力,其氧化电位仅次于氟,高达2.80V。
另外, 羟基自由基具有很高的电负性或亲电性,其电子亲和能高达569.3kJ,具有很强的加成反应特性,因而Fenton试剂可无选择氧化水中的大多数有机物,特别适用于生物难降解或一般化学氧化难以凑效的有机废水的氧化处理。
一、氧化机理由于在催化剂的存在下,能高效率地分解生成具有强氧化能力和高电负性或亲电子性(电子亲和能力569.3KJ的羟基自由基,可以氧化降解水体中的有机污染物,使其最终矿化为,及无机盐类等小分子物质。
据计算在pH=3的溶液中,的氧化电位高达2.73 V,其氧化能力在溶液中仅次于氢氟酸。
因此,芬顿试剂对绝大部分的有机物都可以氧化降解。
Fenton试剂具有很强的氧化性,而且其氧化性没有选择性,能适应各种废水的处理。
二、Fenton工艺具有如下特点:2.1 氧化能力强羟基自由基的氧化还原电位为2.8V,仅次于氟(2.87V),这意味着其氧化能力远远超过普通的化学氧化剂,能够氧化绝大多数有机物,而且可以引发后面的链反应,使反应能够顺利进行。
2.2 氧化速率快过氧化氢分解成羟基自由基的速度很快,氧化速率也较高。
羟基自由基与不同有机物的反应速率常数相差很小,反应异常迅速。
另一方面也表明羟基自由基对有机物氧化的选择性很小,一般的有机物都可氧化。
2.3 适用范围广羟基自由基具有很高的电负性或亲电性。
很容易进攻高电子云密度点,这决定了Fenton试剂在处理含硝基、磺酸基、氯基等电子密度高的有机物的氧化方面具有独特优势。
而这些物质的B/C的值小,生物化学方法很难将其降解,一般化学氧化法也难以凑效。
因此Fenton试剂弥补了这个方面的不足,具有很大的潜力。
对废水中干扰物质的承受能力较强,既可以单独使用,也可以与其他工艺联合使用,以降低成本,提高处理效果。


影响芬顿工艺的因素
1.溶液的性质:溶液的性质对芬顿工艺的效果有直接影响。
首先,溶
液的酸碱度(pH值)是一个重要的因素。
pH值的选择会影响铁离子和氢
氧自由基生成的速率,进而影响氧化反应的进行。
通常情况下,酸性条件
下芬顿工艺更容易进行。
其次,溶液中有机物的种类和浓度也会对芬顿工
艺产生影响。
有机物的种类不同,其降解速率也会有所差异。
此外,有机
物的浓度越高,可能会抑制氢氧自由基的生成,从而影响反应的速率。
2.反应条件:反应条件的选择对芬顿工艺的效果同样至关重要。
首先,温度是一个重要的因素。
温度的升高可以增加反应速率,但过高的温度可
能会导致铁离子和氢氧自由基的失活。
其次,反应时间的选择也是需要考
虑的因素。
反应时间过短可能无法完全降解污染物,反应时间过长则会浪
费资源和能源。
此外,反应物的浓度和比例也会影响反应的进行,需要根
据具体情况进行调控。
3.催化剂:芬顿工艺通常需要添加催化剂以增加氧化反应的速率。
常
用的催化剂包括氢过氧化物、过氧化氢和过硫酸盐等。
催化剂的种类和浓
度选择会直接影响反应速率和效果。
总之,影响芬顿工艺的因素包括溶液的性质、反应条件和催化剂。
正
确选择这些因素可以有效提高芬顿工艺的降解效果,从而实现对有机污染
物的高效处理。

芬顿高级氧化工艺缺点及问题详解水处理工艺最少要3个环节,如厌氧-好氧-絮凝。
多年以为我国的污水处理采用传统工艺进行污水处理,随着近年来国家逐渐提高污水排放标准,处理力度越来越大。
传统工艺只要药剂质量不好就难以稳定达标。
在这个时候,许多企业就会采用深度处理工艺进行废水处理以适应新的废水排放标准,比如臭氧处理,芬顿处理(硫酸亚铁+双氧水),膜处理,电吸咐等等。
目前应用最为广泛,市场最为认可的便是芬顿法(硫酸亚铁+双氧水)处理废水。
芬顿处理缺点与问题采用芬顿深度处理工艺的特点是需要有条件,要求前面处理效果比较好,污染物溶度比较低等。
芬顿法处理的主要药剂是硫酸亚铁,双氧水,酸,碱(方法是反应后回调PH值)。
芬顿存在不少问题,主要如下:1.芬顿处理劳动强度大。
双氧水操作难度大,硫酸亚铁投加必须是固体,且硫酸亚铁含铁20%左右,相对于聚铁的11%含铁,大大增加了污泥处理强度。
2.芬顿处理的成本高,污泥多。
如双氧水的药剂成本高也是一方面,并且现在大多数企业所计算的成本往往还不包括污泥增加(硫酸亚铁的投加带来的大量污泥),设备折旧,维修费用等.3.芬顿处理容易返色。
(如双氧水与硫酸亚铁的投加量与投加比例控制不好,或三价铁不沉淀容易导致废水呈现出微黄色或黄褐色。
)4.比较难控制。
因为双氧水与硫酸亚铁的最佳比例需要进行正交实验才可以得出,并且受到反应PH值、反映时间长短、搅拌混合程度的影响,所以比例很难控制。
5.芬顿处理腐蚀性大,连水泥池都被腐蚀掉。
双氧水强氧化性,其氧化性仅次于氟气(F2),如果防护不好对人体都有一定程度的腐蚀,硫酸亚铁也具有一定的腐蚀性。
6.芬顿的处理效果也不是像文献说的那么好。
部份文献说可以把COD处理到0mg/L,实际上通过众多客户的验证很难以处理到50mg/L,根本达不到新的排放标准。

芬顿
一、反应机理
H2O2 +Fe 2+→Fe 3+ + HO - + HO·(1)
RH+HO·→R·+H2O (2)
R·+Fe3+→Fe2+ + 产物(3)
H2O 2 + HO·→HO2·+H2O (4)
Fe2+ + HO·→Fe3+ + HO - (5)
Fe 3+ +H2O2→Fe 2+ +H + + HO2·(6)
Fe 3+ + HO2·→Fe2+ +H+ + O2 (7)
三、实验影响因素
芬顿试剂的影响因素有:pH值、H2O2投加量、Fe2+投加量、反应时间和反应温度。
(1)H2O2投加量:H2O2的浓度较低时,H2O2的浓度增加导致羟基量的增加;H2O2的浓度过高时,过量的H2O2不但不能通过分解产生更多的自由基,反而在反应的一开始就把Fe2+迅速氧化成Fe3+,使氧化在Fe3+的催化下进行,这样就既消耗了H2O2又抑制羟基的产生。
(2)Fe2+投加量:Fe2+浓度过低,反应速度极慢;Fe2+过量,它还原H2O2且自身氧化为Fe3+,消耗药剂的同时增加出水色度。
(3)pH值:芬顿试剂是在酸性条件下发生作用的,在中性和碱性的环境中Fe2+不能催化氧化H2O2产生OH-,pH值在3~4附近时去除率最大。
(4)反应时间,反应温度:根据反应动力学原理,随着温度的增加,反应速度加快。
但是对于芬顿试剂这样复杂的反应体系,温度升高,不仅加速正反应的进行,也加速副反应。
因此,温度对于芬顿试剂处理废水的影响复杂,适当的温度可以激活羟基自由基,温度过高会使双氧水分解成水和氧气。

芬顿反应
一、芬顿反应的原理
1.1反应原理
过氧化氢(H2O)与二价铁离子Fe的混合溶液把大分子氧化成小
分子把小分子氧化成二氧化碳和水,同时FeSO可以被氧化成3价铁离子,有一定的絮凝的作用,3价铁离子变成氢氧化铁,有一定的网捕作用,从而达到处理水的目的。
二、F enton试剂法的优点
Fenton试剂是一种常用的高级氧化技术,相对其他氧化剂而言,其在黑暗中就能破坏有机物,具有操作过程简单、反应易得、运行成本低廉、设备投资少且对环境友好性等优点。
三、芬顿反应在污水处理的应用。
芬顿法处理难降解污水原理及案例分析芬顿法是一种利用光照和过氧化氢来降解有机污染物的方法。
其原理是通过光照催化过氧化氢产生自由基,进而与有机污染物发生氧化反应,将其降解为无害的物质。
在芬顿法处理难降解污水时,首先将待处理的污水与过氧化氢混合,并在一定条件下加入光源。
当光飞自由基在光照下与溶液中的有机污染物接触时,会发生氧化反应,将有机污染物分解为较简单的无机物。
此外,过氧化氢也会经过自我分解,生成氢氧自由基,进一步加速有机物的氧化反应。
1.染料废水处理:染料废水中含有大量的有机色素,传统的处理方法往往无法有效去除色素物质。
利用芬顿法处理染料废水,可以将有机色素分解为无色无臭的物质,达到有效净化水体的效果。
2.印染厂废水处理:印染厂废水中含有大量的有机物、酸性物质和重金属离子等难降解物质。
芬顿法可以将有机物降解为无害物质,同时也可以将酸性物质中和,还可以将重金属离子沉淀,达到对印染厂废水的全面处理。
3.石油化工废水处理:石油化工废水中通常含有大量的有机物、酚类、苯类化合物等难降解物质。
芬顿法可以有效将这些有机物分解为CO2和H2O等无害物质,从而达到处理石油化工废水的目的。
4.农药废水处理:农药废水中含有大量的农药残留和有机物,芬顿法可以将这些有机物和农药分解为无害物质,达到净化农药废水的目的。
芬顿法还可以对农药废水中的重金属离子进行去除,实现对农药废水的全面处理。
总的来说,芬顿法通过光照和过氧化氢的协同作用,能够有效地降解难降解的有机污染物。
通过对不同类型污水的案例分析,可以看出芬顿法在各种难降解污水的处理中具有广泛应用的前景。
但是需要注意的是,芬顿法在处理过程中需要控制条件,确保反应的顺利进行,避免产生二次污染。
同时,对于不同类型的污水,芬顿法的处理效果可能存在差异,因此在实际应用中需要根据具体情况进行优化和改进。
高级芬顿反应处理染料废水的影响因素及工艺条件优化
高级芬顿反应处理染料废水的影响因素及工艺条件优化
通过实验分析高级芬顿体系处理染料废水的影响因素,并获得优化的工艺条件.结果表明各种因素对评价指标的影响顺序不同,但过氧化氢的影响始终是最大的.对COD去除的优化工艺为:H2O2浓度为300 mg/L,Fe2+浓度20 mg/L,H2C2O4浓度为15 mg/L,pH为3.0,时间为40 min.对TOC去除的优化工艺为:H2O2浓度为300 mg/L,Fe2+浓度20 mg/L,H2C2O4浓度为20 mg/L,pH为3.0,时间为60 min.在优化的工艺条件下能有效的降解3种染料,降解速率顺序为GR>X3-B>KN-R.处理后的废水COD去除率可达到80%,TOC去除率达到70%.
作者:丁巍董晓丽张秀芳张新欣陈頔 DING Wei DONG Xiao-li ZHANG Xiu-fang ZHANG Xin-xin CHEN Di 作者单位:大连轻工业学院,化工与材料学院,辽宁,大连,116034 刊名:大连轻工业学院学报 ISTIC PKU 英文刊名: JOURNAL OF DALIAN INSTITUTE OF LIGHT INDUSTRY 年,卷(期): 2005 24(3) 分类号: X788 关键词:高级芬顿体系染料废水处理化学需氧量(COD) 总有机碳(TOC)。
芬顿法处理工艺及其影响因素芬顿法是一种常用的废水处理工艺,用于降解和去除有机物质。
它主要基于氢氧自由基的产生和作用机理,通过光照、电解、臭氧、紫外光等途径产生氢氧自由基,进而使有机物质被氧化降解。
芬顿法处理工艺及其影响因素如下:1.反应条件:芬顿法处理废水需要一定的反应条件。
其中,温度、pH 值和反应时间是影响芬顿法反应效果的重要因素。
较高的温度有利于催化剂的活性,通常35-45°C的温度范围是较为适宜的。
pH值影响着芬顿法反应的产物性质和反应速率,通常在2.0-4.0的范围内反应效果较好。
反应时间一般需要几十分钟到几小时,具体取决于废水中有机物的浓度和种类。
2.催化剂:芬顿法需要添加适量的铁盐作为催化剂。
通常使用的铁盐有FeSO4、FeCl2等。
催化剂的添加量需要根据废水中有机物的浓度和种类来确定,一般为1-5g/L。
过量的催化剂含量可能会导致催化剂损失,造成经济浪费。
3.氧化剂:为了增强芬顿法的氧化效果,常常需要添加氧化剂。
常用的氧化剂有H2O2、臭氧等。
氧化剂的添加量需要根据废水中有机物的浓度和种类来确定,一般为1-10mL/L。
适当的氧化剂添加可以提高芬顿法的降解效果,但添加过多可能会损失催化剂,增加处理成本。
4.光照条件:光照是芬顿法的一种辅助条件,可以通过光照来产生氢氧自由基,加速有机物的降解。
光照条件的选择需要考虑废水中有机物的特性和光源的强弱,通常需要选择适当的光源和较长的光照时间来达到理想的反应效果。
5.有机物特性:废水中的有机物特性对芬顿法的处理效果有较大影响。
不同种类的有机物在芬顿法中的降解速率可能不同,对应的添加剂和条件也会有所区别。
此外,废水中的悬浮颗粒、溶解氧和其他复杂组分也会对芬顿法的处理效果产生一定影响。
总之,芬顿法是一种有效的废水处理工艺,可以对有机物进行降解和去除。
在实际应用中,需要考虑反应条件、催化剂、氧化剂、光照条件和废水中的有机物特性等因素,以达到最佳的处理效果。
芬顿法和类芬顿法对水中污染物的去除研究芬顿法和类芬顿法对水中污染物的去除研究一、引言随着人类工业和农业活动的不断发展,水污染问题日益严重。
水中污染物对生态环境和人类健康造成了严重的威胁。
因此,研究高效、经济、环保的水污染物去除技术变得尤为重要。
芬顿法和类芬顿法作为常用的水处理技术,具有广泛的应用前景。
本文将介绍芬顿法和类芬顿法的原理、工艺优化、拓展应用以及存在的问题和挑战。
二、芬顿法原理芬顿法是一种通过氢氧化亚铁(Fe²⁺)和过氧化氢(H₂O₂)催化产生的羟基自由基(·OH)对水中的有机污染物进行氧化分解的方法。
芬顿反应的化学方程式为:Fe²⁺ + H₂O₂ → Fe³⁺ + ·OH + OH⁻产生的羟基自由基具有高度活性,能够迅速氧化分解有机污染物,将其转化为无害的物质。
芬顿法具有高效、低成本的优势,广泛应用于废水处理领域。
三、芬顿法工艺优化在实际应用中,芬顿法的工艺参数对去除效果具有重要影响。
常见的工艺优化方法包括催化剂选择、Fe²⁺和H₂O₂的比例、反应pH值、温度和反应时间等。
例如,选择合适的催化剂可以提高反应速率和去除效果。
增加Fe²⁺浓度或H₂O₂添加量可以增加羟基自由基的生成量,进而提高去除效果。
调节反应pH值可以影响反应速率和产生反应中间产物的种类。
温度和反应时间的增加可以加快反应速率,但需要平衡能耗和去除效果之间的关系。
四、类芬顿法的研究进展除了传统的芬顿法,近年来还出现了一些类芬顿法,如Fe²⁺/二氧化硫(SO₃²⁻)氧化体系、Fe²⁺/过硫酸盐等。
这些类芬顿法利用不同的氧化剂和催化剂组合,实现对水中污染物的高效去除。
例如,Fe²⁺/二氧化硫(SO₃²⁻)氧化体系在中性条件下具有较高的活性,适用于一些pH值较高的水体。
类芬顿法通过调节不同的反应条件,如氧化剂种类、催化剂浓度和反应pH值等,可以实现对不同类型污染物的去除。
Fenton处理效率的影响因素Fenton处理效率的影响因素编辑pH值因为Fe 在溶液中的存在形式受制于溶液的pH值,所以Fenton 试剂只在酸性条件下发生作用,在中性和碱性环境中,Fe不能催化H202产生·OH。
研究者普遍认为,当pH值在2~4范围内时,氧化废水处理效果较好,最佳效果出现在pH=3时。
Lin和Peng [10]在采用Fenton试剂处理纺织废水时发现,当pH值增加并超过3时,废水中的COD迅速升高,从而得到最优点pH=3。
在该条件下,COD的去除率达到80%。
Casero将Fenton 试剂运用于芳香胺废水处理时发现,O-联茴香胺转化成开环有机物的过程与起始pH值无关。
反应完全后,废水的pH值比起始pH值有所下降,原因可能是Fenton反应产物Fe水解使pH值下降。
同时,Fenton试剂在较宽的pH值范围都能降解有机物,这就避免了对废水的缓冲。
试剂配比在Fenton反应中,Fe起到催化剂的作用,是催化H202产生自由基的必要条件。
在无Fe条件下,H202难于分解产生自由基。
当Fe 浓度很低时,反应(1)速度很慢,自由基的产生量小,产生速度慢,整个过程受到限制。
当Fe浓度过高时,会将H202还原且被氧化成Fe,造成色度增加。
J.Yoon研究了不同[Fe]/[ H202 ] 比值对反应的影响。
在[ Fe]/[ H202] = 2 环境中,当有机物不存在时,Fe在几秒内消耗完。
有机物存在时,Fe的消耗大大受到限制。
但不管有机物存在与否,H202都在反应开始的几秒内被完全消耗。
这表明,在高[ Fe]/[ H202 ]比值条件下,消耗H202产生·OH自由基的过程在几秒内进行完毕。
在[ Fe2+ ]/[ H202 ] = 1环境中,当有机物不存在时,H202的消耗在反应刚开始时消耗迅速,随后消耗速度缓慢。
有机物存在时,H202的消耗在反应刚开始时非常迅速,随后完全停止。
芬顿法处理工艺及其影响
因素
This manuscript was revised on November 28, 2020
芬顿法处理工艺及其影响因素
1 处理工艺
芬顿氧化法概述
芬顿法的实质是二价铁离子(Fe2+)、和双氧水之间的链反应催化生成羟基自由基,具有较强的氧化能力,其氧化电位仅次于氟,高达。
无机化学反应过程是,过氧化氢
(H
2O
2
)与二价铁离子(Fe2+)的混合溶液将很多已知的有机化合物如羧酸、醇、酯类氧化为
无机态。
另外, 羟基自由基具有很高的电负性或亲电性,其电子亲和能高达具有很强的加成反应特性,因而 Fenton反应具有去除难降解有机污染物的高能力,在印染废水、含油废水、含酚废水、焦化废水、含硝基苯废水、二苯胺废水等废水处理中体现了很广泛的应用。
氧化机理
芬顿氧化法是在酸性条件下,H
2O
2
在Fe2+存在下生成强氧化能力的羟基自由基
(·OH),并引发更多的其他活性氧,以实现对有机物的降解,其氧化过程为链式反应。
其中以·OH产生为链的开始,而其他活性氧和反应中间体构成了链的节点,各活性氧被消耗,反应链终止。
其反应机理较为复杂,这些活性氧仅供有机分子并使其矿化为CO
2
和
H
2
O等无机物。
从而使Fenton氧化法成为重要的高级氧化技术之一。
当芬顿发现芬顿试剂时,尚不清楚过氧化氢与二价铁离子反应到底生成了什么氧化剂具有如此强的氧化能力。
二十多年后,有人假设可能反应中产生了羟基自由基,否则,氧化性不会有如此强。
因此,以后人们采用了一个较广泛引用的化学反应方程式来
描述芬顿试剂中发生的化学反应: Fe2++ H
2O
2
→Fe3++OH-+ OH ①从上式可以看出,
1mol的H
2O
2
与1mol的Fe2+反应后生成1mol的Fe3+,同时伴随生成1mol的OH-外加1mol
的羟基自由基。
正是羟基自由基的存在,使得芬顿试剂具有强的氧化能力。
据计算在pH = 4 的溶液中,OH自由基的氧化电势高达 V。
在自然界中,氧化能力在溶液中仅次于氟气。
因此,持久性有机物,特别是通常的试剂难以氧化的芳香类化合物及一些杂环类化合物,在芬顿试剂面前全部被无选择氧化降解掉。
1975 年,美国着名环境化学家
Walling C 系统研究了芬顿试剂中各类自由基的种类及Fe 在Fenton 试剂中扮演的角
色,得出如下化学反应方程: H
2O
2
+ Fe2+→ Fe3+ + O
2
+ 2H +② O
2
+ Fe2+→ Fe3+ + O
2
③可以看出,芬顿试剂中除了产生1mol的OH自由基外,还伴随着生成1mol的过氧自由基O
2
,但是过氧自由基的氧化电势只有 V左右,所以,在芬顿试剂中起主要氧化作用的是OH自由基。
Fenton系统工艺流程简述
在二沉池出水井用Fenton供料泵送至Fenton氧化塔,将废水中难以降解的污染物氧化降解,Fenton氧化塔出水自流至中和池,在中和池投加液碱,将废水中和至中性;中和池废水自流至脱气池中,通过鼓风搅拌,将废水中的少量气泡脱除;脱气池出水自流至混凝反应池中,在该池中投加絮凝剂PAM并进行充分反应,使废水中铁泥絮凝;混凝反应后的废水自流至终沉池,将其中的铁泥沉淀,上清液达标排放。
终沉池铁泥由污泥泵送至原污泥处理系统进行处理。
2 影响因素
温度
温度是芬顿反应的重要影响因素之一。
一般化学反应随着温度的升高会加快反应速度,芬顿反应也不例外,温度升高会加快·OH的生成速度,有助于·OH与有机物反应,提高氧化效果和COD的去除率;但是,对于芬顿试剂这样复杂的反应体系,温度升
高,不仅加速正反应的进行,也加速副反应,温度升高也会加速H
2O
2
的分解,分解为O
2
和H
2
O,不利于·OH的生成。
不同种类工业废水的芬顿反应最佳温度,也存在一定差异。
处理聚丙烯酰胺水溶液处理时,最佳温度控制在30℃~50℃。
研究洗胶废水处理时发现最佳温度为85℃。
处理三氯(苯)酚时,当温度低于60℃时,温度有助于反应的进行,反之当高于60℃时,不利于反应。
一般来说,芬顿试剂是在酸性条件下发生反应的,在中性和碱性的环境中Fe2+不能
催化氧化H
2O
2
产生·OH,而且会产生氢氧化铁沉淀而失去催化能力。
当溶液中的H+浓度
过高,Fe3+不能顺利的被还原为Fe2+,催化反应受阻。
多项研究结果表明芬顿试剂在酸性条件下,特别是pH在3~5时氧化能力很强,此时的有机物降解速率最快,能够在短短几分钟内降解。
此时有机物的反应速率常数正比于Fe2+和过氧化氢的初始浓度。
因此,在工程上采用芬顿工艺时,建议将废水调节到=2~4,理论上在为时为最佳。
有机底物
针对不同种类的废水,芬顿试剂的投加量、氧化效果是不同的。
这是因为不同类型的废水,有机物的种类是不同的。
对于醇类(甘油)及糖类等碳水化合物,在羟基自由基作用下,分子发生脱氢反应,然后C-C键的断链;对于大分子的糖类,羟基自由基使糖分子链中的糖苷键发生断裂,降解生成小分子物质;对于水溶性的高分子及乙烯化合物,羟基自由基使得C=C键断裂;并且羟基自由基可以使得芳香族化合物的开环,形成脂肪类化合物,从而消除降低该种类废水的生物毒性,改善其可生化性;针对染料类,羟基自由基可以打开染料中官能团的不饱和键,使染料氧化分解,达到脱色和降低COD
的目的。
用芬顿试剂降解壳聚糖的实验表明当介质pH值3~5,聚糖、 H
2O
2
及催化剂的
摩尔比在240:12~24:1~2时,芬顿反应可以使壳聚糖分子链中的糖苷键发生断裂,从而生成小分子的产物。
过氧化氢与催化剂投加量
芬顿工艺在处理废水时需要判断药剂投加量及经济性。
H
2O
2
的投加量大,废水COD
的去除率会有所提高,但是当H
2O
2
投加量增加到一定程度后, COD的去除率会慢慢下
降。
因为在芬顿反应中H
2O
2
投加量增加,·OH的产量会增加,则COD的去除率会升高,
但是当H
2O
2
的浓度过高时,双氧水会发生分解,并不产生羟基自由基。
催化剂的投加量
也有与双氧水投加量相同的情况,一般情况下,增加Fe2+的用量,废水COD的去除率会增大,当Fe2+增加到一定程度后。
COD的去除率开始下降。
原因是因为当Fe2+浓度低
时,随着Fe2+浓度升高,H
2O
2
产生的·OH增加;当Fe2+的浓度过高时,也会导致H
2
O
2
发生无效分解,释放出O
2。