有机化学汪小兰第十一章取代酸
- 格式:ppt
- 大小:305.00 KB
- 文档页数:15

目录第一章绪论 (1)第二章饱和烃 (2)第三章不饱和烃 (6)第四章环烃 (14)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应用 (33)第八章醇酚醚 (43)第九章醛、酮、醌 (52)第十章羧酸及其衍生物 (63)第十一章取代酸 (71)第十二章含氮化合物 (77)第十三章含硫和含磷有机化合物 (85)第十四章碳水化合物 (88)第十五章氨基酸、多肽与蛋白质 (99)第十六章类脂化合物 (104)第十七章杂环化合物 (113)Fulin 湛师第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H HHCC HH HH或 b.H C H c.H N Hd.H S He.H O NO f.O C H Hg.O POO H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OH H或1.5下列各化合物哪个有偶极矩?画出其方向。

绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:1.4写出下列化合物的Lewis电子式。
a. C2H4b. CH3Clc. NH3d. H2Se. HNO3f. HCHOg.H3PO4 h. C2H6i. C2H2 j. H2SO4答案:1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I2b. CH2Cl2c. HBrd. CHCl3e. CH3OHf. CH3OCH3答案:1.6根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性O > S , H2O与H2S相比,H2O有较强的偶极作用及氢键。
1.7下列分子中那些可以形成氢键?答案:d. CH3NH2e. CH3CH2OH1.8醋酸分子式为CH3COOH,它是否能溶于水?为什么?答案:能溶于水,因为含有C=O和OH两种极性基团,根据相似相容原理,可以溶于极性水。
第二章 饱和烃2.1 卷心菜叶表面的蜡质中含有29个碳的直链烷烃,写出其分子式。
C29H602.2 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。

绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:1.4写出下列化合物的Lewis电子式。
a. C2H4b. CH3Clc. NH3d. H2Se. HNO3f. HCHOg. H3PO4h. C2H6i. C2H2 j. H2SO4答案:1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I2b. CH2Cl2c. HBrd. CHCl3e. CH3OHf. CH3OCH3答案:1.6根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性O > S , H2O与H2S相比,H2O有较强的偶极作用及氢键。
1.7 下列分子中那些可以形成氢键?答案:d. CH3NH2e. CH3CH2OH1.8 醋酸分子式为CH3COOH ,它是否能溶于水?为什么?答案:能溶于水,因为含有C=O 和OH 两种极性基团,根据相似相容原理,可以溶于极性水。
第二章 饱和烃2.1 卷心菜叶表面的蜡质中含有29个碳的直链烷烃,写出其分子式。
C29H602.2 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。

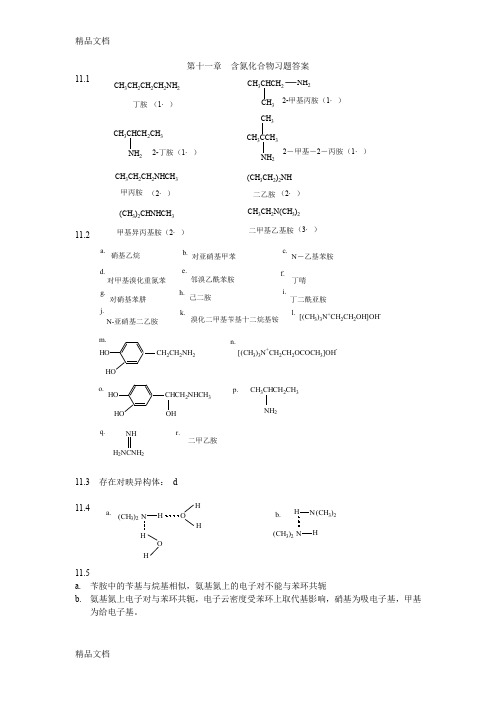
第十一章 含氮化合物习题答案11.111.211.3 存在对映异构体: d11.411.5a. 苄胺中的苄基与烷基相似,氨基氮上的电子对不能与苯环共轭b. 氨基氮上电子对与苯环共轭,电子云密度受苯环上取代基影响,硝基为吸电子基,甲基为给电子基。
a.硝基乙烷b.对亚硝基甲苯c.N -乙基苯胺d.对甲基溴化重氮苯e.邻溴乙酰苯胺f.丁啨g.对硝基苯肼h.己二胺i.j.N-亚硝基二乙胺k.溴化二甲基苄基十二烷基铵l.[(CH 3)3N +CH 2CH 2OH]OH -m.2CH 2NH 2[(CH 3)3N +CH 2CH 2OCOCH 3]OH -n.o.CHCH 2NHCH 3OH p.CH 3CHCH 2CH 3NH 2q.H 2NCNH 2NH r.二甲乙胺丁二酰亚胺(CH 3)2N H HO H H O H a. b.(CH 3)2N H H N (CH 3)2CH 3CH 2CH 2NHCH 3甲丙胺(2·)(CH 3CH 2)2NH 二乙胺(2·)(CH 3)2CHNHCH 3(2·)甲基异丙基胺CH 3CH 2N(CH 3)2(3·)CH 3CH 2CH 2CH 2NH 2丁胺(1·)CH 3CHCH 2CH 3NH 22-丁胺(1·)CH 3CHCH 2NH 232-甲基丙胺(1·)CH 3CCH 3CH 3NH 22-甲基-2-丙胺(1·)二甲基乙基胺11.611.7 a.叔胺 b. 伯胺 c.叔胺盐 d. 伯胺盐 e. 季铵盐f.叔胺g.仲胺h.仲胺盐11.8 作为亲核试剂的是:a ,b ,c ,d ,e ,f11.9(+)-酒石酸+(±)-仲丁胺(+)-仲丁胺.(+)-酒石酸.(+)-酒石酸(+)-仲丁胺(-)-仲丁胺a.3H 2SO 4NH 2b.NH 23NHCOCH 3NHCOCH 332H O/H +NH 2NO 2c.CH 3COOH 3CH 3COONH 4CH 3CONH 2d.CH 3CH 2OH K Cr O 24CH 3CHO C H MgBr H 2O/H CH 3CHCH 2CH 3OH CH 3CHCH 2CH 3Br NH CH 3CHCH 2CH 3NH 2过量233NO 2NH 2f.NO 2Br Br NH 22H +Br N 2+Cl -N=N NH 211.1011.11 a. FeCl 3,苯磺酰氯/NaOH b. AgNO 311.1211.13 苯磺酰氯/NaOH11.14 a<c<b<d<e11.153g.NH 22H N 2+Cl -CH 33CH 3CH 3OHN=N CH3a.N N b.N N N O=CCH 3c.CH 3d.N CH 3CH 3+I -Ne.N 2f.N O=CCH 2CH 3g.N=O N CH 3HNO 2-+h.CH 3HCl -+N H 2Cl -+a. b.c. d.(C 2H 5)3N +Br -3)2(CH 3)3N +(CH 2)3CH 3CH 3NCH 3COCH 2CH 3NO N(C 2H 5)2苄胺苄醇对甲苯酚水层(对甲苯酚钠)有机层H CO 对甲苯酚HCl 有机层(苄醇)NaOH 苄胺11.16有关反应式略A. B.C.CH 3CHCH 2CH(CH 3)2NH 2CH 3CHCH 2CH(CH 3)2OHCH 3CH=CHCH(CH 3)2。

绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol 的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:1.4写出下列化合物的Lewis电子式。
a. C2H4b. CH3Clc. NH3d. H2Se. HNO3f. HCHOg. H3PO4 h. C2H6i. C2H2 j. H2SO4答案:1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I2b. CH2Cl2c. HBrd. CHCl3e. CH3OHf. CH3OCH3答案:1.6根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性O > S , H2O与H2S相比,H2O有较强的偶极作用及氢键。
1.7下列分子中那些可以形成氢键?答案:d. CH3NH2e. CH3CH2OH1.8醋酸分子式为CH3COOH,它是否能溶于水?为什么?答案:能溶于水,因为含有C=O和OH两种极性基团,根据相似相容原理,可以溶于极性水。
第二章 饱和烃2.1 卷心菜叶表面的蜡质中含有29个碳的直链烷烃,写出其分子式。
C29H602.2 用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。
有机化学答案汪小兰【篇一:汪小兰有机化学答案】>1.2绪论nacl与kbr各1mol与nabr及kcl各1mol溶于水中所得溶液相同。
因为两者溶液--中均为na+ , k+ , br, cl离子各1mol。
由于ch4 与ccl4及chcl3与ch3cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3c+624hcy2pz2p2s2pxhch4中c中有4个电子与氢成键为sp3杂化轨道,正四面体结构ch4sp3杂化1.4a.hcchhhc.d.或hchchhb.hhh或hhhhhshe.hof.ohchg.hhhhhh.hhhhi.hcchj.hho或hh1.5b.clc.hbrd.h3ce.hf.h3c31.6电负性 o s , h2o与h2s相比,h2o有较强的偶极作用及氢键。
1第二章饱和脂肪烃2.1a. 2,4,4-三甲基-5-正丁基壬烷5-butyl-2,4,4-trimethylnonaneb. 正己烷 hexanec. 3,3-二乙基戊烷3,3-diethylpentaned. 3-甲基-5-异丙基辛烷5-isopropyl-3-methyloctanee. 2-甲基丙烷(异丁烷)2-methylpropane (iso-butane)f. 2,2-二甲基丙烷(新戊烷) 2,2-dimethylpropane (neopentane)g. 3-甲基戊烷3-methylpentaneh. 2-甲基-5-乙基庚烷5-ethyl-2-methylheptane2.2a = b = d = e为2,3,5-三甲基己烷c = f 为2,3,4,5-四甲基己烷2.3a.错,应为2,2-二甲基丁烷b.c.d.e.f.错,应为2,3,3-三甲基戊烷g.错,应为2,3,5-三甲基庚烷h.2.5c b e a d 2.63 种1clcl23cl2.7 a是共同的 2.8abcd2.10这个化合物为2.11 稳定性 c a b第三章不饱和脂肪烃3.1 用系统命名法命名下列化合物a. 2-乙基-1-丁烯2-ethyl-1-buteneb. 2-丙基-1-己烯2-propyl-1-hexenec. 3,5-二甲基-3-庚烯 3,5-dimethyl-3-heptened. 2,5-二甲基-2-己烯 2,5-dimethyl -2-hexene 3.22a.b.错,应为1-丁烯c.d.e.h.f.错,应为2,3-二甲基-1-戊烯g.错,应为2-甲基-3-乙基-2-己烯3.4 下列烯烃哪个有顺、反异构?写出顺、反异构体的构型,并命名。
______________________________________________________________________________________________________________目录第一章绪论 (1)第二章饱和烃 (3)第三章不饱和烃 (8)第四章环烃 (19)第五章旋光异构 (30)第六章卤代烃 (37)第七章波谱法在有机化学中的应用 (44)第八章醇酚醚 (58)第九章醛、酮、醌 (69)第十章羧酸及其衍生物 (83)第十一章取代酸 (93)第十二章含氮化合物 (100)第十三章含硫和含磷有机化合物 (111)第十四章碳水化合物 (114)第十五章氨基酸、多肽与蛋白质 (129)第十六章类脂化合物 (136)第十七章杂环化合物 (148)______________________________________________________________________________________________________________ Fulin 湛师第一章绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+,K+,Br -, Cl-离子各1mol。
由于CH4与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。