不同点有哪些认识?使用它们注意哪些事项?
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
答案:酸式滴定管:取酸液或强氧化性溶液,特征:玻璃活塞。碱式滴
定管:取碱液,特征:内有玻璃球的橡皮管。注意点:a.检查是否漏水,玻璃
活塞用左手指内扣转动。b.滴定前要洗涤:洗涤剂洗—自来水洗—蒸馏
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
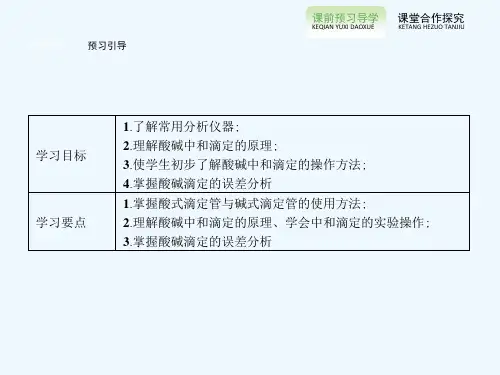
预习引导
(4)取:从碱式滴定管中放出 25.00 mL 氢氧化钠溶液于锥形瓶中,
滴入 2 滴酚酞溶液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白
纸。
(5)滴定:左手控制活塞,右手振荡锥形瓶,边滴入盐酸,边不断摇动锥
内含少量的氢氧化钾,用标准盐酸溶液进行滴定(偏低)
(2)同上情况,若氢氧化钠中含有少量的碳酸钠,结果如何(偏低)
问题导学
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
当堂检测
迁移与应用
例 3 用标准盐酸滴定未知浓度的 NaOH 溶液时,若测得的结
目标导航
课前预习导学
课堂合作探究
KEQIAN YUXI DAOXUE
KETANG HEZUO TANJIU
预习引导
答案:①不能用量筒代替滴定管,因为计量的精确度不同。在量取液
体的体积时,量筒只能读至 0.1 mL,而滴定管可读至 0.01 mL。用滴定管
测量时有测定值的精确度较高,读数方便,操作简单等优点。
(4)滴定操作时,有少量盐酸滴于锥形瓶外(偏高)