cr,OH
0.1000 20.02 0.1000 20.00 20.02 20.00
5 105
pOH 4.3
pH 9.7
PPT学习交流
26
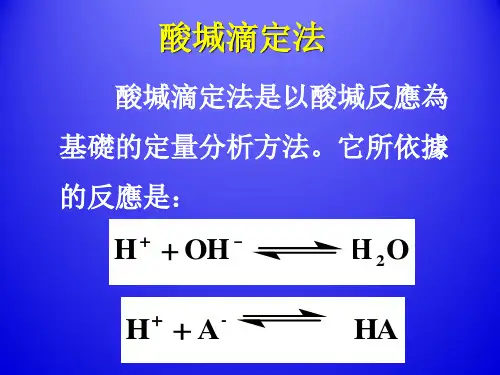
按上述计算方法所组成的滴定曲线见下图:
PPT学习交流
27
2、曲线分析 (1)曲线的突跃范围是在pH为7.74~9.70。 (2)在理论终点前溶液已呈碱性,所以在理
PPT学习交流
29
PPT学习交流
30
当酸的浓度一定時,如果我们要求终 点误差为±0.2%,则强碱能够用指示剂直 接准确滴定弱酸的可行性判据为:
滴定条件 cr,a·Kθa ≥10-8 。
PPT学习交流
31
5、强酸滴定弱碱
例:0.1000mol·L-1HCl滴定20.00mL 0.1000 mol·L-1 NH3·H2O (1)滴定前 HCl+NH3·H2O = NH4Cl + H2O
B4O72- + 5H2O = 2H2BO3- + 2H3BO3 H2BO3-与H3BO3为共轭酸碱对, H3BO3的 Kθa = 5.9 ×10-10 , H2BO3- 的 Kθb = 1.7×10-5, 其碱性与氨水相似,
PPT学习交流
36
因此可用强酸(HCl)滴定H2BO3-来标 定HCl的浓度。能够用指示剂直接准确 滴定弱碱的可行性判据
论终点时pH值不是7而是8.72。 3、指示剂的选择
选择碱性区域变色的指示剂。如酚酞、 百里酚蓝等,但不能是甲基橙。
PPT学习交流
28
4、影响突跃范围的因素 (1)浓度 (2)酸的强度 当弱酸的浓度一定时,
酸越弱(Kθa值越小),曲线起点的pH值越大, 突跃范围越窄。当Kθa < 10-7时,无明显的 突跃,就不能用一般的方法进行酸碱滴定。