热力学函数的统计热力学计算
- 格式:ppt
- 大小:1.24 MB
- 文档页数:106


热⼒学与统计物理第五章知识总结§5.1 热⼒学量的统计表达式我们根据Bolzman分布推导热⼒学量的统计表达式⼀、配分函数粒⼦的总数为令(1)名为配分函数,则系统的总粒⼦数为(2)⼆、热⼒学量1、内能(是系统中粒⼦⽆规则运动的总能量的统计平均值)由(1)(2)得(3)此即内能的统计表达式2、⼴义⼒,⼴义功由理论⼒学知取⼴义坐标为y时,外界施于处于能级上的⼀个粒⼦的⼒为则外界对整个系统的⼴义作⽤⼒y为(4)此式即⼴义作⽤⼒的统计表达式。
⼀个特例是(5)在⽆穷⼩的准静态过程中,当外参量有dy的改变时,外界对系统所做的功为(6)对内能求全微分,可得(7)(7)式表明,内能的改变分为两项:第⼀项是粒⼦的分布不变时,由于能级的改变⽽引起的内能变化;地⼆项是粒⼦能级不变时,由于粒⼦分布发⽣变化⽽引起的内能变化。
在热⼒学中我们讲过,在⽆穷⼩过程中,系统在过程前后内能的变化dU等于在过程中外界对系统所作的功及系统从外界吸收的热量之和:(8)与(6)(7)式相⽐可知,第⼀项代表在准静态过程中外界对系统所作的功,第⼆项代表在准静态过程中系统从外界吸收的热量。
这就是说,在准静态过程中,系统从外界吸收的热量等于粒⼦在其能级上重新分布所增加的内能。
热量是在热现象中所特有的宏观量,它与内能U和⼴义⼒Y不同。
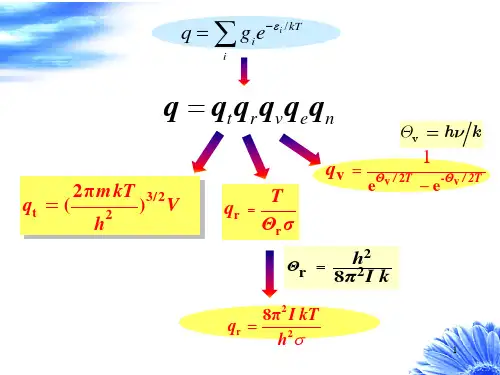
3、熵1)熵的统计表达式由熵的定义和热⼒学第⼆定律可知(9)由和可得⽤乘上式,得由于引进的配分函数是,的函数。
是y的函数,所以Z是,y的函数。
LnZ的全微分为:因此得(10)从上式可看出:也是的积分因⼦,既然与都是的积分因⼦,我们可令(11)根据微分⽅程关于积分因⼦的理论,当微分式有⼀个积分因⼦时,它就有⽆穷多个积分因⼦,任意两个积分因⼦之⽐是S的函数(dS是⽤积分因⼦乘微分式后所得的全微分)⽐较(9)、(10)式我们有积分后得(12)我们把积分常数选为零,此即熵的统计表达式。
2)熵函数的统计意义由配分函数的定义及得由玻⽿兹曼分布得所以(13)此式称为Boltzman关系,表明某宏观状态的熵等于玻⽿兹曼k乘以相应的微观状态数的对数。




热力学中的热力学函数热力学函数是热力学研究中的核心概念之一,用于描述系统在不同状态下的性质和行为。
它们通过数学函数的形式,将系统的热力学性质与物质的物理性质联系起来,使得我们可以通过研究这些函数来了解系统的特性。
本文将介绍几种常见的热力学函数及其在研究中的应用。
一、内能(U)内能是热力学中最基本、最常用的热力学函数之一,它表示系统所含能量的总和。
内能的变化可以用来分析系统的能量转移和能量转化过程。
当系统中没有发生化学反应和质量转移时,内能变化可以用下式表示:ΔU = Q + W其中,ΔU表示内能变化,Q表示系统吸收或释放的热量,W表示系统对外界做功。
当系统对外界做功时(W>0),内能会减少;而当外界对系统做功时(W<0),内能会增加。
二、焓(H)焓是描述恒压热力学过程中能量变化的重要函数。
在恒压条件下,焓的变化等于系统吸收或释放的热量。
即:ΔH = Qp其中,ΔH表示焓变化,Qp表示系统在恒压过程中吸收或释放的热量。
由于焓变化只与物质的初末状态有关,因此焓是一种状态函数。
三、自由能(G)自由能是一种描述系统在恒温、恒压条件下的能量变化的函数,它可以用来预测物质反应的方向和可逆性。
自由能由内能和系统对外界做功的能力两部分组成,可以用下式表示:G = U + pV - TS其中,G表示自由能,U表示内能,p表示压强,V表示体积,T表示温度,S表示熵。
自由能的变化量ΔG与反应的可逆性有关,当ΔG<0时,反应是可逆的;当ΔG>0时,反应是不可逆的。
四、熵(S)熵是描述系统有序程度的函数,也是描述系统混乱度或无序程度的度量。
熵的增加可以用来判断反应的可逆性,熵的减少则表示反应的趋于有序。
熵是与统计力学深度相关的一个量,它可以通过统计力学的方法来计算。
总结:热力学函数是热力学研究中不可或缺的工具,它们通过数学函数的形式,将热力学性质与物质的物理性质联系起来,为研究热力学系统提供了便利。

热力学中的热力学函数的计算热力学是物理学中关于热和温度、能量转化的科学。
在热力学中,热力学函数是非常重要的一种概念,它们直接描述了物质的性质和特性。
本文将从热力学函数的基本概念、种类及其计算方法等方面进行论述。
一、热力学函数的基本概念1. 热力学系统热力学中的热力学系统是指物质组成固定,各种物理性质可以测定的一定空间范围内的物质。
热力学系统可以是封闭系统、开放系统或者孤立系统。
2. 热力学函数热力学函数是一个函数,可以通过物体内部的各种性质和变量来计算,又称为状态函数。
常见的热力学函数有内能、焓、自由能等,这些函数是用来计算过程中的能量变化和状态变化的。
3. 状态量和过程量在热力学中,状态量是指只和初始和末状态有关的量,如体积、温度、压强等。
过程量则是指在时间内的变化率,如功、热量、熵等。
二、热力学函数分类1. 内能内能是指物体系统所有可能的微观状态的总结,由于内能只与系统当前的状态有关,它是热力学函数的一种。
2. 焓焓是系统对外做功所需要的热量,它等于内能加上PV,因为焓是工程上最常用的热力学函数之一,它通常使用于流体力学和热力学等领域。
3. 自由能自由能是指热力学系统的总能量中与系统内部不稳定的能量有关的部分。
它是常常使用在判定化学反应是否会自发发生的指标,可以作为是否达到平衡的参考。
三、热力学函数计算方法1. 内能的计算方法内能的计算方法有以下三个步骤:(1)计算出系统内所有分子/原子的能量总和。
(2)根据热力学第一定律,计算内能变化量δU。
(3)通过统计力学的方法,得到内能的表达式。
2. 焓的计算方法焓的计算方法有以下两个步骤:(1)计算出以某个状态为基础的能量总和。
(2)根据热力学第二定律,计算焓的表达式。
3. 自由能的计算方法自由能的计算方法有以下两个步骤:(1)计算出系统内所有分子/原子的能量总和。
(2)通过统计力学的方法,得到内能的表达式,结合惠尔姆霍兹自由能的定义,计算自由能的表达式。



统计力学中的分配函数与热力学描述统计力学是研究宏观系统中微观粒子的统计规律的一门学科。
在统计力学中,分配函数是一个重要的概念,它与热力学描述密切相关。
本文将介绍统计力学中的分配函数以及它与热力学的关系。
在统计力学中,分配函数是描述系统微观粒子分布状态的函数。
它的定义如下:对于一个有N个粒子的系统,其分配函数记作Z,可以表示为所有可能微观状态的求和:Z = Σe^(-βEi)其中,Ei表示第i个微观状态的能量,β为热力学温度的倒数,也就是β=1/(kT),其中k为玻尔兹曼常数,T为系统的温度。
分配函数的值与系统的能量和温度有关。
分配函数的重要性在于它可以通过微观粒子的分布状态来计算系统的宏观性质。
例如,系统的内能可以通过分配函数的导数来计算,即U = -∂lnZ/∂β。
这个公式告诉我们,通过求分配函数对β的导数,就可以得到系统的内能。
这是统计力学与热力学的一个重要联系。
除了内能,分配函数还可以用来计算系统的其他宏观性质,例如熵、自由能等。
系统的熵可以通过分配函数的导数来计算,即S = k(βU + lnZ)。
这个公式告诉我们,通过分配函数和内能的关系,可以得到系统的熵。
而系统的自由能可以通过分配函数的变换得到,即F = -kTlnZ。
这些公式表明了分配函数与热力学描述之间的密切联系。
除了上述的宏观性质,分配函数还可以用来计算系统的平均值。
例如,系统的能量平均值可以通过分配函数和能量的关系来计算,即<U> = -∂lnZ/∂β。
这个公式告诉我们,通过分配函数和能量的关系,可以得到系统能量的平均值。
类似地,其他宏观性质的平均值也可以通过分配函数来计算。
分配函数在统计力学中扮演着重要的角色。
它不仅可以描述系统微观粒子的分布状态,还可以计算系统的宏观性质和平均值。
通过分配函数,我们可以将微观粒子的行为与宏观性质相联系,从而建立起统计力学与热力学之间的桥梁。
总结起来,统计力学中的分配函数是描述系统微观粒子分布状态的函数。
统计物理必备公式总结归纳统计物理是研究宏观系统的统计规律的分支科学,它与微观粒子的运动无关,而是通过统计方法来研究大量粒子的集体行为。
在统计物理学中,公式是理解和描述系统行为的关键工具。
本文将对统计物理中一些必备公式进行总结归纳,以帮助读者更好地理解和应用统计物理。
一、热力学量公式1. 内能U的计算公式:U = 3/2kT其中,U为内能,k为玻尔兹曼常数,T为系统温度。
2. 熵S的计算公式:S = k lnΩ其中,S为熵,k为玻尔兹曼常数,Ω为系统的微观状态数。
3. 自由能F的计算公式:F = U - TS其中,F为自由能,U为内能,T为系统温度,S为熵。
二、热力学过程公式1. 等温过程的工作公式:W = -nRT ln(V2/V1)其中,W为系统所做的功,n为物质的摩尔数,R为气体常数,T 为系统温度,V2和V1为过程中体积的变化。
2. 绝热过程的压强体积关系:P1V1^γ = P2V2^γ其中,P1和P2为过程中的初始和末态的压强,V1和V2为初始和末态的体积,γ为绝热指数。
三、碳氢化合物平均动能公式1. 一维单原子分子平均动能公式:〈E〉 = (1/2)kT其中,〈E〉为平均动能,k为玻尔兹曼常数,T为系统温度。
2. 一维双原子分子平均动能公式:〈E〉 = (1/2)kT + (1/2)kT(1 + 2/3exp(-θ/T))其中,〈E〉为平均动能,k为玻尔兹曼常数,T为系统温度,θ为势能常数。
四、费米-狄拉克分布和玻尔兹曼分布公式1. 费米-狄拉克分布公式:f(E) = 1 / (exp((E-μ)/(kT)) + 1)其中,f(E)为能级E上的费米分布函数,μ为系统的化学势,k为玻尔兹曼常数,T为系统温度。
2. 玻尔兹曼分布公式:f(E) = exp((μ-E)/(kT))其中,f(E)为能级E上的玻尔兹曼分布函数,μ为系统的化学势,k为玻尔兹曼常数,T为系统温度。
五、统计物理中的重要关系公式1. 统计物理中的状态方程:PV = NkT其中,P为系统的压强,V为系统的体积,N为系统中的粒子数,k为玻尔兹曼常数,T为系统温度。