原子的结构
- 格式:pptx
- 大小:817.03 KB
- 文档页数:18

原子与分子的结构原子和分子是构成物质的基本单位,它们的结构对物质的性质和行为起着重要的决定性作用。
本文将从原子和分子的组成以及结构的角度来探讨原子与分子的结构。
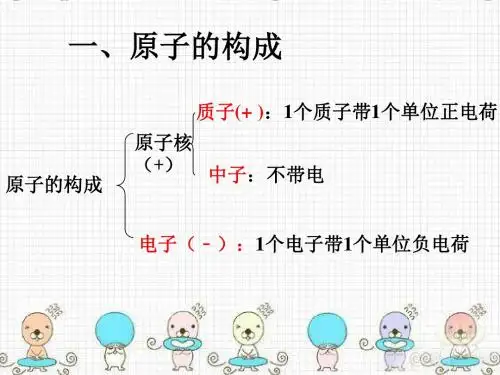
一、原子的结构原子是物质的最小单位,由原子核和电子组成。
原子核位于原子的中心,由质子和中子组成,而电子则围绕原子核运动。
1. 原子核原子核由质子和中子组成。
质子带正电荷,中子不带电荷。
质子和中子的质量几乎相同,都远大于电子的质量。
2. 电子电子是负电荷的基本粒子,质量很小。
电子围绕原子核以轨道运动,形成电子云。
电子云的轨道可以分为不同能级,每个能级可以容纳一定数量的电子。
二、分子的结构分子是由两个或多个原子通过化学键连接在一起形成的。
分子的结构包括原子的排列方式以及化学键的类型和角度。
1. 原子排列分子中原子的排列方式决定了分子的种类和性质。
不同原子可以通过共价键、离子键或金属键连接在一起形成分子。
2. 化学键化学键是原子之间的相互作用力,包括共价键、离子键和金属键。
- 共价键是通过原子间的电子共享形成的。
共价键可以分为单键、双键、三键等,共享的电子越多,化学键越强。
- 离子键是由带正电荷的离子和带负电荷的离子之间的电荷吸引力形成的。
离子键通常存在于正负离子化合物中。
- 金属键是金属原子间的电子云形成的。
金属键的特点是电子自由移动,使得金属具有良好的导电性和热传导性。
三、原子与分子间的相互作用原子和分子间存在着相互作用,这些相互作用对物质的性质和行为有着重要的影响。
1. 范德华力范德华力是分子间的吸引力,是由于分子之间的瞬时或短时极化而产生的。
范德华力对于非极性分子尤为重要,它影响着分子的状态、相变和溶解度等性质。
2. 氢键氢键是一种特殊的化学键,它是由于分子中氢原子与较电负的原子(如氧、氮、氟)之间的吸引作用形成的。
氢键在生物分子的结构和功能中起着重要的作用。
3. 离子间相互作用离子间相互作用是来自带电离子间的相互吸引力和排斥力。
离子间相互作用决定了离子晶体的结构和性质,也影响了溶液的电导性和溶解度等。

原子的结构原子是构成物质的基本单位,也是能够保持化学反应的最小单位。
它由核部分和电子云部分构成。
核部分包括质子和中子,而电子云部分则包括电子。
质子是带有正电荷的基本粒子,它们存在于原子核中。
质子的质量约为1.67×10^-27千克,其电荷为元电荷即+1。
原子的质子数目被称为原子的原子序数,通常用字母Z表示。
质子的数量决定了原子的化学属性和元素的身份。
中子是电中性的基本粒子,它们也存在于原子核中。
中子的质量约为1.67×10^-27千克,由于没有电荷,所以中子对原子的化学反应没有直接影响。
电子是负电荷的基本粒子,其质量要远小于质子和中子,约为9.11×10^-31千克。
电子云是指围绕着原子核的电子,它们以不确定的方式分布在原子周围的轨道中。
根据量子力学理论,原子的电子以能级的形式存在。
能级是指位于不同轨道上的电子具有不同的能量。
通常,原子的电子云可以分为不同的壳层,每个壳层可以容纳不同数量的电子。
内层壳层离核较近,能量较低,外层壳层离核较远,能量较高。
按照杨振宁和约会一瑟尔提出的电子自旋相对论解(Dirac方程),每个原子都可以由四个量子数来描述。
主量子数(n)表示电子所在能级的大小,角量子数(l)表示电子的角动量大小,磁量子数(m)表示电子在空间中方向的分布,自旋量子数(s)表示电子的自旋方向。
此外,原子还具有一些其他特征,如原子半径、离子半径、原子的电离能和电子亲和能等。
原子半径是指原子核外电子云边界与原子核的距离。
离子半径是指带电原子(即离子)中正负电荷之间的距离。
原子的电离能是指从原子中永久移除一个电子所需的能量。
电子亲和能是指从原子或离子中获得一个电子所释放的能量。
总结而言,原子具有复杂的结构,包括质子、中子和电子三个基本粒子。
质子和中子位于原子核中,而电子以电子云的形式环绕核。
电子在不同的能级上以不确定的方式存在,并且通过量子数来描述。
此外,原子还具有其他特征,如半径、离子半径、电离能和电子亲和能等。





原子一、原子1.原子的结构原子是由位于原子中心的中子构成的。
原子核位于原子的做高速运动。
注:(1)不是所有原子的原子(2)核电荷数=质子数(3)原子的质子数(或核数不同。
(4)原子核内质子数与中2.核外电子的排布 (1)原子的核外电子排布①电子层在含有多个电子的原子里能量高的通常在离核较远的区稍远的叫第二层,由里向外依②原子结构示意图:如钠(2)元素原子最外层电子原子的相关知识 中心的带正电的原子核和核外带负电的电子构成。
原子原子的中心,体积很小,原子里有很大的空间,电子的原子核中都有中子。
子数=核外电子数。
或核电荷数)决定原子的种类,因此不同种类的原数与中子数不一定相等。
子排布 原子里,电子的能量并不相同,能量低的通常在离核较近远的区域运动。
把能量最低、离核最近的叫第一层,向外依次类推,叫三、四、五、六、七层。
如钠原子结构示意图。
层电子数与元素化学性质的关系原子核是由质子和电子在这个空间里类的原子,核内质子核较近的区域运动,,能量稍高、离核元素类别 稀有气体元素 金属元素非金属元素 一般多(3)原子结构示意图的书要正确书写原子结构示意①每一电子层上所容纳的纳2×12=2个;第二层上能容纳②核外电子是逐层排布的依此类推。
③最外层电子数不得超过二、离子1.离子概念:带电的原子(或原分类:阳离子:带正电的原子或原阴离子:带负电的原子或原离子的形成过程:(1)金属原子的最外层电核外电子数,所以带正电荷(2)非金属原子的最外层于核外电子数,所以带负电荷2.离子符号(1)离子符号表示的意义(2)分子、原子和离子的最外层电子数 得失电子倾向 8个(He 为2) 不易得失 一般少于4个 易失去最外层电子 一般多于4个或等于4个 易得到电子图的书写及相关判断构示意图,必须遵循核外电子排布的一般规律:容纳的电子数不超过2n 2个(n 为电子层数)。
例如,能容纳2×22=8个电子;第三层上能容纳2×32=18个电子排布的,先排满第一层,再排第二层,第二层排满后得超过8个。

《原子的结构》课件一、教学内容本节课的教学内容来自于小学科学六年级下册,第四章“物质的构成”,第二节《原子的结构》。
本节课主要内容有:原子的定义、原子的组成、原子核和电子、原子的结构模型。
二、教学目标1. 让学生了解原子的定义和组成,知道原子核和电子的关系。
2. 能够通过观察和思考,理解原子的结构模型。
3. 培养学生的观察能力、思考能力和动手能力。
三、教学难点与重点重点:原子的组成、原子核和电子的关系、原子的结构模型。
难点:原子核和电子的互动关系、原子的结构模型的构建。
四、教具与学具准备教具:PPT、模型原子、电子、原子核。
学具:笔记本、彩色笔。
五、教学过程1. 实践情景引入:通过一个有关原子的故事,引出原子的定义和组成。
2. 知识讲解:讲解原子核和电子的关系,介绍原子的结构模型。
3. 模型演示:用模型原子、电子、原子核进行演示,让学生直观地理解原子的结构。
4. 随堂练习:让学生用彩色笔在笔记本上画出原子的结构模型。
5. 例题讲解:通过一些有关原子的问题,让学生进一步理解原子的结构。
6. 小组讨论:让学生分组讨论,分享自己对于原子的理解和感受。
六、板书设计原子组成:原子核 + 电子结构模型:原子核(质子、中子) + 电子云七、作业设计1. 请用彩色笔在笔记本上画出原子的结构模型。
2. 请用自己的话,简述原子的组成和结构模型。
答案:1. 略2. 原子的组成:原子核 + 电子。
原子核由质子和中子组成,电子在原子核外围形成电子云。
八、课后反思及拓展延伸本节课通过模型演示、随堂练习、例题讲解等方式,让学生了解了原子的定义、组成和结构模型。
课堂上,学生积极参与,表现出对原子知识的兴趣。
但在小组讨论环节,部分学生表现出对原子核和电子互动关系的不理解。
在课后,可以针对这部分学生进行个别辅导,或组织更深入的小组讨论,以帮助学生更好地理解原子的结构。
拓展延伸:可以让学生进行家庭实验,观察日常生活中的原子现象,如酸碱反应等,从而加深对原子的理解。

什么是原子结构一九四四年,经物理学家亨利·格林筑基梁发现原子内部结构构成原子,从而奠定了原子结构研究的基础。
原子结构,也就是构成原子的要素,包括原子核、电子等组成,对于探究物质世界有着重要意义。
(一)原子核的构成原子核,又称原子核结构,是构成原子的最重要部分。
它由永久性的质子、中子和由核反应产生的暂时性的介子,组成的静态的构成物。
有的原子核由原子核附着的地雷;而且,质子和中子本身也具有海德斯-安塔尔结构,有着非常精细的结构关系。
(二)电子的构成电子是原子得以稳定的主要原因,它是一种极小的带负电荷的粒子,存在于原子核之外,绕原子核运动。
根据电子层级原理,原子由共同构成不同原子的电子排列形成,而电子能量层的数量直接决定了原子的特性及稳定性。
(三)原子结构的影响原子结构的影响,主要体现在原子的化学特性以及其他外在性质上。
因为原子核和电子及其他介子的分布情况不同,那么原子间的化学反应前提供的能量也不一样,不同结构的原子就会表现出特定的性质。
例如:氢原子有两个双核电子,它与其他元素进行化学反应时发生的反应热明显较小,因而氢是一种极易反应的元素。
(四)原子结构的研究史上著名的物理学家开展了原子结构的研究,其中第一个是爱因斯坦,他在1905年提出的量子理论为原子结构的研究建立了基础。
紧接着,弗罗伦茨·喀胡拉对原子核进行了精确的模型描述,把原子核看作是质子和中子组成的物理结构,指导着电子在原子核外运动。
(五)原子结构的实际应用原子结构的实际应用十分广泛,从放射和辐射研究到重大的工程应用,都会使用到原子结构的知识。
例如:原子结构的研究帮助科学家了解核反应的本质,从而开发出的大型发电站的燃料元素;熔断电路保护设计中,也要用到原子结构的概念。
所以,原子结构的研究,对于社会发展至关重要。
综上所述,原子结构是构成原子的最重要部分,其中包含质子、中子、电子等要素。
原子结构的研究不仅对深入理解物质世界有直接的意义,实际的应用也十分的重要,是社会迅速发展的根本因素。

原子结构是指描述原子内部组成和排列方式的概念。
它包括原子的基本组成部分,如质子、中子和电子,以及它们在原子中的位置和数量。
具体来说,原子结构由以下要素组成:
1.质子:质子是带正电荷的基本粒子,它们位于原子核中。
每个质子的电荷都为+1,其质
量约等于1.67 x 10^-27千克。
2.中子:中子是没有电荷(即电中性)的基本粒子,它们也位于原子核中。
每个中子的质
量与质子相近,约等于1.67 x 10^-27千克。
3.电子:电子是带负电荷的基本粒子,它们绕着原子核运动。
每个电子的电荷为-1,其质
量约为质子和中子的1/1836。
4.原子核:原子核是包含质子和中子的中心部分,其中质子和中子紧密结合在一起。
原子
核的直径相对较小,但它占据整个原子的绝大部分质量。
5.原子壳层:电子以不同的能级(或壳层)存在于原子周围。
这些能级由电子的能量确定,
每个能级可以容纳一定数量的电子。
原子结构的描述通常采用元素符号和电子排布来表示,例如氢原子(H)由一个质子、一个中子和一个电子组成。
原子结构对于理解化学反应、物质性质和元素周期表等方面具有关键意义。
通过研究原子结构,我们可以深入了解物质世界的微观组成和行为规律。
原子结构及元素周期表原子结构是指原子的组成和构造,了解原子结构对于理解元素周期表及化学反应至关重要。
本文将介绍原子结构的基本知识,并探讨元素周期表的构成和应用。
一、原子结构原子是物质的基本单位,由质子、中子和电子组成。
质子带有正电荷,中子不带电,电子带有负电荷。
原子的核心由质子和中子组成,电子绕核心运动。
原子的质量数等于质子和中子的数量之和,原子的电荷数等于质子的数量减去电子的数量。
原子中质子数和电子数相等,因此原子是电中性的。
二、元素周期表的构成元素周期表是对所有已知元素按一定规律排列的表格。
元素周期表按照原子序数(质子数)的顺序排列,将具有相似化学性质的元素放在同一垂直列中。
元素周期表的每个水平行称为一个周期,每个垂直列称为一个族。
周期表中的元素按照金属性和非金属性分成两部分,金属性元素在左侧,非金属性元素在右侧。
三、元素周期表的应用1. 元素周期表可以提供元素的基本信息。
周期表上标注了每个元素的符号、原子序数、原子质量等重要数据,这些信息对于化学实验和研究都是十分重要的参考。
2. 元素周期表可以预测元素的性质。
根据元素在周期表中所处的位置和周期表规律,可以推测元素的原子半径、电负性、离子化倾向等性质,为化学实验和反应提供指导。
3. 元素周期表有助于研究元素化合物和反应。
分析元素周期表中元素的位置和性质,可以预测元素之间的化学反应、氧化还原反应等,并进行相关实验验证。
4. 元素周期表的发展推动了新元素的发现。
周期表的存在和规律使科学家能够预测某些未被发现的元素的存在和性质,从而推动新元素的发现和研究。
总结:原子结构是指原子的组成和构造,包括质子、中子和电子。
元素周期表是对所有已知元素按照原子序数的顺序排列的表格,可以提供元素的基本信息、预测元素的性质、研究元素化合物和反应,以及推动新元素的发现和研究。
了解原子结构和元素周期表对于深入理解化学和开展科学研究具有重要意义。
原子的结构和性质原子是物质的基本构建单元,由一个中心核和绕核运动的电子组成。
原子的结构和性质对于理解物质的性质和化学反应机制至关重要。
本文将从原子的结构、原子的物理性质、原子的化学性质和原子的性质的变化等方面进行阐述。
首先,原子的结构主要由原子核和电子组成。
原子核是位于原子中心的带正电荷的粒子,由质子和中子组成。
质子带正电荷,中子不带电荷。
电子是带负电荷的粒子,围绕在原子核外层的电子壳中。
原子核的质量集中在质子和中子上,而电子的质量很小。
原子的物理性质包括质量、电荷和大小。
原子的质量可以通过质子和中子的数量来确定,通常用原子质量单位来表示。
原子的电荷由电子和质子的数量决定,通常情况下原子是电中性的,即正电荷和负电荷平衡。
原子的大小通常通过原子半径来表示,原子半径的大小和电子壳的分布有关,一般来说,原子的半径越大,中心核和外层电子之间的距离越远。
原子的化学性质主要涉及原子的化学键和化学反应。
原子通过与其他原子形成化学键来形成化合物。
化学键主要包括共价键和离子键。
共价键是通过电子共享来形成的,如在氢气分子中,两个氢原子共享一对电子。
离子键是由正离子和负离子之间的吸引力形成的,如氯化钠中的氯离子和钠离子。
化学反应是指原子之间的重新排列以形成新的化学物质。
在化学反应中,原子的化学键会被打破和形成,导致反应物变为产物。
原子的性质会随着原子的变化而变化。
首先,原子的性质可以通过元素周期表来归类和预测。
元素周期表是按照原子序数排列的表格,元素周期规律地从左到右和从上到下排列。
在同一周期中,原子的大小和电负性呈现出规律性的变化。
在同一族中,原子的性质也会有相似之处,如同一族的元素通常具有相似的化学性质。
其次,原子的性质还与原子的能级结构有关。
原子中的电子按照能级填充,每个能级可以容纳一定数量的电子。
不同能级的电子具有不同的能量。
最外层的电子被称为价电子,它们对于原子的化学性质起着重要的作用。
价电子的数量和分布决定了原子的化学键和化学反应。
第十一讲 原子的结构一、原子的结构1.原子的结构1897年,英国科学家 发现电子,证明原子的可分性。
图33原子结构模拟图2.原子中核电荷数、质子数与核外电子数的关系 (1)核电荷数指的是 所带的正电荷数。
(2)原子不显电性,每个质子带一个单位 ,每个 带一个单位负电荷,所以质子数等于核 外电子数。
(3)所以:质子数= =核外电子数3.关于原子结构注意点①原子的质量几乎集中在上。
②(核内质子数)的多少,决定了原子的。
③核电荷数=质子数= 。
④氢原子中就。
二、原子核外电子的排布1.基本概念(1)在含有多个电子的原子中,核外电子具有不同的运动状态。
离核的电子能量,离核,电子的能量,所以具有不同能量的电子在不同的电子层上运动。
(2)离原子核最近的电子层为第1层,次之为第2层,依次类推为第3、4、5、6、7 层,也可以用字母表示,依次为K、L、M、N、O、P、Q。
2.核外电子排布规律(1)核外电子总是尽可能的电子层上,然后由里向外依次排布在能量的电子层上。
(2)每层最多容纳电子,最外层不能超过个。
3.原子结构示意图(1)钠原子结构示意图(2)常见原子结构示意图4.原子结构与性质的关系(1)稀有气体氦气、氖气、氩气等化学性质极不活泼,又称,从原子结构上观察可知,当原子(只有一层时为2)时,为,。
(2)当原子最外层电子数 4 时,该原子易最外层的电子;当原子最外层电子数4时,该原子易电子,从而达到8 电子稳定结构;原子最外层电子数为 4时,既不容易得电子,也不容易失电子。
(3) 决定原子的;最外层电子数,化学性质(同一列)。
三、离子1.离子的形成(1)最外层电子数大于4个的原子为了达到稳定结构就很容易得到电子,得电子后变成了离子。
则<核外电子数,从而原子带上了负电,其结构示意图如图所示:(2)反之,最外层电子数小于4 个的原子就很容易失去电子,质子数>,从而原子带上了正电,如图所示:2.离子的定义(1)离子:荷的或原子团,如C l、C u2+ 、SO24等。