2020版药典新增及变化全汇总
- 格式:doc
- 大小:2.22 MB
- 文档页数:15

中国药品标准DrugStandardsofChina2021,22(1) ·5 · 第一作者简介:赵雄,副研究员,研究方向:生物制品研发及质量控制。
Tel:010 67079598;E mail:zhaoxiong@chp org cn 通讯作者简介:郭中平,研究员,研究方向:生物制品。
Tel:010 67079561;E mail:guozhongping@chp org cn《中国药典》2020年版(三部)生物技术产品增修订概况赵雄,王晓娟,曹琰,郭中平(国家药典委员会,北京100061)摘要:生物技术产业的快速发展推动了生物技术产品国家标准的不断提升。
本文介绍了《中国药典》2020年版(三部)生物技术产品及相关通用技术要求的增修订概况,阐释了增修订的考量和特点,旨在为正确理解和执行生物技术产品国家标准提供参考。
关键词:生物技术产品;国家标准;增修订中图分类号:R921 2 文献标识码:A 文章编号:1009-3656(2021)01-0005-05doi:10 19778/j chp 2021 01 001UpdatesandAmendmentsofBiotechnologyProductsintheChinesePharmacopoeia2020(VolumeⅢ)ZHAOXiong,WANGXiaojuan,CAOYan,GUOZhongping(ChinesePharmacopoeiaCommission,Beijing100061,China)Abstract:Therapiddevelopmentofthebiotechnologyindustryhaspromotedthecontinuousimprovementofnation alstandardsforbiotechnologyproducts TheupdatesandamendmentsofbiotechnologyproductsandgeneralrequirementsintheChinesePharmacopoeia2020(VolumeⅢ)areintroduced,andtheconsiderationsandcharac teristicsoftherevisionsareexplained Thataimstoprovideareferencefortheaccurateunderstandingandimple mentationofnationalstandardsforbiotechnologyproducts.Keywords:biotechnologyproducts;nationalstandards;updatesandamendments 生物技术产品是指采用生物技术制备的、临床上用于疾病治疗的大分子生物制品[1]。


2020年版药典中药材、中药饮片都有哪些新变化{{中国药典}}2020年版收载品种总数计划达到6400个左右,其中:中药增加品种约220个,化学药增加品种约420个,生物制品增加品种收载30个,药用辅料增加品种约100个,药包材品种收载30个,共约800个。
药典已收载品种计划修订1400个,其中:中药500个,化药600个,生物制品150个。
中药材标准的增修订中药材是中医临床和中药产业的根本,是基础中的基础,必须建立严格、科学的标准。
(一)品种的增加与退出(1)增加收载有临床用药需求、基础研究扎实、资源(野生和栽培)丰富的品种。
(2)增加收载现版药典收载或拟收载中成药处方药味中未收入药典的中药材标准。
(3)对于野生资源枯竭、商品匮乏、存在明显安全性、伦理等问题(如化石类、人类胎盘类、动物粪便类等),以及基础研究薄弱的品种从药典中退出或不再增加收入本版药典。
(4)已有中药材品种新增基原,原则上按照“新发现中药材”进行申报注册,获得批准后,可考虑作为新的基原收入药典,但经本草考证证明属于历史误用需要正本清源的品种不在此列。
(二)中药材名称、来源和药用部位的修订与规范根据本草考证,结合中药材生产实际,对部分中药材名称、来源和药用部位进行修订;对原植、动物的科、属、种和拉丁学名、原矿物的类、族和矿石进行进一步的考证,进一步修订和规范中药材的来源。
(三)中药材采收和加工方法及药材性状的修订当前,随着中药农业的快速发展,许多常用中药材已不再依赖野生资源,实现了大规模种植养殖,且采收和加工已相对集中,并逐步实现机械化。
中国药典要顺应中药产业的变革和进步,把好质量关,本版药典须对中药材采收和加工方法及药材性状进行修订。
(1)制定中药材采收加工技术评价方法和指导原则,把中药材采收和产地加工纳入科学化、法制化轨道。
(2)收载和规范中药材趁鲜切片直接干燥的产地加工方式。
其收载品种必须符合上述指导原则的要求,仅限于部分传统采收加工方法落后,药材难以干燥且长时间干燥过程中易霉变或导致成分明显下降的中药材以及对传统采用硫磺熏蒸改用产地无硫加工方法的中药材。

本版药典(三部)新增品种名单预防类•23价肺炎球菌多糖疫苗•无细胞百白破b型流感嗜血杆菌联合疫苗•黄热减毒活疫苗•冻干人用狂犬病疫苗(人二倍体细胞)•S a b i n株脊髓灰质炎灭活疫苗(V e r o细胞)•口服I型I I I型脊髓灰质炎减毒活疫苗(人二倍体细胞)治疗类•马破伤风免疫球蛋白F(a b')2•人凝血酶•人干扰素α2b阴道泡腾片•外用人粒细胞巨噬细胞刺激因子凝胶•康柏西普眼用注射液•精蛋白人胰岛素混合注射液(30R)•精蛋白人胰岛素混合注射液(50R)•甘精胰岛素•甘精胰岛素注射液•赖脯胰岛素•赖脯胰岛素注射液•治疗用卡介苗体外诊断类•人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法)•乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒1型核酸检测试剂盒二部转三部品种•人胰岛素•人胰岛素注射液•精蛋白人胰岛素注射液•注射用人生长激素本版药典(三部)采用生物制品通用名称与原通用名称对照本版药典(三部)新增的生物制品通则/总论/通则和指导原则名单一、新增的生物制品通则•生物制品通用名称命名原则二、新增的总论•人用聚乙二醇化重组蛋白及多肽制品总论•人用基因治疗制品总论•生物制品病毒安全性控制•螨变应原制品总论人用马免疫血清制品总论三、新增的通则和指导原则•3128抗毒素/抗血清制品分子大小分布测定法•3129单抗电荷变异体测定法•3130单抗N糖谱测定法•3208人血白蛋白铝残留量测定法(第二法)•3303鼠源性病毒检査法(第二法)•3307黄热减毒活疫苗猴体试验•3308禽源性病毒荧光定量P C R(Q-P C R)检查法•3407外源性D N A残留量测定法(第三法)•3428人免疫球蛋白类制品I g A残留量测定法•3429免疫化学法•3503人用狂犬病疫苗效价测定法(第二法)•3534S a b i n株脊髓灰质炎灭活疫苗效力试验•3535康柏西普生物学活性测定法•3601生物制品生产及检定用实验动物质量控制•3603重组胰蛋白酶•3650氢氧化铝佐剂•9401生物制品生物活性/效价测定方法验证指导原则•9402生物制品稳定性试验指导原则生物制品术语本版药典(三部)未收载2015年版药典(三部)及增补本中的品种名单治疗类•注射用重组链激酶体外诊断类•梅毒快速血桨反应素诊断试剂•梅毒甲苯胺红不加热血清试验诊断试剂。

主要特点和增修订内容2.1制剂通则论述框架和技术要求进一步完善2.1.1系统修订制剂通则整体框架0100制剂通则旨在通过对药物制剂的总体论述来指导医药工作者对不同剂型、亚剂型进行合理的应用。
《中国药典》2015年版制剂通则是《中国药典》2010年版中药、化学药和生物制品制剂通则的简单整合,缺少关键考察项的汇总和归纳。
为进一步引导生产企业全面关注制剂生产质量控制和整体要求,对0100制剂通则进行修订,主要修改包括两个方面:首先完善了叙述结构。
从药物制剂制备的原则“安全、有效、可控、依从性”的角度出发,增加对剂量单位均匀性、稳定性、安全性与有效性、剂型与给药途径、包装与贮藏和标签与说明书等部分的分论述;强调中药制剂在整个生产过程中的关键质量属性,关注每个关键环节的量值传递规律。
其次,完善了具体内容。
提出剂量单位均匀性的要求,保障制剂生产质量的批间和批内药物含量等的一致性,体现制剂全过程控制的理念;在稳定性中提出复检期概念,促进生产企业根据产品自身的稳定性特性进行前瞻性的质量考察;在安全性与有效性中提出“通过人体临床试验证明药物的安全有效性后,药物才能最终获得上市与临床应用”,提示上市制剂的处方和工艺不得随意变更。
2.1.2系统修订各制剂通则的框架和表述《中国药典》2020年版制剂通则统一了各剂型论述框架及主要制备技术的简单论述。
除0110糊剂及0186膏剂外,其他36个剂型均不同程度修订了体例格式。
为进一步统一目前各剂型的表述问题,规范统一“生产与贮藏期间应符合下列规定”项下内容,按照原辅料→工艺与技术→质量与控制→包装与使用→贮存与运输等五方面的技术要点,着重补充大多数剂型缺少的工艺与技术方面的阐述。
增加特殊亚剂型临床使用关注点,如泡腾片不得直接吞服等,指导临床合理用药。
2.1.3收载和整合临床成熟剂型和亚剂型收载和整合临床成熟剂型和亚剂型,体现《中国药典》的先进性和对我国临床成熟新制剂技术的支持。

2020年我国药典三部(简称2020年版药典)是我国医药行业的重要文献,对于保障人民群众用药安全、推动中医药现代化、促进行业发展具有重要意义。
本篇文章将通过对2020年版药典的全文内容进行介绍,分析其对医药行业的影响以及对公众健康的意义。
一、2020年版药典的编纂背景2020年版药典是我国药典的第三次修订,是在充分吸取前两次版本的经验基础上,结合我国医药行业发展的新需求和新情况而编写的。
本次修订共分为三部,分别是《中华人民共和国药典》、《我国药典附录》和《中华人民共和国药典补编》。
编纂工作由我国药典委员会牵头,全面深化对药品的审评审核工作,力求使药品质量更加稳定可靠。
二、2020年版药典的主要内容1. 《中华人民共和国药典》《中华人民共和国药典》是我国药典的主体部分,详细收录了临床常用的中成药和西药的药材、制药工艺、理化性质、炮制鉴别、贮藏和药用等内容。
在本次修订中,《中华人民共和国药典》在原有基础上新增了多种药材,并对中药鉴别、品质评价等内容进行了全面修订,以确保药品质量的稳定和可靠。
2. 《我国药典附录》《我国药典附录》是对《中华人民共和国药典》的补充和扩展,主要包括了罕用药材和一些外国传入的新药材等内容。
在本次修订中,《我国药典附录》增加了对罕用药材的详细描述和鉴别方法,以帮助临床上遇到少见药材时的鉴别和使用。
3. 《中华人民共和国药典补编》《中华人民共和国药典补编》是对已实施的《中华人民共和国药典》进行现代化补充的部分,主要内容包括对国际通用的一些新增药材和用药技术的收录。
在本次修订中,《中华人民共和国药典补编》新增了多种国际通用的药材和药物制剂制备技术,以满足医药行业对国际化交流合作的需求。
三、2020年版药典对医药行业的影响2020年版药典的发布对医药行业有一系列的积极影响。
它为医药企业提供了权威的药品质量标准,有助于规范药品生产和监管,提高药品的质量和安全性。
它促进了中医药传统药材的保护和利用,加强了对中药材的产地保护和质量控制,推动了中医药的国际化发展。

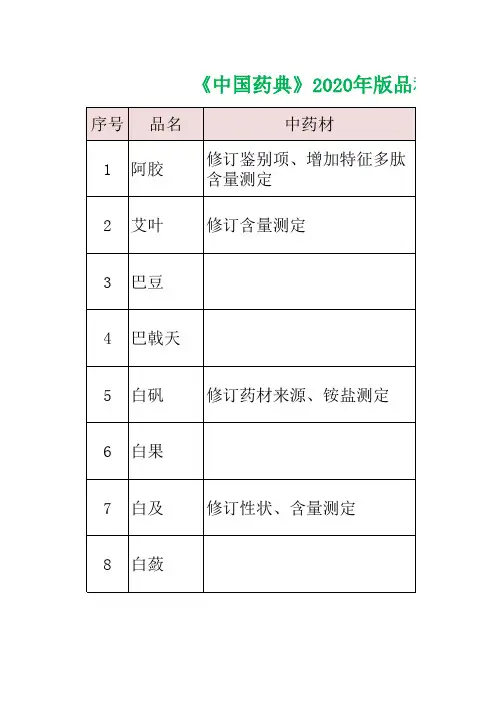
020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
新增了药材:裸花紫珠。
新增制剂:116个,具体清单如下:二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
2020年版药典二部新增品种(117个),与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。
具体清单如下:未收载品种(8个)本版药典(二部)未收载2015年版药典(二部)中的品种名单:•鱼肝油•重组人生长激素•注射用重组人生长激素•重组人胰岛素•重组人胰岛素注射液•精蛋白重组人胰岛素注射液•盐酸吡硫醇注射液•注射用盐酸吡硫醇新增品种(117个)本版药典(二部)新增品种名单:1.注射用门冬氨酸鸟氨酸2.马来酸氟伏沙明3.马来酸氟伏沙明片4.扎来普隆5.乌苯美司片6.丙戊酸钠缓释片(I)7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)8.丙酸氟替卡松9.左卡尼汀10.左甲状腺素钠11.左甲状腺素钠片12.右佐匹克隆13.右佐匹克隆片14.卡培他滨15.卡培他滨片16.甲钴胺片17.甲钴胺注射液18.甲磺酸多沙唑嗪19.甲磺酸多沙唑嗪片20.甲磺酸多沙唑嗪胶囊21.甲磺酸瑞波西汀22.甲磺酸瑞波西汀片23.甲磺酸瑞波西汀胶囊24.兰索拉唑肠溶胶囊25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)27.地红霉素肠溶片28.地红霉素肠溶胶囊29.西尼地平胶囊30.西吡氯铵31.西吡氯铵含漱液32.西咪替丁注射液33.西洛他唑片34.托拉塞米35.托拉塞米片36.托拉塞米胶囊37.注射用托拉塞米38.吗替麦考酚酯分散片39.伏格列波糖40.伏格列波糖片41.伏格列波糖胶囊42.米氮平43.米氮平片44.那他霉素45.那他霉素滴眼液46.坎地沙坦酯片47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]48.更昔洛韦胶囊49.来曲唑50.来曲唑片51.吲哚美辛片52.佐米曲普坦分散片53.阿托伐他汀钙54.阿利沙坦酯55.阿利沙坦酯片56.阿那曲唑片57.苯磺酸左氨氯地平58.苯磺酸左氨氯地平片59.拉西地平60.拉西地平片61.依巴斯汀62.依巴斯汀片63.草酸艾司西酞普兰64.草酸艾司西酞普兰片65.枸橼酸坦度螺酮66.枸橼酸坦度螺酮胶囊67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]68.枸橡酸钾颗粒69.氟尿苷(曾用名:氟脲苷)70.复方氨基酸(15)双肽(2)注射液71.美司钠72.美司钠注射液73.盐酸乙哌立松74.盐酸乙哌立松片75.盐酸左布比卡因76.盐酸左布比卡因注射液77.盐酸托烷司琼片78.盐酸托烷司琼胶囊79.盐酸曲普利啶80.盐酸伊达比星81.注射用盐酸伊达比星82.盐酸奈福泮胶囊83.盐酸度洛西汀84.盐酸度洛西汀肠溶片85.盐酸度洛西汀肠溶胶囊86.盐酸羟甲唑啉87.盐酸羟甲唑啉喷雾剂88.盐酸羟甲唑啉喷鼻液89.盐酸羟苄唑90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)91.盐酸奥布卡因92.盐酸奥布卡因滴眼液93.氨糖美辛肠溶片94.氨糖美辛肠溶胶囊95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)96.酒石酸溴莫尼定97.酒石酸溴莫尼定滴眼液98.酚磺乙胺99.注射用酚磺乙胺100.铝碳酸镁101.铝碳酸镁咀嚼片102.葡萄糖酸钙氯化钠注射液103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)] 104.氯沙坦钾105.氯沙坦钾片106.氯沙坦钾胶囊107.酮咯酸氨丁三醇108.酮咯酸氨丁三醇注射液109.腺苷110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]111.去氨加压素片(曾用名:醋酸去氨加压素片)112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)113.磷酸氟达拉滨114.注射用磷酸氟达拉滨115.磷酸腺嘌呤(曾用名:维生素b4)116.磷酸腺嘌呤片(曾用名:维生B4片)117.碘帕醇注射液三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。

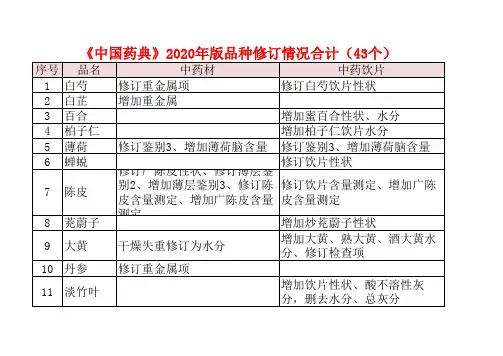

无菌检查法,逐字对比20版药典变化无菌检查的定义及无菌检查的适用条件无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器械、原料、辅料及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供拭品中微生物的检出。
单向流空气区域、工作台面及受控环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。
培养基的制备及培养条件培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基或成品培养基商品化的预制培养基。
胰酪胨 1.50g氯化钠 2.5g酵母浸出粉 5.0g葡萄糖/无水葡萄糖 5.5g/5.0g新配制的0.1% 刃天青溶液 1.0mlL-胱氨酸0.5g琼脂 0.75g硫乙醇酸钠 0.5g水 1000ml(或硫乙醇酸)(0.3ml)除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节PH为弱碱性,煮沸,滤清,加人葡萄糖和刃天青溶液,摇匀,调节PH, 使灭菌后在25℃的PH值为7.1土0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。
灭菌。
2、胰酪大豆胨液体培养基▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化3、中和或灭活用培养基按上述硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基的处方及制法,在培养基灭菌前或使用前加人适宜的中和剂、灭活剂或表面活性剂,其用量同方法适用性试验。
4、0.5 %葡萄糖肉汤培养基(用于硫酸链霉素等抗生素的无菌检查)▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化5、胰酪大豆胨琼脂培养基▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化6、沙氏葡萄糖液体培养基▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化7、沙氏葡萄糖琼脂培养基▲该项目下2020版药典四部通则与2015版药典四部通则内容无变化培养基的适用性检查无菌性检查每批培养基一般随机取不少5支(瓶),置各培养基规定的温度培养14天,应无菌生长。
中华人民共和国药典是我国药物监管部门颁布的国家药典,是指导我国从事药品生产、质量控制的基本依据。
《中华人民共和国药典》的出版对于我国药品行业的规范化发展、药品质量的提高具有重要意义。
2020年版的《中华人民共和国药典》于近期发布,该版本的药典内容和标准有哪些变化?对于医药行业和用户来说有哪些影响?本文将对2020年版《中华人民共和国药典》进行解读,分析其对于行业、企业和用户的意义和影响。
一、《中华人民共和国药典》的历史和意义《中华人民共和国药典》是我国肩负国家药物标准化工作的基本依据和权威性标准,是指导药品质量的主要依据。
从1949年首次颁布开始,我国的药典编纂工作经历了多次修订和更新,不断完善和发展。
每个版本的《中华人民共和国药典》都在保留传统中药基础上,不断增加现代药物的种类和标准。
它的出版不仅对于我国药品质量的保障、国际间药品贸易具有重要意义,同时也对于世界药品监管的发展有一定的影响。
二、2020年版《中华人民共和国药典》的主要内容和标准变化1. 基本药物标准的修订:2020年版《中华人民共和国药典》在基本药物标准的编制上有了新的变化,增补了一些新的常用药物的标准,同时修订了一些旧版药典中的标准内容,以适应医疗技术的发展和药品质量的提高。
2. 草药材的鉴别标准更新:在《中华人民共和国药典》中,草药材的鉴别标准一直是一个重要的内容,对于保障中药质量和药效具有重要意义。
2020年版药典对于一些常用的中药材的鉴别标准进行了修订和更新,增加了一些新的鉴别方法和技术。
3. 药物质量监管的新要求:随着医药技术和质量监管标准的不断提高,2020年版《中华人民共和国药典》对于药物质量监管的要求也有了一些新的变化和更新,增加了对于药品生产、贮藏、运输等过程中的质量控制要求,提高了对于药品质量的监管标准。
三、2020年版《中华人民共和国药典》对于医药行业和用户的影响1. 对于医药企业的影响:2020年版《中华人民共和国药典》对于医药生产企业的影响主要体现在药品生产过程中的质量控制要求和技术标准的更新。
2020年版药典二部新增品种(117个),这个数字很巧合,与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。
未收载品种(8个)本版药典(二部)未收载2015年版药典(二部)中的品种名单•鱼肝油•重组人生长激素•注射用重组人生长激素•重组人胰岛素•重组人胰岛素注射液•精蛋白重组人胰岛素注射液•盐酸吡硫醇注射液•注射用盐酸吡硫醇名称变化品种(5个)新增品种(117个)本版药典(二部)新增品种名单1.注射用门冬氨酸鸟氨酸2.马来酸氟伏沙明3.马来酸氟伏沙明片4.扎来普隆5.乌苯美司片6.丙戊酸钠缓释片(I)7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)8.丙酸氟替卡松9.左卡尼汀10.左甲状腺素钠11.左甲状腺素钠片12.右佐匹克隆13.右佐匹克隆片14.卡培他滨15.卡培他滨片16.甲钴胺片17.甲钴胺注射液18.甲磺酸多沙唑嗪19.甲磺酸多沙唑嗪片20.甲磺酸多沙唑嗪胶囊21.甲磺酸瑞波西汀22.甲磺酸瑞波西汀片23.甲磺酸瑞波西汀胶囊24.兰索拉唑肠溶胶囊25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)27.地红霉素肠溶片28.地红霉素肠溶胶囊29.西尼地平胶囊30.西吡氯铵31.西吡氯铵含漱液32.西咪替丁注射液33.西洛他唑片34.托拉塞米35.托拉塞米片36.托拉塞米胶囊37.注射用托拉塞米38.吗替麦考酚酯分散片39.伏格列波糖40.伏格列波糖片41.伏格列波糖胶囊42.米氮平43.米氮平片44.那他霉素45.那他霉素滴眼液46.坎地沙坦酯片47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]48.更昔洛韦胶囊49.来曲唑50.来曲唑片51.吲哚美辛片52.佐米曲普坦分散片53.阿托伐他汀钙54.阿利沙坦酯55.阿利沙坦酯片56.阿那曲唑片57.苯磺酸左氨氯地平58.苯磺酸左氨氯地平片59.拉西地平60.拉西地平片61.依巴斯汀62.依巴斯汀片63.草酸艾司西酞普兰64.草酸艾司西酞普兰片65.枸橼酸坦度螺酮66.枸橼酸坦度螺酮胶囊67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]68.枸橡酸钾颗粒69.氟尿苷(曾用名:氟脲苷)70.复方氨基酸(15)双肽(2)注射液71.美司钠72.美司钠注射液73.盐酸乙哌立松74.盐酸乙哌立松片75.盐酸左布比卡因76.盐酸左布比卡因注射液77.盐酸托烷司琼片78.盐酸托烷司琼胶囊79.盐酸曲普利啶80.盐酸伊达比星81.注射用盐酸伊达比星82.盐酸奈福泮胶囊83.盐酸度洛西汀84.盐酸度洛西汀肠溶片85.盐酸度洛西汀肠溶胶囊86.盐酸羟甲唑啉87.盐酸羟甲唑啉喷雾剂88.盐酸羟甲唑啉喷鼻液89.盐酸羟苄唑90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)91.盐酸奥布卡因92.盐酸奥布卡因滴眼液93.氨糖美辛肠溶片94.氨糖美辛肠溶胶囊95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)96.酒石酸溴莫尼定97.酒石酸溴莫尼定滴眼液98.酚磺乙胺99.注射用酚磺乙胺100.铝碳酸镁101.铝碳酸镁咀嚼片102.葡萄糖酸钙氯化钠注射液103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)]104.氯沙坦钾105.氯沙坦钾片106.氯沙坦钾胶囊107.酮咯酸氨丁三醇108.酮咯酸氨丁三醇注射液109.腺苷110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]111.去氨加压素片(曾用名:醋酸去氨加压素片)112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)113.磷酸氟达拉滨114.注射用磷酸氟达拉滨115.磷酸腺嘌呤(曾用名:维生素b4)116.磷酸腺嘌呤片(曾用名:维生B4片)117.碘帕醇注射液。
医疗器械2020版新药典与2015版药典变化《中国药典》每五年修订一次,2020版《中国药典》是第十一版药典,现在已经发布并将于2020年12月1日正式实施。
针对2020版《中国药典》的更新,作为医疗器械企业关注的纯化水、无菌检查和微生物计数,我们对比了2015版和2020版《中国药典》中关于纯化水、无菌检查和微生物计数的项目供大家参考。
1.2015版和2020版《中国药典》中纯化水、注射用水、灭菌注射用水的对比2015版和2020版《中国药典》中对于纯化水、注射用水、灭菌注射用水的要求没有变化,企业可根据原有的质量管理体系文件规定继续执行。
2.2015版和2020版《中国药典》中无菌检查和微生物计数法的对比.2015版和2020版《中国药典》中对于无菌检查和微生物计数法的主要变化详见后文附表,对于此次的变化我们将其分为:【一般变更】(企业需根据变化修改内部的检验文件)和【重要变更】(企业除了需根据变化修改内部的检验文件外,需更多的关注实际操作的变化),具体内容如下:a.①“医疗器具”改为“医疗器械”:《中国药典》对于医疗器械的适用性;【一般变更】②“监控”改为“监测”:除了对洁净环境进行日常监测外,无菌检查时还应对洁净工作台的沉降菌进行监测;【一般变更】b.制备好的培养基“密闭容器”保存改为“无菌密闭容器”,保存时间由“一般可在一年内使用”改为“经验证的保存期内使用”:企业可根据保存需要对制备好的培养基的保存期进行验证,经验证后方能按验证的保存期对制备好的培养基进行保存使用;【重要变更】c. “1/5”改为“1/3”:在供试品接种前,需检查硫乙醇酸盐流体培养基氧化层的高度,确保氧化层的高度不得超过培养基深度的1/3;【重要变更】d.新增“马铃薯葡萄糖琼脂培养基”:用于黑曲霉的培养;【重要变更】e.增加“和确认”:采购的菌种应采用适宜的菌种保藏技术进行保存,定期转种传代,并对其纯度、特性等进行确认,以保证试其生物学特性;【重要变更】f.①白色念珠菌的新鲜培养物培养时间“24〜48小时”改为“2〜3天”:增加培养时间更利于白色念珠菌的生长,获取所需的菌种新鲜培养物;【重要变更】②“每1ml含菌数小于100cfu(菌落形成单位)的菌悬液”改为“适宜浓度菌悬液”:企业可根据实际菌悬液的浓度进行操作,不再强制要求1ml菌悬液的含菌数小于100cfu;【一般变更】③“20〜25℃培养5〜7天”改为“20〜25℃培养5〜7天或直到获得丰富的孢子”;“3〜5ml”改为“适量”:不再强制要求黑曲霉洗脱液的容量和增加培养时间都为了确保最终能获取足够的黑曲霉孢子;【重要变更】④“0.9%无菌氯化钠溶液”改为“含0.05% (ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液”:更利于黑曲霉孢子的洗脱;【重要变更】⑤“每1ml含孢子数小于100cfu的孢子悬液”改为“适宜浓度的孢子悬液”:企业可根据实际孢子悬液的浓度进行操作,不再强制要求1ml孢子悬液的含孢子数小于100cfu;【一般变更】g.①“每管装量为12ml”“每管装量为9ml”改为“适宜装量”:不再强制要求培养基的每管装量;【一般变更】②“小于100cfu”改为“不大于100cfu”:不再强制要求接种的菌种数量小于100cfu;【一般变更】③培养时间“3天”“5天”改为“接种细菌的培养管培养时间不超过3天,接种真菌的培养管培养时间不得超过5天”:企业可根据实际细菌和真菌的生长情况选择培养时间;【重要变更】h. “滤清”改为“必要时滤过使澄清”:企业可根据需求选择是否需要滤过澄清;【一般变更】i.①“小于100cfu”改为“不大于100cfu”:不再强制要求加入的试验菌数量小于100cfu;【一般变更】j.②“加硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基至滤筒内”改为“加培养基至滤筒内,接种金黄色葡萄球菌、大肠埃希菌、生孢梭菌的滤筒内加硫乙醇酸盐流体培养基;接种枯草芽孢杆菌、白色念珠菌、黑曲霉的滤筒内加胰酪大豆胨液体培养基”:明确接种不同菌种对应的培养基,更利于企业实际操作;【一般变更】k. “培养72小时”改为“培养不超过5天”:增加阳性对照菌的培养时间,确保某些生长较慢阳性菌的生长,更利于阳性对照结果的判断;【重要变更】l. “消毒液”改为“方法”:不再强制要求用消毒液对供试品容器表面进行消毒,企业可选择适用于实际的消毒方法对供试品容器表面进行消毒;【一般变更】m.①增加“若使用其他尺寸的滤膜,应对稀释液和冲洗液体积进行调整,并重新验证”:企业可选择其他尺寸的滤膜,但需对稀释液和冲洗液体积进行调整,并重新进行方法验证;【一般变更】②“总冲洗量不得超过1000ml”改为“总冲洗量一般不超过500ml,最高不得超过1000ml”:减少了每张滤膜的总冲洗量,但也考虑到产品的差异性,给定了最高冲洗量的限定;【重要变更】n.①“温度不得超过44°C”改为“加热温度一般不超过40℃,最高不得超过44℃”:降低了溶于十四烷酸异丙酯的膏剂和黏性油剂供试品的加热温度,但也给定了最高加热温度的限定;【一般变更】②增加“或其他适宜的灭菌方法”:除了薄膜过滤法过滤除菌,企业可选择其他灭菌方法制备十四烷酸异丙酯;【一般变更】o.增加“采用专用设备将供试品转移至封闭式薄膜过滤器中”、“迅速消毒供试品开启部位或阀门,正置容器,用无菌钢锥或针样设备以无菌操作迅速在与容器阀门结构相匹配的适宜位置钻一小孔,钻孔后应无明显抛射剂抛出,轻轻转动容器,使抛射剂缓缓释出”和“必要时用冲洗液冲洗容器内壁”:增加具体的操作细节,更利于企业实际操作;【一般变更】p. “同时应采用适宜的方法进行包装中所配带的无菌针头的无菌检查”改为“同时应采用适宜的方法对包装中所配带的针头等要求无菌的部件进行无菌检查”:增加了供试品中其他的无菌部件的无菌检查要求;【一般变更】q. “同时应采用直接接种法进行包装中所配带的针头的无菌检査”改为“同时应采用适宜的方法对包装中所配带的针头等要求无菌的部件进行无菌检查”:增加了供试品中其他的无菌部件的无菌检查要求,不再强制要求用直接接种法进行无菌部件的无菌检查;【一般变更】r.①“培养14天”改为“培养不少于14天”“培养3天”改为“将原始培养物和新接种的培养基继续培养不少于4天”:根据药典要求,如在加入供试品后或在培养过程中,培养基出现浑浊,培养14天后,不能从外观上判断有无微生物生长,可取该培养液不少于1ml转种至同种新鲜培养基中,将原始培养物和新接种的培养基继续培养不少于4天,因此原始培养物的培养改为不少于14天更合适;【重要变更】②“逐日观察”改为“定期观察”:不再强制要求逐日观察,企业可根据实际需求确定观察周期;【一般变更】s.删除“阳性对照管应生长良好,阴性对照管不得有菌生长。