15版药典变化
- 格式:docx
- 大小:37.62 KB
- 文档页数:8

《中国药典》2015年版制剂通则变化⽐较《中国药典》2015年版制剂通则变化⽐较2015年版《中国药典》⽆论是在品种收载、标准增修订幅度、检验⽅法完善、检测限度设定,还是在标准体系的系统完善、质控⽔平的整体提升都上了⼀个新的台阶。
通过学习、熟悉2015 年版《中国药典》制剂通则的变化,了解⽬前我国⽤药⽔平、制药⽔平和监管⽔平现状,解读未来我国药品⾏业的趋势。
学习重点:熟悉药典制剂通则,掌握其标准的提升。
第⼀部分制剂通则⽐较2015年版《中国药典》已于2015年6⽉5⽇由国家⾷品药品监督管理总局正式颁布,于2015年12⽉1⽇正式实施。
新版药典是国家药品标准的组成部分,是国家药品标准体系的核⼼。
按照党中央提出的“四个最严”要求,新版药典的制修订始终坚持“科学、先进、实⽤、规范”的原则,依据试验数据、研究结果、专家评估,体现药典编制的科学性和严谨性,以持续改进提⾼药品质量。
新版药典的颁布标志着我国⽤药、制药以及监管⽔平的全⾯提升,将促进药品质量的整体提⾼,对于保障公众⽤药安全有效意义重⼤。
《中国药典》2015年版进⼀步扩⼤药品品种的收载和修订,共收载品种5608种。
其中,⼀部收载品种2598种,⼆部收载品种2603种,三部收载品种137种。
本版药典是将三部药典的附录合⼀,加强共性的系统化、完善化及规范化,新版《中国药典》的附录调整为凡例、通则与⽅法、指导原则、药⽤辅料等单独成卷,为第四部。
第四部的名称为“《中国药典》2015 年版总则”,包括现有药典⼀部、⼆部、三部的附录(现改为“通则”)内容和药⽤辅料品种正⽂。
⼀、《中国药典》2015 年版总则(四部)项⽬组成:1、前⾔2、第⼗届药典委员会委员名单3、⽬录4、中国药典沿⾰5、品种及通则变化名单6、凡例(三部合⼀)7、品名⽬次(保留笔画索引,品种正⽂拟改为按拼⾳排序)8、通则(原药典附录内容):包括导引图、制剂通则、通⽤⽅法/检测⽅法及指导原则9、附表:包括原⼦量表、国际单位换算表及新旧附录/通则编码对照表10、药⽤辅料品种正⽂(原收载于药典⼆部正⽂品种第⼆部分)11、总索引(中英⽂索引)⼆、修订说明1、使分类更加清晰明确,药典标准更加系统化、规范化将上⼀版药典中中药、化学药、⽣物制品三部分别收载的附录(凡例、制剂通则、分析⽅法、指导原则、药⽤辅料等)三合⼀,独⽴成卷作为第四部。


2015与2020年版药典的变化下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!药典是指用于规范和指导药品研制、生产、质量控制和使用的权威性标准。

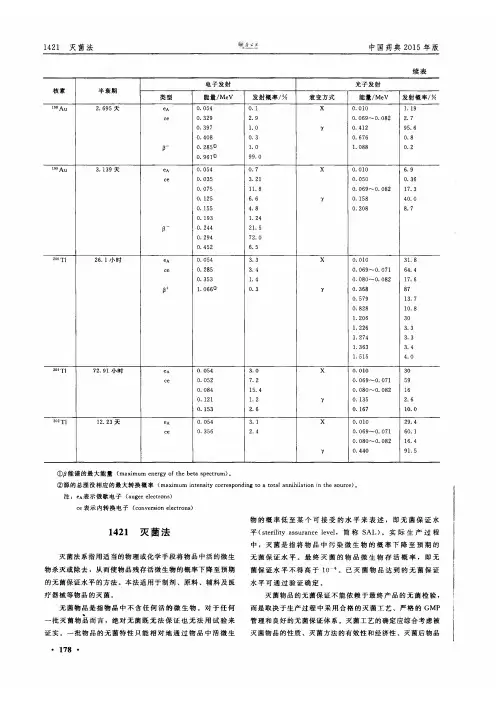
1421灭菌法中国药典2015年版续表核素半衰期电子发射光子发射类型能量/M e V发射概率/%衰变方式能量/M e V发射概率/% 198 A u 2. 695 天eA0. 0540. 1X0.010 1. 19ce0. 329 2. 90. 0690. 082 2. 70. 397 1. 070. 41295. 60. 4080. 30. 6760. 8r0. 285® 1. 0 1. 0880. 20. 961®99. 0199 A u 3.139天eA0.0540. 7X0.010 6. 9ce0. 035 3. 210. 0500. 360. 07511. 80. 0690. 08217. 30. 125 6. 6y0. 15840. 00.155 4. 80. 2088.70. 193 1. 24r0. 24421. 50. 29472. 00. 452 6. 5200 T126. 1小时eA0. 054 3. 3X0. 01031. 8ce0. 285 3. 40.0690. 07164. 40. 353 1. 40. 0800. 08217. 60+ 1.066®0. 3y0- 368870. 57913. 70. 82810. 81. 206301.226 3. 31. 274 3. 31. 363 3. 41. 515 4.0201 T|72. 91小时eA0. 054 3.0X0.01030ce0. 0527. 20.0690. 071590. 08415. 40. 0800. 082160. 121 1. 270. 135 2. 60.153 2. 60. 16710.0202 T112. 23 天eA0. 054 3. 1X0. 01029. 4ce0. 356 2. 40.0690.07160. 10‘ 0800_ 08216. 4y0. 44091. 5①卢能谱的最大能量(m a xim u m energy o f th e beta sp e ctru m)。

注释:红色带中间横线的文字表示在2020版药典删除了的2015版内容;蓝色字表示2020版药典新增加的。
9001 原料药物与制剂稳定性试验指导原则稳定性试验的目的是考察原料药物或制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药物或1批制剂进行;如果试验结果不明确,则应加试2个批次样品。
生物制品应直接使用3个批次。
加速试验与长期试验要求用3批供试品进行。
(2)原料药物供试品应是一定规模生产的。
供试品量相当于制剂稳定性试验所要求的批量,原料药物合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,至少是中试规模批次。
片剂至少应通常为100000片,胶囊剂至少应为100000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少通常应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(43)加速试验与长期试验所用供试品的包装应与拟上市产品一致。
(54)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(65)若由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的 3 批规模生产的产品仍需进行加速试验与长期稳定性试验。
(6)对包装在有通透性容器内的药物制剂应当考虑药物的湿敏感性或可能的溶剂损失。
(7)制剂质量的“显著变化”通常定义为:①含量与初始值相差5%;或采用生物或免疫法测定时效价不符合规定。

2015版中国药典微生物项变化的应对策略—厂房设施这篇的厂房设施写的重点不在设施改造,更着重于微生物实验室的厂房设施所创造的实验环境如何符合15版药典的管理要求。
在15版药典的指导原则中有两份指导原则有所提及,分别是9203《药品微生物实验室质量管理指导原则》中的“环境”项下及9205《药品洁净实验室微生物监测和控制指导原则》的内容。
一、微生物实验室的布局实验室布局的基本原则是既要最大可能防止微生物的污染,又要防止检验过程对环境及人员造成危害。
通常,实验室按功能划分为洁净区、活菌操作区和其他功能区,同时应根据实验目的,在时间和空间上有效分隔各类实验活动,将交叉污染的风险降到最低。
1、洁净区一般微生物实验室的洁净区设置有微生物限度检查洁净室及无菌检查洁净室,两个实验区域的空调系统应独立,微限操作有一定菌数数量级的样品,无菌操作有无菌的样品,本身实验概念上不同,必须设置专属的工作区域。
微生物限度检查洁净室的洁净级别药典要求是不低于D级背景下的B级单向流空气区域内进行,一般大家还是喜欢使用超净台作为实验台,根据10版药典的规定,实验室内微限室是达到C+A的水平,个人建议可以将微限室降级为D级洁净室,但是其空调系统的配制可达到C级净化水平,因为一方面更多的企业选择在无菌检查使用隔离器,也就是无菌检查室会倾向使用控制级别较低的D级洁净背景管理,便于统一管理;另外D级洁净室比C级的风量及相应的换气次数要低,可以降低能耗,节约洁净区运行成本。
在D级洁净室内置上超净台或生物安全柜均可,个人倾向生物安全柜,这也是中检所老师推荐的,理由就是既保护样品又保护实验人员,举个例子,有个公司的超净台是平流式的,正好生产的是促进胃动力的药品,生产车间使用超净台对产品进行操作的人员每天中午的饭量都很大,最后调查因为吸入药品粉末所致,其实这样的药品对于人并不算有太大影响,但是如果配制垂直流的生物安全柜并做成室外排风,那这样是不是更人性化呢,当然检品到实验室这一道其检验量原本就不多,对实验人员一般不会带来什么,但我更相信,在这样更科学化人性化的管理理念下,实验人员也会更认真的处理检品,这不就是企业希望带来的结果吗。


2015版药典主要的七个方面变化七大变化提升总体水平张伟表示,2015版药典主要有七个方面的变化:一是收载品种增幅达到27.4%。
2015版药典拟收载5800个品种,比2010版药典增加1200多个,修订品种751个。
二是通过药典凡例、通则、总论的全面增修订,从整体上进一步提升了对药品质量控制的要求,完善了药典标准的技术规定,使药典标准更加系统化、规范化。
三是健全了药品标准体系。
特别是药用辅料品种增加至260个,新增相关指导原则;在归纳、验证和规范的基础上实现了《中国药典》各部共性检测方法的协调统一。
四是2015版药典附录(通则)、辅料独立成卷,构成《中国药典》四部的主要内容。
五是药用辅料品种收载数量显著增加。
拟新增128个,共计260个,增长率高达97%。
六是安全性控制项目大幅提升。
中药:制定了中药材及饮片中二氧化硫残留量限度标准,推进建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准;加强对重金属以及中药材的有毒有害物质的控制等。
化学药:有关物质加强了杂质定性和定量测定方法的研究,实现对已知杂质和未知杂质的区别控制,优化抗生素聚合物测定方法,设定合理的控制限度,整体上进一步提高有关物质项目的科生物制品:增加相关总论的要求,严格生物制品全过程质量控制要求,以保证产品的安全有效性,同时增订“生物制品生产用原辅材料质量控制通用性技术要求”,加强源头控制,最大限度降低安全性风险等。
七是进一步加强有效性控制。
中药材加强了专属性鉴别和含量测定项设定。
化学药适当增加了控制制剂有效性的指标,研究建立科学合理的检查方法。
生物制品进一步提高效力测定检测方法的规范性,加强体外法替代体内法效力测定方法的研究与应用,保证效力测定方法的准确性和可操作性。
2015版<药典>中药材标准的变化新药典变化概述:1.药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
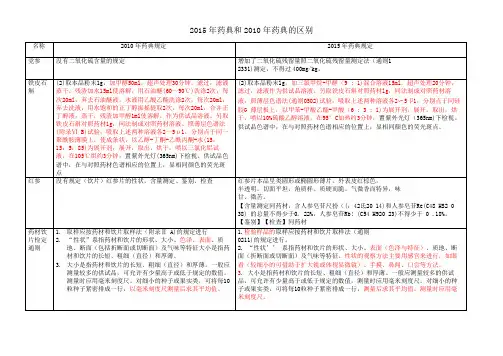

硝苯地平X iaoben dipingNifedipine一、三版药典内容提纲2015年:品名(包括中文名、汉语拼音、英文名)、有机药物结构式、化学名称、分子式与分子量、含量、性状、鉴别(化学法、紫外-可见分光光度法、红外光谱法)、检查(有关物质、干燥失重、炽灼残渣、重金属)、含量测定、类别、贮藏、制剂(硝苯地平片、硝中并没有写全,现今市售硝苯地平制剂主要有缓释片、控释片、胶囊、乳膏。
注射剂主要用于兽医方面。
此处应该可以更加完善。
2010年:品名(包括中文名、汉语拼音、英文名)、有机药物结构式、化学名称、分子式与分子量、含量、性状、鉴别(化学法、紫外-灼残渣、重金属)、含量测定、类别、贮藏、制剂(硝苯地平片、硝苯地平软胶囊、硝苯地平胶囊)2005年:品名(包括中文名、汉语拼音、英文名)、有机药物结构式、化学名称、分子式与分子量、含量、性状、鉴别(化学法、紫外-二、硝苯地平2010年与2005年版相对于2015年版的变化及优缺点如上标注之处即为变化之处:(1)在2015年药典中杂质2,6-二甲基-4-(2-硝基苯基)-3,5-吡啶二甲酸二甲酯与2,6-二甲基-4-(2-亚硝基苯基)-3,5-吡啶二甲酸二甲酯的化学式、分子量、结构直接附在制剂之后,一目了然,是一大改进。
(2)在这三版药典的检查项中针对硝苯地平有关物质的检查有所变化:都是采用高效液相色谱法以峰面积计算看是否符合杂质限量。
①2015年相对于10年版药典相比少了调节灵敏度这步。
10年中是,取对照品溶液20μL,注人液相色谱仪使硝苯地平色谱峰高约为满量程的50%。
这步增加了检查有关物质的灵敏性,使检查结果更可靠。
②2005年与2010年版药典相比变化更大:进样的对照品浓度不同(2005年版是每1ml中含样品、杂质Ⅰ、Ⅱ各2μg;2010年是每1ml中含样品、杂质Ⅰ、Ⅱ各1mg、10μg、10μg);调节灵敏度的要求不一样(2005年中是,取对照品溶液20μL,注人液相色谱仪使杂质A和B色谱峰高约为满量程的20%);杂质限量要求也不一样(2010年版是:供试品溶液的色谱图中如有与杂质I 峰、杂质II峰保留时间一致的色谱峰,按外标法以峰面积计算,均不得过0.1 % ;其他单个杂质峰面积不得大于对照溶液中硝苯地平峰面积(0.2% );杂质总量不得过0.5%。
关于《中国药典》2015年版实施公告有关问题的解读时间: 2015-12-03 14:37:03各有关单位:为进一步做好《中国药典》2015年版药典实施工作,经商国家食品药品监督管理总局药品化妆品注册管理司,现就部分药品生产企业和监管部门反馈的涉及新版药典执行的有关问题做进一步解释和明确(见附件),以便正确理解和执行国家食品药品监督管理总局关于实施《中华人民共和国药典》2015年版有关事宜的公告(2015年第105号)的有关要求。
各有关单位在《中国药典》2015年版执行过程中,可随时将遇到的问题和相关建议反馈我委。
我委将对反映比较集中的问题,会同有关部门协商后,在“2015年版药典实施专栏”中予以统一答复。
附件:关于《中国药典》2015年版实施公告有关问题的解读(一).doc《中国药典》2015年版实施公告有关问题的解读(一)1.问:国家食品药品监督管理总局关于实施《中华人民共和国药典》2015年版(以下简称“2015年版药典”)有关事宜的公告(以下简称“公告”)(2015年第105号)中规定,为符合2015年版药典而需进行补充申请的,应在2015年12月1日前进行申报,2015年12月1日后是否仍可提交相应补充申请?答:对2015年版药典发布前已上市药品,生产企业应在2015年12月1日前完成原标准与新版药典相关要求的研究和比对,并应按公告要求进行相应的备案或补充申报。
2015年12月1日以后仍可以提交相应补充申请。
2.问:企业的注册标准已经对2010年版药典相关品种进行评估的,且2010年版与2015年版药典品种质量标准和检测方法无变化的,是否需要重新对产品进行评估?答:虽然品种正文内容与2015年版药典品种规定无变化,但由于2015年版药典通用性要求,包括凡例、通则、制剂通则以及通用性检验方法等进行了全面的增修订,因此,生产企业仍需针对2015年版药典通用性要求方面对本产品进行相应的评估。
医疗器械2020版新药典与2015版药典变化《中国药典》每五年修订一次,2020版《中国药典》是第十一版药典,现在已经发布并将于2020年12月1日正式实施。
针对2020版《中国药典》的更新,作为医疗器械企业关注的纯化水、无菌检查和微生物计数,我们对比了2015版和2020版《中国药典》中关于纯化水、无菌检查和微生物计数的项目供大家参考。
1.2015版和2020版《中国药典》中纯化水、注射用水、灭菌注射用水的对比2015版和2020版《中国药典》中对于纯化水、注射用水、灭菌注射用水的要求没有变化,企业可根据原有的质量管理体系文件规定继续执行。
2.2015版和2020版《中国药典》中无菌检查和微生物计数法的对比.2015版和2020版《中国药典》中对于无菌检查和微生物计数法的主要变化详见后文附表,对于此次的变化我们将其分为:【一般变更】(企业需根据变化修改内部的检验文件)和【重要变更】(企业除了需根据变化修改内部的检验文件外,需更多的关注实际操作的变化),具体内容如下:a.①“医疗器具”改为“医疗器械”:《中国药典》对于医疗器械的适用性;【一般变更】②“监控”改为“监测”:除了对洁净环境进行日常监测外,无菌检查时还应对洁净工作台的沉降菌进行监测;【一般变更】b.制备好的培养基“密闭容器”保存改为“无菌密闭容器”,保存时间由“一般可在一年内使用”改为“经验证的保存期内使用”:企业可根据保存需要对制备好的培养基的保存期进行验证,经验证后方能按验证的保存期对制备好的培养基进行保存使用;【重要变更】c. “1/5”改为“1/3”:在供试品接种前,需检查硫乙醇酸盐流体培养基氧化层的高度,确保氧化层的高度不得超过培养基深度的1/3;【重要变更】d.新增“马铃薯葡萄糖琼脂培养基”:用于黑曲霉的培养;【重要变更】e.增加“和确认”:采购的菌种应采用适宜的菌种保藏技术进行保存,定期转种传代,并对其纯度、特性等进行确认,以保证试其生物学特性;【重要变更】f.①白色念珠菌的新鲜培养物培养时间“24〜48小时”改为“2〜3天”:增加培养时间更利于白色念珠菌的生长,获取所需的菌种新鲜培养物;【重要变更】②“每1ml含菌数小于100cfu(菌落形成单位)的菌悬液”改为“适宜浓度菌悬液”:企业可根据实际菌悬液的浓度进行操作,不再强制要求1ml菌悬液的含菌数小于100cfu;【一般变更】③“20〜25℃培养5〜7天”改为“20〜25℃培养5〜7天或直到获得丰富的孢子”;“3〜5ml”改为“适量”:不再强制要求黑曲霉洗脱液的容量和增加培养时间都为了确保最终能获取足够的黑曲霉孢子;【重要变更】④“0.9%无菌氯化钠溶液”改为“含0.05% (ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液”:更利于黑曲霉孢子的洗脱;【重要变更】⑤“每1ml含孢子数小于100cfu的孢子悬液”改为“适宜浓度的孢子悬液”:企业可根据实际孢子悬液的浓度进行操作,不再强制要求1ml孢子悬液的含孢子数小于100cfu;【一般变更】g.①“每管装量为12ml”“每管装量为9ml”改为“适宜装量”:不再强制要求培养基的每管装量;【一般变更】②“小于100cfu”改为“不大于100cfu”:不再强制要求接种的菌种数量小于100cfu;【一般变更】③培养时间“3天”“5天”改为“接种细菌的培养管培养时间不超过3天,接种真菌的培养管培养时间不得超过5天”:企业可根据实际细菌和真菌的生长情况选择培养时间;【重要变更】h. “滤清”改为“必要时滤过使澄清”:企业可根据需求选择是否需要滤过澄清;【一般变更】i.①“小于100cfu”改为“不大于100cfu”:不再强制要求加入的试验菌数量小于100cfu;【一般变更】j.②“加硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基至滤筒内”改为“加培养基至滤筒内,接种金黄色葡萄球菌、大肠埃希菌、生孢梭菌的滤筒内加硫乙醇酸盐流体培养基;接种枯草芽孢杆菌、白色念珠菌、黑曲霉的滤筒内加胰酪大豆胨液体培养基”:明确接种不同菌种对应的培养基,更利于企业实际操作;【一般变更】k. “培养72小时”改为“培养不超过5天”:增加阳性对照菌的培养时间,确保某些生长较慢阳性菌的生长,更利于阳性对照结果的判断;【重要变更】l. “消毒液”改为“方法”:不再强制要求用消毒液对供试品容器表面进行消毒,企业可选择适用于实际的消毒方法对供试品容器表面进行消毒;【一般变更】m.①增加“若使用其他尺寸的滤膜,应对稀释液和冲洗液体积进行调整,并重新验证”:企业可选择其他尺寸的滤膜,但需对稀释液和冲洗液体积进行调整,并重新进行方法验证;【一般变更】②“总冲洗量不得超过1000ml”改为“总冲洗量一般不超过500ml,最高不得超过1000ml”:减少了每张滤膜的总冲洗量,但也考虑到产品的差异性,给定了最高冲洗量的限定;【重要变更】n.①“温度不得超过44°C”改为“加热温度一般不超过40℃,最高不得超过44℃”:降低了溶于十四烷酸异丙酯的膏剂和黏性油剂供试品的加热温度,但也给定了最高加热温度的限定;【一般变更】②增加“或其他适宜的灭菌方法”:除了薄膜过滤法过滤除菌,企业可选择其他灭菌方法制备十四烷酸异丙酯;【一般变更】o.增加“采用专用设备将供试品转移至封闭式薄膜过滤器中”、“迅速消毒供试品开启部位或阀门,正置容器,用无菌钢锥或针样设备以无菌操作迅速在与容器阀门结构相匹配的适宜位置钻一小孔,钻孔后应无明显抛射剂抛出,轻轻转动容器,使抛射剂缓缓释出”和“必要时用冲洗液冲洗容器内壁”:增加具体的操作细节,更利于企业实际操作;【一般变更】p. “同时应采用适宜的方法进行包装中所配带的无菌针头的无菌检查”改为“同时应采用适宜的方法对包装中所配带的针头等要求无菌的部件进行无菌检查”:增加了供试品中其他的无菌部件的无菌检查要求;【一般变更】q. “同时应采用直接接种法进行包装中所配带的针头的无菌检査”改为“同时应采用适宜的方法对包装中所配带的针头等要求无菌的部件进行无菌检查”:增加了供试品中其他的无菌部件的无菌检查要求,不再强制要求用直接接种法进行无菌部件的无菌检查;【一般变更】r.①“培养14天”改为“培养不少于14天”“培养3天”改为“将原始培养物和新接种的培养基继续培养不少于4天”:根据药典要求,如在加入供试品后或在培养过程中,培养基出现浑浊,培养14天后,不能从外观上判断有无微生物生长,可取该培养液不少于1ml转种至同种新鲜培养基中,将原始培养物和新接种的培养基继续培养不少于4天,因此原始培养物的培养改为不少于14天更合适;【重要变更】②“逐日观察”改为“定期观察”:不再强制要求逐日观察,企业可根据实际需求确定观察周期;【一般变更】s.删除“阳性对照管应生长良好,阴性对照管不得有菌生长。
2015版《药典》中药材标准的变化情况
新药典变化概述:
1.药典一部收载药材和饮片、植物油脂和提取物、成方制剂和单味制剂等,品种共计2598种,其中新增440种,修订517种,不收载7种。
2.重新建立规范的编码体系,并首次将通则、药用辅料单独作为《中国药典》四部。
3.完善了“药材和饮片检定通则”“炮制通则”和“药用辅料通则”。
4.制定了中药材及饮片中二氧化硫残留量限度标准,建立和完善重金属及有害元素、黄曲霉毒素、农药残留量等物质的检测限度标准。
5.中药材增加专属性的显微鉴别检查、特征氨基酸含量测定等。
6.不再新增处方中含羚羊角、豹骨、龙骨、龙齿等濒危物种和化石的中成药品种。
新药典增减药材情况:
新药典“性状”修订情况
新药典“显微鉴别”增加品种
三颗针、干漆、山楂、广金钱草、女贞子、马兜铃、天仙子、升麻、生姜、瓜子金、瓜蒌皮、老鹳草、西青果、红大戟、花椒、花蕊石、杜仲叶、豆蔻、牡蛎、余甘子、沙苑子、诃子、补骨脂、苦杏仁、苦楝皮、虎杖、知母、使君子、金果榄、金银花、鱼腥草、卷柏、油松节、韭菜子、骨碎补、钩藤、胖大海、夏枯草、浮萍、预知子、菊花、野木瓜、款冬花、棕榈、紫苏叶、紫苏梗、锁阳、蓝布正、槐角、锦灯笼、豨莶草、暴马子皮、薤白、瞿麦、翻白草新药典“检查”修订情况
二氧化硫残留量
通则规定,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得超过150mg/kg。
正文规定,山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛10味中药及其饮片的二氧化硫残留量不得超过400mg/kg。
农药残留量
15版药典新增以下8种药材的重金属限量规定。