有机化学重要反应和反应历程
- 格式:doc
- 大小:464.50 KB
- 文档页数:9



大学有机化学反应方程式总结重排反应反应方程式是有机化学中非常重要的一部分,它描述了化学反应中物质的转化过程。
在大学有机化学中,我们学习了各种各样的反应方程式,其中包括重排反应。
本文将对大学有机化学中的重排反应进行总结,介绍其机理和一些典型反应。
1. 环丙烷重排反应(C1C2速度放缓)在环丙烷分子中,碳原子1和碳原子2之间为一个甲基基团,环丙烷重排反应就是指这个甲基基团发生位移,形成其他异构体的过程。
环丙烷重排反应可以发生两种类型的重排:1,2-重排和1,3-重排。
1,2-重排:环丙烷中的甲基基团发生位移,形成丙烯和丙烯烷的异构体。
1,3-重排:环丙烷中的甲基基团发生位移,并且环丙烷的碳原子2和碳原子3之间的键断裂,形成丙烯和甲烯烷的异构体。
2.1-甲基移位反应1-甲基移位反应是指分子中一个碳原子上的甲基基团在反应中发生迁移,形成另一种异构体。
这种反应在很多有机化合物中都可以观察到,例如烷烃、烯烃等。
3. α,β-不饱和酮的Knoevenagel缩合反应Knoevenagel缩合反应是α,β-不饱和酮与活性甲基化合物(如甲醛、甲基丙烯酮等)在碱的催化下进行的加成反应。
这个反应的机理涉及羰基亲核加成和酸碱中和等步骤。
4. 列维架桥异构化反应列维架桥异构化反应发生在某些烯烃和孤立的单质金属之间的反应中。
该反应可以形成由金属和碳原子构成的稳定的配位化合物。
总结:大学有机化学中的反应方程式总结重排反应,包括环丙烷重排反应、1-甲基移位反应、α,β-不饱和酮的Knoevenagel缩合反应和列维架桥异构化反应等。
这些反应在有机合成中具有重要的地位,对于理解有机反应的机理和应用具有重要意义。
在学习和运用这些反应时,我们需要深入了解它们的机理,并且掌握相应的实验操作技巧。
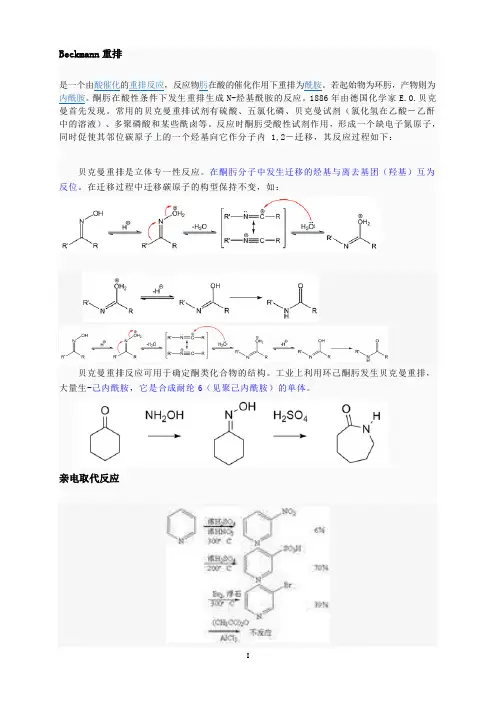
Beckmann重排是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
若起始物为环肟,产物则为内酰胺。
酮肟在酸性条件下发生重排生成N-烃基酰胺的反应。
1886年由德国化学家E.O.贝克曼首先发现。
常用的贝克曼重排试剂有硫酸、五氯化磷、贝克曼试剂(氯化氢在乙酸-乙酐中的溶液)、多聚磷酸和某些酰卤等。
反应时酮肟受酸性试剂作用,形成一个缺电子氮原子,同时促使其邻位碳原子上的一个烃基向它作分子内 1,2-迁移,其反应过程如下:贝克曼重排是立体专一性反应。
在酮肟分子中发生迁移的烃基与离去基团(羟基)互为反位。
在迁移过程中迁移碳原子的构型保持不变,如:贝克曼重排反应可用于确定酮类化合物的结构。
工业上利用环己酮肟发生贝克曼重排,大量生-己内酰胺,它是合成耐纶6(见聚己内酰胺)的单体。
亲电取代反应亲电取代反应一种亲电试剂取代其它官能团的化学反应,这种被取代的基团通常是氢,但其他基团被取代的情形也是存在的。
亲电取代是芳香族化合物的特性之一.芳香烃的亲电取代是一种向芳香环系,如苯环上引入官能团的重要方法。
其它另一种主要的亲电取代反应是脂肪族的亲电取代。
亲电加成反应亲电加成反应是烯烃的加成反应,是派电子与实际作用的结果。
派键较弱,派电子受核的束缚较小,结合较松散,因此的作为电子的来源,给别的反应物提供电子。
反应时,把它作为反应底物,与它反应的试剂应是缺电子的化合物,俗称亲电试剂。
这些物质又酸中的质子,极化的带正电的卤素。
又叫马氏加成,由马可尼科夫规则而得名:“烯烃与氢卤酸的加成,氢加在氢多的碳上”。
广义的亲电加成亲反应是由任何亲电试剂与底物发生的加成反应。
在烯烃的亲电加成反应过程中,氢正离子首先进攻双键(这一步是定速步骤),生成一个碳正离子,然后卤素负离子再进攻碳正离子生成产物。
立体化学研究发现,后续的卤素负离子的进攻是从与氢离子相反的方向发生的,也就是反式加成。
如丙烯与HBr的加成:CH-CH=CH+ HBr → CH-CHBr-CH2第一步,HBr电离生成H和Br离子,氢离子作为亲电试剂首先进攻C=C双键,形成这样的结构:第二步,由于氢已经占据了一侧的位置,溴只能从另外一边进攻。


自由基加成反应历程
自由基加成反应是一种重要的有机化学反应。
该反应是通过自由基的加成来形成新的化学键,并从而合成出新的化合物。
自由基加成反应的历程包括以下几个步骤:
1. 初始自由基生成:在反应条件下,通常是高温或光照条件下,开始加热或曝光反应物,产生自由基。
2. 自由基的扩散:自由基在反应体系中通过扩散的方式传递,
这是自由基反应的关键步骤之一。
3. 自由基的加成反应:反应物中的自由基通过加成反应形成化
学键,产生新的化合物。
4. 反应产物的形成:反应在一定时间内进行,产物逐渐形成。
反应结束后,通过适当的方法将产物从反应体系中提取出来。
自由基加成反应的历程中,自由基的稳定性和反应体系的温度、光照条件等因素对反应的速度和产物的生成都有着重要的影响。
因此,在实验室中进行自由基加成反应时,需要控制好反应条件,以实现高效的反应和良好的产物收率。
- 1 -。


重要的有机反应及类型 1.取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫取代反应。
(1)酯化反应:醇、酸(包括有机羧酸和无机含氧酸)(2)水解反应:卤代烃、酯、油脂、糖、蛋白质;水解条件应区分清楚。
如:卤代烃—强碱的水溶液;糖—强酸溶液;酯—无机酸或碱(碱性条件水解反应趋于完全);油脂—无机酸或碱(碱性条件水解反应趋于完全);蛋白质—酸、碱、酶。
C 2H 5Cl+H 2O ∆−−→−NaOH C 2H 5OH+HClCH 3COOC 2H 5+H 2O −−−→−无机酸或碱CH 3COOH+C 2H 5OH (3)硝化反应:苯、苯的同系物、苯酚(4)卤代反应:烷烃、苯,苯的同系物,苯酚、醇、饱和卤代烃等。
特点:每取代一个氢原子,消耗一个卤素分子,同时生成一个卤化氢分子。
2.加成反应:有机物分子里不饱和碳原子与其他原子或原子团直接结合生成新化合物的反应叫加成反应。
如烯烃与卤素、卤化氢或氢气、水的反应;炔烃与卤素、卤化氢或氢气的反应;苯与氢气的反应等。
3.氧化反应(1)与O 2反应①点燃:有机物燃烧的反应都是氧化反应. ②催化氧化:如:醇→醛(属去氢氧化反应);醛→羧酸(属加氧氧化反应)2C 2H 2+5O 2−−−−→−点燃4CO 2+2H 2O 2CH 3CH 2OH+O 2℃网550−−→−Ag 2CH 3CHO+2H 2O 2CH 3CHO+O 2℃~锰盐7565−−→− (2)使酸性高锰酸钾溶液褪色的反应在有机物中如:R —CH=CH 2、R—CCH 、 ROH (醇羟基)、R—CHO 、苯的同系物等都能使酸性高锰酸钾溶液褪色,发生的反应都属氧化反应。
(3)银镜反应和使Cu(OH)2转变成Cu 2O 的反应实质上都是有机物分子中的醛基(-CHO )加氧转变为羧基(—COOH )的反应.因此凡是含有醛基的物质均可发生上述反应(碱性条件).例如:含醛基的物质:醛、甲酸(HCOOH )、甲酸酯(HCOOR )、甲酸盐、葡萄糖、麦芽糖 。

有机化学反应历程1四.有机反应历程1.有机反应类型(1)加成反应亲电加成 C=C,C≡C;亲核加成 C=O, C≡C,C≡N;带有吸电⼦基团的加成C=C,如C=C-C=O,C=C-C≡N;⾃由基加成C=C。
(2)取代反应取代反应有三种:亲电取代,重要的是芳环上H 被取代;亲核取代,经常是⾮H原⼦被取代;⾃由基取代,重要的是α取代。
(3)消除反应主要是1,2-消除⽣成烯,也有1,1-消除⽣成碳烯。
(4)重排反应常见的是碳正离⼦重排或其它缺电⼦的中间体重排。
(5)周环反应包括电环化反应、环加成反应及σ迁移反应。
2.反应活性中间体主要活性中间体有其它活性中间体有碳烯R2C∶(卡宾Carbene)氮烯RN∶(乃春 Nitrene);苯炔(Benzyne)。
(1)⾃由基⾃由基的相对稳定性可以从C—H键离解能⼤⼩判别,键离解能越⼤,⾃由基稳定性越⼩。
如按稳定性次序排列R3C·>R2CH·>RCH2·>CH3·C—H键离解能(kJ/mol):380.7 395.4 410.0 435.1C6H5CH2·≈CH2=CH-CH2·>R3C·C—H键离解能(kJ/mol):355.6 355.5Ph3C·>Ph2CH·>PhCH2·Ph3C·为涡轮形,具有约30°夹⾓,因此稳定性不会⽐Ph2CH·⾼得很多,且易发⽣⼆聚形成酿式结构。
【例1】下列游离基哪⼀个最稳定?B.CH2=CHCH2· D.CH3·解:B。
(2)碳正离⼦含有带正电荷的三价碳原⼦的化合物叫碳正离⼦,它具有6个价电⼦,⼀般情况下是sp2杂化,平⾯构型,其稳定性次序为:任何使正电荷离域的条件都能稳定碳正离⼦。
孤电⼦对能分散正电荷故MeOCH2Cl溶剂解反应⽐CH3Cl快1014倍。
邻基效应⽣成桥式碳正离⼦芳⾹化稳定碳正离⼦,例如(3)碳负离⼦碳负离⼦是碳原⼦上带有负电荷的体系,其结构⼤多是⾓锥形sp3杂化构型,此构型使孤电⼦对和三对成键电⼦之间相斥作⽤最⼩。

Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 SN2 进行的分子内重排反应:反应实例Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。

化学有机化学重要反应机理归纳化学中,有机化学是一个重要的分支领域,涉及到有机物的构造、合成和变化等方面。
而有机化学的重要反应机理也是学习有机化学的关键所在。
本文将对有机化学中的一些重要反应机理进行归纳和讨论。
一、亲核取代反应机理亲核取代反应是有机化学中常见的反应类型,其机理通常由亲核试剂与底物发生取代反应而引起。
最常见的机理是亲核试剂攻击底物中的部分正离子,形成一个烷基或烯基化合物。
这种反应在有机合成中广泛应用,常用于功能团的引入和官能团的转化。
例如,在醇的酸催化下,亲核试剂氯化氢(HCl)可以取代醇中的羟基,生成相应的氯代烷。
2.亲电取代反应机理亲电取代反应是有机化学中另一种常见的反应类型,涉及到亲电试剂与底物之间的电子转移。
亲电试剂通常是带有亲电性的分子,如卤代烷、酸或碱等。
在亲电取代反应机理中,亲电试剂攻击底物中的亲电中心,生成一个新的化学键。
例如,溴代烷和氢氧根离子之间的反应是一个典型的亲电取代反应。
在这个反应中,溴离子攻击了溴代烷中的溴原子,形成醇和氢溴酸。
3.自由基取代反应机理自由基取代反应是一类基于自由基的反应机理。
在这种反应中,自由基反应物首先通过光或热能输入得到激发,然后断裂键,生成具有活性的自由基。
这些自由基会与其他分子发生反应,以使反应系统达到稳定状态。
一个典型的自由基取代反应是溴代烃的氢(H)取代反应。
在紫外光的照射下,溴代烃被激发成溴自由基,然后溴自由基与氢气反应生成氢溴酸。
4.加成反应机理加成反应是一种常见的有机反应类型,涉及到底物中的多个亲核中心或亲电中心与试剂发生加成反应,形成一个新的化学键。
例如,烯烃和氢气之间的加成反应是合成烷烃的一种重要方法。
在该反应中,烯烃中的双键被氢气加成,生成相应的烷烃。
5.消除反应机理消除反应是一种将底物中的两个官能团除去并形成新的双键或多键的反应类型。
它涉及到一个亲核试剂和一个酸或碱试剂。
例如,醇与酸发生消除反应时,醇中的羟基与酸反应,失去一个分子的水并形成双键。
Beckmann重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如反应实例Bouveault-Blanc还原反应机理反应实例Claisen-Schmidt反应一个无α-氢原子的醛与一个带有α-氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β-不饱和醛或酮:反应机理反应实例Claisen酯缩合反应二元羧酸酯的分子内酯缩合见Dieckmann 缩合反应。
反应机理:反应实例:Cope 消除反应反应机理反应实例Cope重排1,5-二烯类化合物受热时发生类似于O-烯丙基重排为C-烯丙基的重排反应(Claisen重排)反应称为Cope重排。
这个反应30多年来引起人们的广泛注意。
1,5-二烯在150—200℃单独加热短时间就容易发生重排,并且产率非常好。
Cope重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。
例如:内消旋-3,4-二甲基-1,5-己二烯重排后,得到的产物几乎全部是(Z, E)-2,6辛二烯:反应机理Cope重排是[3,3] -迁移反应,反应过程是经过一个环状过渡态进行的协同反应:在立体化学上,表现为经过椅式环状过渡态:反应实例Clemmensen还原醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用Wolff-Kishner-黄鸣龙反应还原。
反应实例Diels-Alder反应含有一个活泼的双键或叁键的化合物(亲双烯体)与共轭二烯类化合物(双烯体)发生1,4-加成,生成六员环状化合物:这个反应极易进行并且反应速度快,应用范围极广泛,是合成环状化合物的一个非常重要的方法。
Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺.迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
具有α—活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α—活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到季戊四醇:反应机理醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上.反应实例Claisen 酯缩合反应含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β—酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见Dieckmann缩合反应。
反应机理乙酸乙酯的α—氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pK a~15。
9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
1.自由基反应历程ctrl+A 全部选中,按ctrl+c 复制(自由基反应,通常指有机分子在反应中共价键发生均裂,产生自由基活性中间体,有自由基参加的反应即为自由基反应自由基通常有两种方式产生:1由光、热、或辐射提供能力,使分子共价键均裂产生自由基。
例如 Cl Cl 2Cl hv R C O O C R O O2R C O 2R CO 2 O2.通过氧化还原单电子转移产生H 2O 2Fe2HO OH Fe 3Ph COFe 3Ph C O H Fe 2H 前者更为多见。
共价键是否容易均裂,决定于该共价键的解离能,解离能越小越容易均裂,如-O-O-键解离能较小易均裂,所以过氧化物常作为均裂剂,在反应中何种部位易形成自由基,自由基反应速度大小,在很大程度上决定于生成自由基的稳定性。
自由基反应历程为一连锁反应,主要包括:链引发、链传递和链中止三个主要阶段2.烯烃及二烯烃亲电加成反应历程由于烯烃容易给出电子,也就易被亲电试剂进攻,凡缺电子的物种都多为亲电试剂,如正离子等。
这种对烯烃及二烯烃等由亲电试剂进攻发生的加成反应称为亲电加成反应。
烯烃亲电加成反应历程及立体化学可用如下通式表示: C C C CENuE Nu E EC CC C 反式加成Nu 具体反应按何种历程进行,因烯烃和亲电试剂不同而不同。
(1)烯烃与卤素的加成 首先卤素与c=c 经π络合物形成卤鎓离子,亲核的X-经反式加成生成产物,这在环状烯烃的加卤素反应中更为主要。
如果用溴水或氯水与C=C 键加成,则生成溴代醇或氯代醇,这是由于溴离子和水对溴鎓离子中间体的竞争反应而得到的。
如:H2C CH2H2C CH2BrH2Br 2B r H 2O H H2C CH2H2C CH2Br OH BrBr(2)烯烃与HX 的加成 加成历程:质子首先加成到碳碳双键电子云密度较高的碳上,形成较稳定的碳正离子,然后x-再加成上去,如果质子加成后生成的碳正离子不十分稳定,也可能发生重排,得到更稳定的碳正离子,生成取代或消除产物。
简述有机化学发展史
有机化学是化学中最具代表性的分支之一,它研究的是碳原子化学特性、结构、化学反应等。
有机化学是化学历史上的一个重要发展阶段,下面将分步骤阐述有机化学的发展史。
1. 前有机化学时期
前有机化学时期,人们对于化学反应的了解非常有限,更多的是在实
验中摸索。
其中最著名的两个人是黑尔姆霍兹和弗拉纳哥-拉埃尔。
黑
尔姆霍兹在1857年发表了一篇关于酸碱数的文章,弗拉纳哥-拉埃尔
则提出了结构化学的概念。
这些人的工作为后来有机化学的发展奠定
了基础。
2. 经典有机化学时期
经典有机化学时期主要发生在19世纪,大量的有机反应被发现。
其中
最著名的有机反应当属闵克说法。
这个说法认为碳的原子价仅为4,然而它仍可以与四个不同的官能团发生反应。
闵克的这个说法后来促进
了有机化学反应的研究,最终有机化学的发展从这里开始。
3. 现代有机化学时期
现代有机化学时期从20世纪初开始,它主要发展了有机分子结构分析
和有机催化剂。
这个时期的知名有机化学家有沃尔夫、范特霍夫、勃
拉格等人。
4. 21世纪的有机化学
21世纪的有机化学主要致力于绿色化学和有机电子化学。
这个时期的重要发展包括有机太阳能电池、有机场效应晶体管、液态晶体等等。
这些发展进一步扩展了有机化学的研究领域。
总之,有机化学的发展历程是一个取得了大量成就的历史过程,它让我们更好地了解了碳原子的化学特性,拓展了人类在化学领域的认识和应用。
有机化学反应历程怎么写
有机化学反应历程如下:
1、合成反应:主要是将两种或两种以上的有机物经过适当的反应条件,通过重组原子、分子结构,在原子、分子结合能的作用下,产生新的
化合物的反应。
2、有机氧化反应:有机物在氧化剂的作用下,经过氧化作用,生成
有机物的氧化物,是有机化学中最重要的反应之一。
3、改性反应:是将一种有机物,通过化学反应,用合适的试剂或添
加剂去改变其结构和性质,使其具有一定的新特性,以达到用途的反应。
4、加成反应:是指两种有机物在活性催化剂的作用下,共同参加反应,在分子结构上进行碳-碳键的形成,生成更具有官能团的更复杂的化
合物的反应。
5、取代反应:通过改变原有的原子或分子结构形成新的物质的反应,取代反应是有机物的合成中常见也重要的反应方式。
6、肝素反应:也叫分子内氯代加成反应,它是一种特殊的取代反应,其原理是通过格氏试剂将原有物质的氯原子取代掉,从而形成新的有机物
的反应。
有机化学重要反应和反应历程
摘要:有机化学(organic chemistry)是研究有机化合物的来源、制备、结构、性能、应用以及有关理论和方法学的科学,是化学学科的一个分支,它的研究对象是有机化合物。
有机化学是一系列相关工业的基础,在能源、材料、人口、环境、国防计划的实施中,在为推动科技发展、社会进步,提高人类的生活质量,改善人类的生存环境的努力中,已经并将继续显现出它的高度开创性和解决重大问题的巨大能力。
关键词: 有机化学;反应;机理:
一、取代反应
(一)、自由基取代
自由基反应包括连引发、连转移、链终止三个阶段。
由于键的均裂需要能量,所以连引发的阶段需要加热或者光照。
连转移阶段是由一个自由基变成另一个自由基的阶段,自由基不断的传递下去。
链终止是消失自由基的阶段,自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。
实例1:甲烷的氯化。
实例2:对甲氧基甲苯的氯化。
(二)、脂肪族化合物的亲核取代。
化合物分子中的原子和原子团被亲核实际取代的反应称为亲核取代反应。
用S N 表示,在反应中,受试剂进攻的对象称为第底物,亲核进攻试剂称为亲核试剂,在反应中离开的基团称为离去基团,与离去基团相连的碳原子称为中心碳原子,生成物称为产物。
在上述反应中,若受进攻的对象是饱和碳原子,则称此类反应为饱和碳原子上的亲核取代反应。
目前认为,脂肪族化合物的亲核取代中基本的历程有单分子亲核取代(SN1)和双分子亲核取代(SN2)两大类。
实例1:氯代烃双分子亲和取代的反应机理。
实例2:氯代烃单分子亲和取代的反应机理
(三)、脂肪族化合物的亲电取代。
脂肪亲电取代反应也可分为两种机制,即SE1和SE2,这与脂肪亲核取代反应可分为SN1和SN2是类似的。
进攻试剂本身已不具有获取电子倾向,反而有提供电子能力,如醇、-SH(巯)、胺基与炔反应时,是有提供电子能力的RO-(不是离子,未达到电离程度)先进攻炔键,称亲核加成。
实例1:脂的酸性水解历程。
实例2:烯胺的烷基化
(四)、芳香族化合物的亲电取代。
最常见的芳香取代如硝化、卤化以及付克反应(Friedel-Crafts Reaction) 均为亲电取代,比较经典的氯甲基化反应,图X所示。
布朗克反应(Blanc Reaction) 亦为芳香亲电取代反应。
实例1:苯的氯化反应。
实例2:苯的磺化反应。
(五)、芳香族化合物的亲核取代。
如果说亲电取代主要是取代芳环上的氢原子,则亲核取代更多是取代环上已有的取代基。
在这类取代反应中,进攻试剂为负离子或具孤对电子的中性分子。
芳香亲核取代则很少有人研究,比较权威的化学期刊上关于芳香亲核取代反应的文献寥寥无几,以至于当提到芳香取代反应的时候,人们第一印象就是硝化、卤化等亲电取代反应。
实例1:乙基格氏试剂取代甲氧基
实例2:醚键断裂
NO 2
OC 2H 5
NO
2
+
NH 2
NO 2
NO 2
H N
+
EtOH
二、多重键的加成
(一)
、碳碳多重键
加成反应可以按照环中间体机制、碳正离子中间体机制、离子对中间体
机制和三中心过渡态机理四种途径进行。
实例1:环戊烯与溴的加成
实例2:烯烃和氯化氢的反应
(二)碳杂多重键
实例1:杂环的形成
实例2:氰离子和酮的反应
三、消去反应
在一个有机分子中消去两个原子或者基团的反应称之为消除反应。
可以根据两个消去基团的相对位置将其分类,若两个消去基团连在同一个碳原子上,称为1,1-消除:两个消去基团连在两个相邻的碳原子上,则称为1,2-消除,两个消去基团连在1,3位碳原子上,则称为1,3消除。
实例1:醇的消除
实例2:溴代烷的消除
四、重排反应
若反应中分子的股价发生变化则称重排反应。
一般常见的重排是缺电子重排。
有机化学中常见的重排有1,2重排(迁移)、烯丙重排、芳环上重排、协同反应中重排等。
实例1:嚬呐醇重排
实例2:贝克曼重排
五、氧化还原反应
有机化学中的氧化和还原是指有机化合物分子中的碳原子和其他原子的氧化和还原,可根据氧化数的变化来确定,氧化书升高为氧化,氧化数降低为还原,氧化和还原是同时发生的,由于有机反应的属性是根据第五的变化来确定的,因此常常将有机分子中的碳原子数升高的反应称为氧化反应,碳原子氧化数降低的反应为还原反应。
有机反应中,多数氧化反应表现为分子中的氧增加或氢的减少,多数还原反应表现为分子中的氧的减少或氢的增加。
实例1:苯甲醛在空气中自动氧化成苯甲酸的反应历程
实例2:脂的双分子还原
六、结束语
有机反应若以键的键裂形式分类,一般分为三类:一类是键的异裂,为极性反应;另一类是链的均裂,为自由基历程;还有一类是键的断裂和生成同时进行,称作协同反应。
在极性反应中,反应试剂为提供电子的反应叫亲核反应;反应试剂为获取电子的反应。
高等有机化学中涉及的主要历程有:取代反应(脂肪族化合物的亲核取代、脂肪族化合物的亲电取代、芳香族化合物的亲核取代、芳香族化合物的亲电取代、自由基取代),多重键的加成(碳碳多重键、碳杂多重键),消去反应,重排反应,氧化还原反应。
19世纪中到20世纪初,有机化学工业逐渐变为以煤焦油为主要原料。
合成染料的发现,使染料、制药工业蓬勃发展,推动了对芳香族化合物和杂环化合物的研究。
30年代以后,以乙炔为原料的有机合成兴起。
40年代前后,有机化学工业的原料又逐渐转变为以石油和天然气为主,发展了合成橡胶、合成塑料和合成纤维工业。
由于石油资源将日趋枯竭,以煤为原料的有机化学工业必将重新发展。
当然,通过应用上述反应的合成过程来合成天然的动、植物和微生物体仍是重要的研究对象。
七、参考文献
[1] 田仕凯.醇的取代反应研究, 中国科学技术大学博士学位论文, 26-28.
[2] 陈丽涛, 肖鹤鸣, 肖继军. 甲苯定向硝化的理论研究. 化学学报.2003:61(8)1169-1174.
[3] 战长友. 芳环亲电取代反应中的电子效应及其影响. 广西广播电视大学学报. 2000,11(2):41-44.
[4] 司玉贵, 黄浩, 姜标. 末端炔烃对碳氧和碳氮双键的加成反应. 有机化学. 2010,24(11): 1389-1395.
[5] 王爱霞, 宋振雷, 高栓虎, 姜毅君, 袁道义, 涂永强, 李宁子. 苯并螺环β-溴代酮
Wagner-Meerwein重排反应研究及其在(±)-Colchicine形式合成中的应用. 有机化学.
2007,27(9): 1171-1175
[6] 吕秀阳, 任浩明, 李准. C02一高温液态水介质中的频那醇重排反应. 化工学报.2008,59(1): 96-100
[7] 沈晓莉, 陈中元, 严剑锋,尹玲飞. 法沃尔斯基重排反应及其新应用的研究. 杭州化工.
2006,36(2),20-23
[8] 杜大明, 陈晓, 花文廷. 离子液体介质中有机合成及不对称催化反应研究新进展. 有机
化学. 2003, 23(4):331-343。