炔烃和二烯烃说课材料
- 格式:doc
- 大小:1.15 MB
- 文档页数:21

课程名称:有机化学第六章 炔烃和二烯烃§6.1 炔 烃 一、炔烃的命名1 炔烃的系统命名法和烯烃相似,只是将“烯”字改为“炔”字。
2 烯炔(同时含有三键和双键的分子)的命名: (1)选择含有三键和双键的最长碳链为主链。
(2)主链的编号遵循链中双、三键位次最低系列原则。
(3)通常使双键具有最小的位次。
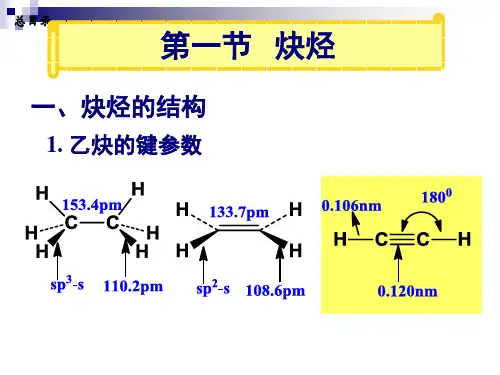
二、炔烃的结构与异构 1炔烃的结构最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。
现代物理方法证明,乙炔分子是一个线型分子,分之中四个原子排在一条直线上杂化轨道理论认为三键碳原子既满足8电子结构结构年 月 日 x0404-08≡C C H 0.106nm0.12nm180°课程名称:有机化学和碳的四价,又形成直线型分子,故三键碳原子成键时采用了SP 杂化方式 . 1 sp 杂化轨道杂化后形成两个sp 杂化轨道(含1/2 S 和1/2 P 成分),剩下两个未杂化的P 轨道。
两个sp 杂化轨道成180分布,两个未杂化的P 轨道互相垂直,且都垂直于sp 杂化轨道轴所在的直线。
2 三键的形成σ年 月 日2s2p2s2pspp激发杂化180°spspz 两个的空间分布sp 三键碳原子的轨道分布图课程名称:有机化学三、炔烃的物理性质(自学) 炔烃的沸点比对应的烯烃高10-20°C ,比重比对应的烯烃稍大,在水里的溶解度也比烷和烯烃大些。
四、炔烃的化学性质 1炔烃的酸性1.叁键碳sp 杂化,电负性大(3.29),σ电子靠近C 原子,易异裂出H +和C ≡C -,∴炔烃具有酸性。
乙炔的酸性比乙烷乙烯强,比水弱。
2.炔烃的鉴定三键碳上的氢原子具有微弱酸性(pK a =25),可被金属取代,生成炔化物。
生成炔银、炔铜的反应很灵敏,现象明显,可用来鉴定乙炔和端基炔烃。
年 月 日H-C C-H ≡2AgNO 3 + 2NH 4OH≡Cu-C C-Cu ≡2NH 4NO 3 + 2H 2O2NH 4Cl + 2H 2OR-C C-H ≡R-C C-Ag ≡R-C C-Cu ≡Ag(NH )+乙炔银(白色)乙炔亚铜(棕红色)炔铜(棕红课程名称:有机化学例:鉴别己烷、己烯、己炔己烷己烯己炔Br 2/CCl 4不褪色褪色褪色323生成沉淀无沉淀干燥的炔银或炔铜受热或震动时易发生爆炸生成金属和碳。


第四章炔烃和二烯烃(教案)(学时数:4)
一、教学目的和要求
要求学生掌握炔烃分子中碳原子的杂化状态及结构特征;熟练掌握炔烃和二烯烃的系统命名和普通命名法;熟练掌握末端炔烃的化学性质、共轭二烯烃的共轭加成、双烯合成反应等;基本熟悉炔烃和共轭二烯烃的制备方法;了解共轭效应的基本概念及其对有机化合物物理和化学性质的影响。
二、教学重点
1. 基本概念:sp杂化、双烯合成、共轭加成、Lindlar催化剂及选
择性还原等
2. 炔烃和二烯烃的命名和结构特征
3. 共轭二烯烃的性质:共轭加成、双烯合成反应等
4. 末端炔烃的性质及应用
三、教学难点
炔烃和烯烃亲电加成反应活性的比较;共轭效应的概念
四、教学内容
(一) 炔烃
1. 乙炔的结构
2. 炔烃的命名
3. 炔烃的物理性质
4. 炔烃的化学性质
5. 炔烃的制备
(二) 共轭二烯烃
1. 二烯烃的分类和命名
2. 二烯烃的结构
3. 共轭二烯烃的物理性质
4. 共轭二烯烃的化学性质
5. 1,3-丁二烯的来源
五、教学方法
课堂讲授,配合课堂讨论和课后练习。
六、课堂讨论题
1. 与烯烃相比,炔烃的催化氢化反应有什么特点?
2. 共轭二烯烃可以进行1,2-和1,4-加成,这由什么来决定?用
反应机理来进行说明。
七、课后练习
查阅文献资料,写一篇关于Diels-Alder反应在有机合成中的应用的小论文。




《炔烃》说课稿尊敬的各位评委老师:大家好!今天我说课的内容是《炔烃》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教学方法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析本节课选自人教版高中化学选修 5《有机化学基础》第三章《烃的含氧衍生物》中的第一节《炔烃》。
在前面的学习中,学生已经掌握了烷烃、烯烃的结构和性质,为本节课的学习奠定了基础。
炔烃作为一类重要的不饱和烃,在有机化学中具有重要的地位。
通过对炔烃的学习,学生能够进一步深化对有机化合物结构与性质关系的理解,为后续学习芳香烃、卤代烃等有机化合物打下坚实的基础。
教材首先介绍了炔烃的定义和通式,然后重点讲解了乙炔的结构、物理性质和化学性质。
通过实验探究,让学生亲身体验乙炔的化学性质,培养学生的实验操作能力和观察分析能力。
教材还安排了一些思考与交流的环节,引导学生进行自主探究和合作学习,提高学生的思维能力和创新能力。
二、学情分析学生在之前的学习中已经对有机化学有了一定的了解,掌握了烷烃和烯烃的相关知识,具备了一定的有机化学思维和实验操作能力。
但是,对于炔烃这类较为复杂的不饱和烃,学生可能会感到陌生和抽象。
因此,在教学过程中,要注重引导学生从已有的知识出发,通过类比、迁移等方法,帮助学生理解炔烃的结构和性质。
此外,高二的学生正处于思维活跃、好奇心强的阶段,他们喜欢动手实验,对新鲜事物充满兴趣。
在教学中,可以充分利用学生的这些特点,设计多样化的教学活动,激发学生的学习积极性和主动性。
三、教学目标1、知识与技能目标(1)了解炔烃的定义、通式和结构特点。
(2)掌握乙炔的物理性质和化学性质。
(3)能够书写乙炔的加成反应方程式。
2、过程与方法目标(1)通过对乙炔结构和性质的探究,培养学生的观察能力、实验操作能力和分析推理能力。
(2)通过小组合作学习,培养学生的合作意识和交流能力。
3、情感态度与价值观目标(1)让学生感受有机化学的魅力,激发学生学习化学的兴趣。
炔烃和二烯烃第四章 炔烃和二烯烃 Chapter four Alkynes And Dienes第一节 炔烃(Alkynes)一、炔烃的结构 、同分异构和命名: 1. 结构(Structure ): 乙炔的构造式 分子式: C 2H 4[讨论]:1、键角:角H-C-C=180O 2、键长:三键 < 双键 < 单键3、键能:EC-H:乙炔 > 乙烯 > 乙烷 LC≡C=1.21Å自由基稳定性: 4、酸性: PKa 25 36.5 42 电负性 SP > SP2 >SP3 5、碳原子正电性:乙炔>乙烯 二、 异构现象一、位置异构: 二、碳架异构:C C H HH CH 3CH 2>CH 2CH >CHCC H 3C H 2C HCH >C H H>C H 2HCCCC C与CCCC C CC 与CCCCC[注]:无顺反异构现象。
三、炔烃的命名1、最多不饱和链2、最长碳链3、最多双键4、最小序数(1)总和最小(2)有选择时,烯键最小。
四、炔烃的物理性质一、沸点:C1-C4气体,C4以上为液体。
二、直链烃的沸点:烯<烷<炔[原因]: (1)偶极矩:炔>烯>烷(2)分子量:烷>烯>炔HC C CCH2CH2CH3CH2CH2CH3C CH CH23,4二丙基1,3己二烯5炔CH CH25炔CH3CC C H CH2C H CH241乙烯基庚烯CH2CH CHC CHCH CH CH2C(3)分子形状:烷>炔>烯综合结果:烯<烷<炔 五、 炔烃的化学性质 一、催化加氢部分还原:[讨论]: 反应活性: (1)单独加氢 烯>炔(2)同时存在 炔 >烯二、亲电加成 1、加卤素[说明]: 1、实际意义 (1)制备四卤化物(2)定性鉴定2、反应活性:烯>炔CHCH CH CH +Cl 2FeCl 3催化剂ClClCl 2Cl 2CH CHCl 2如:因为:2讨论]:1、加成方向:[注]:条件:过氧化物作用下,称过氧化物效应。
3、硼氢化-氧化反应:三、亲核加成亲核试剂——能供给电子,反应时进攻反应物中带部分正电荷的原子而发生的反应,这类试剂称亲核试剂。
如:负离子、Lewis碱等。
亲核加成——由亲核试剂进攻而引起的加成反应。
1、加水该反应称库切洛夫反应。
(KyyePOB)Br+CH CH比Br+CH CH稳定C H2C HC l C H3C HC l2+HC lR C CH H B r R CH CH B rROOR+CR CB2H6H2O2/OHR CH2CHCl2.1.[讨论]:1、互变异构的推动力ΔH=E C=C+E C-O+E O-H-E C-C-E C-H-E C=O =610+357.7+462.8-345.6-435.1-736.4 =1430.5-1517.1=-86.6(放热)2、加成方向——马氏加成2、加HCN+H C H CNCH CH+CN CH CNCH CH CN+H CH CNCH2[说明]:为何亲核加成(1)稳定性CN<H(2)乙炔中碳的正电性大2、亲核加成活性炔>烯[原因]:正电性炔>烯负碳稳定性>CH2CH2CH CH CN CN3、加ROH、RCOOH、RNH2四、聚合反应五、氧化反应80-100℃15atm六、炔氢的酸性反应1、酸性:[思考]下列反应能否发生:2、炔化物的生成[注]:属离子化合物所以第二个氢不能再被夺取。
H2O RC CH NH3RCH CH2RH >>>>15.6 25 35 36.5 42R C CH+NaNH2液NH3R C CH+NH3R C CNa+H2OCH CNa[注]:(1)上述两个反应用于鉴定炔氢的存在,无炔氢时不反应。
如:不反应。
(2)易爆,所以要除去。
其方法是:3、炔化物的烃基化反应[注]R-X 以伯卤代烃最好,3o R-X 则得到烯烃。
六、 炔烃的制备 一、二卤代烃脱卤化氢RC +CR Ag (NH 3)2NO 3RC CAgRCCAg +HNO 3CH +AgNO 3(CH 3)3C-Br CH(CH 3)2C=CH 2+CH CH+NaBr+CH2CH2应 用举例:1.NaNH22.C 2H 5BrCH 3CH 2C CH1.NaNH 22.CH 3I CH 3C CCH 2CH 3NaNH 3(L)C CCH 3CH 3HHCH 3CH 3C 2H 5C 2H 5H HBr Br Br BrH H +Br 2二、四卤代烷脱卤素三、炔化物的制备第二节二烯烃diene一、分类及命名1、分类:累积二烯烃(如:丙二烯 CH2=C=CH2)根据两个双键的孤立二烯烃(如:1,4-戊二烯CH2=CH-CH2-CH=CH2)共轭二烯烃(如: 1,3-丁二烯 CH2=CH-CH=CH2)2、命名(1)、最多双链 CH2=C(CH3)CH=CH2 2-甲基-1,3-丁二烯(2)、最小序数CH2=CH-CH2-C(CH3)=CH-CH34-甲基-1,4-己二烯(3)构型、构象要表示例1:CH 3-CH=CH-CH=CH-CH 3 3个顺反异构体:H 3CHCC CC HCH 3H HHCCCC HHHCH 3H 3CHCC CCH HHCH 3H 3C顺,顺-2,4-己二烯 反,反-2,4-己二烯 反,顺-2,4-己二烯 (2Z,4Z)- 2,4-己二烯 (2E,4 E )- 2,4-己二烯 (2Z,4E)- 2,4-己二烯 例2:HH 2CCH 2CC HHH 2CCH 2CC HS-顺-1,3-丁二烯(构象) S-反-1,3-丁二烯(构象)S-顺- 两个双键位于单键同侧。
S-反- 两个双键位于单键异侧。
二、二烯烃的结构 1、丙二烯的结构C=C=CHH HHSP 2 SP SP 2[说明]C=C=Ca bc d当 a≠b ,c≠d 时,不存在顺反异构体。
存在对映异构体 2、共轭二烯烃的结构 近代物理方法测定:1.337 1.463 1.337CH2CH CH CH2(单键键长为: 1.54,双键键长为:1.34)碳碳双键的键长和单烯烃的双键的键长近似,碳碳单键的键长明显小于烷烃中碳碳单键的键长。
氢化热CH2CH CH CH2CH32H2CH3CH2CH2CH2CH3 226 KJ/molCH2CH CH2CH2CH 2H2CH3CH2CH2CH2CH3 254 KJ/mol单烯烃双键氢化热:125.5KJ/mol,但1,3-丁二烯氢化热238KJ/mol,低了13KJ/mol。
说明具有较低的能量。
为什么呢?杂化轨道理论认为:碳原子采取SP2杂化:形成∏44链,称这种体系为共轭体系。
在共轭体系中,形成不定域的化学键称离域键。
电子离域的结果:(1)链长趋于平均化(2)体系内能降低,分子更稳定(3)电子云密度趋于平均化例:CH2=CH-CH2-CH=CH2△H氢化=-254.4KJ/molCH3-CH=CH-CH=CH2 △H氢化=-226.3KJ/mol△(△H )=254.4-226.3=28.1KJ/mol 称离域能。
离域能——对于给定的烃按定域结构和离域结构所算出的能量差称共轭能。
离域能——由于形成离域键而产生的额外的稳定化能叫做离域能或共轭能3、共轭效应(1)定义:分子中由于存在特殊的原子间的相互影响,使分子中成链电子发生离域化的效应称为共轭效应。
[说明]:特点: ①、平面性②、键长趋于平均化,电子云密度趋于平均化。
③、体系能量降低,趋于稳定。
④、易极化——折射率增高。
(2)共轭体系的类型π-π共轭体系:CH 2=CH-CH=CH 2 π键与π键的重叠,使电子离域体系稳定。
р-π共轭体系: CH 2=CH-CH 2· p 轨道与π键的重叠,使电子离域体系稳定。
р-р共轭体系:CH 3-CH-Cl¨ σ-π与σ-p 共轭体系(超共轭):CH 2(3)共轭效应的相对强度及方向在共轭体系中,若某基团能使电子云共轭地向其转移时,则称为吸电子共轭效应(-C 表示),反之称推电子共轭效应(+C 效应)。
р-π共轭体系中:非π-π 共扼体系,由电子密度平均化决定取代基共扼 效应方向:X 具有+C 效应 р-р共轭体系:CH 2CH CH 2CH 2CH2=CH-具有+C 效应σ-π与σ-p 共轭体系(超共轭):R-具有+C 效应 π-π共轭体系中:由电负性决定取代基共扼效应方向。
[注]:共扼效应沿共轭链传递,正负电荷交替出现,不随碳链增长迅速减弱。
相对难度:同族元素:+C 效应 F >Cl >Br >I -OR >-SR >-SOR同周期超共轭体系: +C 效应:-CH 3>-CH 2CH 3>-CH(CH 3)2 同周期元素:+C 效应:-NR2>-OR>-F [注]:诱导效应和共轭效应的区别: ①、使碳链极性沿单一方向发生变化;②、不产生电子离域,主要是链的极性的改变,不出现极性交替现象。
③、基团电子效应(诱导效应和共轭效应) -I >+C 效应:F Cl Br I-I 效应<+C 效应:-OH -OR -NH 2 -NR 2 -NH-COR -O-COR -I 效应,-C 效应:由大到小+ I 与+ C 效应: R 基:CH 3- CH 3CH 2- CH(CH 3)2- +C 效应: CH 3 > CH 3CH 2 > CH(CH 3)2 (5)应用:C NOC OHHOC O CR>>>>O例一、为什么CH3CH=CHCH3比CH3CH2CH=CH2稳定?例二、亲电加成CH2=CH2与CH2=CHCl何者活泼?为什么?例三、CH3CH2Cl(偶极矩2.05)CH2=CHCl(偶极矩1.44)如何理解?三、共轭二烯的化学性质共轭二烯由于电子离域:(1)分子更稳定:共轭二烯>孤立二烯>累积二烯(2)分子折射增大,π电子云可极化,共轭二烯>孤立二烯(3)键长平均化,双链特征:孤立二烯>共轭二烯所以,共轭二烯除具有烯烃的化学性质外,且更加活泼。
同时还有特性。
1、亲电加成实验事实:Br2CH2=CH-CHBr-CHBr+CH2=CH-CH=CH2CH2Br-CH=CH-CH2Br 亲电试剂(溴)加到C-1和C-4上(即共轭体系的两端),双键移到中间,称1,4-加成或共轭加成。
共轭体系作为整体形式参与加成反应,通称共轭加成。
[讨论]:(1)反应历程:CH2=CH-CH=CH2+Br223412=CH-CH-CH2Br2=CH-CHBr-CH2(1)(2)(1)中存在р-π共轭效应而(2)中没有,∴(2)难生成。