实验二重组质粒酶切鉴定2016
- 格式:pdf
- 大小:1.37 MB
- 文档页数:30

重组质粒的酶切和PCR验证1、学习和利用限制性内切酶酶切检验重组质粒插入片段的方法;2、复习限制性内切酶酶切原理和方法;3、学习和掌握PCR反应的基本原理和实验技术;4、学习利用PCR方法检验重组质粒插入片段的方法;5、了解引物设计的基本要求;【实验原理】1、重组质粒是外源基因通过单酶切与用相同的限制性核酸内切酶切割的质粒载体连接后获得的,因此在连接处仍保留原限制性核酸内切酶的识别序列,用该酶再次切割重组质粒,能把插入片段切离载体,根据琼脂糖凝胶电泳检测可见有载体片段和插入的外源DNA片段,并可知插入片段的大小。
2、聚合酶链式反应(Polymerase chain reaction),即PCR技术是一种体外快速扩增特定基因或DNA序列的方法,故又称为基因的体外扩增法。
PCR的反应组分包括:模板DNA、寡核苷酸引物、Mg2+、4中脱氧核糖核苷酸(dNTPs)、DNA聚合酶和适合的缓冲体系等。
反应包括DNA变性,引物复性和引物延伸三个基本过程。
①DNA变性,即在90-95℃高温下,加热使模板DNA双链解离,形成两条单链DNA;②引物复性,又称为引物退火。
将反应温度降低,使两个引物分别与变性的单链靶DNA特定部位结合形成部分双链DNA;③引物延伸,即在60-72℃以及四种脱氧核糖核苷三磷酸存在的条件下,由DNA 聚合酶催化,以单链靶DNA为模板,根据碱基配对原色,在引物3’端掺入dNTP合成新的DNA互补链,产生新的双链DNA。
3、PCR反应有两个重要特征:一是经PCR扩增后,扩增产物片段在大小由两个引物与模板的结合位点决定;二是经过PCR扩增,产物以指数级数增加,可达到目的片段的大量扩增。
在此实验中PCR技术实际上是在模板DNA、引物和4种脱氧核糖核苷酸存在的条件下依赖于DNA聚合酶的酶促合成反应。
PCR 技术的特异性取决于引物和模板DNA结合的特异性。
4、寡核苷酸引物或称PCR引物,是指两段与待扩增的目的DNA序列两侧翼片段互补的一段单链寡核苷酸序列。


实验七重组质粒DNA的提取及酶切鉴定【实验原理】分离制备质粒DNA的方法很多,其中常用的方法有碱裂解法、煮沸法、SDS法、羟基磷灰石层析法等。
在实际操作中可以根据宿主菌株类型、质粒分子大小、碱基组成和结构等特点以及质粒DNA的用途进行选择。
本实验采用SDS碱裂解法提取重组质粒DNA,十二烷基磺酸钠(SDS)是一种阴离子表面活性剂,它既能使细菌细胞裂解,又能使一些蛋白质变性。
限制性内切酶能特异地结合于一段被称为限制性酶识别序列的DNA序列之内或其附近的特异位点上,并切割双链DNA。
限制性内切酶识别序列长度一般为4~8个呈回文序列的特异核苷酸对。
由于限制性内切酶的切割特性不同,分子生物学中主要用到Ⅱ型限制性内切酶(切割位置在识别序列内部)。
对质粒进行酶切,通过跑胶观察片段大小,从而鉴定质粒。
【实验步骤】本次实验所用的质粒提取试剂盒为天根的质粒小提试剂盒,操作步骤按说明书进行。
1. 吸附柱中加500ul 平衡液(BL),12000rpm离心1min ,弃收集管中的液体。
2.取1.5ml菌液至2ml离心管中,12,000rpm离心1min,弃上清。
3. 加250ul solution Ⅰ(P1),vortex。
4. 加250 solution Ⅱ(P2),上下颠倒混匀。
操作时间不能超过5min 注:此步骤不宜超过5 min。
5. 加350 solution Ⅲ(P3),立即颠倒混匀几次。
12000rpm离心10min。
6. 吸取上清加入吸附柱中,尽量不要吸出沉淀12000rpm离心1min ,弃收集管中的液体。
注:此时4℃离心不利于沉淀沉降。
7. 加入600μL漂洗液(PW)于离心吸附柱中,12000rpm离心1min ,倒掉废液。
8. 重复上一步,9. 空管离2min。
将吸附柱放入1.5ml离心管中,在超净台中晾5min。
10. 将700 μl的Rinse B加入Spin Column中,12,000 rpm离心30 sec,弃滤液。

重组质粒的酶切和PCR验证⼭东⼤学实验报告 2013年 11 ⽉26⽇⾄12⽉10⽇姓名系年级 2011级⽣物技术组别四科⽬分⼦实验同组者学号题⽬重组质粒的酶切和PCR验证⼀、【实验题⽬】重组质粒的酶切和PCR验证⼆、【实验⽬的】1.学习和掌握PCR反应的基本原理和实验技术。
2.了解引物设计的基本要求。
3.复习凝胶电泳进⾏DNA分离纯化的⽅法。
4.复习DNA的酶切操作技术。
三、【实验试剂及器材】试剂:Hin d III 、酶切Buffer、Hin d Ⅲ、ddH2O、琼脂糖,TAE缓冲液、Loading Buffer、EB 染液、PCR buffer,dNTPs,Taq DNA聚合酶,引物器材:枪和枪尖、1.5 ml的Ep管、电泳仪、PCR反应⼩管四、【实验原理】1.PCR技术原理PCR (po lymerase chain react ion) 中⽂译为聚合酶链式反应或体外扩增技术, 是1985 年美国Cetus 公司⼈类遗传部、加利福尼亚⼤学洛杉机分校和How ghes 医院等联合建⽴的⼀项⽣物技术. 其原理类似于天然DNA 的复制, 在模板DNA、引物和4 种dN TP 等存在的条件下,依赖于DNA 聚合酶(Taq 酶) 的酶促合成反应. 其具体反应分三步: 变性、退⽕、聚合. 以上三步为⼀个循环, 如图1. 每⼀循环的产物DNA ⼜可以作为下⼀个循环的模板, 数⼩时后, 介于两个引物之间的⽬的DNA 得到⼤量的复制, 经过25~ 30 次循环, DNA 数量可达2×106-7拷贝数。
PCR基本原理是以单链DNA为模板,4种dNTP为底物,在模板3’末端有引物存在的情况下,⽤酶进⾏互补链的延伸,多次反复的循环能使微量的模板DNA得到极⼤程度的扩增。
在微量离⼼管中,加⼊与待扩增的DNA⽚段两端已知序列分别互补的两个引物、适量的缓冲液、微量的DNA膜板、四种dNTP溶液、耐热Taq DNA聚合酶、Mg2+等。
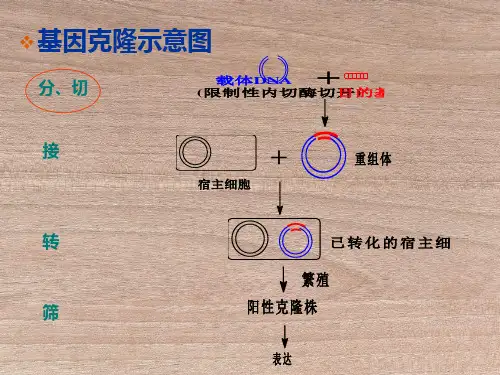

重组质粒的酶切鉴定与PCR实验一、【实验目的】1、酶切鉴定重组质粒插入片段的大小;2、学习和掌握PCR反响的根本原理和操作技术,了解引物设计的根本要求。
二、【实验原理】1、PCR反响根本原理PCR技术的根本原理类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。
PCR由变性--退火--延伸三个根本反响步骤构成:①模板DNA的变性:模板DNA经加热至93℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反响作准备;②模板DNA与引物的退火〔复性〕:模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合;③引物的延伸:DNA模板--引物结合物在TaqDNA聚合酶的作用下,以dNTP为反响原料,靶序列为模板,按碱基互补配对与半保存复制原理,合成一条新的与模板DNA链互补的半保存复制链,重复循环变性--退火--延伸三过程就可获得更多的“半保存复制链〞,而且这种新链又可成为下次循环的模板。
每完成一个循环需2~4分钟,2~3小时就能将待扩目的基因扩增放大几百万倍。
PCR反响原理图2、PCR反响体系与反响条件(1) 标准的PCR反响体系①PCR反响的缓冲液提供适宜的酸碱度与某些离子③底物浓度 dNTP以等摩尔浓度配制,20~200umol/L④TaqDNA聚合酶 2.5U(100ul〕⑥反响温度和循环次数变性温度和时间 95℃,30s退火温度和时间低于引物Tm值5 ℃左右,一般在45~55℃延伸温度和时间 72℃,1min/kb(10kb内〕Tm值=4(G+C) +2(A+T)循环次数:一般为25 ~ 30次。
循环数决定PCR扩增的产量。
模板初始浓度低,可增加循环数以便达到有效的扩增量。
但循环数并不是可以无限增加的。
一般循环数为30个左右,循环数超过30个以后,DNA聚合酶活性逐渐达到饱和,产物的量不再随循环数的增加而增加,出现了所谓的“平台期〞。

重组质粒进行鉴定时,可以采用两种方法进行鉴定。
1.通过pcr方法鉴定:以重组质粒为模板,pcr产物的特异性引物或载体的通用引物进行PCR 扩增后电泳鉴定。
2..就是酶切鉴定:双酶切鉴定时只要出现质粒条带和你的插入片段的目的条带就行了。
至于出现质粒条带很亮,而目的条带暗的现象,其实很正常。
因为一般情况下,质粒的碱基数比你的目的条带的碱基数多的多(一般质粒碱基都有好几千bp,而目的条带通常就几百到一千多bp)。
当我们用EB进行染色时,EB是掺入到到dna链中,碱基数越多则掺入的eb就越多,在紫外光下显示的条带就越亮,也就是说条带亮度与你的片段的长度成正比。
最后,如果两种方法都鉴定正确了,你就可以送到公司进行测序,做最后的鉴定了。
如果你非要看到你的目的条带很明显的话,也可以采取如下方法:
1.电泳时吸取的产物量加大,加入到大孔梳子的胶当中,如可以加产物10微升或更多。
2.凝胶成像拍照时,可以适当把曝光时间提高一点。
3.如果还是不清楚,就把你的酶切产物浓缩一下。

质粒重组实验报告质粒重组实验报告引言:质粒重组是一种重要的实验技术,可以将外源基因导入到宿主细胞中,用于研究基因功能、蛋白质表达等方面。
本实验旨在通过质粒重组技术,将外源基因成功导入到大肠杆菌中,并通过酶切、连接、转化等步骤验证重组质粒的构建。
材料与方法:1. 外源基因:选择了编码了绿色荧光蛋白(GFP)的质粒pGFP。
2. 宿主细胞:采用大肠杆菌作为宿主细胞。
3. 酶切酶:使用限制酶EcoRI和BamHI进行酶切反应。
4. 连接酶:使用T4 DNA连接酶进行连接反应。
5. 培养基:含有抗生素的LB培养基。
实验步骤:1. 酶切反应:将pGFP质粒和EcoRI、BamHI酶切酶按照指定条件进行酶切反应,以得到线性化的质粒和目标基因片段。
2. 连接反应:将线性化的质粒和目标基因片段加入连接酶缓冲液中,按照指定条件进行连接反应,形成重组质粒。
3. 转化:将重组质粒加入含有大肠杆菌的培养基中,通过热激转化法使质粒进入细胞。
4. 筛选:将转化后的细胞均匀涂布在含有抗生素的LB平板上,筛选出含有重组质粒的菌落。
5. 验证:通过PCR、酶切等方法对筛选出的菌落进行验证,确认质粒重组成功。
结果与讨论:经过酶切、连接、转化等步骤,成功构建了质粒重组实验系统。
在LB平板上筛选出了多个抗生素耐受的菌落,表明转化成功。
通过PCR验证,检测到了目标基因片段的特异扩增带,证明重组质粒中成功导入了外源基因。
进一步进行酶切验证,发现重组质粒经过连接反应后,酶切位点发生改变,与未连接的质粒有明显差异。
这些结果表明,质粒重组实验成功构建了重组质粒,并将外源基因导入到大肠杆菌中。
质粒重组实验的成功对于基因功能研究和蛋白质表达具有重要意义。
通过重组质粒,可以将外源基因导入到宿主细胞中,进而研究其在生物体内的功能和表达情况。
例如,可以通过重组质粒实现基因敲除、基因表达调控等功能,从而深入了解基因在生物体内的作用机制。
同时,重组质粒还可以用于蛋白质表达,通过外源基因的转录和翻译,使宿主细胞产生目标蛋白质,用于研究其结构、功能等方面。

重组DNA转化受体细胞后,须在不同水平上进行筛选,以区别转化子与非转化子、重组子与非重组子以及鉴定所需的特异性重组子。
在转化过程中,并非每个受体细胞都被转化;即使获得转化细胞,也并非都含有目的基因,所以需采用有效方法进行筛选。
筛选的方法包括根据遗传表型筛选、限制性内切酶分析筛选、核酸探针筛选、PCR筛选等。
本实验采用遗传表型筛选中的抗生素平板筛选或α互补筛选的方法。
一、抗生素平板筛选【实验原理】目标基因是Kan的抗性基因,而载体含Amp 的抗性基因,因此在含有Amp 和Kan的培养基中生长的菌落即为阳性菌落。
【操作步骤】1.制备含有Amp 和 Kan 的LB琼脂培养板2.将100μl转化菌液用无菌涂布器均匀涂布于含有Amp 和Kan培养板上,37℃培养12-16h 。
3.在含有Amp和Kan培养板上能生长的菌落即为阳性重组质粒。
并将其接种于含Kan的LB液体培养基2ml中培养8-16h。
4.小量制备质粒,限制性酶切分析进一步鉴定。
二、α互补筛选【实验原理】适用于含有半乳糖苷酶基因〔LacZ〕的载体,如 pUC系列等,其原理是:载体含有LacZ 的调控序列和N端146个氨基酸的编码信息。
在这个编码区中插入了一个多克隆位点。
当这种载体进入可编码β-半乳糖苷酶C端局部序列的宿主细胞后〔质粒和宿主细胞编码的片段各自都没有酶活性〕,它们可以融为一体,形成具有酶学活性的蛋白质,这种现象叫α互补。
由α互补而产生的 Lac+细菌在呈色底物 5-溴-4-氯-3-吲哚-β-半乳糖苷〔X-gal〕和诱导剂异丙基硫代-β-D-半乳糖苷〔IPTG〕存在下形成蓝色菌落。
当外源DNA插入到质粒的多克隆位点后,导致产生无α互补能力的氨基端片段。
因此,带有重组质粒的细菌形成白色菌落。
通过呈色反响即可初步识别可能带有重组质粒的菌落。
通过小量制备质粒DNA进行限制酶切分析,即可确定这些质粒的结构。
【试剂】1.X-gal〔20mg/m l〕:将20mg X-gal溶于l ml二甲基甲酰胺中,-20℃避光保存。


第三次分子生物学实验报告重组质粒的酶切鉴定及PCR实验一、实验目的1、通过酶切鉴定重组质粒的插入片段的大小;2、学习并掌握PCR技术的原理和基本操作。
二、实验原理1、重组质粒酶切鉴定将含有外源DNA的转化子的E.coliDH5α菌株进行培养,并用试剂盒提取其质粒DNA,将所提取的DNA用切pUC19质粒的同一种限制性内切酶进行切割以验证所插入的外源DNA的大小。
2、PCR原理PCR(Polymerase Chain Reaction)即聚合酶链式反应是1986 年由Kallis Mullis 发现。
这项技术已广泛地应用于分子生物学各个领域,它不仅可用于基因分离克隆和核酸序列分析,还可用于突变体和重组体的构建,基因表达调控的研究,基因多态性的分析等方面。
本次实验旨在通过学习和掌握PCR反应的基本原理和实验技术,以验证重组质粒插入片段大小。
(1)聚合酶链式反应原理CR是一种利用两种与相反链杂交并附着于靶DNA两侧的寡核苷酸引物,经酶促合成特异的DNA 片段的体外方法。
反应过程由高温变性,低温退火和适温延伸等几步反应组成一个循环,然后反复进行,使目的的DNA 得以迅速扩增。
置待扩增DNA 于高温下解链成为单链DNA 模板,人工合成的两个寡核苷酸引物在低温条件下分别与目的片段两侧的两条链互补结合,DNA聚合酶在72℃将单核苷酸从引物3'端开始掺入,沿模板5'—3'方向延伸,合成DNA 新链。
由于每一循环所产生的DNA均能成为下一次循环的模板,所以PCR 产物以指数方式增加,经25—30次周期之后,理论上可增加109倍,实际上可增加107倍。
PCR 技术具有操作简便、省时、灵敏度高特异性强和对原始材料质量要求低等优点,但由于所用的TaqDNA 聚合酶缺乏5'—3'核酶外切酶活性,不能纠正反应中发生的错误核苷酸掺入,估计每9000个核苷酸会导致一个掺入错误,但是错误掺入的碱基有终止链延伸的作用倾向,使得错误不会扩大。
限制性内切酶酶切法鉴定重组质粒作业指导书实验目的掌握单、双酶切的技术,理解酶切法进行重组质粒进行鉴定的原理。
实验原理(一)酶切各种限制性内切酶能专一地识别碱基顺序,例如,Eco R Ⅰ酶的识别顺序为:GAATTC;Scal I酶的识别顺序为:AGTACT,用Eco R I和Scal I同时酶解含有这两个单一酶切位点的环状双链DNA分子,就产生两条带有相应酶切位点的线性DNA分子。
当Eco R I和Scal I同时酶切一个质粒DNA时,酶切反应必须完全。
不同酶切反应都需要Mg2+并要求一定的盐离子浓度,但不同的酶达到最佳酶切效率所需的盐浓度不同。
因此生产厂商在销售酶的同时往往附带专门的缓冲液。
如果盐离子浓度使用不当,会使酶的识别位点发生改变,例如当盐离子浓度低于50mmol/L时,Eco R I内切酶的专一性就降低,只能识别中间的4个核苷酸序列(称该酶为Eco R I*)。
绝大多数酶的反应温度是在370C,酶切反应时间需30min、60min以至2h以上。
一般来说,如酶的纯度不佳,酶切时间不能太长。
终止酶切反应时,大多数可在65℃水浴中,保温10min,就可使大部分酶失活。
Eco R I酶置65℃水浴中,保温10min,丧失95%的酶活性。
内切酶一般都保存在50%甘油的缓冲液中。
当保存在10%甘油中时,酶活力丧失更快。
少数较耐热的酶,在加热前先加pH7.5的EDTA,至终浓度为10mmol/L。
EDTA螯合了反应系统中所有的二价阳离子,就更便于终止酶切反应。
酶切要完全,酶解的数量也要适当。
设计酶解DNA的数量时,除了根据连接与转化的要求外,还要按照DNA浓度的高低,酶液单位的高低等具体情况而定。
同时还要考虑到DNA每经一步处理,就得重新纯化,这样DNA浓度的损失量几乎达到50%。
并且每经一步操作后,都要取一定量的DNA样品进行电泳鉴定或作为电泳对照样品。
因此,在设计酶解数量时,不能用量太少,但是酶解数量过多,势必要消耗大量限制性内切酶和DNA,这也是不必要的。
重组质粒双酶切鉴定结果
质粒双酶切鉴定是一种用于确定质粒DNA序列的技术。
通过
使用限制性内切酶对质粒进行酶切,然后运用电泳分析,可以获得关于质粒DNA序列的信息。
重组质粒双酶切鉴定结果通常包括以下内容:
1. 双酶切酶的酶切模式:双酶切鉴定通常使用两种限制性内切酶来进行酶切。
酶切模式描述了每个酶切酶在质粒上切割的位置,包括切割位点及其与质粒线性DNA的相对位置。
2. 酶切产物的大小:通过电泳将酶切后的质粒DNA进行分离,可以得到一系列的DNA片段。
通过估算这些片段的大小,可
以进一步确定酶切酶的切割位点以及质粒DNA的序列。
3. 酶切图谱:酶切图谱是通过将电泳分离的酶切产物进行可视化的图像,通常以荧光标记或放射性标记的方式进行。
酶切图谱可以帮助鉴定质粒的酶切模式,确认切割位点,以及评估酶切的效果。
通过分析重组质粒双酶切鉴定结果,可以确定质粒的基本结构和序列信息。
这对于研究质粒的功能和用途,以及进行基因工程和生物技术研究都具有重要意义。
第1篇一、实验目的1. 学习DNA体外重组技术的原理和方法。
2. 掌握重组质粒的构建、转化、筛选和鉴定技术。
3. 熟悉实验操作步骤和注意事项。
二、实验原理DNA体外重组技术是指将外源DNA片段与载体DNA片段在体外进行连接,形成重组DNA分子的技术。
通过该技术,可以将外源基因导入宿主细胞,实现基因表达和功能研究。
三、实验材料1. 载体:pUC19质粒2. 目的基因:基因片段3. 限制性核酸内切酶:EcoRI、BamHI4. DNA连接酶:T4 DNA连接酶5. DNA聚合酶:Klenow片段6. 琼脂糖凝胶电泳试剂7. DNA标记物8. 转化试剂:CaCl2、SDS、乙醇9. 受体细胞:大肠杆菌DH5α四、实验步骤1. 目的基因的扩增(1)设计引物:根据目的基因序列设计一对引物,引物长度一般为20-25bp,5'端添加EcoRI和BamHI酶切位点。
(2)PCR扩增:以基因片段为模板,引物为引物,进行PCR扩增。
2. 载体的酶切(1)将pUC19质粒和PCR扩增的目的基因分别用EcoRI和BamHI进行酶切。
(2)回收酶切片段:琼脂糖凝胶电泳分离酶切片段,回收目的片段。
3. DNA连接(1)将回收的目的基因片段和载体片段混合,加入DNA连接酶,进行连接反应。
(2)将连接产物转化到大肠杆菌DH5α感受态细胞中。
4. 转化后细胞的培养与筛选(1)将转化后的细胞在含有氨苄青霉素的LB培养基中培养过夜。
(2)取适量菌液进行PCR检测,筛选出阳性克隆。
5. 阳性克隆的鉴定(1)提取阳性克隆的质粒DNA。
(2)用EcoRI和BamHI进行酶切,琼脂糖凝胶电泳检测酶切片段。
(3)将酶切片段与标记物进行对比,验证重组质粒的正确性。
五、实验结果与分析1. PCR扩增结果:在PCR产物中,可见一条与预期片段大小相符的条带。
2. 酶切结果:在琼脂糖凝胶电泳中,可见目的基因片段和载体片段的酶切片段。
3. 阳性克隆的鉴定:在琼脂糖凝胶电泳中,可见与预期片段大小相符的条带,证明重组质粒构建成功。
质粒dna酶切实验报告实验报告:质粒DNA酶切实验一、实验目的1. 熟悉质粒DNA的抽提方法及质量检测方法。
2. 掌握酶切反应中各种试剂的使用方法和浓度。
3. 学习构建质粒的操作技术,合理选择酶切酶和酶切条件,成功制备目标DNA 片段。
二、实验原理质粒是宿主细胞负责复制、分离和基因表达的非必需DNA分子,通常还携带有特定的基因片段。
酶切反应是一种通过酶解水解代表性结构的方法,主要应用于DNA检测、分析和改造等方面。
在质粒DNA酶切实验中,需要先将质粒DNA利用DNA抽提试剂提取,之后与适当的酶切酶混合进行酶切反应,最终得到目标DNA片段。
三、实验步骤1. 取200µl E.coli DH5α预菌液,离心5min,弃去上清液,用PBS洗菌2次。
2. 加入200µl胰蛋白酶,37°C水浴混合反应5min,离心1min,上清液弃掉。
3. 加入200µl重组核酸缓冲液,同样37°C水浴混合反应5min,离心1min,上清液弃掉。
4. 加入50µl重组蛋白酶K,65°C水浴下混合反应50min,离心5min(13000r/min),上清液弃掉。
5. 加入50µl除菌水,65°C混匀5min后,离心5min,上清液收集起来,质粒DNA抽提完成。
6. 按照要求将质粒DNA加入载体质粒pUC19中,加入合适的限制酶进行酶切反应。
7. 通过琼脂糖凝胶电泳法将分子量合适的目标DNA片段筛选出来。
四、实验结果本次实验成功提取了质粒DNA,并利用限制酶EcoRI和BamHI进行了酶切反应。
最终,经琼脂糖凝胶电泳检测,成功得到目标DNA片段,质量均匀、纯度高。
五、实验总结本次实验通过对质粒DNA的抽提和酶切反应,加深了对质粒结构及酶切法原理的理解,并提高了实验操作的技术能力及分析数据的能力。
在今后的实验中,将继续加强实验操作,探究更多质粒DNA的构建与酶切方法,为基因检测及分析领域提供更多有效的技术支持。