第三篇 水环境化学(1)天然水的组成和性质
- 格式:ppt
- 大小:1.35 MB
- 文档页数:217




第三章:水环境化学——天然水的性质第三章:水环境化学——天然水的基本特征以及污染物存在形态一、水和水分子结构的特异性二、天然水的基本特征1、天然水的组成(离子、溶解气体、水生生物)2、天然水的化学特征3、天然水的性质(1)碳酸盐系统(2)酸度和碱度(3)天然水的缓冲能力● 缓冲溶液能够抵御外界的影响,使其组分保持一定的稳定性,pH 缓冲溶液能够在一定程度上保持pH 不变化。
● 天然水体的pH 值一般在6-9之间,而且对于某一水体,其pH 几乎保持不变,这表明天然水体具有一定的缓冲能力,是一个缓冲体系。
● 一般认为各种碳酸盐化合物是控制水体pH 值的主要因素,并使水体具有缓冲作用。
但最近研究表明,水体与周围环境之间发生的多种物理、化学和生物化学反应,对水体的pH 值也有着重要作用。
● 但无论如何,碳酸化合物仍是水体缓冲作用的重要因素。
因而,人们时常根据它的存在情况来估算水体的缓冲能力。
对于碳酸水体系,当pH<8.3时,可以只考虑一级碳酸平衡,故其pH 值可由下式确定:][][lg 3*321--=HCO CO H pK pH如果向水体投入△B 量的碱性废水时,相应由△B 量H 2CO 3*转化为HCO 3-,水体pH 升高为pH ',则:B HCO BCO H pK pH ∆+∆--=-][][lg 3*321'水体中pH 变化为△pH=pH '-pH ,即:][][lg ][][lg 3*323*32--+∆+∆--=∆HCO CO H B HCO BCO H pH由于通常情况下,在天然水体中,pH=7左右,对碱度贡献的主要物质就是[HCO 3-],因此经常情况下,可以把[HCO 3-]作为碱度。
若把[HCO 3-]作为水的碱度,[H 2CO 3*]作为水中游离碳酸[CO 2],就可推出:△B=[碱度][10△pH -1]/(1+K 1×10pH+△pH )△pH 即为相应改变的pH 值。






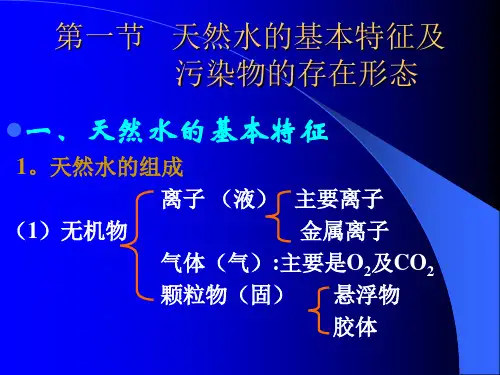
第三章:水环境化学第一节:天然水的基本特征及污染物的存在形式1.水中八大离子:K+,Ca+,Na+,Mg+,HCO3-,NO3-,Cl-,SO4(2-)2.气体在水中的溶解度服从Henry定律:一种气体在液体中的溶解度正比于液体所接触的该种气体的分压。
溶解度【X(aq)】=K H×p G K H为气体一定温度下Henry定律常数,p G分压3.氧在水中的溶解度CO2的溶解度P150页4.:BOD(生化需氧量):在一定体积水中有机物降解所需消耗的氧的量。
BOD5=DO1-DO55.碳酸平衡P152-P157计算题重点区域★★★6.水中污染物的分布和存在形态:A.有机污染物:农药(有机氯、磷,氨基甲酸醇),多氯联苯PCBs,卤代脂肪烃,醚类,单环芳香族化合物,苯酚类和甲酚类,钛酸酯类,多环芳烃PAH,亚硝胺和其他化合物B.金属污染物:镉,汞,铅,砷,铬,铜,锌,铊等7.优先污染物:有毒物质品种繁多,在众多的污染物中筛选出潜在危险大的作为优先研究和控制对象。
8.水中的营养元素:N,P,C,O和微量元素9.水体富营养化:生物所需的N,P等营养物质大量进入湖泊,河口等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,鱼类及其他生物大量死亡的现象。
10.N/P>100,贫营养化;N/P<10,富营养化;第二节:水中无机污染物的迁移转化一,颗粒物与水之间的迁移:1水中颗粒物类别:矿物微粒和黏土矿物,金属水合氧化物,腐殖质,水体悬浮沉积物2.水环境中胶体颗粒物的吸附作用类别:表面吸附,离子交换吸附,专属吸附。
3.表面吸附:胶体具有巨大的比表面积和表面能,因此固液界面存在表面吸附作用,属于物理吸附。
4.离子交换吸附:环境中大部分胶体带负电荷,容易吸附阳离子,在吸附过程中,胶体每吸附一部分阳离子,同时也放出等量的其他阳离子。
5.专属吸附:除了化学键的作用外,尚有加强的憎水键和范德华力或氢键在起作用。