衡水中学高考化学一轮复习
- 格式:ppt
- 大小:3.54 MB
- 文档页数:103

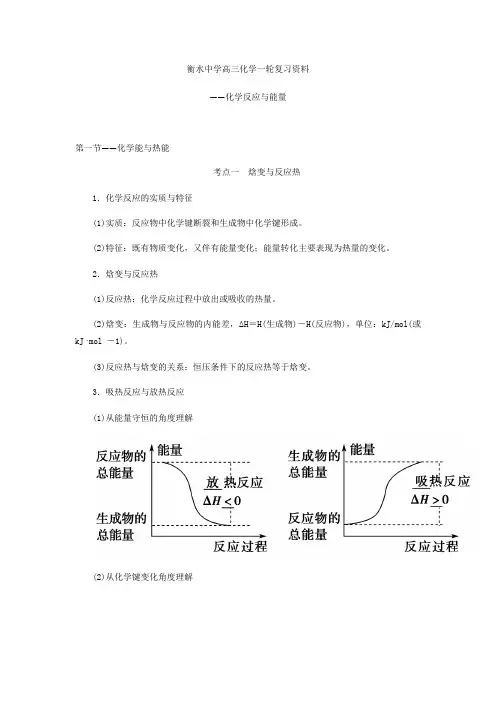
衡水中学高三化学一轮复习资料——化学反应与能量第一节——化学能与热能考点一焓变与反应热1.化学反应的实质与特征(1)实质:反应物中化学键断裂和生成物中化学键形成。
(2)特征:既有物质变化,又伴有能量变化;能量转化主要表现为热量的变化。
2.焓变与反应热(1)反应热:化学反应过程中放出或吸收的热量。
(2)焓变:生成物与反应物的内能差,ΔH=H(生成物)-H(反应物),单位:kJ/mol(或kJ·mol -1)。
(3)反应热与焓变的关系:恒压条件下的反应热等于焓变。
3.吸热反应与放热反应(1)从能量守恒的角度理解(2)从化学键变化角度理解4.中和反应的反应热(简称中和热)(1)含义:酸与碱发生中和反应生成1_mol H2O(l)时所释放出的热量,其值为-57.3 kJ ·mol -1。
(2)中和反应反应热的测定 ①装置(请在横线上填写仪器名称)②计算公式 ΔH =-0.418t2-t10.025kJ/mol 。
t1——起始温度,t2——终止温度。
③注意事项a .泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,减少实验过程中的热量损失。
b .为保证酸完全中和,采取的措施是使碱稍过量。
考点阐释:1.正确理解活化能与反应热的关系催化剂能降低反应所需活化能,但不影响焓变的大小。
2.反应热答题规范指导(1)用“焓变(ΔH)”表示反应热时,ΔH>0表示吸热,ΔH<0表示放热,因而,ΔH 后所跟数值需要带“+”、“-”符号。
(2)描述反应热时,无论是用“反应热”、“焓变”表示还是用ΔH 表示,其后所跟数值需要带“+”、“-”符号。
3.利用键能计算反应热,其关键是算清物质中化学键的数目在中学阶段要掌握常见单质、化合物中所含共价键的数目。
原子晶体:1 mol 金刚石中含2 mol C —C 键,1 mol 硅中含2 mol Si —Si 键,1 mol SiO2晶体中含4 mol Si -O 键:分子晶体:1 mol P4中含有6 mol P -P 键,1 mol P4O10(即五氧化二磷)中,含有12 mol P —O 键、4 mol P===O 键,1 mol CH3CH3中含有6 mol C —H 键和1 mol C —C 键。

河北衡水高中化学高三一轮复习Na 及其重要化合物知识点汇总钠及其化合物知识点N A:1、 2Na2O2-----2CO2/2H 2O-----O2------2e-Na2O2----KMnO 4 1 Na 2O2----2 e-Na2O2----SO2 1 Na 2O2----2 e-2、将 CO2通过过氧化钠使其增重ag 时,反应转移电子数为aN A/283、 120gNaHSO4和 KHSO4组成的混合物中共有3N A的阴阳离子×NaHSO4晶体或熔融态存在钠离子和硫酸氢根,水溶液中存在钠离子、氢离子、硫酸根。
4、电解 1L 氯化钠溶液至氢氧根浓度为0.2mol/L时,转移电子数为0.4N A×5、钠和氯气的反应中,当有0.2mol 电子转移时生成的NaCl 分子数目为0.2N A。
×6、 1molNaCl 中,所有Na+的最外层电子总数为8N A。
×7、等 n 的 Na2O2和 Na2O含阴离子均为N A。
化学与生活:1、纯碱、小苏打都可用作食用碱。
2、泡沫灭火器是碳酸氢钠和硫酸铝反应,硫酸铝放玻璃筒,碳酸氢钠放铁桶。
3、阿司匹林乙酰水杨酸中毒可静脉注射碳酸氢钠溶液。
4、钠镁着火只能用沙子扑灭,不能用水灭火。
酒精灯着火可用湿布盖灭。
5、氢氧化铝、碳酸氢钠、碳酸钙、碳酸镁、氢氧化镁都可以治疗胃酸过多。
6、食盐白糖可用作调味剂,也可用作食品防腐剂。
7、焰色反应用铁丝或铂丝,用稀盐酸清洗,检验的是金属元素的性质。
8、亚硝酸钠能防腐、增色。
9、不能用纯碱洗矿物油油污,可以洗油脂油污。
10、冶炼 Na 不能用热还原法。
11、高铁酸钠既能杀菌消毒又能净水。
12、炉火纯青与焰色反应无关,火树银花与焰色反应有关。
化学与实验 :1、Na+的检验:焰色反应,洗烧蘸烧洗烧2、不能用 PH试纸测 NaClO溶液的 PH3、将过氧化钠加入到红色石蕊溶液中,先变红后褪色4、碳酸钠溶于水和水发生反应生成Na2CO3.XH2O 放热。

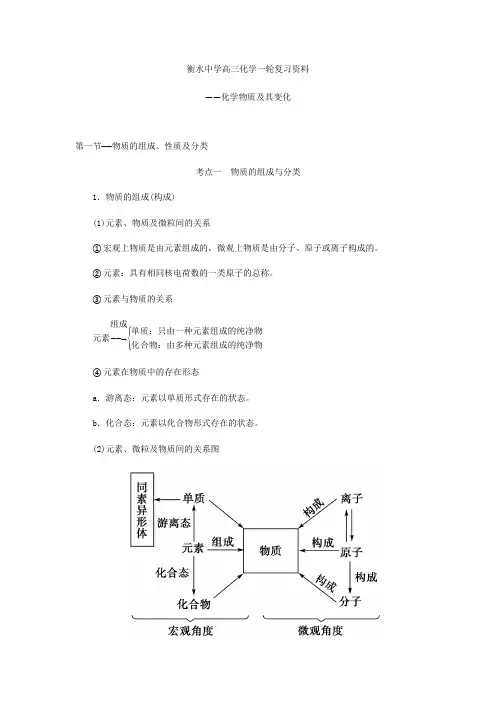
衡水中学高三化学一轮复习资料——化学物质及其变化第一节——物质的组成、性质及分类考点一 物质的组成与分类1.物质的组成(构成) (1)元素、物质及微粒间的关系①宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
②元素:具有相同核电荷数的一类原子的总称。
③元素与物质的关系元素――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物化合物:由多种元素组成的纯净物④元素在物质中的存在形态a .游离态:元素以单质形式存在的状态。
b .化合态:元素以化合物形式存在的状态。
(2)元素、微粒及物质间的关系图(3)同素异形体①由同种元素形成的不同单质叫同素异形体。
同素异形体的形成有两种方式:a.原子个数不同,如O2和O3;b.原子排列方式不同,如金刚石和石墨。
②同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化。
2.简单分类方法及其应用(1)分类方法常用的两种方法是交叉分类法和树状分类法。
①交叉分类法示例②树状分类法示例(2)分类方法的应用Ⅰ.认识物质间的转化和性质③、④的化学方程式分别为: Ca(OH)2+CO2===CaCO3↓+H2OC +O2=====点燃CO2Ⅱ.认识化学反应的分类依据分解反应 置换反应 吸热 放热考点阐释:规避物质分类的“三大误区”误区一 误认为由相同元素组成的物质一定是纯净物。
(1)若某物质是由一种元素的单质混合而成,如O2、O3组成的混合气体就是混合物,由12C 和13C 组成的石墨则是纯净物。
(2)分子式相同的化合物可能存在同分异构体,最简式相同的化合物不一定是同一物质。
如C4H10的结构有正丁烷和异丁烷,二者组成混合物;C2H2与C6H6最简式相同,但前者为乙炔,后者为苯。
误区二误认为溶液呈酸性的物质一定是酸,溶液呈碱性的物质一定是碱。
(1)NaHSO4、CuSO4、NH4Cl溶液呈酸性,这些物质均属盐。
(2)Na2CO3、NaHCO3溶液呈碱性,这些物质均属盐。

高考化学一轮总复习提升训练:微考点3 电离平衡常数的相关计算1.(2023·河北衡水中学模拟)25 ℃时,用0.1 mol·L -1CH 3COOH 溶液滴定20 mL 0.1mol·L -1NaOH 溶液,当滴加V mL CH 3COOH 溶液时,混合溶液的pH =7。
已知CH 3COOH 的电离平衡常数为K a ,忽略混合时溶液体积的变化。
下列关系式正确的是( A )A .K a =2×10-70.1V -2B.V =2×10-70.1K a -2C .K a =2×10-7V +20D.K a =2×10-8V[解析] 当pH =7时,溶液中c (CH 3COO -)=c (Na +)=2V +20mol·L -1,由物料守恒知c (CH 3COOH)=0.1V V +20 mol·L -1-2V +20 mol·L -1=0.1V -2V +20mol·L -1,再根据K a =c H +·c CH 3COO -c CH 3COOH ,代入相关数据可得K a =2×10-70.1V -2。
2.(2023·湖南邵阳模拟)常温下,联氨(N 2H 4)在水溶液中分步发生电离:①N 2H 4+H 2O N 2H +5+OH -K a1;②N 2H +5+H 2ON 2H 2+6+OH -K a2。
该溶液中的微粒的物质的量分数δ(X)随pOH[pOH =-lg c (OH -)]变化的关系如图所示。
下列叙述错误的是( B )A .给N 2H 4的水溶液中加水稀释,电离程度逐渐增大B .电离常数K a1:A<B =D<C C .据图中A 点可求:K a1=10-6D .图D 点溶液的c (OH -)=10-10.5 mol·L -1[解析] 给N 2H 4的水溶液中加水稀释,电离平衡正向移动,故电离程度逐渐增大,A 正确;电离常数只与温度有关,与溶液的酸碱性无关,故电离常数K a1:A =B =D =C ,B 错误;题图中A 点δ(N 2H 4)=δ(N 2H +5),pOH =6,此时c (N 2H 4)=c (N 2H +5)、c (OH -)=10-6mol·L -1,则N 2H 4的电离常数K a1=c N 2H +5·c OH -c N 2H 4=c (OH -)=10-6,C 正确;同理,据题图中C点计算电离常数K a2=c OH -·c N 2H 2+6c N 2H +5=c (OH -)=10-15,题图中D 点溶液中δ(N 2H 4)=δ(N 2H 2+6),则有K a1·K a2=10-6×10-15=c 2(OH -),解得c (OH -)=10-10.5 mol·L -1,D 正确。
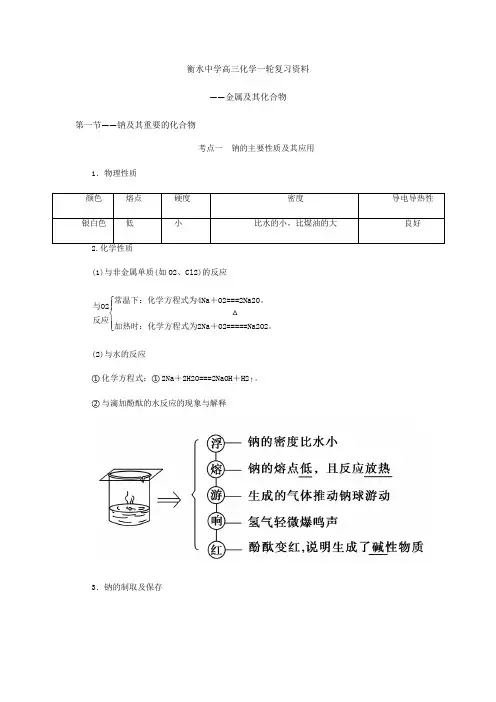
衡水中学高三化学一轮复习资料——金属及其化合物第一节——钠及其重要的化合物考点一 钠的主要性质及其应用1.物理性质(1)与非金属单质(如O2、Cl2)的反应与O2反应⎩⎪⎨⎪⎧常温下:化学方程式为4Na +O2===2Na2O 。
加热时:化学方程式为2Na +O2=====△Na2O2。
(2)与水的反应①化学方程式:①2Na +2H2O===2NaOH +H2↑。
②与滴加酚酞的水反应的现象与解释3.钠的制取及保存4.焰色反应(1)概念:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色。
属于物理变化,是元素的物理性质。
(2)常见元素焰色反应的颜色:钠元素:黄色;钾元素:紫色(透过蓝色钴玻璃)。
5.钠的用途考点阐释:1.金属钠露置在空气中的变化过程银白色金属钠Na ――→O2表面变暗生成Na2O ――→H2O 出现白色固体生成NaOH――→H2O 表面变成溶液NaOH 潮解――→CO2白色块状物质―→生成Na2CO3·10H2O――→风化白色粉末状物质生成Na2CO32.钠与水、酸、盐溶液的反应(1)钠与水、酸的反应实质上均是和H +反应钠与稀硫酸、盐酸等非氧化性酸反应时,首先是钠直接跟酸反应,过量的钠再与水反应,而不能认为是钠先跟水反应,生成的NaOH 再跟酸中和。
钠投入足量盐酸中反应的化学方程式:2Na+2HCl===2NaCl+H2↑离子方程式:2Na+2H+===2Na++H2↑(2)钠与盐溶液的反应先考虑Na与水反应生成NaOH,再考虑NaOH是否与盐发生复分解反应①投入NaCl溶液中,只有H2放出。
2Na+2H2O===2NaOH+H2↑②投入饱和NaCl溶液中,有H2放出,还有NaCl晶体析出(温度不变)。
③投入NH4Cl溶液中,有H2和NH3逸出。
④投入CuSO4溶液中,有H2放出和蓝色沉淀生成。
2Na+2H2O+CuSO4===Cu(OH)2↓+Na2SO4+H2↑考点二氧化钠和过氧化钠1∶21∶2考点阐释:Na2O2与某些氧化物反应的规律1.过氧化钠的强氧化性2.Na2O2与CO2、H2O反应的重要关系(1)气体体积差的关系2Na2O2+2CO2===2Na2CO3+O2 气体体积差①2 1 ΔV=12Na2O2+2H2O(g)===4NaOH+O2↑气体体积差②2 1 ΔV=1由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的12,即为生成氧气的量。


