理想气体的热力过程
- 格式:ppt
- 大小:5.18 MB
- 文档页数:75


第四章 理想气体的热力过程概 述热能⇔机械能的相互转化是靠工质在热力设备中吸热、膨胀、压缩等状态变化的过程来实现的,这个状态变化的过程就是热力过程,那么,在前面第一章研究的平衡状态,第二章研究理想气体的性质以及第三章研究分析开、闭口系热力状态变化的工具——热力学第一定律都是为这一章打基础。
前面第三章已提到过相同的工质在相同的温度下,不同的热力过程,能量转化的状况是不同的。
P V q q >,00v p w w ==膨技,,因此工程上实际过程多种多样、复杂、多变,不是可逆过程,据传递能量的工质不一不可能一一加以研究,何况逐个研究不总结规律性的知识用途也不大。
因此,我们仍采用热力学常用的方法,对复杂多样的热力过程进行合理化的假设。
认为是理想气体的可逆过程,这就是我们下面要研究的理想气体○V ○P ○T ○S 。
○P :例如各种环热设备,工质一面流动一面被加热,流动中克服阻力的压力降与其压力相比小很多,故认为压力不变。
○V :汽油机工作时,火花塞一点火,气缸内已被压缩的可燃混合气即燃烧,在一瞬间烧完,这期间气缸与外界无质量交换,活塞移动极微,可近似定容过程。
○T :如往复式压气机,气体在气缸中被压缩时温度升高,为了省功气缸周围有冷却水套,若冷却效果好,气缸中温度几乎不变,可近似定温过程。
○S :例气缸中燃烧产物在气缸中膨胀对外作功过程,由于工质与外界交换的热量很少可略去不计,认为是定熵过程。
上述过程实际上是略去次要因素后的一个等同特征,就是过程中有一个状态参数不变,对理想气体()u f t = ()h f t =这研究起来就方便很多,而且只有实际意义。
4—1 研究热力过程的目的及方法一. 目的1.实现预期的能量转化,合理安排热力过程,从而来提高功力装置的热经济性。
2.对确定的过程,也可预计热→功之多少。
二.解决的问题1.根据过程特点,寻找过程方程式 2.分析状态参数在过程中的变化规律3.确定热功转化的数量关系,及过程中,,u h s ∆∆∆的变化 4.在P —V ,T —S 图上直观地表示。


十、理想气体的热力过程10.1 过程目的及分析方法实施一热力过程(热力学状态连续变化过程)之1. 实现预期的热能-机械能的相互转换目的 (如燃气轮机、制冷机等);2. 达到预期的热力状态(如压气机)。
分析方法:因实际热力过程 复杂、不可逆(存在摩擦、流阻、温差散热、内部扰动)分析热力过程,先按理想的可逆过程(忽略上述不可逆因素)计算,在实际应用时,引入经验(实验)系数对其修正,以得到最终和实际接近的结果。
理想的可逆过程中有四个便于热力学分析的典型热力过程, 定压过程 C o n s t p = (如燃气轮机燃烧室加热过程) 定容过程 C o n s t v = (如汽油机汽缸中燃烧加热过程) 定温过程 C o n s t T = (冷却压气机的压缩过程)定熵过程 C o n s t s = (气体的高速压缩、膨胀过程) 4个过程参量分别对应着两对共轭的广延量与强度量。
因一般热力设备中的热力过程都可抽象为这四种或它们的组合,上述过程称为基本热力过程。
热力过程可更一般地表为 多变过程 C o n s t pv n =()(/101C v p n c c n n n nv p '=±∞====定容)定熵,(定温,定压,κ)复杂的实际过程总可用分段(n 变化)的多变过程来逼近对于不能抽象成理想气体的实际气体(如水蒸气、氟利昂等离相变区不远的气体)的热力过程借助图表分析计算。
10.2 过程方程定压过程 C o n s t p = 定容过程 C o n s t v = 定温过程 C o n s t T =绝热(定熵)过程 C o n s t s =p dp c V dv c ds v p +=−−→−=0ds 0=+p dpv dv c c v p →0=+pdp v dv κConst pv =→κ若定比热 取vp c c =κ,γκ=若变2121t t vt t p av c c =κ,或221κκκ+=av , 1,1,1v p c c =κ,2,2,2v p c c =κ多变过程C o n s t pv n = pv1n2n3n10.3 初、终态参数间关系定压过程 12p p = 1212T T v v = 定容过程 12v v =1212T T p p = 定温过程 12T T = + T R pv g = 1122v p v p = 定熵过程 12s s =κκ1122v p v p =→ 12112-⎪⎪⎭⎫ ⎝⎛=κv v T T ,11212-⎪⎪⎭⎫ ⎝⎛=κp p T T多变过程nn v p v p 1122= 12112-⎪⎪⎭⎫ ⎝⎛=n v v T T ,11212-⎪⎪⎭⎫⎝⎛=n p p T T10.4 内能、焓、熵的变化)(12T T c u v -=∆ )(1221t t c u t t v -=∆ )(12T T c h p -=∆ )(1221t t c h t t p -=∆1212ln ln p p R T T c s g p -=∆ 1212ln ln 21p p R T T c s gT T p -=∆ 1212ln lnv vR T T c g v +=1212ln lnv v c p p c p v +=10.5 过程体积功与技术功定压过程 )()(122112T T R v vp pdv w g -=-==⎰⎰=-=210v d p w t定容过程 ⎰==210pdv w , )(2121p p v v d p wt-=-=⎰定比热变比热定温过程 12111211122121ln ln lnp p v p v v v p v v T R dv vT R pdv w g g -=====⎰⎰ 1211211221ln lnp pv p p p T R dp pT R vdp w g g t -=-=-=-=⎰⎰ t w w = 绝热过程()kv v v p vC dv v C pdv w -----=-===⎰⎰1112112121121111κκκκκκ⎥⎥⎦⎤⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-=⎥⎥⎦⎤⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-=--12111211111-111-1κκκκv v T R v v v p g⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-=-κκκ112111-1p p T R g (也可通过能量方程去推()2211212111)(1)(v p v p T T R T T c u w w u q gv --=--=-=∆-=→-∆=κκ) ⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛--=⎥⎥⎦⎤⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛--=-=-=--⎰⎰κκκκκκκκκ112112121111211111p p T R v v T R dp p C vdp w g g t or()()()22112121211)(1v p v p T T R T T c T T c h w w h q g V p t t --=--=-=-=∆-=→+∆=κκκκκw w t κ=多变过程 ⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-=⎥⎥⎦⎤⎢⎢⎣⎡⎪⎪⎭⎫ ⎝⎛-=--n n g n g p p T R n v v T R n w 1121121111-111-1 ()22112111)(1v p v p n T T n R g--=--=nw w t =10.6 过程热量利用上面求得的w u ∆∆,即可由w u q +∆=得过程热量定压过程 ()())(12T T c h pv u pv u v p u q p -=∆=+∆=∆+∆=∆+∆=或 ()1221t t c q t t p-=定容过程 )(12T T c u q V -=∆= 或 ()1221t t c q t t V -=定温过程 0)(12=-=∆T T c u V1211121112ln ln ln p p v p v v v p v v T R w q g -====或 因过程可逆 121221ln ln v v T R p p T R s T Tds q g g =-=∆==⎰ 绝热过程 0=q多变过程 w u q +∆==)(1)(2112T T n R T T c gV --+- =)(1)(11-)(122112T T c n n T T c n T T c V V V ---=--+-κκ 故可得多变过程的比热V n c n n c 1--=κ10.7 过程图示IIIIIIIVvp定压0=n 定温1=n 定熵κ=n 定容±∞=np-v 图上,定容线与定压线将其分为了II 、、IV 四个区。

理想气体的基本热力过程热力设备中,热能与机械能的相互转化,通常是通过气态工质的吸热、膨胀、放热、压缩等热力过程来实现的。
实际的热力过程都很复杂,而且几乎都是非平衡、非可逆的过程。
但若仔细观察会发现,某些常见过程非常近似一些简单的可逆过程。
常见的主要有四种简单可逆过程-基本热力过程,指系统某一状态参数保持不变的可逆过程。
包括定容过程、定压过程、定温过程和绝热过程。
我们以1kg理想气体的闭口系统为例来分析这几种基本热力过程,分析方法包括5点:(1)依据过程特点建立过程方程式;(2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系,即P1、v1、T1和P2、v2、T2之间的关系;(3)绘制过程曲线;我们主要绘制两种坐标图P-v图和T-s图,因为P-v图上可以表示过程中做功量的多少,而T-s图上可以表示过程中吸收或放出热量的多少;(4)分析计算△u,△h,△s;(5)分析计算过程的热量q和功w。
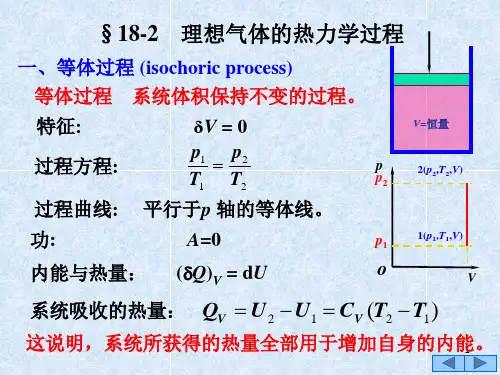
一、定容过程定容过程即工质的容积在整个过程中维持不变,dv=0,通常是一定量的气体在刚性容器中进行定容加热或定容放热。
(1)依据过程特点建立过程方程式定容过程的特点是体积保持不变,所以建立过程方程式:v=常数;或dv=0或v1=v2(2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系过程方程式:v1=v2理想气体状态方程:112212Pv P v T T = 由以上两个方程可以得到初末基本状态参数之间的关系:122211v v P T P T =⎧⎪⎨=⎪⎩ 即定容过程中工质的压力与温度成正比。
(3)绘制过程曲线;定容过程有两种情况:定容加热和定容放热。
(4)分析计算△u ,△h ,△s ;2211v v u u u c dT c T ∆=-==∆⎰ 2211p p h h h c dT c T ∆=-==∆⎰ 222111ln ln ln p v v v P P s c c c v P P ∆=+=或222111ln ln ln v v T v T s c R c T v T ∆=+= (5)分析计算过程的热量q 和功w 。





理想气体的典型热力过程
1. 等压过程:在恒定的压力下,气体的体积增加或减少,热量从气体传给环境或从环境传给气体。
这类过程也称作“伯努利过程”。
2. 等温过程:在恒定的温度下,气体随着压力的变化而膨胀或收缩,此时所吸收或释放的热量与温度成正比例。
这类过程也称作“卡诺过程”。
3. 等体过程:在恒定的体积下,气体的压强增加或减少,需要向气体注入或从气体中抽取热能。
这类过程也称作“热容过程”。
4. 绝热过程:在没有热量交换的情况下,气体的压强、温度和体积都同时变化。
这类过程也称作“奥托过程”。