2019年高考理综化学I卷和Ⅱ卷中的晶体结构:内容向纵深突进
- 格式:doc
- 大小:772.00 KB
- 文档页数:6

绝密★启用前2019年普通高等学校招生全国统一考试理科综合·化学(全国Ⅰ卷)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24 S 32 Fe 56 Cu 64一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点8.关于化合物2−苯基丙烯(),下列说法正确的是A.不能使稀高锰酸钾溶液褪色B.可以发生加成聚合反应C.分子中所有原子共平面D.易溶于水及甲苯9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A .向圆底烧瓶中滴加苯和溴的混合液前需先打开KB .实验中装置b 中的液体逐渐变为浅红色C .装置c 中的碳酸钠溶液的作用是吸收溴化氢D .反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl 气体分子在253 K 冰表面吸附和溶解过程的示意图。
下列叙述错误的是A .冰表面第一层中,HCl 以分子形式存在B .冰表面第二层中,H +浓度为5×10−3 mol·L −1(设冰的密度为0.9 g·cm −3)C .冰表面第三层中,冰的氢键网络结构保持不变D .冰表面各层之间,均存在可逆反应HCl H ++Cl −11.NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H 2A 的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。

绝密★启用前2019年普通高等学校招生全国统一考试(全国卷Ⅰ)理科综合能力测试(化学)注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 mg24 s32 fe56 u64一、选择题(共7题;共42分)1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是()A. “雨过天晴云破处”所描述的瓷器青色,来自氧化铁B. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C. 陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D. 陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点2.关于化合物2−苯基丙烯(),下列说法正确的是()A. 不能使稀高锰酸钾溶液褪色B. 可以发生加成聚合反应C. 分子中所有原子共平面D. 易溶于水及甲苯3.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是()A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开KB. 实验中装置b中的液体逐渐变为浅红色C. 装置c中的碳酸钠溶液的作用是吸收溴化氢D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯4.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是()A. 冰表面第一层中,HCl以分子形式存在B. 冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)C. 冰表面第三层中,冰的氢键网格结构保持不变D. 冰表面各层之间,均存在可逆反应HCl ⇌H++Cl−5.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。

42019年全国卷Ⅱ理综化学可能用到的相对原子质量:H1C12N14O16F19Na23S32Cl35.5As75I127 Sm150一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是A.蚕丝的主要成分是蛋白质B.蚕丝属于天热高分子材料C.“蜡炬成灰”过程中发生了氧化反应D.古代的蜡是高级脂肪酸酯,属于高分子聚合物8.已知NA是阿伏加德罗常数的值,下列说法错误的是A.3g3He含有的中子数为1NAB.1L0.1mol·L1磷酸钠溶液含有的PO3数目为0.1NAC.1mol K2Cr2O7被还原为Cr3+转移的电子数为6N AD.48g正丁烷和10g异丁烷的混合物中共价键数目为13NA9.今年是门捷列夫发现元素周期律150周年。
下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。
下列说法错误的是A.原子半径:W<XB.常温常压下,Y单质为固态C.气态氢化物热稳定性:Z<WD.X的最高价氧化物的水化物是强碱10.下列实验现象与实验操作不相匹配的是实验操作实验现象A向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置溶液的紫色逐渐褪去,静置后溶液分层BC将镁条点燃后迅速伸入集满CO2的集气瓶向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸集气瓶中产生浓烟并有黑色颗粒产生有刺激性气味气体产生,溶液变浑浊D向盛有FeCl3溶液的试管中加过量铁粉,充分黄色逐渐消失,加KSCN后溶液颜色不变振荡后加1滴KSCN溶液11.下列化学方程式中,不能正确表达反应颜色变化的是A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4Cu+ZnSO4B.澄清的石灰水久置后出现白色固体Ca(OH)2+CO2CaCO3↓+H2OC.Na2O2在空气中放置后由淡黄色变为白色2Na2O22Na2O+O2↑D.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl32Fe(OH)3+3MgCl212.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。

2019年高考全国I卷理综化学试题注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
相对原子质量:H:1;C:12;N:14;O:16;S:32;Cl:35.5;K:39;Ti:48;Fe:56;I:127一、选择题(本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)7、下列生活用品中主要由合成纤维制造的是A. 尼龙绳B. 宣纸C. 羊绒衫D. 棉衬衣【答案】A【解析】A.尼龙是聚酰胺,故它是合成纤维,故A正确;B.宣纸原料为木浆,主要成分为天然纤维(纤维素),故B错误C.羊毛的主要成分为蛋白质,故C错误D.棉花的主要成分为天然纤维,故D错误【考点】常用合成高分子材料的化学成分及其性能;天然高分子蛋白质、纤维素等;【专题】有机化合物的获得与应用。
【点评】本题考查常见高分子材料的分类及应用,题目难度不大,明确常见有机物组成、性质及分类为解答关键,注意掌握合成纤维与纤维素、蛋白质等区别.8、《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针,尖长者为胜,平短者次之”,文中涉及的操作方法是A. 蒸馏B. 升华C. 干馏D. 萃取【答案】B【解析】蒸馏即将液体转化为气体,再冷凝为液体。
升华是将固体直接转化为气体,再通过凝华转为固体。
结合生砒原本为固态及题意中的“如针”,题目中的状态转化为固-气-固,故选B升华。
【考点】物质的分离、提纯的基本方法选择与应用。
【专题】物质的分离提纯和鉴别。
【点评】本题考查物质的分离、提纯,为高频考点,侧重考查学生的分析能力和实验能力,有利于培养学生良好的科学素养,注意把握题给信息以及常见分离方法,难度不大.C H,下列说法正确9、化合物(b)、(d)、(p)的分子式均为66的是A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种C. b、d、p均可与酸性高锰酸钾溶液反应D. b 、d 、p 中只有b 的所有原子处于同一平面【答案】D【解析】A.(b )的同分异构体不止两种,如,故A错误 B.(d )的二氯化物有、、、、、,故B 错误C.(b )与(p )不与酸性4KMnO 溶液反应,故C 错误D.(d )2与5号碳为饱和碳,故1,2,3不在同一平面,4,5,6亦不在同一平面,(p )为立体结构,故D 正确。

2019年高考理综试卷-(全国II卷与答案)1.选择题共13小题,每小题6分,共计78分。
在每小题的四个选项中,只有一项符合题目要求。
1.真核细胞内质网和细胞核中能够合成的物质分别是:A。
脂质、RNAB。
氨基酸、蛋白质C。
RNA、DNAD。
DNA、蛋白质2.马铃薯块茎储藏不当会出现酸味,这种现象与马铃薯块茎细胞的无氧呼吸有关。
以下哪项叙述是正确的?A。
马铃薯块茎细胞无氧呼吸的产物是乳酸和葡萄糖B。
马铃薯块茎细胞无氧呼吸产生的乳酸是由丙酮酸转化而来C。
马铃薯块茎细胞无氧呼吸产生丙酮酸的过程不能生成ATPD。
马铃薯块茎储藏库中氧气浓度升高会增加酸味的产生3.某种H-ATPase是一种位于膜上的载体蛋白,具有ATP 水解酶活性,能够利用水解ATP释放的能量逆浓度梯度跨膜转运H。
以下哪项推测是不合理的?A。
H+-ATPase位于保卫细胞质膜上,蓝光能够引起细胞内的H+转运到细胞外B。
蓝光通过保卫细胞质膜上的H+-ATPase发挥作用导致H+逆浓度梯度跨膜运输C。
H+-ATPase逆浓度梯度跨膜转运H+所需的能量可由蓝光直接提供D。
溶液中的H+不能通过自由扩散的方式透过细胞质膜进入保卫细胞4.当人体失水过多时,以下哪项生理变化不会发生?A。
血浆渗透压升高B。
产生渴感C。
血液中的抗利尿激素含量升高D。
肾小管对水的重吸收降低5.某种植物的羽裂叶和全缘叶是一对相对性状。
某同学用全缘叶植株(植株甲)进行了以下四个实验。
哪个实验可以判定植株甲为杂合子?A。
植株甲进行自花传粉,子代出现性状分离B。
用植株甲给另一全缘叶植株授粉,子代均为全缘叶C。
用植株甲给羽裂叶植株授粉,子代中全缘叶与羽裂叶的比例为1:1D。
用植株甲给另一全缘叶植株授粉,子代中全缘叶与羽裂叶的比例为3:16.如果食物链上各营养级均以生物个体的数量来表示,并以食物链起点的生物个体数作底层来绘制数量金字塔,则数量金字塔的侧面积代表了:A。
生物个体的数量B。
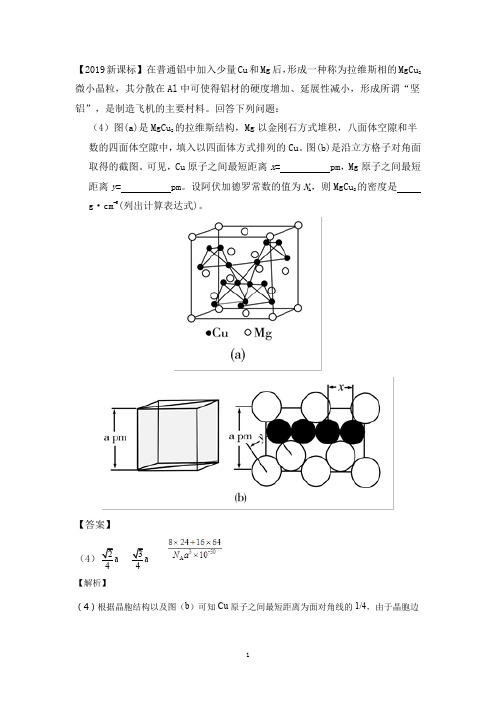
【2019新课标】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。
回答下列问题:(4)图(a)是MgCu的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半2数的四面体空隙中,填入以四面体方式排列的Cu。
图(b)是沿立方格子对角面取得的截图。
可见,Cu原子之间最短距离x= pm,Mg原子之间最短距离y= pm。
设阿伏加德罗常数的值为N A,则MgCu2的密度是g·cm−3(列出计算表达式)。
【答案】(4)2a3a【解析】(4)根据晶胞结构以及图(b)可知Cu原子之间最短距离为面对角线的1/4,由于晶胞边a pm;长是a pm,则x=4Mg原子以金刚石方式堆积,因此我们可以先把Mg原子的堆积方式提取出来,如图,其中原子坐标参数A为;B为;C为;E,这样就构成了正四面体A-BCE, D为正四面的重心,D的原子坐标参数(1/4,1/4,1/4)参考2016年全国卷1的物质结构试题。
结合图(b)我们不难发现Mg原子之间最短距离为AD的长度(即图b中y的长度),也就是正四面体的重心到各个顶点的距离。
所以可以利用正四面体的性质来解答y的长度。
解法一:把正四面体A-BCE从晶胞中拿出来,如下图,解:正四面体A-BCE的中心D到各个顶点的距离为y,延长AD交面BCE于H,H为三角形BCE中心(直观结论),重心D到底面的距离为 h,现令晶胞的边长为1,则正四面体的棱长为,结合正四面的性质,由题意知,CH=CO=××=,AH===,在Rt▵CHD中,CD2=DH2+CH2 即y2=(-y)2+1/6解此方程式y=。
当晶胞的边长为apm时,则y=34apm。
解法2:根据图b可以知道y为等腰▵ACD的一个边的长度。
过D点做AC的垂线交AC于F点,如图所示。
所以在等腰▵ACD有AD2=AF2+DF2AC= a pm,AF=24a pm, DF=1/4 a,即y2=(24a)2+(1/4 a)2解得根据晶胞结构可知晶胞中含有镁原子的个数是8×1/8+6×1/2+4=8,则Cu原子个数16,晶胞的质量是。
2019年第二次全国大联考【新课标Ⅰ卷】理科综合·化学(考试时间:50分钟试卷满分:100分)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。
写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 B 11 C 12 O 16 Na 23 S 32 Fe 56 Zn 65 As 75第Ⅰ卷一、选择题:本题共7个小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与社会、生活、科技有着密切的联系,下列说法中不正确的是A.利用高纯硅制造的太阳能电池板,可将光能直接转化为电能B.大量使用含丙烷、二甲醚等辅助成分的“空气清新剂”,会对环境造成新的污染C.陶瓷的烧制、石油的分馏、煤的干馏过程中,均涉及化学变化D.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强8.设N A为阿伏加德罗常数的值。
下列有关叙述正确的是A.100 mL 0.1 mol·L−1的Na2CO3溶液中,含阴离子的数目大于0.01N AB.1 mol SO2与足量O2充分反应生成SO3,共转移电子数为2N AC.标准状况下,22.4 L CHCl3中含有的C—Cl键数为3N AD.46.8 g过氧化钠晶体中所含阴离子的数目为1.2N A9.下列关于有机物结构和性质的说法错误的是A.分子式为C5H10O且能发生银镜反应的结构有4种B.淀粉、蛋白质和油脂都是天然高分子化合物C.苯乙烯()分子中所有原子可能位于同一平面D.1 mol盐酸美西律()最多可与3 mol H2发生加成10.某学习小组拟利用下列装置探究CO2和锌粉反应是否生成CO,已知CO能与氯化钯溶液发生反应生成黑色金属钯:CO+PdCl2+H2O CO2+Pd↓+2HCl。
绝密★启用前2019年普通高等学校招生全国统一考试理科综合能力测试化学部分可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A. “雨过天晴云破处”所描述的瓷器青色,来自氧化铁B. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C. 陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D. 陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点2.关于化合物2−苯基丙烯(),下列说法正确的是A. 不能使稀高锰酸钾溶液褪色B. 可以发生加成聚合反应C. 分子中所有原子共平面D.易溶于水及甲苯3.实验室制备溴苯反应装置如下图所示,关于实验操作或叙述错误的是A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开KB. 实验中装置b中的液体逐渐变为浅红色C. 装置c中的碳酸钠溶液的作用是吸收溴化氢D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯4.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是A. 冰表面第一层中,HCl以分子形式存在B. 冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)C. 冰表面第三层中,冰的氢键网格结构保持不变D. 冰表面各层之间,均存在可逆反应HCl H++Cl−5.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。
2019全国高考(Ⅰ、Ⅱ、Ⅲ、江苏卷)物质结构与性质试题深度解析35.(2019全国Ⅰ卷)[化学—选修3:物质结构与性质](15分)在普通铝中加入少量Cu 和Mg ,后形成一种称为拉维斯相的MgCu 2微小晶粒,其分散在Al 中可使得铝材的硬度增加,延展性减小,形成所谓"坚铝",是制造飞机的主要材料。
回答下列问题:(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_____________(填标号)。
A 、[Ne]B 、[Ne] C 、[Ne]D 、[Ne] (2)乙二胺(H 2NCH 2CH 2NH 2)是一种有机化合物,分子中氮、碳的杂化类型分别是____________、____________________。
乙二胺能与Mg 2+、Cu 2+等金属离子形成稳定环状离子,其原因是___________________________,其中与乙二胺形成的化合物稳定性相对较高的是______________________(填“Mg 2+”或“Cu 2+”)。
(3)一些氧化物的熔点如下表所示:解释表中氧化物之间熔点差异的原因__________________________________________。
(4)图(a )是MgCu 2的拉维斯结构,Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu 。
图(b )是沿立方格子对角面取得的截图。
可见,Cu 原子之间最短距离x=___________pm ,Mg 原子之间最短距离y=______________pm 。
设阿伏加德罗常数的值为N A ,则MgCu 2的密度是________________g •cm -3(列出计算表达式)。
【答案】(1)A(a ) (b )(2)sp 3、 sp 3。
乙二胺的两个N 提供孤对电子给金属离子形成配位键,从而形成环状稳定结构;Cu 2+(3)Li 2O 、MgO 为离子晶体,P 4O 6、SO 2为分子晶体,晶格能:MgO >Li 2O ,分子间作用力(相对分子质量):P 4O 6>SO 2。
2019年高考全国卷1理综(化学部分)试题及答案可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35。
5 Ar 40 Fe 56 I 127 一、选择题:每小题6分.在每小题给出的四个选项中,只有一项是符合题目要求的。
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点9.实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红色C.装置c中的碳酸钠溶液的作用是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图。
下列叙述错误的是11.NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1。
1×10−3,Ka2=3。
9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点.下列叙述错误的是A.混合溶液的导电能力与离子浓度和种类有关B.Na+与A2−的导电能力之和大于HA−的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)〉c(K+)〉c(OH−)12.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。
下列说法错误的是A.相比现有工业合成氨,该方法条件温和,同时还可提供电能B.阴极区,在氢化酶作用下发生反应H2+2MV2+2H++2MV+C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3D.电池工作时质子通过交换膜由负极区向正极区移动13.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。
高考《晶体结构》:内容向纵深突进安徽黄山巨人教育胡征善2019年高考理综化学I卷和Ⅱ卷中的晶体结构试题,内容有向纵深发展的迹象,对2020年高考备考复习有着暗示作用。
一、试题分析2019年理综I卷35.在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。
回答下列问题:(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。
图(b)是沿立方格子对角面取得的截图。
可见,Cu原子之间最短距离x=_______pm,Mg原子之间最短距离y=_______pm。
设阿伏伽德罗常数的值为N A,则MgCu2的密度是_____ g·cm—3(列出计算表达式)。
【解析】①欲求原子间的最短距离,先要分析原子间相切。
根据图(b)可知:Cu 原子间相切是面对角线4x,Mg原子间相切是体对角线4y。
在立方晶胞中,若已知晶胞常数a,面对角线(红线)为a,体对角线(蓝线)为a。
则有:4x=a,4y=a,故x =a/4,y=a/4。
②欲求MgCu2的密度,先必须求MgCu2拉维斯结构的化学式。
“Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙,填入以四面体方式排列的Cu”和(a)结构图可知:8个四面体空隙填有4个Cu4四面体,八面体空隙是4个Cu4四面体最邻近的Cu连接成一个八面体空隙的四面体(下图中红线连接部分),Cu 原子数16,Mg原子数8(既可由化学式MgCu2求得,也可由分摊法顶点8×1/8+面6×1/2+体内4),拉维斯结构图的化学式为Mg8Cu16。
也可根据分摊法求出Mg数再根据化学式MgCu2求出Cu原子数。
【答案】x=a/4,y=a/4ρ(MgCu2)=8M(MgCu2)/(N A×a3)=8(24+2×64)/[N A(a×10—10)3]2019年理综Ⅱ卷35.近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。
回答下列问题:(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(1/2,1/2,1/2),则原子2和3的坐标分别为__________、__________。
【解析】根据图1和图2可知:Sm和As分别处在2个小四方体8个侧面面心(前后左右侧面交替排列),侧面As和Sm各有4个,晶胞内分摊:2个As和2个Sm,2个Fe,顶点和底面面心共2个O或F,因此晶胞中原子数之比:Sm︰Fe︰As︰O或F=1︰1︰1︰1,若F−为x,则O2−为1−x。
故化学式为:SmFeAsO1—x F x【答案】SmFeAsO1F x 2[281+16(1—x)+19x]/(a2cN A×10—30)—x(1/2,1/2,0) (0,0,1/2)二、内容拓展通过上面2题的分析:虽然延续了历年命题对晶胞结构的认识、晶胞密度的求算(晶胞常数、分摊法求晶胞化学式)等知识,在考查的内容上有较大的变化:1、晶胞结构的投影:由三维结构转化为二维(或一维)结构;2、晶胞类型突破了立方晶系,涉及到四方晶系;3、涉及了晶胞的空隙数、分数坐标。
关注配位数。
这些拓展需要结合试题背景,运用数学上的立几知识来解决题设问题。
(1)常见晶胞的空隙正四面体空隙正八面体空隙r(空隙)=0.225r r(空隙)=0.414r(面对角线相切)[r+r(空隙)=3h/4=3×(/3)×2 r/4=r/2] 此外还有三角形空隙、立方体空隙、三角柱空隙。
面心立方(A1):每个晶胞中,有4个球,四面体空隙数有8个,八面体空隙有4个——中心1个,12条棱心12×1/4=3。
所以整个晶体中:球数:四面体空隙:八面体空隙=1:2:1面心两点间距离为a/2六方晶胞(A3)每个晶胞中,粗线为截取的晶胞。
晶胞上底面的3个原子和中层的2个原子(其中有1个是晶胞外的原子)和晶胞外另1个原子构成1个正八面体的空隙(1、2、3、4构成平面,5、6在平面上下)。
此正八面体在晶胞中占1/2,晶胞中共有4个这样的正八面体,故晶胞中正八面体空隙数为1/2×4=2。
正四面体空隙,正四面体空隙数1/4×8+2=4。
所以在A3每个晶胞中,球数:正四面体数:正八面体数=2:4:2=1:2:1。
空隙:八面体紫色:八面体蓝色:四面体四面体体心立方(A2)型堆积中有变形八面体空隙、变形四面体空隙和三角形空隙(亦可视为变形三方双锥空隙)。
八面体空隙存在于面心和棱心,其数目=6×1/2+12×1/4=6,每个原子平均摊到3个八面体空隙,该空隙是压扁了的八面体,长轴为a,短轴为a,其空隙中可容纳的另一原子的最大半径为0.154r(见下求证)。
设原来的原子半径为r,可容纳另一原子的最大半径为r0。
a=4r /,即:r+r0=a/2=2r /,r0= [(2/)—1]r=0.154r四面体空隙存在于面上,每个面上有4个,其数目=4×6×1/2=12,每个原子平均摊到6个四面体空隙,该空隙是压扁了的四面体,2条长轴为a,4条短轴为a/2,其空隙可容纳的另一原子的最大半径为0.291r(见下求证)。
设原来的原子半径为r,可容纳另一原子的最大半径为r0。
r+r0=a/4 =(/4)×4r /=r /,r0=[(/)—1] r =0.291r球数:变形正四面体数:变形正八面体数=2:12:6=1:6:3。
三角形空隙实际上是上述两种多面体空隙的连接面,三角形空隙存在于面上和体内,每条棱的面上有2个,体内有1个,其数目12(2/2+1)=24个,每个原子分摊12个。
几种典型的金属单质晶体结构小结结构堆积方式密置层叠放方式配位数晶胞中球数球数︰八面体空隙数︰四面体空隙数空间利用率/%实例A1立方最密ABCABC 12 4 4:4:8=1:1:2 74.5 Cu Ag Au Ni Pd Pt…A3六方最密ABABAB 12 2 2:2:4=1:1:2 74.5 Be Mg Zn Cd Zr La…A2立方体心8 2 2:6:12=1:3:668.02 Li Na K Cr Mo W…A4金刚石型 4 8 34.01 Ge 灰锡综上可知:八面体空隙数︰四面体空隙数均为1:2(最简比)。
(1)晶胞的边长为单位1,8个顶点是相同的原子对晶胞贡献是1个原子,其坐标为(0,0,0),不取(1,1,1)。
其它原子的坐标值均为<1的分数(相反方向可取负值);(2)分数坐标数==晶胞化学式中的粒子数;(3)相同环境的点取离坐标原点最近的点。
如:平行六面体的8个顶点只取(0,0,0);6个面心只取(1/2,1/2,0)、(0,1/2,1/2)、(1/2,0,1/2);12条棱心只取(1/2,0,0)、(0,1/2,0)、(0,0,1/2)。
体内每个点均需写出。
例如2019年理综Ⅱ卷35(见图1).原子的分数坐标:Sm:(1/2,0,1/4)(0,1/2,3/4) ,不取(1/2,1,1/4)(1,1/2,3/4)Fe:原子1、3的坐标见答案,不取(1,0,1/2)(1,1,1/2)(0,1,1/2)As:(0,1/2,1/4)(1/2,0,3/4),不取(1, 1/2,1/4)(1/2,1,3/4)O或F:(0,0,0)(1/2,1/2,1/2)【变式题】下图是铜镁合金的拉维斯(Laves,德国矿物学家、晶体学家)结构:1、写出该合金拉维斯结构的最简化学式和Mg原子的堆积方式2、4个Cu原子构成正四面体填充在何种空隙,占有率分别是多少?3、若取坐标系,写出Mg和Cu4的分数坐标。
4、Mg和Cu原子的配位数各是多少?5、沿面对角线截图得下图:则Mg和Cu的原子半径比是多少?6、已知Mg原子半径为160.0 pm,求该合金的密度。
【答案】1、MgCu2金刚石型2、8个四面体空隙和四个八面体空隙(体心1个,棱心3个=12×1/4),Cu4四面体占据4个四面体空隙,占有率50%,占据1个八面体空隙,占有率25%3、8个Mg:顶点(0,0,0)面心(1/2,1/2,0)(1/2,0,1/2)(0,1/2,1/2)体内(3/4,1/4,1/4)(1/4,3/4,1/4)(1/4,1/4,3/4)(3/4,3/4,3/4)Cu4缩为一点,4个Cu4占据4点(以表示)其分数坐标为:(1/4,1/4,1/4)(3/4, 3/4,1/4)(3/4,1/4,3/4)(1/4,3/4,3/4)可与体内4个Mg的分数坐标互换4、每个Mg原子有4个Mg和12个Cu配位,配位数为16,每个Cu原子有6个Mg原子和6个Cu原子配位,配位数为12【解析】配位数是指某质点(一般是原子)最邻近的质点数(原子数)。
金刚石中每个C原子的配位数为4(见前述的表中数据)。
但在铜镁合金的Laves 结构中体内多了4个Cu4(见上图),考察体内某个Mg原子的周围除了另外4个Mg原子,还有前后左右4个Cu4,且与面上的3个Cu等距,所以共有12个Cu原子与之配位。
考察图中红点的Cu原子,周围有另外6个Cu原子配位,6个Mg原子(红线) 有关配位数的考点在2017年理综I卷曾考过:与K紧邻的O个数为______。
【答案】12【解析】在此晶胞中有3个面心O与K最紧邻,分摊到此晶胞中只有1.5个O,若使K原子处于大立方体的体心,则需8个此晶胞组成,故1.5×8=12.5、因4x=a,4y=a,所以r(Mg)/r(Cu)= y/x=1.51/2=1.2256、a=4y/=8r(Mg)/=739.0 pm=7.390×10—8 cmρ=8M(MgCu2)/(N A×a3)=8(24.31+2×63.55)/[6.022×1023×(7.390×10—8)3]=4.99 g/cm3。