卤代烃及亲核取代反应
- 格式:ppt
- 大小:1018.50 KB
- 文档页数:95


卤代烃的化学性质卤代烃最典型、最具代表性的反应有两类:亲核取代反应和消除反应,另外,卤代烷还可与活泼金属反生成金属有机化合物。
一、亲核取代反应⏹ 在卤代烃分子中,由于Cl 的电负性大于C ,则C-Cl 键中的共用电子对就偏向于Cl 原子一端,使Cl 带有部分负电荷(Cl -δ),碳原子带部分正电荷(C +δ)。
这样C 原子就成为亲电反应中心,当与-OH 、-NH2等一些亲核试剂(带负电或富电子物种)时,亲核试剂就会进攻C +δ,Cl 则带一个单位负电荷离去。
⏹ 亲核试剂:带负电荷或有未共用电子对的具有亲核性的试剂。
⏹ 亲核取代反应:由亲核试剂进攻带部分正电荷的C +δ原子而引起的取代反应。
⏹ 亲核取代反应可用下面反应式表示+XR X +R Nu -Nu -⏹ 亲核试剂(Nucleophile ) 通常用 :Nu- 表示。
⏹ 取代反应(Substitution ) 通常用 S 表示。
⏹ 亲核取代反应 就用 SN 表示。
⏹ 卤烃常见的亲核取代反应有:⏹ 1. 水解 2. 醇解 3. 氰解 4. 氨解 5. 与硝酸银的反应 6. 与炔化钠的反应 (一)卤烃的水解⏹ 卤代烷与水作用,水解为醇,反应是可逆反应。
如:CH 3CH 2Br + H 2O CH 3CH 2OH + HBr在一般情况下,此反应很慢。
为增大反应速率,提高醇的产率,常加入强碱(氢氧化钠),使生成的HX 与强碱反应,可加速反应并提高了醇的产率。
CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr⏹ 此反应工业用途不大,因卤烷在工业上是由醇制取,但可用于有机合成中官能团的转化。
用于复杂分子中引入羟基(先卤代,再水解)。
(二)卤烃的醇解⏹ 卤烃的醇解是卤烃与醇钠的醇溶液反应,生成醚。
CH 3CH 2Cl + CH 3CH 2ONa CH 3CH 2OCH 2CH 3 + NaCl⏹ 此反应是制备混合醚的经典合成方法,称为威廉森(Williamson )合成法。



卤代烃亲核取代和消除反应机理亲核取代反应历程卤代烃的亲核取代反应是⼀类重要反应,由于这类反应可⽤于各种官能团的转变,在有机合成中具有⼴泛的⽤途,因此,对其反应历程的研究也就⽐较重要。
在亲核取代反应中,研究最多的是卤代烃的⽔解,在反应的动⼒学、⽴体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动⼒学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进⾏的,即双分⼦亲核取代反应(S N 2反应)和单分⼦亲核取代反应(S N 1反应)。
⼀、双分⼦亲核取代反应(S N 2反应)实验证明:伯卤代烃的⽔解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为⽔解速率,k 为⽔解常数。
因为RCH 2Br 的⽔解速率与RCH 2Br 和OH -的浓度有关,所以叫做双分⼦亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背⾯进攻中⼼碳原⼦。
当亲核试剂与中⼼碳原⼦之间逐渐成键时,离去基团与中⼼碳原⼦之间的键逐渐断裂,新键的形成和旧键的断裂是同步进⾏的协同过程,其反应过程如下所⽰。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可⽤反应进程-势能曲线图表⽰如下:S N 2反应进程中的能量变化3.S N 2反应的⽴体化学:背⾯进攻和构型翻转。
(1)背⾯进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同⼀边或离去基团的背⾯进攻中⼼碳原⼦(C δ+)。
若从离去基团的同⼀边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升⾼,不利于反应的进⾏。
若从离去基团的背⾯进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进⾏。
(2)构型翻转:在S N 2反应中,中⼼碳原⼦由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中⼼碳原⼦的两边,且与中⼼碳原⼦处在同⼀直线上,中⼼碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu⼦与它上⾯的其他三个基团处于同⼀平⾯内。


卤代烃的亲核取代反应亲核取代反应是有机化学中一种重要的反应类型,其中卤代烃作为反应物参与。
这类反应是通过亲核试剂与卤代烃之间的反应来实现,产物通常是新生成的化学键。
在本文中,我们将详细探讨卤代烃的亲核取代反应及其应用。
一、亲核取代反应简介亲核取代反应是一种通过亲核试剂攻击含有可离子性卤素的有机化合物的取代反应。
在这种反应中,亲核试剂以亲核性离子或亲核中心作为活性试剂,攻击卤代烃中的卤素离子,从而将卤素离子取代为新的官能团或基团。
这种取代反应的产物往往具有更加活泼和活性的性质。
二、亲核试剂的选择在亲核取代反应中,选择合适的亲核试剂非常重要。
常见的亲核试剂包括碱(如氢氧化钠、氢氧化钾)、醇类、胺类、硫醇、卤代醇和卤代胺等。
亲核试剂的选择应根据反应的需求以及亲核试剂的性质来确定。
三、亲核取代反应的机理亲核取代反应的机理主要有两种类型:亲核取代SN2反应和亲核取代SN1反应。
1. SN2反应机理:在SN2反应中,亲核试剂以一个步骤进攻卤代烃的碳中心,同时将离去基团踢出。
这种反应机理通常发生在较低的温度下,并且是一种立体选择性反应。
2. SN1反应机理:在SN1反应中,卤代烃首先发生解离,形成卤素离子和一个碳阳离子中间体。
随后,亲核试剂攻击碳阳离子,生成产物。
这种反应机理常发生在较高的温度下,并且不具有立体选择性。
四、亲核取代反应的应用1. 制备醇类化合物:通过亲核取代反应,可以将卤代烃与醇反应,生成醇类化合物。
这种反应常用于有机合成中,特别是制备醇类溶剂或中间体。
2. 制备胺类化合物:亲核取代反应对于合成胺类化合物也非常常见。
卤代烃与胺反应,可以得到相应的胺化合物,该反应广泛用于制备医药和农药中的胺类化合物。
3. 制备酯类化合物:通过卤代烃与醇类反应,可以得到酯类化合物。
这种反应常用于合成食品添加剂、香料以及某些有机合成反应的催化剂。
4. 制备硫醚化合物:卤代烃与硫醇反应,可以生成硫醚化合物。
硫醚是一类重要的有机溶剂和催化剂,具有广泛的应用。



六, 卤代烃的亲核取代反应、消除反应及和金属的反应卤代烃的亲和取代和消除是有机化学中的难点,希望同学们能比较仔细地阅读本部分内容。
这里有一些内容和一般的教科书中介绍的有所不同。
6-1 卤代烃的亲核取代反应,S N1和S N2在有机化学反应中,常常把反应物分为底物和试剂。
在讨论卤代烃的反应中,卤代烃就是底物。
本节主要讨论卤代烷作为底物的取代反应。
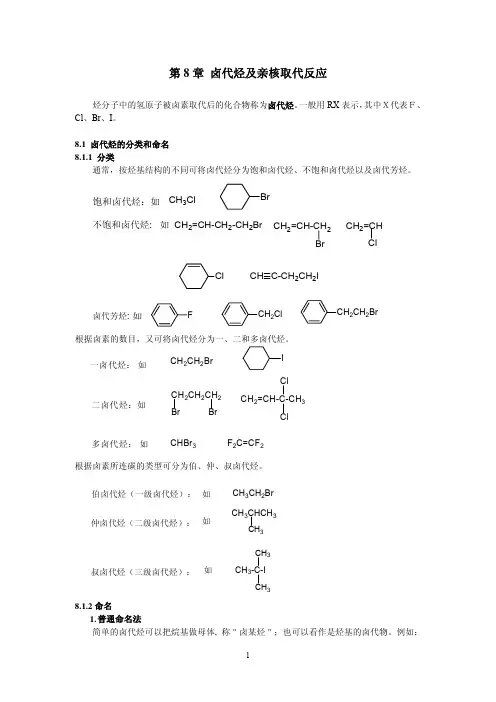
卤代烷就是烷烃中的一个氢为卤素取代的“结构为RX(R=烷基,X=卤素)的化合物,又称为烷基卤[化物],P5。
”取代反应就是“分子中某一原子或基团被另一原子或基团替换的基元或分步反应,P86。
”卤代烷的亲核取代反应就是富电子的或带负电荷的试剂把卤代烃中卤素取代下来的反应。
这个反应在合成中非常有用。
例如:RX + Na+ -OH −→ROH + Na+X-RX + Na+ -OR’−→ROR’ + Na+X-制醚的重要方法,称为Williamson醚合成法RX + Na+ -CN −→RCN + Na+X-制腈的重要方法RX + Na+ -C≡CH −→RC≡CH + Na+X-把炔键引入分子从上面的几个反应来看,钠离子没有在反应中起作用,起作用的是-OH、-OR、-CN、-C≡CH等负离子。
是这些负离子把卤素负离子取代了下来。
在这个反应中卤代烷中的卤素是带着一对电子成为卤素负离子离去的,叫做离去基团。
如果把带负电荷的亲核试剂写成Nu-而把离去基团写成-L。
那么卤代烷的亲核取代反应就可以拓展为:R-L + Nu-−→RNu + L-这实际上可看成是一个广义的酸碱反应。
只要是带负电荷的亲核试剂Nu-的碱性比取代下来的离去基团L-的碱性强,这种反应就能发生。
亲核试剂可以是:HO-、RO-、CN-、HC≡C-、RCOO-、CH3COC-HCOOC2H5(以后会知道这就是乙酰乙酸乙酯的合成法)、C2H5OOCC-HCOOC2H5(丙二酸二乙酯合成法)……如果把上面的氧原子换成硫原子,又是一批亲核试剂。
亲核取代反应历程卤代烃的亲核取代反应是一类重要反应,由于这类反应可用于各种官能团的转变,在有机合成中具有广泛的用途,因此,对其反应历程的研究也就比较重要。
在亲核取代反应中,研究最多的是卤代烃的水解,在反应的动力学、立体化学,以及卤代物的结构,溶剂等对反应速率的影响等都有不少的资料。
根据化学动力学的研究及许多实验表明,卤代烃的亲核取代反应是按两种历程进行的,即双分子亲核取代反应(S N 2反应)和单分子亲核取代反应(S N 1反应)。
一、双分子亲核取代反应(S N 2反应)实验证明:伯卤代烃的水解反应为S N 2历程。
RCH 2Br+OH -→RCH 2OH+Br -,v =k [RCH 2Br]·[OH -],v 为水解速率,k 为水解常数。
因为RCH 2Br 的水解速率与RCH 2Br 和OH -的浓度有关,所以叫做 双分子亲核取代反应(S N 2反应)。
1.S N 2反应机理:亲核试剂(Nu -)从离去基团(L)的背面进攻中心碳原子。
当亲核试剂与中心碳原子之间逐渐成键时,离去基团与中心碳原子之间的键逐渐断裂,新键的形成和旧键的断裂是同步进行的协同过程,其反应过程如下所示。
反应物(sp 3) 过渡态(sp 2)产物(sp 3) 2.S N 2反应的能量变化,可用反应进程-势能曲线图表示如下:S N 2反应进程中的能量变化3.S N 2反应的立体化学:背面进攻和构型翻转。
(1)背面进攻反应:在S N 2反应中,亲核试剂Nu -可以从离去基团的同一边或离去基团的背面进攻中心碳原子(C δ+)。
若从离去基团的同一边进攻,则亲核试剂与带负电荷的离去基团(L δ-)之间,除空间障碍外,还因同种电荷相互排斥使反应活化能升高,不利于反应的进行。
若从离去基团的背面进攻,则反应活化能较低,容易形成相对较稳定的过渡态,反应易于进行。
(2)构型翻转:在S N 2反应中,中心碳原子由反应底物时的sp 3杂化转变为过渡态时的sp 2杂化,这时亲核试剂与离去基团分布在中心碳原子的两边,且与中心碳原子处在同一直线上,中心碳原CδδNu C + L -δδNu C + L δδNu C + L -Nu子与它上面的其他三个基团处于同一平面内。
卤代烃及金属有机化合物一.亲核取代反应:1水解反应:卤代烷与水作用发生水解反应,产物是醇和相应的卤化氢。
由于离去基X-的亲核性及碱性比水分子强,所以卤代烷的水解反应是可逆反应。
为了使水解反应进行完全,加入碱OH-则反应为不可逆,这是由于碱性强弱次序为:OH>X>H2O。
卤代烷在碱性条件下的水解是强喊取代了弱碱。
离去基X-的碱性越小,就越易于被HO-取代。
相同烷基不同卤原子的卤代烷,它们的水解反应活性是:RI>RBr>RCl >RF-2.醇解反应与醇钠作用卤代烷与醇钠在相应醇溶液中反应,卤原子被烷氧基(—OR)取代生成醚。
这种方法常用下合成不对称的醚,称为Williamson法合成醚;但此方法对所使用的卤代烷有限制,一般是使用伯卤代烷,而不能使用叔卤代烷,否则得到的主产物将不是醚而是烯烃。
对于不同的卤代烷,卤原子被取代的难易次序是:Rl>RBr>RCI》RF。
3.氨解反应:氨与卤代烷发生亲核取代反应,结果在碳原予上引人了一个氨基生成伯胺。
伯胺属有机弱碱,它与生成的卤化氢结合形成盐,当这个盐与强碱作用时,则得到游离的伯胺。
4.氰解反应卤代烷与氰化钠或氰化钾作用,则卤原子被氰基(一CN)取代生成睛(R—CN)。
通常是由伯或仲卤代烷的醇溶液与氰化钠作用来合成睛的。
卤代烷转变成睛后,分子中增加了一个碳原子,这是有机合成中增长碳链的方法之一。
在以上反应中,卤代烷的活性都是RI>RBr>RCl >RF,与三级卤代烷反应时基本都是烯烃。
-5卤离子交换反应(鉴别氯代烃或者溴代烃)在丙酮中,氯代烷和溴代烷分别与碘化钠反应,则生成碘代烷。
这是由于碘化钠溶于丙酮,则生而氯化钠和溴化钠不溶于丙酮,从而有利于反应的进行。
氯代烷和溴代烷的活性次序是1°> 2°> 3°。
碘化钠的丙酮溶液很稳定,且操作方便。
故此反应可用于检验氯代烷和溴代烷。
6..与硝酸银作用(推测卤代烃可能结构)卤代烷与硝酸银的乙醇溶液反应,生成卤化银沉淀:不同的卤代烷,其活性次序也是RI>RBr>RCl;当卤原子相同而烷基结构不同时,其活性次序为:3°>2°>1。
卤代烃的消除反应和取代反应以卤代烃的消除反应和取代反应为主题,我们来探讨一下这两种常见的有机化学反应。
我们来讨论卤代烃的消除反应。
消除反应是指在适当的条件下,卤代烃中的卤素原子与相邻碳原子之间的键被断裂,形成双键或三键。
消除反应通常需要加热或使用碱性条件。
最常见的消除反应是氢氧化钠或氢氧化钾存在下的醇消除反应,也称为醇酸消除反应。
在碱性条件下,卤代烃中的卤素原子被氢氧根离子取代,生成醇和卤化钠或卤化钾。
这个反应是通过亲核取代机制进行的。
在反应过程中,碱性条件下的氢氧根离子攻击卤代烃中的碳原子,断裂碳-卤键,形成碳阳离子中间体。
然后,碳阳离子会捕获溶液中的氢氧根离子,生成醇。
最后,生成的醇和卤化钠或卤化钾会在溶液中分离出来。
另一种常见的消除反应是碱性条件下的醇醚消除反应。
在碱性条件下,醇醚中的氢氧根离子攻击卤代烃中的碳原子,形成碳阳离子中间体。
然后,碳阳离子会捕获醇醚中的氢氧根离子,生成烯烃和醇或醚。
接下来,我们来讨论卤代烃的取代反应。
取代反应是指卤代烃中的卤素原子被其他原子或基团取代的反应。
取代反应通常需要使用亲核试剂或电荷亲和试剂。
最常见的取代反应是亲核取代反应。
在亲核取代反应中,亲核试剂攻击卤代烃中的卤素原子,形成碳-亲核试剂键。
在这个过程中,亲核试剂可以是氢氧根离子、醇分子、胺分子等。
最常见的亲核取代反应是氢氧根离子取代反应,也称为SN2反应。
在SN2反应中,亲核试剂从卤素的背面进攻,同时卤素原子离去,形成一个过渡态。
然后,亲核试剂与过渡态中的碳原子形成新的键,形成取代产物。
SN2反应是一个一步反应,不经历离去基团离去的过渡态。
除了SN2反应,还有SN1反应。
在SN1反应中,卤代烃中的卤素原子先离去,形成一个稳定的碳阳离子中间体。
然后,亲核试剂攻击碳阳离子,形成取代产物。
SN1反应是一个两步反应,首先发生离去基团的离去,然后再发生亲核试剂的攻击。
除了亲核取代反应,还有电荷亲和取代反应。
在电荷亲和取代反应中,电荷亲和试剂攻击卤代烃中的卤素原子,形成一个离子中间体。