硼元素的简介-无机与分析化学
- 格式:doc
- 大小:52.50 KB
- 文档页数:5

元素序号:5元素符号:B元素名称:硼元素原子量:10.81元素类型:非金属发现人:戴维、盖吕萨克、泰纳发现年代:1808年发现过程:1808年,英国的戴维和法国的盖吕萨克、泰纳,用钾还原硼酸而制得硼。
元素描述:它是最外层少于4个电子的仅有的非金属元素。
其单质有无定形和结晶形两种。
前者呈棕黑色到黑色的粉末。
后者呈乌黑色到银灰色,并有金属光泽。
硬度与金刚石相近。
无定形的硼密度2.3克/厘米3,(25-27℃);晶形的硼密度2.31克/厘米3,熔点2300℃,沸点2550℃,化合价3。
在室温下无定形硼在空气中缓慢氧化,在800℃左右能自燃。
硼与盐酸或氢氟酸,即使长期煮沸,也不起作用。
它能被热浓硝酸和重铬酸钠与硫酸的混合物缓慢侵蚀和氧化。
过氧化氢和过硫酸铵也能缓慢氧化结晶硼。
上述试剂与无定形硼作用激烈。
与碱金属碳酸盐和氢氧化物混合物共熔时,所有各种形态的硼都被完全氧化。
氯、溴、氟与硼作用而形成相应的卤化硼。
约在600℃硼与硫激烈反应形成一种硫化硼的混合物。
硼在氮或氨气中加热到1000℃以上则形成氮化硼,温度在1800-2000℃是硼和氢仍不发生反应,硼和硅在2000℃以上反应生成硼化硅。
在高温时硼能与许多金属和金属氧化物反应,生成金属硼化物。
元素来源:制备方法有:硼的氧化物用活泼金属热还原;用氢还原硼的卤化物;用碳热还硼砂;电解熔融硼酸盐或其他含硼化合物;热分解硼的氢化合物上述方法所得初产品均应真空除气或控制卤化,才可制得高纯度的硼。
元素用途:由于硼在高温时特别活泼,因此被用来作冶金除气剂、锻铁的热处理、增加合金钢高温强固性,硼还用于原子反应堆和高温技术中。
棒状和条状硼钢在原子反应堆中广泛用作控制棒。
由于硼具有低密度、高强度和高熔点的性质,可用来制作导弹的火箭中所用的某些结构材料。
硼的化合物在农业、医药、玻璃工业等方面用途很广。
元素辅助资料:天然含硼的化合物硼砂(Na2B4O7·10H2O)早为古代医药学家所知悉。

硼元素的高考知识点归纳硼(B)是一种化学元素,其在化学元素周期表中的原子序数为5。
作为一种主组元素,硼具有许多重要的化学和物理特性,是高中化学学科中重要的一部分内容。
在高考中,对于硼元素的相关知识点的了解和掌握是非常必要的。
本文将对硼元素的高考知识点进行归纳和总结,希望能够帮助读者更好地掌握相关知识。
硼元素的基本性质硼元素是一种典型的准金属元素,具有特殊的物理和化学性质。
硼的原子结构为1s²2s²2p¹。
硼元素的原子半径较小,电负性较高,具有较强的电子亲和能力。
另外,硼元素具有良好的导电性和热导性能,并且对于中子有很好的吸收能力,因此在核能工业中也有一定的应用。
硼元素的同位素硼元素存在两种稳定同位素,分别为硼-10和硼-11。
硼-10的质量数为10,占自然界中硼元素的约20%;硼-11的质量数为11,占自然界中硼元素的约80%。
此外,硼元素还存在一种放射性同位素,即硼-8,其半衰期极短,仅为157 ns。
硼元素的化合物和反应硼元素与氧、氢等多种元素之间能够形成多种化合物。
其中,最重要的化合物之一是硼酸(H3BO3),硼酸是一种弱酸,可溶于水,并具有良好的缓冲和阻燃性能。
此外,硼元素还与碱金属和碱土金属等元素形成金属硼化物,如NaBH4和CaB6等。
这些金属硼化物在化工和材料领域有着广泛的应用。
硼元素的应用硼元素具有广泛的应用价值,在许多领域都有重要的应用。
首先,硼元素在玻璃和陶瓷工业中被用作增强剂和阻燃剂;其次,硼元素也被用于制备特种材料,如硼化硅陶瓷、金属硼化物等;此外,硼元素还在医学、农业和能源等领域有着广泛的应用。
例如,硼中子俘获治疗(BNCT)是一种新型的抗癌治疗方法,利用硼元素对中子的吸收作用,对癌细胞进行热杀伤。
硼元素的历史和发现硼元素的发现和研究历史可以追溯到公元前9世纪的古代文明。
在古代,人们就已经开始使用含硼矿石来制备颜料,如硼砂(硼酸钠)。
然而,直到1808年,英国化学家梅杰(Humphry Davy)才成功地从硼酸中分离出纯净的硼元素。


硼族元素及其化合物
一、硼的性质
硼(Boron)是一种族IIIb的元素,在化学元素周期表中第五位,原子序数为5,原子质量为10.81、硼元素是一种半金属元素,具有金属质地,保持着类似硅的结构。
硼具有极强的抗氧化、加热稳定性、腐蚀性,使其有着优良的电性能,适用于电子设备中的导电成份,还拥有稳定的介电性能,是线路板制作的上佳材料。
二、硼的化合物
(1)氢氧化硼
氢氧化硼(H₂BO₃)是硼元素的最常见的化合物。
它是一种无色粉末状的晶体,熔点为350℃,有特殊的稀酸味,非常溶于水,但在碳酸钠、碳酸氢钠水溶液中极难溶解。
氢氧化硼是一种电解质,是用作电缆、电池和电磁浮动的主要材料。
(2)硼酸
硼酸(HBO₂)是硼的重要的化合物之一,其有机半氧化物的形式为
H₃BO₃,通常以白色粉末的形式存在,溶于水,不溶于二氯甲烷,拥有特殊的稀酸性味道。
硼酸有着广泛的应用,主要用作农药、洗涤剂、轻工业中制作消光剂、染料、防腐剂和焊条等。
(3)硼酸钠
硼酸钠(Na₂B₂O₄·2H₂O)是一种水溶性的硼酸盐,主要用作染料、洗涤剂、消光剂、增塑剂、绝缘剂、涂料等。

硼元素中子-概述说明以及解释1.引言1.1 概述硼元素(B)是化学元素周期表中的一种非金属元素,原子序数为5。
它的原子结构简单,由5个质子和5个中子组成,并且在外层电子壳中只有3个电子。
硼元素在自然界中以硼矿石的形式存在,如硼砂和硼酸盐。
硼元素具有一些特殊的物理和化学性质。
首先,它具有较高的熔点和沸点,使其在高温条件下保持稳定性。
此外,硼元素具有较低的密度和良好的导热性能。
这些特性使得硼元素在核工业、航空航天、材料科学等领域具有广泛的应用前景。
硼元素在核工业中被广泛应用于核燃料材料、核反应堆的结构材料和控制杆等方面。
由于硼元素的中子截获截面大,它可以有效地吸收中子并控制核反应堆中的核反应速率。
此外,硼元素还可以作为核燃料的添加剂,提高燃料的热导率和机械强度。
在航空航天领域,硼元素被广泛用作航天器的结构材料,例如硼纤维增强复合材料。
硼纤维具有优异的强度和刚度,同时具有轻质化的特点,因此非常适合用作航天器的结构材料。
此外,硼元素还在化学、冶金、医疗器械等领域有着重要的应用。
例如,硼元素被用作玻璃制造中的添加剂,可以提高玻璃的硬度和耐热性。
在医疗器械中,硼元素被用作放射性示踪剂,用于诊断和治疗某些疾病。
总之,硼元素作为一种重要的元素,在各个领域都发挥着重要的作用。
它的特殊性质使得硼元素在核工业、航空航天、材料科学等领域具有广泛的应用前景。
随着科学技术的进步和人们对硼元素更深入的研究,相信硼元素未来的发展还将带来更多的惊喜。
1.2文章结构在文章结构部分,我们将对本文的组织和结构进行介绍。
本文共分为三个部分:引言、正文和结论。
引言部分将介绍本文的背景和意义。
在概述部分,我们将简要介绍硼元素的重要性和研究现状。
随后,我们会详细讨论本文的结构和内容安排。
最后,我们会明确本文的目的,即阐述硼元素中子的相关知识。
正文部分是本文的核心部分,将详细论述硼元素的基本特性和应用领域。
在2.1节中,我们将介绍硼元素的基本特性,包括其原子结构、物理性质和化学性质等。


无机化学总结硼族元素无机化学总结硼族元素无机化学总结硼族元素一硼单质及其化合物制作成员:摆宫泽贾震韦仕富硼单质硼单质可以分为晶体与无定形两大类。
晶体硼呈灰黑色硬度极高,导电性差但它的电导率却随着温度的升高而增大从而显示出与金属导体的不同。
不太纯的无定形硼为棕色粉末。
晶体硼单质的化学反应活性较低无定形硼相对活泼。
硼单质的晶体结构晶体硼单质基本结构单元为正二十面体,12个硼原子占据着多面体的顶点。
a—菱形硼:B12结构单元间的硼硼化学键属于三中心二电子键。
由片层间B12结构单元按面心立方最密堆积方式形成晶体其中所以硼原子间均形成共价键使单质硬度大导热能力强,导电能力弱。
B—菱形硼:结构更复杂其中含B84结构单元。
硼单质的化学性质常温下与F2化合:2B+3F2=2BF3在空气中燃烧放出大量热:4B+3O2=2B2O33由于硼氢键的键能很大所以硼能从许多稳定的氧化物如SiO2,P2O5中夺取氧。
硼在炼钢过程中可以作为去氧剂。
4赤热下无定形硼与水蒸气反应:2B+6H2O(g)=2B(OH)3+2H2 5在高温下硼能同N2,S,_2等非金属单质反应2B+N2=2BN2B+3CI2=2BCI22B+3S=B2S36在高温下硼也能同金属反应生成金属硼化物如NbB4,ZrB2,LaB6等。
硼化物一般具有咼硬度咼熔点。
7无定形硼不与非氧化性酸作用但可以与热浓H2SO4,热的HN03反应:B+3HN03(浓)=B(OH)3+3NO2f2B+3H2SO4(浓)=2B(0H)3+3SO2f8有氧化剂存在时硼与强碱共熔可得到偏硼酸盐:2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O硼单质的制备工业上用碱法分解硼镁矿制取单质硼。
Mg2B2O5?H2O+2NaBO2=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=NaB4O7?10H2O+Na2CO3NaB4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3=B2O3+3H2OB2O3+Mg=2B+3MgO用硫酸与硼镁矿反应一步制得硼酸:Mg2B2O5?H2O+2H2SO4=2H3BO3+2MgSO4硼氢化合物称为硼烷已知的有:B2HqB4Hio,B5H9,B8Hi6,B8Hi8等,BnHn+4与BnHn+6共20多种。

化学元素硼
硼(Boron)是化学元素周期表中的第五号元素,原子序数为5,原子量为10.81。
硼是一种金属样的非金属元素,具有多种同素异形体,常见的有无定形硼和晶体硼。
晶体硼有几种不同的同素异形体,包括无色或棕黑色的透明晶体和无定形棕色粉末。
硼的硬度很高,仅次于金刚石,但它的质地较脆。
硼的化学性质不活泼,它在室温下对酸和碱相对稳定,不会与它们发生反应。
然而,硼能够与卤素直接反应形成卤化硼,如氯化硼(BCl3)和氟化硼(BF3)。
此外,硼还能与金属反应形成金属硼化物,这些化合物通常具有高硬度和耐熔性。
硼在自然界中以化合物的形式存在,最常见的硼矿是硼砂(Na2B4O7·10H2O)和白硼钙石(CaB2O4)。
硼砂是一种重要的工业原料,广泛用于玻璃、陶瓷、洗涤剂和化肥等行业。
硼酸(H3BO3)也是一种常见的硼化合物,它曾用作食品防腐剂,但由于其潜在的健康风险,现在这种用途已经减少。
硼的用途非常广泛,它被用于制作玻璃和陶瓷的耐热剂,洗涤剂中的防腐剂,农业上的微量元素肥料,以及许多其他化学产品的添加剂。
在电子工业中,硼化物被用作半导体材
料的掺杂剂,因为它们能够提供所需的导电性能。
在科学研究中,硼的化合物也用于各种实验室分析和合成反应。
硼化合物在医学和生物化学领域也有应用,例如,硼酸用于治疗皮肤病和作为防腐剂,而硼化合物在药物递送系统中也有潜在的应用。
总的来说,硼是一个多用途的元素,它在工业、农业、医药和科学研究等领域都有着重要的作用。

化学元素硼硼是一种化学元素,其化学符号为B,原子序数为5。
它的原子结构为2,3。
在室温和标准压力下,硼为黑色固体,具有较高的熔点和热导率。
硼具有广泛的用途,主要用于制造陶瓷、玻璃、金属工业和化学品等领域。
硼是一种金属loid,在化学元素周期表上位于组三,水平排名第二。
硼的原子结构包含5个质子和5个电子,并且有2个中子。
它的原子量为10.81。
硼的自然存在形式为两种同位素:硼-10和硼-11。
硼-10是稳定同位素,但硼-11则是放射性同位素。
硼是一种多功能化工原料,它的应用范围非常广泛。
硼可用于制造陶瓷和玻璃,其中可以改善其结构性能。
硼可以用作金属工业和制药业中的触媒。
硼化合物可以制成纤维、涂料、塑料、橡胶和化妆品等。
硼化合物还可以用于生产防火剂、石墨化合物、超导体和磁性材料。
硼在医学中也有广泛用途。
硼可以在放射治疗中阻止辐射的扩散。
硼可以在药物制剂中用作氢离子缓冲剂和酸碱度调节剂。
硼还可以用作药物的载体,例如将硼化合物包装入小颗粒中,在靶向治疗中使用。
硼在环境保护中也发挥着作用。
硼化合物可以用于水处理和污水处理中。
硼污染的土地可以使用硼细菌修复技术和生物修复技术来清洁。
此外,硼在天然气开采和钻井中也有使用。
硼的化学性质较为特殊,它可以与许多元素发生化学反应。
硼如同氢气和氧气一样具有出色的可燃性,但它的燃烧温度较高。
硼也易与空气中的氧气发生反应,产生B2O3等产品。
硼的能级位置特殊,其电子属于价电子,能够吸收不同能级的光线。
这使其在光学领域有更广泛的应用。
硼纤维和硼化合物还可以用于制造高强度和高温陶瓷。

化学竞赛无机化学绝密课件硼族元素摘要:本文主要介绍了化学竞赛中无机化学部分的重要知识点——硼族元素。
通过对硼族元素的概述、性质、化合物以及应用等方面的详细讲解,旨在帮助参赛者更好地掌握这一部分内容,提高化学竞赛成绩。
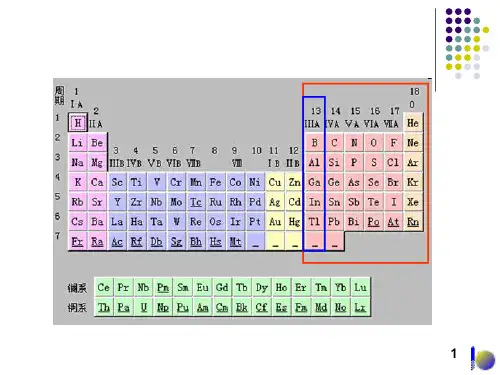
一、硼族元素概述硼族元素位于元素周期表的第二族,包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铍(Tl)等元素。
硼族元素在自然界中分布广泛,其中硼和铝是地壳中含量较多的元素。
硼族元素在化学性质上具有一定的相似性,但在物理性质和应用方面存在较大差异。
二、硼族元素的性质1.电子结构:硼族元素的原子结构中,最外层电子数为3个,因此它们在化学反应中容易失去3个电子,形成+3价离子。
2.金属性和非金属性:从上到下,硼族元素的金属性逐渐增强,非金属性逐渐减弱。
硼和铝具有较强的非金属性,而铟和铍的金属性较强。
3.离子半径:硼族元素的离子半径随着原子序数的增加而增大,这是因为原子核对最外层电子的吸引力逐渐减弱。
4.电负性:硼族元素的电负性随着原子序数的增加而减小,这是因为原子核对最外层电子的吸引力逐渐减弱。
三、硼族元素的化合物1.氧化物:硼族元素与氧元素形成的氧化物具有多种类型,如硼酸、氧化铝、氧化镓等。
这些氧化物在工业、医药等领域具有广泛的应用。
2.硼化物:硼族元素与金属元素形成的硼化物具有高熔点、高硬度和良好的导电性等特点,如碳化硼、氮化硼等。
3.氢化物:硼族元素与氢元素形成的氢化物在有机合成中具有重要应用,如硼氢化钠、硼氢化铝等。
4.硼酸盐:硼酸盐是一类重要的无机化合物,如硼砂、硼酸铝等。
它们在玻璃、陶瓷、洗涤剂等领域具有广泛应用。
四、硼族元素的应用1.金属铝:铝是硼族元素中应用最广泛的元素,广泛应用于建筑、交通、包装、电力等领域。
铝具有良好的导电性、导热性和轻质等特点,是国民经济的重要支柱产业。
2.硼化合物:硼化合物在农业、医药、化工等领域具有重要应用。
如硼酸用作植物生长调节剂,硼氢化钠在有机合成中作为还原剂等。
硼11化学成分硼是一种化学元素,其原子序数为11。
它的化学符号是B,属于主族元素。
硼是一种非金属元素,具有特殊的化学性质和广泛的应用。
硼的原子结构包含5个电子壳。
其中,第一层和第二层分别含有2个电子,而第三层含有3个电子。
硼原子的电子排布为1s22s22p1。
由于硼原子的外层电子数目较少,它具有较高的电子亲和能力和较强的还原性。
硼在自然界中以许多形式存在,最常见的是硼酸和硼酸盐。
硼酸是一种无机酸,化学式为H3BO3。
它是一种无色结晶体,可溶于水。
硼酸具有很强的酸性,可与金属氧化物反应生成相应的硼酸盐。
硼酸盐是硼与金属形成的化合物,具有多种用途。
硼酸盐可用作玻璃和陶瓷的添加剂,能够增加其硬度和耐热性。
此外,硼酸盐还可用于防腐剂、防火剂和杀菌剂。
硼酸盐的应用范围很广,包括建筑材料、电子设备、农业等领域。
硼还可以与氢形成硼化氢,化学式为BH3。
硼化氢是一种无色气体,具有刺激性气味。
硼化氢是一种强还原剂,可以与许多化合物发生反应。
它可用作有机合成的试剂,常用于制备药物、农药和塑料等有机化合物。
硼还可以与氧形成硼氧化物。
硼氧化物是一类化合物,具有不同的化学结构和性质。
硼氧化物在高温下具有很高的熔点和硬度,可用于制备高温材料和陶瓷。
此外,硼氧化物还具有良好的绝缘性能,可用于制备电子器件和涂层材料。
除了上述化合物,硼还可以与其他元素形成许多化合物。
硼化物是硼与金属或非金属元素形成的化合物,具有多样的物理和化学性质。
硼化物常用于制备硬质材料、磁性材料和半导体材料。
硼是一种重要的化学元素,具有丰富的化学性质和广泛的应用。
硼及其化合物在材料科学、化学工业、农业等领域发挥着重要作用。
通过深入研究硼的化学成分和性质,我们可以更好地利用硼的特殊性质,推动科技和工业的发展。
硼元素的简介摘要硼作为硼族唯一的非金属元素,平时并不为人所熟识,现写下此篇小论文,对硼及其化合物作了简要介绍。
关键词硼氧化合物硼卤化合物金属硼氢化物硼烷正文1.硼的发现史硼在自然界中的含量相当丰富。
天然产的硼砂(Na2B4O7·10H2O),在我国古代就已作为药物,叫做蓬砂或盆砂,可能是从西藏传到印度,再丛印度传到欧洲去的。
1702年法国化学家霍姆贝格首先用硼砂和硫酸亚铁一起加热,制得硼酸。
1747——1748年间,法国化学家德·埃努维认识到硼酸是一种酸,而硼砂是硼酸和苏打化合而成的盐。
1789年拉瓦锡把硼酸基作为一种元素,列入他的元素分类表中。
根据他的观点,硼酸是硼酸基和氧的化合物。
1808年,法国化学家盖·吕萨克和泰纳尔和英国化学家戴维各自独立地制得单质硼。
他的拉丁文名称Borium来自拉丁文baurag,是焊接的意思。
因为硼砂能熔解金属氧化物,在焊接中用作助熔剂。
2.硼单质硼约占地壳组成的0.001%,它在自然界中主要矿石是硼砂(Na2B4O7·10H2O)、白硼钙石(Ca2B6O11·5H2O)和镁钙石(Mg2B2O5)。
我国西藏自治区许多含硼盐湖,蒸发干涸后有大量硼砂晶体堆积。
单质硼主要用钠、镁或铝等活泼金属在高温下还原氧化硼制得,所起的化学反应主要是Na2B4O7·10H2O+2HCl==4H3BO3+2NaCl+5H2O2H3BO3==B2O3+3H2OB2O3+3Mg==3MgO+2B用盐酸洗去氧化镁和未反应的金属镁,就得到棕色的无定形硼。
膨在高温下跟多种金属反应而生成硼化物,因此上面得到的无定形硼中往往含有金属硼化物和未还原的硼的氧化物等杂质。
要除去这些杂质,应使产物跟稀盐酸一起煮沸,再用氢氟酸处理。
最纯的单质硼用氢还原法制得:使氢和三溴化硼的混合气体经过钽丝,电热到1500K,三溴化硼在高温下被氢还原,生成的硼在钽丝上成片状或针状结构。
3.硼的物理性质单质硼是原子晶体。
由于硼原子的缺电子特征,它的晶体结构在所有元素中具有最特殊的复杂性。
现在至少有3种硼的晶体是已知的。
其中2种是菱形六面体,在他们的晶胞中分别有12个和108个硼原子。
另一种是四方结构,每个晶胞中有50个硼原子。
无定形硼是暗棕色粉末。
结晶硼具有光泽的黄色到灰色晶体,硬度接近金刚石。
硼的密度约为2.37g/cm3,熔点为2303K,沸点4203K。
4.硼的化学性质硼是非金属元素,它的氢氧化物(H3BO3硼酸)是弱酸。
硼的最外层有三个电子只能形25.硼的用途单质硼主要用来制造硼钢。
硼钢用作原子反应堆的挖制棒。
含硼的微量元素肥料叫做硼素肥料(简称硼肥),能促进作物体内碳水化合物的运送,增强抗病害能力,并有利于开花结果。
这种肥料对甜菜、豆料作物有特别良好的作用。
6.硼氧化合物6.1 氧化硼单质硼在纯氧或空气里燃烧时,生成氧化硼,放出大量的热。
4B+3O2 ==2B2O3+2844KJ氧化硼溶解于水,生成(正)硼酸,所以它是硼酸的酸酐。
B2O3+3H2O==2H3BO3硼酸加热脱水,最后生成玻璃状态的氧化硼。
在较低温度和减压条件下脱水,得到的是白色粉末状的氧化硼。
它有很强的吸湿性,在潮湿的空气中能迅速同水结合而生成正硼酸,所以它用作脱水剂。
在气态时,氧化硼是由单分子组成的。
氧化硼是两性氧化物,它能跟金属氧化物(碱性氧化物)在高温下化合,生成有各种特殊颜色的透明的偏硼酸盐(硼玻璃)。
例如在氧化焰中,CuO+B2O3==Cu(BO2)2蓝色它也能跟有些非金属氧化物(酸性氧化物)化合,生成盐类,例如,P2O5+B2O3==2BPO46.2硼酸硼酸是白色闪亮鳞片状晶体。
工业上常用硫酸分解硼的矿石(例如硼镁石,Mg2B2O5·H2O)的方法来制取。
Mg2B2O5·H2O+2H2SO4==2MgSO4+2H3BO3在硼酸分子中,每个B原子跟3个氢氧根中的氧原子通过共价键结合,成为平面三角形结构。
然后以B(OH3)为单位,通过氢键相互连结成大分子。
它具有层状结构,层和层之间的距离是318pm。
硼酸易溶于热水(373K时在水里的溶解度是28.7g/100g H2O),在冷水中的溶解度较小(293K时是4.9g/100g H2O)。
硼酸在食品工业和医药上用作防腐剂,它有微弱的抑菌作用,刺激性小,适宜用于皮肤、黏膜和创面的防腐。
在鞣革、制造颜料和釉药时也有广泛的用途。
7.硼卤化合物硼的主要卤化物是三卤化物,其中最重要的是三氟化硼。
它是用硼砂、氢氟酸和硫酸为原料制取的。
反应分两步进行:Na2B4O7+12HF==NA2O(BF3)4+6H2ONA2O(BF3)4+2H2SO4==4BF3+2NaHSO4+H20三氟化硼是无色而有刺激性气味的气体(沸点172K),不能燃烧。
在三氟化硼分子里,硼原子的最外电子层只有6个电子,是一个缺电子分子。
三氟化硼极易溶于水,它的浓溶液是粘稠液体,其中可能喊有氟硼酸(HBF4)。
氟硼酸是有三氟化硼和它的水解产物氢氟酸结合而成的。
BF3+3H2O==B(OH)3+3HFBF3+HF==HBF4三氟化硼广泛用作有机聚合反应和取代反应的催化剂以及制备硼烷的原料。
其他三卤化硼可以由单质硼和卤素在高温下直接化合制得。
液态的三氯化硼在285K时沸腾。
三溴化硼在常温时是液体,沸点364K,熔点227K。
三碘化硼是固体,熔点316K,沸点483K。
它们是比三氟化硼更强的路易斯酸,能跟氨、膦、(PH3)等形成加成化合物。
它们跟水剧烈作用,反应的第一步可能是先由水分子中氧原子的孤对电子作为电子给予体,形成一水合物,然后脱去一个HX分子,并进行水解。
H2O+BCl3==H2O→BCl3H2O→BCl3==HO—BCl2+HClHO—BCl2+2H2O==B(OH)3+2HCl8. 金属硼氢化物金属硼氢化物中的负离子[BH4]-。
它是正四面体的构型,它是负离子[BF4]-的类似物,只是配位体F-被H-所取代。
跟氟硼酸根离子一样,[BH4]-的中心硼原子可以认为是正三价的,B—H键可以认为是B(Ⅲ)接受4个配位体H-的电子对而形成的。
有多种金属硼化物已经制得。
例如硼氢化钠,Na[BH4],可以由加热氢化钠、硼酸甲酯(由甲醇和硼酸的酯化反应生成,3CH3OH+H3BO3==B(OCH3)3+3H2O)的混合物制取。
4NaH+B(OCH3)3==Na[BH4]+3CH3ONa碱金属的硼氢化物是不挥发的离子型晶体。
他们能从冷水中结晶出来,但遇热水就水解。
硼氢化钠是有效的还原剂。
Na[BH4]+4H2O(热)==H3BO3+NaOH+4H2↑盐基性较弱的金属元素的硼氢化物,例如Be{BH4}2和Al[BH4] 3,是共价型的,比离子型的金属硼氢化物活泼。
它们是缺电子化合物,分子中的原子以σ键和三中心键相连结。
例如在Be[BH4] 2中,每个硼原子跟2个氢原子以σ键连结,并通过2个氢原子桥跟铍原子连结。
在这个分子里,铍和硼的原子轨道都假设是sp3杂化了的。
硼的3个sp3杂化轨道里各有1个电子,另一个是空轨道。
铍的2个sp3杂化轨道各含有1个电子,另2个是空轨道。
三中心键是有铍的一个sp3杂化轨道、硼的一个sp3杂化轨道和氢的1s轨道交盖而成的。
9. 硼烷和有关化合物硼和氢不能直接化合,但是能由间接方法制得一系列硼氢二元化合物,通常叫做硼烷。
1912年德国化学家斯托克从硼化镁(Mg3B2)在稀酸中水解的生成物中分离出一系列硼氢化合物,它们有B4H10、B5H9、B6H10、和B10H14等组成。
现在我们已经制得20多种硼烷(较稳定的硼烷),如B2H6(气)、B5H9(液)、和B10H14(固)等,二是通式是B n H n+6的硼烷(不稳定的硼烷),如B4H10(气)、B5H11(液)和B10H16(固)等。
硼烷的命名是在硼字前面用甲、乙、丙、丁等天干或数字来表明分子中硼的原子数,在烷字后面用数字表明分子中氢的原子数。
例如B2H6命名为乙硼烷-6,B5H11命名为戊硼烷-11等。
一般说来,硼烷的稳定性是随着它们的分子量的增大而增加的。
例如,B2H6只在373K 以下稳定,B5H9即使在420K也只能缓慢地分解,而B10H14很稳定。
硼烷在燃烧时防除大量的热,过去曾想试用它们作为火箭和导弹的高能燃料。
但是,几乎所有的硼烷都有毒,而且在空气中容易着火燃烧,最后放弃了这个想法。
硼烷的分子结构十分特殊,不易设计出它们合适的结构式,因此引起人们的兴趣和注意。
最简单的硼烷,甲硼烷-3(BH3),实际上并不存在。
因为像这样缺电子的分子结构,将使它的价键变得极不稳定(但是,BX3是存在的)。
现在已知的硼烷是乙硼烷-6,它可以认作是甲硼烷-3的二聚体,通常用三氟化硼的乙醚络合物缓缓地悬浮在乙醚中的氢化锂中并用回流加热的方法来制取。
8(C2H5)2O→BF3+6LiH==6LiBF4+B2H6+8(C2H5)2O乙硼烷-6也可以用其他方法制取,例如氢化铝锂或硼氢化钠跟三氟化硼的乙醚溶液作用。
3LiAlH4+4BF3==3B2H6+3LiF+3AlF33NaBH4+4BF3==2B2H6+3NaBF4乙硼烷-6分子里的硼和氢如果以共价相结合,那么2个硼原子就缺乏电子来结合。
现在证明,在乙硼烷-6的6个氢原子中,有2个氢原子跟其余的4个氢原子不同。
它分子红一共有12个电子成键,其中8个电子形成四个σ键,剩下的4个电子构成2个三中心二电子键。
两个硼原子通过氢原子桥联系起来。
4个σ键在跟纸垂直的平面上,2个三中心二电子键在纸面上。
乙硼烷-6在空气里容易燃烧,生成氧化硼。
B2H6+3O2==B2O3+3H2O在室温下,乙硼烷-6遇水迅速水解,放出氢气。
B2H6+6H2O==2B(OH)3+6H2↑乙硼烷-6跟氨反应,产生加成产物。
B2H6+2NH33==2H3B←NH32H3B←NH3 是离子型化合物,它的液氨溶液能够导电。
溶液中含有正离子[H2B(NH3)]+和负离子[BH4]-。
正、负离子中的硼的氧化数都是+3。
H3B←NH3加热,或使乙硼烷-6在2较高温度(473K左右)下跟氨作用,结果生成硼氮六环(B3N3H6)。
硼氮六环又叫无机苯,它的分子结构很像苯,可以用相同的方法来描述它的价键状态。
硼原子和氮原子的sp2杂化轨道相互交盖成环(σ键)。
未参与杂化的一个2p轨道从侧面交盖成离域的∏键。
这个分子里构成离域∏键的6个电子不是由构成环的各个原子提供的(这一点跟苯不同),而是由三个氮原子提供的。
硼氮六环的物理性质跟苯相似,而化学性质有许多不同,这是由B-N键的极性引起的。
硼氮六环比苯活泼,能迅速发生加成反应。
小结对硼元素的研究和发现为我们的生活和工作带来了极大的方便,在此仅做简单讨论,如有宝贵意见请与本人交流。