无机与分析化学1
- 格式:docx
- 大小:183.85 KB
- 文档页数:11

无机及分析化学超详细复习知识点(大一,老师整理)第一章化学基本概念和理论1. 物质和化学变化物质:具有质量和体积的实体。
化学变化:物质发生变化,新的物质。
2. 物质的组成和结构元素:由同种原子组成的物质。
原子:物质的基本单位,由原子核和核外电子组成。
3. 化学键和分子间作用力化学键:原子之间通过共享或转移电子而形成的连接。
分子间作用力:分子之间的相互作用力,包括范德华力、氢键等。
4. 化学反应化学反应方程式:表示化学反应过程的方程式。
化学反应速率:单位时间内反应物的浓度变化。
化学平衡:反应物和物浓度不再发生变化的状态。
5. 氧化还原反应氧化:物质失去电子的过程。
还原:物质获得电子的过程。
氧化还原反应:同时发生氧化和还原的反应。
6. 酸碱反应酸:能够释放H+离子的物质。
碱:能够释放OH离子的物质。
中和反应:酸和碱反应盐和水。
7. 溶液溶质:溶解在溶剂中的物质。
溶剂:能够溶解溶质的物质。
溶液的浓度:单位体积或单位质量溶剂中溶解的溶质的量。
8. 化学平衡常数的计算平衡常数:表示化学反应平衡状态的常数。
计算方法:根据反应物和物的浓度计算平衡常数。
9. 氧化还原反应的平衡电极电位:表示氧化还原反应进行方向的电位。
计算方法:根据电极电位计算氧化还原反应的平衡常数。
10. 酸碱反应的平衡pH值:表示溶液酸碱性的指标。
计算方法:根据酸碱的浓度计算pH值。
11. 溶液的酸碱滴定滴定:通过滴加已知浓度的溶液来确定未知溶液的浓度。
计算方法:根据滴定反应的化学方程式和滴定数据计算未知溶液的浓度。
12. 气体定律波义耳定律:在一定温度下,气体的压力与体积成反比。
查理定律:在一定压力下,气体的体积与温度成正比。
阿伏伽德罗定律:在一定温度和压力下,等体积的气体含有相同数量的分子。
13. 气体混合物的计算分压定律:气体混合物中每种气体的分压与该气体在混合物中的摩尔分数成正比。
计算方法:根据分压定律计算气体混合物中每种气体的分压和摩尔分数。





无机及分析化学(Ⅰ)习题解答目录第1章分散体系 (1)第2章化学热力学基础 (8)第3章化学反应速率和化学平衡 (15)第4章物质结构 (22)第5章分析化学概述 (27)第6章酸碱平衡 (31)第7章酸碱滴定法 (36)第8章沉淀溶解平衡 (44)第9章重量分析法和沉淀滴定法 (49)第10章配位化合物 (53)第11章配位滴定法 (62)第12章氧化还原反应 (67)第13章氧化还原滴定法 (78)第14章电势分析法 (83)第15章吸光光度分析法 (86)第16章试样分析中常用的分离方法简介 (90)第17章重要生命元素简述 (93)第18章原子核化学简介 (96)第1章 分散体系1-1.人体注射用的生理盐水中,含有NaCl 0.900%,密度为1.01g·mL -1,若配制此溶液3.00×103g ,需NaCl 多少克?该溶液物质的量浓度是多少?解:配制该溶液需NaCl 的质量为:m (NaCl)=0.900%×3.00×103g=27.0g该溶液的物质的量浓度为:-1-13-1-327.0g/58.5g mol (NaCl)==0.155mol L (3.0010g/1.01g m L )10c ⋅⋅⨯⋅⨯ 1-2.把30.0g 乙醇(C 2H 5OH)溶于50.0g 四氯化碳(CCl 4)中所得溶液的密度为1.28g∙mL -1,计算:(1)乙醇的质量分数;(2)乙醇的物质的量浓度;(3)乙醇的质量摩尔浓度;(4)乙醇的摩尔分数。
解:(1)w (C 2H 5OH) =25254(C H OH)30.0g (C H OH)(CCl )30.0g 50.0gm m m =++=0.38 (2)-12525-1-3(C H OH)30.0g/46g mol (C H OH)[(30.0+50.0)g /1.28g mL ]10n c V ⋅=⋅⨯==10.4mol·L -1 (3)b (C 2H 5OH) =-125-3430.0g(C H OH)46g mol (CCl )50.010kgn m ⋅=⨯=13.0mol·kg -1 (4)x (C 2H 5OH) =-125254-1-130.0g(C H OH)46g mol =30.0g 50.0g (C H OH)+(CCl )+46g mol 153.6g mol n n n ⋅⋅⋅ =0.650.660.650.33=+ 1-3.将5.0g NaOH 、NaCl 、CaCl 2分别置于水中,配成500mL 溶液,试求c (NaOH)、c (NaCl)、c (12CaCl 2)。
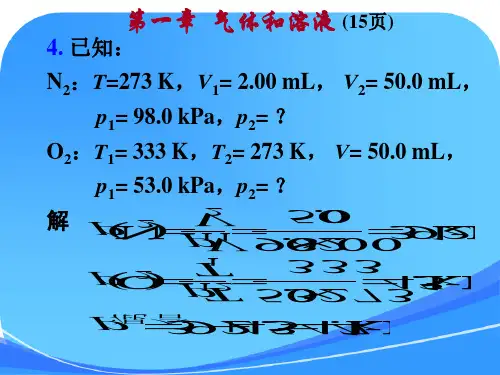


第一章物质的聚集状态(部分)1-3.用作消毒剂的过氧化氢溶液中过氧化氢的质量分数为,这种水溶液的密度为⋅mL-1,请计算这种水溶液中过氧化氢的质量摩尔浓度、物质的量浓度和摩尔分数。
解:1L溶液中,m( H2O2) = 1000mL⨯⋅mL-1⨯ = 30gm( H2O) = 1000mL⨯⋅mL-1⨯(1- = ⨯102gn( H2O2) = 30g/34g⋅moL-1=n( H2O) = 970g/18g.⋅mol-1=54molb( H2O2)= / = ⋅kg-1c( H2O2)= 1L = ⋅L-1x( H2O2) = .+54) =1-4.计算%的蔗糖(C12H22O11)水溶液与%的葡萄糖(C6H12O6)水溶液的沸点。
解:b(C12H22O11)=(342g.⋅mol-1⨯=⋅kg-1b(C6H12O6)=(180g.⋅mol-1⨯=⋅kg-1蔗糖溶液沸点上升∆T b=K b⋅b(C12H22O11)= ⋅kg⋅mol-1⨯⋅kg-1=蔗糖溶液沸点为:+=葡萄糖溶液沸点上升∆T b=K b⋅b(C6H12O6)= ⋅kg⋅mol-1⨯⋅kg-1=葡萄糖溶液沸点为:+ =1-5.比较下列各水溶液的指定性质的高低(或大小)次序。
(l)凝固点: ⋅kg-1 C12H22O11溶液,⋅kg-1 CH3COOH溶液,⋅kg-1 KCl溶液。
(2)渗透压:⋅L-1 C6H12O6溶液,⋅L-1CaCl2溶液,⋅L-1 KCl溶液,1mol⋅L-1 CaCl2溶液。
(提示:从溶液中的粒子数考虑。
)解:凝固点从高到低:⋅kg-1 C12H22O11溶液>⋅kg-1 CH3COOH溶液>⋅kg-1 KCl溶液渗透压从小到大:⋅L-1 C6H12O6溶液<⋅L-1 KCl溶液<⋅L-1 CaCl2 溶液<1mol⋅L-1CaCl2溶液1-6.在20℃时,将血红素溶于适量水中,然后稀释到500mL, 测得渗透压为。

大一无机及分析化学知识点第一章:无机化学基础知识无机化学是研究无机化合物的组成、结构、性质和化学反应的学科。
它是化学的一个重要分支,对于理解和应用其他化学学科具有重要意义。
1.1 原子结构及元素周期表- 原子结构:原子由原子核和围绕核运动的电子组成。
原子核由质子和中子组成,电子负电荷平衡原子核的正电荷。
- 元素周期表:元素周期表是按照元素的原子序数排列的化学元素分类表。
它将元素按照性质的周期性规律分组,方便研究。
1.2 化学键和离子结构- 化学键:原子通过化学键相互连接,形成化合物。
常见的化学键有离子键、共价键和金属键。
- 离子结构:离子结构是指由正负离子通过离子键组成的化合物的结构。
正离子是失去电子的金属原子或原子团,负离子是获得电子的非金属原子或原子团。
1.3 配位化学- 配位化学是研究过渡金属离子与配体之间的键合关系及其化合物的性质的学科。
配位化合物由中心金属离子和配体组成,配体通过配位键与中心金属离子结合。
1.4 水溶液中的离子- 水溶液中的离子是指将化合物溶解在水中时形成的离子。
离子在水中可以进行水合反应,影响溶液的性质。
第二章:分析化学基础知识分析化学是研究物质组成和性质的化学分析方法的学科。
它是化学实验的基础,广泛应用于环境监测、药物分析、食品检测等领域。
2.1 定性分析和定量分析- 定性分析:定性分析是确定物质中所含的元素或化合物的成分和性质的方法。
- 定量分析:定量分析是确定物质中某种或若干种成分的含量的方法。
2.2 大气分析- 大气分析是研究大气中气体成分及其浓度的分析方法。
常用的技术包括气相色谱、质谱等。
2.3 水分析- 水分析是研究水中各种成分及其浓度的分析方法。
常用的技术包括滴定法、光谱分析等。
2.4 有机分析- 有机分析是研究有机物成分和结构的分析方法。
常用的技术包括红外光谱、核磁共振等。
第三章:重要的化学实验化学实验是学习无机及分析化学的重要途径,通过实验可以加深对化学原理的理解,培养实验操作技能。

第一章物质结构基础1-1.简答题(1) 不同之处为:原子轨道的角度分布一般都有正负号之分,而电子云角度分布图均为正值,因为Y平方后便无正负号了;除s轨道的电子云以外,电子云角度分布图比原子轨道的角度分布图要稍“瘦”一些,这是因为︱Y︱≤ 1,除1不变外,其平方后Y2的其他值更小。
(2) 几率:电子在核外某一区域出现的机会。
几率密度:电子在原子核外空间某处单位体积内出现的几率,表示微粒波的强度,用电子云表示。
(3) 原子共价半径:同种元素的两个原子以共价单键连接时,它们核间距离的一半。
金属半径:金属晶体中相邻两个金属原子核间距离的一半。
范德华半径:分子晶体中相邻两个分子核间距离的一半。
(4) BF3分子中B原子采用等性sp2杂化成键,是平面三角形;而NF3分子中N原子采用不等性sp3杂化,是三角锥形。
(5)分子式,既表明物质的元素组成,又表示确实存在如式所示的分子,如CO2、C6H6、H2;化学式,只表明物质中各元素及其存在比例,并不表明确实存在如式所示的分子,如NaCl、SiO2等;分子结构式,不但表明了物质的分子式,而且给出了分子中各原子的具体联接次序和方式,像乙酸的结构式可写为C HH HC OO H其结构简式可记为CH 3COOH 。
1-2解 1错;2错;3对;4对;5对;6错。
7对;8错;9对 10错;11错;12错。
1-3 波动性;微粒性1-4. 3s=3p=3d=4s ;3s< 3p< 4s <3d ;3s< 3p< 3d< 4s ; 1-5 32;E 4s < E 4p < E 4d < E 4f ; 第六周期;La 系;2;铈(Ce) 1-6 HF>HCl>HBr>HI ;HF>HCl>HBr>HI;HF<HCl<HBr<HI;HF>HI>HBr>HCl 。
第1章思考题与习题参考答案一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C 3H8O3)溶液D. 尿素((NH2)2 CO)溶液解:选D。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液C. HAc溶液D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
由于纯化的Fe(OH)3溶胶具有这种聚结稳定性,从而可以存放数年而不聚沉。
无机及分析化学大一知识点笔记一、化学元素及其周期表1. 化学元素的定义化学元素是由具有相同原子序数(即原子核中质子的个数)的原子组成的纯物质。
2. 元素周期表的结构元素周期表是按照原子序数的顺序排列元素的表格,通常分为横行和纵列。
其中,横行称为周期,纵列称为族。
周期表中的元素按照原子序数递增的顺序排列,元素的周期性特征也随之呈现。
3. 元素周期表中的重要分组- 碱金属:位于周期表第一组,具有较低的密度和较强的金属性质,如钠、钾等。
- 碱土金属:位于周期表第二组,比碱金属密度高,但仍为金属,如钙、镁等。
- 过渡金属:位于周期表第三到第十二组,具有变化多端的化合价和复杂的离子形式,如铁、铜等。
- 卤素:位于周期表第七组,具有较强的氧化性和剧毒性质,如氯、溴等。
- 惰性气体:位于周期表第八组,具有稳定的化学性质,几乎不与其他元素反应,如氦、氖等。
二、无机化合物1. ionic化合物- 离子键的形成:在离子化合物中,金属原子会失去电子变成正离子,非金属原子会获得电子变成负离子,通过静电作用互相吸引形成离子晶格。
- 离子化合物的性质:离子化合物通常具有高熔点、高溶解度、良好的电导性和脆性等特点。
2. 共价化合物- 共价键的形成:在共价化合物中,非金属原子通过共用电子对来形成化学键。
共价键的强度取决于原子间电子的共享程度。
- 共价化合物的性质:共价化合物通常具有较低的熔点和较弱的电导性,往往呈现分子结构。
三、化学反应与化学平衡1. 化学反应的种类- 氧化还原反应:涉及电子的转移过程,如金属与非金属离子之间的反应。
- 酸碱中和反应:涉及氢离子或氢氧根离子的转移过程,如强酸与强碱之间的反应。
- 沉淀反应:产生可在溶液中沉淀的物质的反应,如生成不溶于溶液的盐类。
- 配位反应:涉及配位化合物中配体与中心金属离子之间的键的形成或断裂。
2. 化学平衡与平衡常数化学平衡是指化学反应在某一反应条件下,反应物与生成物浓度或压力保持恒定的状态。
第三阶段在线作业
单项选择题
第1题下列分子中,S采取SP2杂化的是
A、SOCl2
B、H2S
C、SO2
D、SO2Cl2
第2题分子结构和中心原子杂化类型都与O3相同
的是
A、SO3
B、SO2
C、CO2
D、ClO2
第3题下列分子或离子中,属于平面三角形的
是
A、SO3
B、O3
C、ICl3
D、H3O+
第4题下列离子的溶液中与Na2S溶液反应,生成黄色沉淀的一组是
A、Fe3+,Bi3+
B、Cd2+,Fe3+
C、Pb2+,As3+
D、Sn4+,Cd2+
第5题既能溶于Na2S又能溶于Na2S2的硫化物是
A、ZnS
B、CuS
C、Sb2S3
D、HgS
第6题不溶于Na2S2的硫化物是
A、ZnS
B、As2S3
C、Sb2S3
D、SnS
第7题下列物质中酸性最强的是
A、H2S
B、H2SO3
C、H2SO4
D、H2S2O7
第8题下列分子中,酸性最弱的是
A、H2SO4
B、H2SO3
C、H2S
D、H2Se
第9题为使已变暗的古油画恢复原来的白色,使用的方法为
A、用SO2气体漂白
B、用稀H2O2溶液擦洗
C、用氯水擦洗
D、用O2漂白
第10题干燥H2S气体,可选用的干燥剂是
A、浓H2SO4
B、KOH
C、P2O5
D、CuSO4
第11题少量H2O2与H2S反应的主要产物是
A、H2SO4
B、H2SO3
C、H2S2O3
D、S
第12题下列物质中,只有还原性的是
A、Na2S2O3
B、Na2S
C、Na2SO3
D、Na2S2
第13题既有氧化性,又有还原性,但以氧化性为主的二元弱酸是
A、H2O2
B、H2S
C、H2SO3
D、H2S2O3
第14题下列物质中,能发生反应的一组是
A、Ag和HCl
B、BaSO4和HCl
C、AlCl3和H2S
D、Na2SO3和I2
第15题下列物质中,既能和H2S反应,又能和稀硝酸反应的是
A、FeSO4
B、SO2
C、KI
D、SO3
第16题与Zn粉反应可生成Na2S2O4的试剂是
A、NaHSO3
B、Na2S2O3
C、Na2SO4
D、Na2S2O7
第17题下列物质中,还原能力最强的是
A、Na2S2O8
B、Na2SO4
C、Na2S4O6
D、Na2S2O7
第18题关于O3的下列叙述中正确的是
A、O3比O2稳定
B、O3是非极性分子
C、O3是顺磁性物质
D、O3比O2的氧化性强
第19题下列说法中错误的是
A、SO2分子为极性分子
B、SO2溶于水可制得纯的H2SO3
C、H2SO3可使品红褪色
D、H2SO3既有氧化性又有还原性
第20题下列方法中不能制得H2O2的是
A、电解NH4HSO4水溶液
B、用H2和O2直接化合
C、乙基蒽醌法
D、金属过氧化物与水作用
第21题工业上生产SO2的方法主要是
A、焙烧FeS2
B、单质硫在空气中燃烧
C、亚硫酸盐与酸反应
D、浓硫酸与铜反应
第22题下列化合物中磷的氧化态最高的是
A、H3PO3
B、H3PO2
C、PH3
D、H4P2O7
第23题下列物质中酸性最强的是
A、N2H4
B、NH2OH
C、NH3
D、HN3
第24题下列酸中为一元酸的是
A、H4P2O7
B、H3PO2
C、H3PO3
D、H3PO4
第25题干燥氨气可选择的干燥剂是
A、浓H2SO4
B、CaCl2
C、P2O5
D、CaO
第26题金属与浓硝酸反应,产物中不能存在的
是
A、硝酸盐
B、金属氧化物
C、氯化物
D、致密氧化膜
第27题在硼的化合物中,硼原子的最高配位数不超过4,这是因为
A、硼原子半径小
B、配位原子半径大
C、硼与配位原子电负性差小
D、硼原子无价层d轨道
第28题下列关于BF3的叙述中,正确的是
A、BF3易形成二聚体
B、BF3为离子化合物
C、BF3为路易斯酸
D、BF3常温下为液体
第29题下列金属单质中,熔点最低的是
A、Cu
B、Zn
C、Na
D、Ga
第30题下列化合物中,熔点最低的是
A、BCl3
B、CCl4
C、SiCl4
D、SnCl4
第31题下列物质在水中的溶解度最小的是
A、Na2CO3
B、NaHCO3
C、Ca(HCO3)2
D、KHCO3
第32题下列各对元素中,化学性质最相似的是
A、Be与Mg
B、Mg与Al
C、Li与Be
D、Be与Al
第33题下列元素中,第一电离能最小的是
A、Li
B、Be
C、Na
D、Mg
第34题下列氮化合物中,最稳定的是
A、Li3N
B、Na3N
C、K3N
D、Ba3N2
第35题下列过氧化物中,最稳定的是
A、Li2O2
B、Na2O2
C、K2O2
D、Rb2O2
第36题下列化合物中,键的离子性最小的是
A、LiCl
B、NaCl
C、KCl
D、BaCL2
第37题下列碳酸盐中,热稳定性最差的是
A、BaCO3
B、CaCO3
C、K2CO3
D、Na2CO3
第38题与银反应能置换出氢气的稀酸是
A、硫酸
B、盐酸
C、硝酸
D、氢碘酸
第39题欲除去ZnSO4溶液中少量CuSO4的最佳试剂是
A、Na2CO3
B、NaOH
C、Na2S
D、Zn粉
第40题欲除去Cu(NO3)2溶液中的少量AgNO3,最好加入
A、铜粉
B、NaOH
C、Na2S
D、NaHCO3。