生化试剂溯源及性能评价
- 格式:pptx
- 大小:14.76 MB
- 文档页数:65
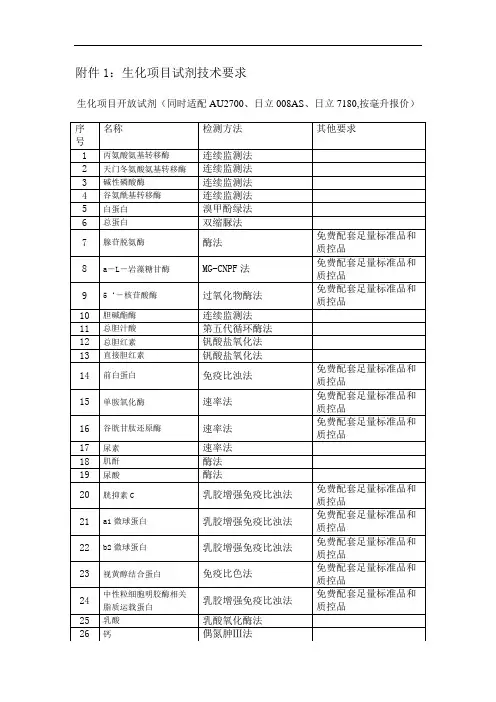
附件1:生化项目试剂技术要求生化项目开放试剂(同时适配AU2700、日立008AS、日立7180,按毫升报价)附件2:综合评分明细表附件3:采购文件书装订顺序采购文件书装订顺序1、封面(公司、项目、联系人、联系方式)2、目录3、品目及报价表(格式见附件3)4、规格型号、配置及偏离表(格式见附件3)5、企业营业执照(复印件)6、组织机构代码证、税务登记证(复印件)7、法定代表人授权书(原件,格式见附件3)暨经办人授权书,法定代表人、经办人身份证(复印件)8、生产厂家授权书(投标人不是生产厂家的)9、如是医疗器械,须提供“中华人民共和国医疗器械生产企业许可证”和“中华人民共和国医疗器械经营企业许可证”(复印件)10、如是医疗器械,须提供“医疗器械产品注册证和注册登记表”(复印件)11、如有产品质量和企业管理体系认证(考核),请提供的有效证明文件的复印或扫描件,质量管理体系认证包括FDA、CE、ISO等认证(提供中文翻译复印件)12、质量检测中心或法定机构出具的产品检测报告,性能自测报告,出厂检验报告的复印或扫描件13、如有其他证书:产品在技术、节能、安全、环保和自主创新方面获得的认证证书或制造厂家和产品所获国家级荣誉称号等复印或扫描件14、产品执行标准(提供产品注册标准:YZB等资料供评审)15、产品质量及货源保证书16、售后服务承诺书,包括质量保证范围,售后服务体系、人员培训计划等,并提供相关人员证明材料,要求见评分办法“售后服务”说明;17、如有,提供进口原材料证明书或产品报关资料等18、产品说明书或与投标医疗耗材型号一致的产品彩页资料和其他有关介绍资料。
19、业绩证明文件(用户名单及联系人与联系方式,格式见附件3),并提供相应证明文件,要求见评分办法“业绩”说明。
20、能满足采购人需求的配送及维保的证明文件。
如有物流公司配送,请提供配送证明材料:配送商基本情况、配送商营业执照复印件、配送商经营许可证复印件21、如有,国家规定的其它相关资质证明文件或其它涉及特许经营许可的须提供相关证书。


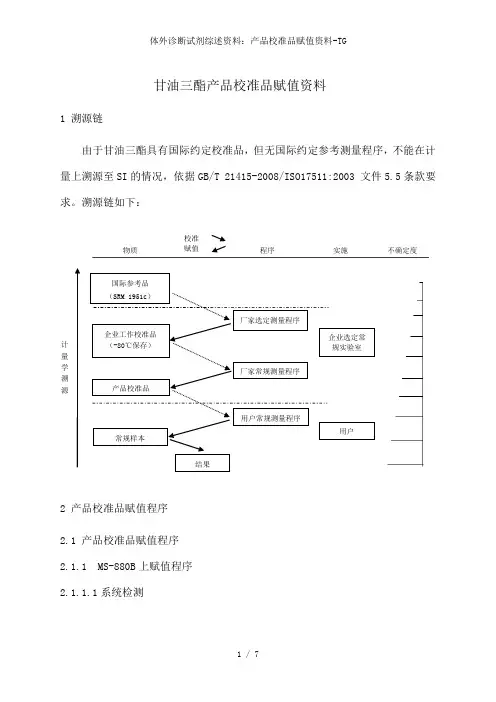
计量学溯源国际参考品(SRM 1951c)企业工作校准品(-80℃保存)产品校准品常规样本厂家选定测量程序厂家常规测量程序用户常规测量程序结果用户物质校准赋值程序实施不确定度企业选定常规实验室甘油三酯产品校准品赋值资料1 溯源链由于甘油三酯具有国际约定校准品,但无国际约定参考测量程序,不能在计量上溯源至SI的情况,依据GB/T 21415-2008/ISO17511:2003 文件5.5条款要求。
溯源链如下:2 产品校准品赋值程序2.1 产品校准品赋值程序2.1.1 MS-880B上赋值程序2.1.1.1系统检测采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),测定内部跟踪质控品(水平1,水平2),重复10次,计算10次测定的均值和变异系数(CV)。
如果测得精密度CV≤5.0%,均值在内部跟踪质控品靶值范围内,则可认为试剂和仪器分析系统符合要求。
2.1.1.2 产品校准品赋值程序采用本公司生产的甘油三酯检测试剂盒及美康MS-880B全自动生化分析仪,以工作校准品为标准作校准曲线(2号检测系统),测定本公司产品校准品10瓶,每瓶测1次,计算十个数据的均值X1、标准差S1和变异系数CV1。
再取其中1瓶,检测10次,计算10个数据的均值X2、标准差S2,按照公式S瓶间=2221SS和CV 瓶间=S 瓶间/ X 1×100%计算CV 瓶间。
如果测得精密度CV 1和CV 瓶间≤5.0%,测得的均值X 1即为产品校准品的初步定值。
测定产品校准品10瓶,每瓶测一次取其中一瓶,重复测10次2.1.1.3 产品校准品可靠性验证采用本公司生产的甘油三酯检测试剂盒及美康MS-880B 全自动生化分析仪,以初步定值的产品校准品为标准作校准曲线(3号检测系统),测定内部跟踪质控品(水平1,水平2),重复10次,计算10次测定的均值和变异系数(CV),同时测定40份样本。

文件编号:肌酐〔CREA〕试剂盒性能分析报告时间: 2016.08.09-08.14仪器:AU5821操陈崇汇总报告:目录:一、实验材料 (3)二、实验方案 (4)2.1 正确度 (4)2.2 批内精密度... (4)2.3 批间精密度 (5)2.4 线性评价 (5)2.5 灵敏度评价 (5)2.6特异性评价 (5)2.7参考范围验证 (5)三、实验数据 (6)3.1 正确度〔附表1〕 (6)3.2 批内精密度〔附表2〕... (6)3.3 批间精密度〔附表3〕 (7)3.4 线性评价〔附表4/附图1〕....................................... . (8)3.5 灵敏度评价〔附表5〕 (9)3.6特异性评价〔附表6〕 (10)3.7参考范围验证〔附表7〕 (11)四、结论 (13)五、附录A 〔朗道校准液溯源性说明以及企业标准〕附录B 〔CREA临床意义〕附录C 〔中元CREA试剂盒、朗道校准液、朗道质控液说明书〕附录D 〔中元CREA试剂盒SOP文件〕附录E 〔中元CREA试剂盒AU5821配套参数表〕附录F 〔中元CREA试剂盒与校准液注册证〕附录G 〔实验原始数据〕实验材料:生化试剂盒:重庆中元生物技术肌酐〔CREA〕试剂盒批号:Z160501有效期:2017.05.01 校准液〔定值液〕:重庆中元生物技术朗道CREA校准品批号:CAL2351-800UE有效期:2017.02.01 质控液:重庆中元生物技术朗道CREA质控品批号:HN1532-791UE;HN1530-1117UN有效期:2017.02.01 测定仪器:AU5821全自动生化分析仪批内精密度样本:临床高值标本3份混合尿液,低值标本3份混合尿液批间精密度样本:临床随机标本3份混合分装冻存线性物质:临床高值标本1份特异性物质:日本希森美康干扰物质一套,批号:160201 效期:2017.02.01参考区间验证样本:挑选体检标本20例分析灵敏度:朗道复合校准品1盒,批号:800UE 有效期:2017.02.01实验方案:2.1 正确度按实验室常规操作程序,进行CREA项目两点定标,然后按照常规样本尿液检测程序测定朗道复合质控品,使用前充分混匀,质控品重复测定3次,计算3次重复测定的均值。



谈谈生化检测系统分析性能的评价检测系统是完成检测项目测试所涉及的包括仪器、试剂、校准品、检验程序、质量控制、保养计划等一系列的模块的组合;大部分检测系统是开放的也就是非配套系统。
需要对检测系统的分析性能可否接受作出判断,决定取舍或以期逐步改进。
判断检测系统的可接受性,首先要确定各检测项目的分析性能标准-允许总误差(TEa);其次要明确各检测项目的总误差,既不精密度(CV)和不准确度(Bias),以此为操作点应用Westgard方法评价决定图,在图上根据预期操作点的所在区域,来判断分析性能的可接受性。
根据室内质控和室间质评得出的不精密度和不准确度作为操作点,应用Westgard方法评价决定图判断各项目的方法性能的可接受性。
结果钙(Ca)、尿素(Ur)、钠(Na)、氯(CL)、总胆红素(TB)、磷(P)、肌酐(Cr)、总蛋白(TP)方法性能属于临界水平;总胆固醇(TC)、淀粉酶(AMY)的方法性能属于良好水平,其他各检测项目的方法性能属于优秀水平。
现对参加室间质评活动中的17个检测项目作了分析性能可接受的判断,分析如下。
一、检测材料和方法1、检测系统仪器为东芝40-FR生化分析仪、康立AFT-500电解质分析仪。
室内质控品、校准品、试剂均为德塞诊断系统(上海)有限公司提供。
其中甘油三酯(TG)、总胆固醇(TC)试剂由中生北控试剂有限公司提供。
淀粉酶(AMY)试剂由温州津玛科技有限公司提供。
室间质控品,由自治区临检中心提供。
室内质控使用德塞诊断系统(上海)有限公司提供的正常值和病理值质控血清,所有检测程序按照仪器和试剂说明书设计,测试过程中除使用德塞诊断系统的正常值和病理值质控品外,还使用罗氏正常值和病理值质控血清验证,使用该系统检测患者标本可以溯源至参考方法或相应参考品或有关的技术标准。
2、评价项目均为目前参加本地区的室间质评的检验项目,包括丙氨酸氨基转移酶(ALT)、总蛋白(TP)、白蛋白(ALB)、总胆红素(TB)、直接胆红素(DB)、尿素(Ur)、肌酐(Cr)、尿酸(UA)、葡萄糖(Glu)、TC、TG、钾(K)、钠(Na)、氯(CL)、钙(Ca)、磷(P)、AMY共17项。



“系统化”应对诊疗需求变化溯源性生化检测系统对临床实验室的价值探讨从医学检验到检验医学,检验学科在人类疾病的诊断、治疗、康复和健康促进方面发挥了越来越重要的作用。
随之带来的是临床检验行业对医学实验室标准化、国际化、规范化质量管理的关注。
随着医改的持续深化,医疗需求得到不断的释放,对医疗质量的要求越来越高,“检验结果互认”和“一单通”等成为各级卫生行政主管部门关注的重点。
这使得临床实验室对溯源性和系统性的要求进一步提高,完整的检测系统能够有效保证检测质量,提高检测效率,降低检测成本。
检测系统的定义及分类1、检测系统的定义:一个或多个测量仪器并包括试剂盒供应物的组合,经过组合可对特定区间的特定量给出测量量值。
其中仪器、配套试剂、具有溯源性的校准品是构成检测系统的核心三要素,保持检测系统三要素的固定组合是实现溯源性的前提,如果改变检测系统中任何一个因素,就组成另一套新检测系统,丧失了原系统的溯源性。
2、检测系统的分类:卫生部临床检验中心专家针对检测系统三要素“仪器、试剂、校准品”的不同组合形式,根据其是否具备系统性和溯源性进行了分类(见表1)。
系统性主要指一个系统的产品即仪器、试剂、校准品的理化属性是否相互匹配,是否在参考实验室和标准化实验室完成了量值溯源。
并不是非原装的仪器、试剂、校准品的任意组合,而是要求三者之间相互匹配能够实现溯源。
单纯的试剂盒没有说明指定在什么仪器上、或没有校准品的,无法证实它对患者样品检验结果的溯源性。
单一的仪器,没有说明使用什么试剂盒,也没有指定的校准品,也无法证实任何溯源性。
检测系统的现状1、在欧美:上世纪70~80年代,不同检验科的报告结果出现明显差异。
为了解决这一问题:美国在上世纪90年代首先提出在向FDA申报产品许可证时,并不是一台仪器的认可,而是整个系统的认可。
临床实验室必须使用经FDA认可的检测系统进行患者样品的检测,对检测系统的任何改动,都被视为实验室自行建立的新检测系统,在使用这样的新检测系统检测患者样品前,必须具备详细实验数据,证实符合要求,上报行政管理部门,经批准后方可检测患者样品。
生化分析的校准及结果溯源性要求生化分析的校准是检验实验室必不可少的一项工作,其重要性不言而喻。
从检验工作者到临床医生,从患者到家属,生化分析都是非常重要的数据。
而生化检测的体系经常受到很多因素的影响,有时会严重影响结果的准确性,因此按照规定时间校准就显得非常重要了。
一、校准校准是操作过程中相当重要的环节,是测试和调整检验系统(如仪器设备、试剂、方法学参数)的一个过程。
校准对于保证实验室检验结果的准确性和可靠性是非常重要的。
原则上讲所有的测定都要做校准,除非在专业的特定要求中注明可以不作校准外,所有用于检验、校准、取样的设备,包括对检验结果准确性有影响的辅助设备(如实验环境测量设备和实验材料)都应进行校准,以保证最终结果的准确性二、仪器校准校准可以分两方面,一方面是仪器校准,另一方面是检验项目校准。
对于仪器校准实验室应该制定相应的程序来规定仪器的校准的方法。
因为仪器设备大多数是使用分光光度计,它的波长,透光率、还有基线,检测限的稳定性等都要进行校准。
另外使用什么样的校准品来校准,以及这些校准品的种类、来源和数量,以及校准的时间间隔等都需要进行规定,对于校准以后的设备应该加添相应的标志,表明其已经经过校准,校准的状态是通过校准还是没通过校准,以及它的是否已经正常工作。
另外校准的有效期,要注明下次校准的时间。
仪器校准还包括,要求实验室制定的校准程序,应该能保证结果的可溯源性。
这一点主要是通过校准品的可溯源性来体现的。
同时要求实验室应该具有并应用评定测量不确定度的程序,测量不确定度也主要是校准品本身来体现出来。
应用校准整个过程的全部数据应该都有记录,不管是如何校准,校准了几次,校准的频度与校准的结果都应该做记录。
三、校准的意义仪器的校准是测量结果准确性的基本保证,校准包括校准程序和校准间隔,这两个都是很重要的。
仪器的校准,比如生化分析仪常用的波长、温度,(反应温度很多要求在 37 ℃,温度是否准确);加样量,因为生化的加样都是非常微小的,经常是两三微升,加样精度要求很高;另外空白吸光度,空白吸光度影响基线的稳定性,基线的稳定性也是非常重要的。
生化检测系统分析性能的评价(作者:___________单位: ___________邮编: ___________)【摘要】目的应用Westgard方法评价决定图对我实验室生化检测系统的可接受性作出评价。
方法将各检测项目变异指数得分(VIS)=150时的不准确度(Bias)确定为允许总误差,根据室内质控和室间质评得出的不精密度和不准确度作为操作点,应用Westgard方法评价决定图判断各项目的方法性能的可接受性。
结果钙(Ca)、尿素(Ur)、钠(Na)、氯(CL)、总胆红素(TB)、磷(P)、肌酐(Cr)、总蛋白(TP)方法性能属于临界水平;总胆固醇(TC)、淀粉酶(AMY)的方法性能属于良好水平,其他各检测项目的方法性能属于优秀水平。
结论应用Westgard方法评价决定图判断生化检测检测系统的分析性能简便易行,适合临床实验室使用;并且认为本实验室的检测系统是可接受的。
【关键词】允许总误差;不准确度;质量控制检测系统是完成检测项目测试所涉及的包括仪器、试剂、校准品、检验程序、质量控制、保养计划等一系列的模块的组合[1];大部分检测系统是开放的也就是非配套系统。
需要对检测系统的分析性能可否接受作出判断,决定取舍或以期逐步改进。
判断检测系统的可接受性,首先要确定各检测项目的分析性能标准-允许总误差(TEa);其次要明确各检测项目的总误差,既不精密度(CV)和不准确度(Bias),以此为操作点应用Westgard方法评价决定图,在图上根据预期操作点的所在区域,来判断分析性能的可接受性。
本实验室所在地区的室间质评采用VIS得分评价系统,现对参加室间质评活动中的17个检测项目作了分析性能可接受的判断,分析如下。
1 材料和方法1.1 检测系统仪器为东芝40-FR生化分析仪、康立AFT-500电解质分析仪。
室内质控品、校准品、试剂均为德塞诊断系统(上海)有限公司提供。
其中甘油三酯(TG)、总胆固醇(TC)试剂由中生北控试剂有限公司提供。