废旧易拉罐制明矾
- 格式:docx
- 大小:12.70 KB
- 文档页数:2

二轮复习题型特训:化学实验基础【精编40题答案+解析】1.用下列装置完成相关实验,合理的是( )A.图①:验证H2CO3的酸性强于H2SiO3B.图②:收集CO2或NH3C.图③:分离Na2CO3溶液与CH3COOC2H5D.图④:分离CH3CH2OH与CH3COOC2H5解析:选B。
图①中制得的CO2中含有HCl,HCl通入Na2SiO3溶液中也会产生白色沉淀,A项不合理;图②中收集CO2时,用向上排空气法,气体从左管进,收集NH3时,用向下排空气法,气体从右管进,B项合理;图③为蒸馏装置,而分离Na2CO3溶液和CH3COOC2H5应用分液的方法,C项不合理;CH3CH2OH和CH3COOC2H5互溶,不能用分液的方法分离,D项不合理。
2.下列实验对应的解释或结论正确的是( )Fe2+,故A错误;浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等,故B 正确;两者都表现还原性,故C错误;乙醇是非电解质,且与实验无对应关系,故D 错误。
3.下列实验方案正确且能达到实验目的的是( )解析:选C。
盐酸易挥发,能和硅酸钠反应,A错误;草酸分解会产生H2O,B错误;足量的酸性高锰酸钾溶液颜色变浅,说明有H2S存在且已除尽,C正确;导管插入饱和碳酸钠溶液中,可能会引起倒吸,D错误。
4.某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。
下列说法错误的是( )A.石蜡油是石油减压蒸馏的产物B.碎瓷片加快了石蜡油的分解C.酸性高锰酸钾溶液褪色说明生成了乙烯D.溴的四氯化碳溶液褪色是因为发生了加成反应C 解析石油在常温下分馏得煤油、柴油、重油等馏分,然后以重油为原料经减压蒸馏可得到石蜡油,A正确;碎瓷片作催化剂,降低了反应的活化能,从而加快了石蜡油分解的速率,B正确;能使酸性高锰酸钾溶液褪色的不一定是乙烯,酸性高锰酸钾溶液褪色只能说明石蜡油分解生成了烯烃,C错误;石蜡油分解得到烯烃和烷烃,其中烯烃能与溴的四氯化碳溶液发生加成反应,D正确。

高考理综化学大题训练一工艺流程题TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-工艺流程1.【2017新课标1卷】(14分)Li 4Ti 5O 12和LiFePO 4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO 3,还含有少量MgO 、SiO 2等杂质)来制备,工艺流程如下: 回答下列问题:(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以24TiOCl -形式存在,写出相应反应的离子方程式__________________。
(3)TiO 2·x H 2O 沉淀与双氧水、氨水反应40 min 所得实验结果如下表所示:温度/℃ 30 35 40 45 50 TiO 2·x H 2O 转化率%9295979388分析40 ℃时TiO 2·x H 2O 转化率最高的原因__________________。
(4)Li 2Ti 5O 15中Ti 的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中21(Mg )0.02mol L c +-=⋅,加入双氧水和磷酸(设溶液体积增加1倍),使3Fe +恰好沉淀完全即溶液中351(Fe ) 1.010mol L c +--=⨯⋅,此时是否有Mg 3(PO 4)2沉淀生成? (列式计算)。
FePO 4、Mg 3(PO 4)2的K sp 分别为22241.310 1.010--⨯⨯、。
(6)写出“高温煅烧②”中由FePO 4制备LiFePO 4的化学方程式 。
2【2017?新课标Ⅱ】水泥是重要的建筑材料.水泥熟料的主要成分为CaO 、SiO 2,并含有一定量的铁、铝和镁等金属的氧化物。
实验室测定水泥样品中钙含量的过程如图所示:回答下列问题:(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。

实验一利用废铝罐制备明矾一、实验目的1、学习废旧物回收、处理制备再利用的过程;2、学习化学反应所用原料或样品的预处理方法;3、由废旧铝质易拉罐制备得到明矾。
二、实验原理众所周知,固体废弃物会造成一定的环境污染。
特别是不易分解的固体废弃物尤其对环境不利。
对这些固体废弃物能够加工再处理并能重新利用具有非常重要的意义。
本实验就是运用一些化学反应及操作,将生活中常见的废弃铝罐变成有用的产物明矾。
明矾常常用于。
此废物利用的原理是铝片与过量的碱反应,形成可溶解的Al(OH)4- 。
Al(OH)4-在弱酸性溶液中可脱去一个OH-,形成Al(OH)3沉淀。
随着酸度的增加,Al(OH)3又可重新溶解,形成Al(H2O)63+。
象Al(OH)3这一类物质,同时具有能够与酸或碱反应的性质,称为两性物质。
本实验的产物明矾[ KAl(SO4)2·12H2O ] 也称硫酸钾铝、钾铝矾、铝钾矾等。
矾类[ M+ M3+ (SO4)2·12H2O ]是一种复盐,能从含有硫酸根、三价阳离子(如:Al3+、Cr3+、Fe3+ 等)与一价阳离子(如:K+, Na+, NH4+)的溶液中结晶出来。
它含有12个结晶水,其中6个结晶水与三价阳离子结合,其余6个结晶水与硫酸根及一价阳离子形成较弱的结合。
复盐溶解于水中即离解出简单盐类溶解时所具有的离子。
本实验利用废弃铝罐制备明矾,4步反应式可表示如下:(1) 铝与KOH的反应:2Al+ 2KOH+ 6H2O −−−→ 2Al(OH)4-+ 2K++3H2(2) 加入H2SO4反应:Al(OH)4-+ H+−−−→Al(OH)3 ↓ + H2O(3) 继续加入H2SO4反应:Al(OH)3↓+ 3 H+−−−→Al3+ + 3H2O(4)加入M+ 生成明矾K+ + Al3+ + 2SO42- + 12H2O −−−→ KAl(SO4)2·12H2O三、实验部分1、实验物品及试剂废铝质易拉罐1只(自备)KOH(1mol/L)H2SO4(6mol/L)2、实验仪器3、实验步骤(1)将废铝质易拉罐裁剪成片状(约60-80 cm2),用砂纸打磨除去表面的颜料和塑胶内膜,洗净备用。
![11、明矾[kal(so4)212h2o]的制备.doc](https://uimg.taocdn.com/2c02c80bfbd6195f312b3169a45177232e60e45d.webp)
实验11 从易拉罐制备净水剂明矾及纯度测定教学目的与要求:1、学会利用身边易得的废铝材料制备明矾的方法;2、巩固溶解度概念及其应用,认识铝和氢氧化铝的两性;3、练习和掌握溶解、过滤、结晶以及沉淀的转移和洗涤等基本操作;4、学习从溶液中培养晶体的原理和方法;5、掌握配位滴定中的返滴定法原理;6、掌握铝含量的测定方法。
教学重点与难点:重点:1.溶解、蒸发、结晶、减压抽滤等操作;2.物质分离提纯的方法。
难点:1.提高制备的明矾的产量和质量;2.物质制备操作步骤的规范化和熟练性。
教学方法与手段:板书,学生操作,现场指导。
学时分配:3学时。
教学内容:水是生命之源,我们每天的生活离不开水,而要想得到纯净的水,就要经历水的净化。
过去,民间常用吸附沉淀的方法来净化水,这就离不开一种关键的净水剂——明矾。
明矾的制备也不难,使用生活中废料——易拉罐就可制得。
走在街上到处可发现被抛弃的饮料罐,其中铝罐是不易被分解废弃物之一,平均寿命约达一百年。
铝虽是地壳中含量第三的元素,但并不表示是用之不尽的,必须找出一可行方法来回收。
一般回收的铝罐多是经加热熔融后再制成其它铝制品重复利用。
在本实验中,将用废弃的易拉罐制成具净水功能的铝明矾,藉以了解铝的化学性质。
明矾即十二水硫酸铝钾,又称:明矾、白矾、钾矾、钾铝矾、钾明矾,是含有结晶水的硫酸钾和硫酸铝的复盐。
古时候,在云南省有个苦孩子叫白凡,和爹爹住在一间破草屋里。
他们的草房外有株很高的树。
每当夏季,这棵树都会开出黄色的小花,花落了,就会长出黑色的果实。
白凡很喜欢这树,这棵树也以其树荫尽心尽力守护着这破草房,使它免受风吹雨打和日晒。
有一天,白凡梦见这棵大树变成英伟的王子。
他自称诃黎勒,本是来自遥远的南方,我要走了,临走前送你这些东西留念,记住,需要时给你老爹吃。
”白凡惊醒,屋前的大树不见了,遗下一包大树的果实,还有一包无色透明、闪亮的晶体。
不久,该地发生了流行病,老人都腹泻不止。
白凡的老爹亦不例外,他把王子留下的两包东西煨烧成灰,再细捣细筛成散,用粥调和,喂给老爹吃。

废旧易拉罐制明矾废旧易拉罐制明矾【实验目的】(1)了解绿色化学理念,学习变废为宝,合理利用废旧易拉罐(2)了解明矾的制备方法(3)熟悉普通过滤,抽滤,蒸发结晶等操作【实验原理】绿色化学又称“环境无害化学”“环境友好化学”“清洁化学”,是指:在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂和溶剂。
明矾:K2SO4·12H2O,又称白矾,钾矾,钾明矾,无色立方晶体,外表呈八面体,密度1.757g/cm3,熔点92.5C,溶于水,不溶于乙醇。
明矾有抗菌作用,收敛作用,可用作中药,制备铝盐,发酵粉,油漆,鞣料,澄清剂,媒染剂,造纸,防水剂等,还可用于食品添加剂。
易拉罐:铝制易拉罐主要成分有铝,硅以及少量的锰铝是两性元素,既能溶于酸,又能溶于强碱,将其溶于浓氢氧化钾溶液后得可溶性的四羟基合铝酸钾K[Al(OH)4],再用稀H2SO4调节pH值,可将之转化为氢氧化铝Al(OH)3,氢氧化铝可溶于硫酸,生成硫酸盐。
硫酸铝能同碱金属硫酸盐如K2SO4在水溶液中结合生成溶解度较小的同晶复盐,即明矾。
冷却溶液时,明矾结晶出来。
整个过程涉及的化学方程式有:2Al+2KOH+2H2O==2KAlO2+3H2↑2KAlO2+H2SO4+2H2O==2Al(OH)3↓+K2SO418H2O+K2SO4+2Al(OH)3+3H2SO4==2KAl(SO4)2·12H2O利用Al2(SO4)3,K2SO4,KAl(SO4)2在水中溶解度的差异进行分离,用无水乙醇进行溶剂置换使明矾结晶出来。
【实验仪器与试剂】仪器:100mL烧杯,25mL量筒,10mL量筒,三角漏斗,布氏漏斗,抽滤瓶,表面皿,蒸发皿,电子台秤,磁力搅拌加热器。
试剂:H2SO4(3mol/L),KOH(1mol/L),1:1的H2SO4,K2SO4(s),无水乙醇,pH试纸,易拉罐【实验步骤】氢氧化铝的制备取废旧易拉罐的铝片,打磨并剪碎。

最新高三化学模拟试题精练(六)(考试用时:50分钟 试卷满分:100分)7.明矾[KAl(SO 4)2·12H 2O]是一种复盐,在造纸等方面应用广泛。
采用废易拉罐制备明矾的过程如下图所示。
下列叙述错误的是( )A .合理处理易拉罐有利于环境保护和资源再利用B .从易拉罐中可回收的金属元素有Al 、FeC .“沉淀”反应的金属离子为Fe 3+D .上述流程中可用NaHSO 4代替NaHCO 3解析:选D 。
A.易拉罐作为可再生资源,其回收再利用对经济效益、社会效益的提高、环境的保护有着巨大的促进作用,正确;B.易拉罐(主要成分为Al ,含有少量的Fe),因此可从易拉罐中回收的金属元素有Al 、Fe ,正确;C.“沉淀”反应是铁离子生成氢氧化铁的反应,正确;D.铝离子与碳酸氢根离子互促水解到底生成氢氧化铝沉淀,硫酸氢根离子是强酸的酸式酸根,不水解,不与铝离子反应,错误。
8.BMO(Bi 2MoO 6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。
下列说法不正确的是( )A .该过程的总反应:C 6H 6O +7O 2――→光BMO6CO 2+3H 2O B .该过程中BMO 表现较强氧化性 C .降解产物的分子中只含有极性共价键 D .①和②中被降解的苯酚的物质的量之比为3∶1解析:选B 。
A.该过程用光催化降解苯酚生成二氧化碳和水,所以反应:C 6H 6O +7O 2――→光BMO 6CO 2+3H 2O ,故A 正确;B.该过程中BMO 是催化剂,BMO 与O 2在光作用下,BMO 被氧化成BMO +,故B 错误;C.降解苯酚的产物为二氧化碳和水,二氧化碳和水分子中都只含有极性共价键,故C 正确;D.①中1 mol O -2要得到3 mol 电子,而②中1 mol BMO +变为1 mol BMO 只要得到1 mol 电子,根据氧化还原反应得失电子相等,所以①、②中被降解的苯酚的物质的量之比为3∶1,故D 正确。
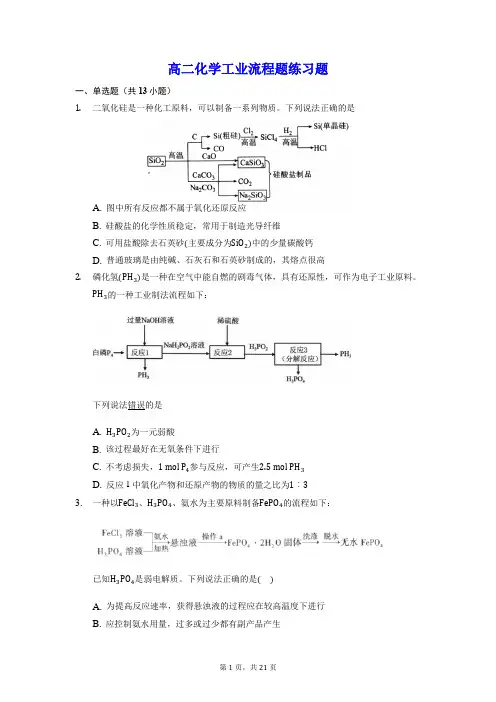
高二化学工业流程题练习题一、单选题(共13小题)1.二氧化硅是一种化工原料,可以制备一系列物质。
下列说法正确的是A. 图中所有反应都不属于氧化还原反应B. 硅酸盐的化学性质稳定,常用于制造光导纤维C. 可用盐酸除去石英砂(主要成分为SiO2)中的少量碳酸钙D. 普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高2.磷化氢(PH3)是一种在空气中能自燃的剧毒气体,具有还原性,可作为电子工业原料。
PH3的一种工业制法流程如下:下列说法错误的是A. H3PO2为一元弱酸B. 该过程最好在无氧条件下进行C. 不考虑损失,1mol P4参与反应,可产生2.5mol PH3D. 反应1中氧化产物和还原产物的物质的量之比为1︰33.一种以FeCl3、H3PO4、氨水为主要原料制备FePO4的流程如下:已知H3PO4是弱电解质。
下列说法正确的是()A. 为提高反应速率,获得悬浊液的过程应在较高温度下进行B. 应控制氨水用量,过多或过少都有副产品产生C. 操作a所需玻璃仪器有分液漏斗、烧杯D. 检验FePO4·2H2O固体是否洗涤干净,选用的试剂可以是KSCN溶液4.废铁屑制Fe2O3的一种流程如下图:下列说法不正确的是()A. 热的纯碱溶液可去除废铁屑表面的油污B. 操作a是萃取C. 冰水既可洗去杂质又可减少固体的溶解D. Fe2O3可用作红色颜料5.碘循环工艺不仅能吸收SO2,减少环境污染,同时又能制得氢气,具体流程如图所示。
下列说法正确的是()A. 分离器中的物质分离操作为过滤B. 该工艺中HI的量没有改变,可视作该工艺的催化剂C. 该工艺中I2和HI的相互转化体现了“碘循环”D. 碘循环工艺的总反应为2SO2+4H2O+I2− △ H2+2H2SO4+2HI6.氯化亚铜常用作有机合成催化剂,难溶于水,不溶于稀硝酸和乙醇,但可溶于Cl−浓度较大的体系生成配离子[CuCl2]−,在潮湿空气中易水解氧化为碱式氯化铜。

广东省广州市2022届高三化学3月综合测试试题(一)(含解析)1.明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。
实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:下列叙述错误的是A. 回收处理废易拉罐有利于保护环境和资源再利用B. “沉淀”为Al2(CO3)3C. “操作a”中包含蒸发浓缩、冷却结晶D. 上述流程中可用过量CO2代替NH4HCO3【答案】B【解析】【详解】A、可回收物是指各种废弃金属、金属制品、塑料等可回收的垃圾,废易拉罐属于可回收垃圾,回收处理废易拉罐有利于保护环境和资源再利用,选项A正确;B、偏铝酸钠与碳酸氢铵发生反应生成碳酸钠、碳酸铵和氢氧化铝,故“沉淀”为Al (OH)3,选项B错误;C、沉淀溶解于稀硫酸,再加入硫酸钾,“操作a”中包含蒸发浓缩、冷却结晶,最后得到明矾,选项C正确;D. 上述流程中可用过量CO2代替NH4HCO3,过量二氧化碳与偏铝酸钠溶液反应得到氢氧化铝沉淀,选项D正确。
答案选B。
2.N A是阿伏加德罗常数的值,下列说法正确的是A. 10 gD2O中含有的质子数与中子数均为5N AB. 标准状况下,22.4LCHC13中含C-Cl键的数目为3N AC. 密闭容器中,1mol NH3和1molHCl反应后气体分子总数为N AD. l00mL1.0 mol/L FeC13溶液与足量Cu反应,电子转移数为0.2N A【答案】A【解析】【详解】A. 10 gD2O 中含有的质子数与中子数均为5N A,选项A正确;B. CHC13标准状况下是液体,22.4LCHC13中含C-Cl键的数目大于3N A,选项B错误;C. NH3和HCl反应生成氯化铵固体,故1mol NH3和1molHCl反应后气体分子总数为0,选项C错误;D. l00mL1.0 mol/L FeC13溶液与足量Cu反应,铁由+3价变为+2价,电子转移数为0.1N A,选项D错误。

实验报告:明矾的制备及组成测定1. 选题背景明矾,无色透明块状结晶或结晶性粉末,无臭,味微甜而酸涩。
在干燥空气中风化失去 结晶水,在潮湿空气中溶化淌水,加热至92·5℃失去9个结晶水,200℃时失去全部结晶水成为白色粉末。
易溶于水,缓慢溶于甘油,不溶于乙醇,丙酮。
其水溶液呈酸性,在水中水解生成氢氧化铝胶状沉淀。
明矾净水是过去民间经常采用的方法,它的原理是明矾在水中可以电离出铝离子,二氯离子容易水解,生成氢氧化铝胶体,氢氧化铝胶体吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清,因此是一种较好的净水剂。
2. 实验原理2.1 制备明矾的原理2.1.1碱法:(实验中使用)2.1.2 酸法:2.2 铝离子含量测定原理Al 3+与EDTA 配位反应,加入过量的EDTA ,并加热煮沸反应完全;AI 3+对二甲酚橙指示剂 有封闭作用,酸度不够时容易水解,在pH 值为3~4时Al 3+与过量的EDTA 在煮沸时配位完全。
+-+-+→+H AlY Al Y H 2322+-+-+→+H ZnY Zn Y H 2)(2222过量再调节pH 值为5-6,以二甲酚橙指示剂,用锌盐标准溶液返滴定剩余EDTA ,加入过量的F NH 4加热煮沸,置换出与+3Al 配位的EDTA ,再用锌盐标准溶液滴定释放出来的EDTA ,至溶液由黄色变为紫红为终点。
--+--+→++223626Y H ALF H F AlY+-+-+→+H ZnY Zn Y H 2)(2222置换反应2.3 净水试验原理明矾在水中可以电离出两种金属离子: -++++=243242)(SO Al K SO KAl而Al3+很容易水解,生成氢氧化铝Al(OH)3胶体:()+++⇔+H OH Al O H Al 33323()()()()()()()224242424324242332424242322262322223624212Al KOH H O K Al OH H K Al OH H SO Al OH K SO H O Al OH H SO Al SO H O Al SO K SO H O KAl SO H O ⎡⎤++=+↑⎣⎦⎡⎤+=↓++⎣⎦+=+++=∙()()()24242324242423223624212Al H SO Al SO H Al SO K SO H O KAl SO H O+=+↑++=∙3.实验步骤和内容3.1明矾的制备3.1.1磨去易拉罐表面的涂料层并剪碎,称取0.7g。

2021届高三化学2轮复习《工业流程图》专题训练(最新选择题)1、.(2020·大联盟一模)某含镍的废催化剂(含有Al、AlO3、Fe及酸碱不溶物)再利用的流程2如下:下列说法错误的是( )A.“碱溶”的主要目的是将Al、Al2O3转化为AlO-2而与其他金属分离B.“酸溶”可以选用硝酸C.滤渣3的主要成分为氢氧化铁D.合理处理含镍废催化剂有利于环境保护和资源再利用答案 B2.(2020·湖南五校联盟一模)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物,还含有少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3-0.5n]m,制备过程如图所示。
下列说法不正确的是( )A.炉渣中FeS与硫酸、氧气反应的离子方程式为4FeS+3O2+12H+===4Fe3++4S+6H2OB.气体M的成分是SO2,通入到双氧水中得到硫酸,可循环使用C.若调节溶液Z的pH偏小,则将导致聚铁中铁的质量分数偏大D.溶液X转化为溶液Y需要加过量铁粉,再过滤答案 C3、(2020·宁波市余姚市3月,24)二氧化铈 (CeO)是一种重要的稀土氧化物。
平板电视显2示屏生产过程中产生大量的废玻璃粉末(含 SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质),某课题组以此粉末为原料回收铈,设计实验流程如下:下列说法不正确的是( )A.洗涤滤渣 A 的目的是为了除去滤渣上附着的 Fe3+、Cl-等,取最后洗涤液少量,滴加 AgNO3溶液,如无白色沉淀,则已洗净B.步骤②中 H2O2作还原剂C.萃取是分离稀土元素的常用方法,用合适的萃取剂能将铈离子从水溶液中萃取出来,此萃取剂不能与水互溶D.如要测定最终产品的纯度,可先准确称取一定量产品,经溶解、预处理后,用带有刻度的烧杯准确配制成 100 mL 溶液用于后续的滴定分析答案 D4、如图是一种综合处理SO气的工艺流程。

一、选择题1.下列从海洋中获取物质的方案不合理...的是A.向海水中加入石灰乳得到Mg(OH)2,加入盐酸得到MgCl2溶液,最后电解该溶液得到镁单质B.苦卤酸化后通入氯气得到溴水,然后用热空气将其吹入SO2水溶液中,再通入氯气,最后通过萃取、分液、蒸馏得到溴单质C.干海带灼烧后加水浸取,然后加入H2O2得到碘水,最后通过萃取、分液、蒸馏得到碘单质D.粗盐先通过除杂、精制得到饱和食盐水,然后电解得到氯气,最后用氯气和石灰乳反应制得漂白粉2.化学与人们的生活、生产密切相关。
下列说法正确的是A.酒精和84消毒液混合使用能提高对新型冠状病毒的预防效果B.纳米铁粉可以去除被污染水体中的Cu2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附C.燃煤中加入CaO可以减少酸雨的形成,同时也可以减少温室气体的排放D.5G时代某三维存储器能储存海量数据,其半导体衬底材料是单晶硅3.下列说法正确的是A.煤是无机化合物,天然气和石油是有机化合物B.利用二氧化碳与环氧丙烷生产可降解塑料符合绿色化学原则C.现实生活中,化学腐蚀现象比电化学腐蚀现象更严重D.铅蓄电池属于一次电池4.下列关于铝及其化合物说法不正确的是A.明矾可用作净水剂和消毒剂B.铝可用作包装材料和建筑材料C.利用铝热反应可冶炼高熔点金属D.氢氧化铝可用作治疗胃酸过多的药物5.“绿色化学”提倡,设计制备物质的方案时,要从经济、环保和技术等方面考虑,以下由铜制取硝酸铜的四种方案中,比较符合“绿色化学”概念且可行的方案是A.Cu → Cu(NO3)2B.Cu → CuO →Cu(NO3)2C.Cu → CuCl2 →Cu(NO3)2D.Cu → CuSO4 →Cu(NO3)26.美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:下列说正确的是A .图中能量转化方式只有2种B .H +向a 极区移动C .b 极发生的电极反应为:N 2+6H ++6e -=2NH 3D .a 极上每产生22.4LO 2流过电极的电子数一定为4×6.02×1023 7.下列说法不正确的是A .钠着火不能用泡沫灭火器灭火B .石灰石在高温下可用于消除燃煤烟气中的SO 2C .二氧化硅具有导电性,可用于制造光导纤维D .利用催化剂可减少汽车尾气中有害气体的排放8.绿色化学助力可持续发展。
一、实验目的1. 掌握废旧易拉罐制备明矾的方法和原理。
2. 了解铝与碱反应生成偏铝酸钠的过程。
3. 学习明矾的结晶和提纯方法。
4. 培养实验操作技能和化学实验思维。
二、实验原理明矾(KAl(SO4)2·12H2O)是一种重要的无机化合物,广泛应用于造纸、净水、食品加工等领域。
本实验利用废旧易拉罐中的铝作为原料,通过一系列化学反应制备明矾。
1. 铝与氢氧化钠溶液反应生成偏铝酸钠和氢气:2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑2. 偏铝酸钠溶液中通入二氧化碳,生成氢氧化铝沉淀和碳酸氢钠:2NaAlO2 + CO2 + 3H2O → 2Al(OH)3↓ + Na2CO33. 氢氧化铝沉淀与硫酸反应生成硫酸铝:2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O4. 硫酸铝与硫酸钾反应生成明矾:Al2(SO4)3 + 3K2SO4 → 2KAl(SO4)2·12H2O三、实验器材与试剂1. 实验器材:烧杯、漏斗、布氏漏斗、玻璃棒、蒸发皿、加热装置、温度计、滤纸等。
2. 试剂:废旧易拉罐、氢氧化钠溶液、二氧化碳、硫酸、硫酸钾、蒸馏水等。
四、实验步骤1. 将废旧易拉罐剪碎,放入烧杯中,加入足量的蒸馏水,浸泡一段时间。
2. 将浸泡好的易拉罐取出,用布氏漏斗抽滤,得到滤液。
3. 向滤液中加入适量的氢氧化钠溶液,搅拌均匀。
4. 将混合溶液加热至沸腾,持续加热一段时间,使铝与氢氧化钠充分反应。
5. 停止加热,待溶液冷却至室温。
6. 向冷却后的溶液中通入二氧化碳气体,使偏铝酸钠转化为氢氧化铝沉淀。
7. 将混合溶液静置一段时间,待氢氧化铝沉淀完全沉降。
8. 用布氏漏斗抽滤,得到氢氧化铝沉淀。
9. 将氢氧化铝沉淀溶解于适量的硫酸中,搅拌均匀。
10. 将混合溶液加热至沸腾,持续加热一段时间,使硫酸铝充分溶解。
11. 停止加热,待溶液冷却至室温。
12. 向冷却后的溶液中加入适量的硫酸钾溶液,搅拌均匀。
2021年高考化学专题练习:无机工艺流程分析1、明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。
实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:下列叙述错误的是( )A. 回收处理废易拉罐有利于保护环境和资源再利用B. “沉淀”为Al2(CO3)3C. “操作a”中包含蒸发浓缩、冷却结晶D. 上述流程中可用过量CO2代替NH4HCO32、实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:下列叙述错误的是()A. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2C. 与加入锌粉反应的离子为Cu2+、H+D. “过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnOLiPF (六氟磷酸锂)。
简3、Kemmitt等使用不锈钢容器合成锂离子电池的电解质材料——6易流程如下(已知HF的沸点约为19.5℃):下列有关说法不正确的是( )A.合成中控制温度的目的是降低HF损失B.操作者必须戴防毒面具和手套C.可以用玻璃容器替代不锈钢容器D.R是HF,循环利用可以提高使用效率4、某化学实验兴趣小组的同学从海带中提取碘单质的实验流程图如下:依据实验下列说法不正确...的是()A. 从上述实验可以得出海带中含有可溶性的含碘化合物IO +6H+ =3I2 +3H2OB. 步骤⑤中可能发生的反应为:5I- +3C. 若步骤④中用CCl4做萃取剂,步骤⑥应取上层溶液得到后续的混合物CD. 整个过程中的操作是利用了物质的溶解性实现了碘元素的富集、分离与提纯5、Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:已知:“酸浸”后,钛主要以24TiOCl -形式存在FeTiO 3+4H ++4Cl -===Fe 2++24TiOCl -+2H 2O下列说法不正确的是( )A .Li 2Ti 5O 15中Ti 的化合价为+4,其中有4个过氧键B .滤液②中的阳离子除了Fe 2+和H +,还有Mg 2+C .滤液②中也可以直接加适量的氯水代替双氧水D .“高温煅烧”过程中,Fe 元素被氧化6、实验室中采用废旧易拉罐(主要成分为Al ,含少量Fe 、Mg 杂质)制备明矾[KAl(SO 4)2·12H 2O 的过程如图所示:下列说法不正确的是( ) A. 试剂①可以选用NaOH 溶液 B. NH 4HCO 3用于调节滤液A 的pH C. 操作a 是蒸发浓缩、冷却结晶、过滤 D. 明矾溶液显酸性,常作消毒杀菌剂7、某学习小组以废催化剂(主要成分SiO 2、ZnO 、ZnS 和CuS )为原料,制备锌和铜的硫酸盐晶体。
由廢鋁罐製備明礬z國立臺灣大學化學系,大學普通化學實驗,第十二版,國立臺灣大學出版中心:台北,民國九十七年。
z版權所有,若需轉載請先徵得同意;疏漏之處,敬請指正。
z臺大化學系普化教學組羅聲晴助教,2007年2月10日。
一、目的:回收廢棄罐製成明礬,利用再結晶法加以純化,並經取代反應製成鉻鋁明礬。
二、實驗技能:學習藥品稱量、液體量取、重力過濾法、抽氣過濾法、再結晶的分離純化及養晶技術。
三、原理:(一)合成鋁明礬鋁是活潑的金屬,但與稀酸反應很慢,因其表面常被一層氧化鋁保護著;而鹼性溶液可溶解此氧化層,進一步再與鋁反應。
鋁片與過量鹼反應形成可溶解的 Al(OH)4-:2Al(s) + 2KOH(aq) + 6H2O(l) → 2K+(aq) + 2Al(OH)4-(aq)+ 3H2(g) (1)當加入酸時,可移去一個 OH-,產生白色柔毛狀 Al(OH)3 沈澱:Al(OH)4-(aq) + H+(aq) → Al(OH)3(s) + H2O(l) (2)繼續加酸,則 Al(OH)3 變成 Al3+ 溶解於酸中:Al(OH)3(s) + 3H+(aq) → Al3+(aq) + 3H2O(l) (3)若將鹼加入 Al(OH)3中,則產生可溶解的Al(OH)4-:Al(OH)3(s) + OH-(aq)→ Al(OH)4-(aq) (4)像Al(OH)3這類既能當鹼又能當做酸的物質,稱為兩性物質(amphotericsubstances),其它如:Sb(OH)3、Sn(OH)2、Sn(OH)4、Pb(OH)2、Cr(OH)3、Zn(OH)2、Ga(OH)3及Ti(OH)4等均為兩性化合物。
明礬(Alum),通式為M+M3+(SO4)2⋅12H2O,是離子化合物,能從含硫酸根、三價陽離子(如:Al3+、Cr3+、Fe3+)和一價陽離子(如:K+、Na+、NH4+)的過飽和溶液中結晶出來,在適當條件下並可長成相當大的晶體。
用废旧易拉罐制备明矾一、实验目的1、了解铝和氧化铝的两性;2、了解明矾的制备方法;3、练习和掌握溶解、过滤、结晶以及沉淀的转移和洗涤等无机制备中常用的基本操作;二、实验原理铝是一种两性元素,既与酸反应,又与碱反应;将其溶于浓氢氧化钠溶液,生成可溶性的四羟基合铝Ш酸钠NaAlOH4,再用稀H2SO4调节溶液的pH值,可将其转化为氢氧化铝;氢氧化铝可溶于硫酸,生成硫酸铝;硫酸铝能同碱金属硫酸盐如硫酸钾在水溶液中结合成一类在水中溶解度较小的同晶的复盐,称为明矾KAlSO42·12H2O;当冷却溶液时,明矾则结晶出来;制备中的化学反应如下:废旧易拉罐的主要成分是铝,因此本实验中采用废旧易拉罐代替纯铝制备明矾,也可采用铝箔等其他铝制品;三、仪器与药品仪器:100mL烧杯两只,20mL、10mL量筒各一只,普通漏斗,布式漏斗,抽滤瓶,表面皿,蒸发皿,水浴锅,电子天平;药品:3mol/LH2SO4溶液,1:1H2SO4溶液,NaOHs,K2SO4S,易拉罐或其他铝制品实验前充分剪碎,pH试纸1~14,无水乙醇;四、实验步骤1、四羟基合铝Ш酸钠NaAlOH4的制备在电子天平上快速称取固体氢氧化钠1g,迅速将其转移至100mL 的烧杯中,加20mL水溶解;称0.5g剪碎的易拉罐,将烧杯置于70℃水浴中加热反应剧烈,防止溅出,分次将易拉罐碎屑放入溶液中;待反应完毕后,趁热用普通漏斗过滤;2、氢氧化铝的生成和洗涤在上述羟基合铝Ш酸钠溶液中加入4mL左右的3mol/LH2SO4溶液应逐滴加入,调节溶液的pH值为7~8,此时溶液中生成大量的白色氢氧化铝沉淀,用布氏漏斗抽滤,并用蒸馏水洗涤沉淀;3、明矾的制备将抽滤后所得的氢氧化铝沉淀转入蒸发皿中,加5mL1:1H2SO4,再加7mL水溶解,加入2g硫酸钾加热至溶解水浴70℃,将所得溶液在空气中自然冷却后,加入3mL无水乙醇,待结晶完全后,减压过滤,用5mL1:1的水-乙醇混合溶液洗涤晶体两次;将晶体用滤纸吸干,称重,计算产率;4、产品的定性分析自己设计定性分析方法提示:用化学方法鉴定,要求写出分析方法;五、思考题1、计算用0.5g纯的金属铝能生成多少克的硫酸铝这些硫酸铝需与多少克硫酸钾反应2、若铝中含有少量铁杂质,在本实验中如何除去。
废铝罐制明矾实验报告废铝片制备明矾晶体废铝片制备明矾晶体实验目的1、学习实际物品做为原料的处理方法2、学习无机制备的基本步骤,称量、加热、3、理解晶体生长的条件实验原理:(1)制备明矾的原理铝屑溶于浓氢氧化钾溶液,可生成可溶性的四羟基合铝(Ⅲ)酸钾K[Al(OH)4],用稀硫酸调节溶液的pH值,将其转化为氢氧化铝,使氢氧化铝溶于硫酸,溶液浓缩后经冷却有较小的同晶复盐,此复盐称为明矾[KAl(SO4)2·12H2O]。
制备中的化学反应如下:2Al + 2KOH + 6H2O ═2 K[Al(OH)4] + 3H2↑2K[Al(OH)4] + H2SO4 ═2Al(OH)3↓+ K2SO4 + 2H2O2Al(OH)3 + 3H2SO4 ═Al2(SO4)3 + 6H2OAl2(SO4)3 + K2SO4 + 24 H2O ═2 KAl(SO4)2·12H2O(2)晶体生长的条件:适当的浓度,适当的温度(3)净水原理明矾溶于水后电离产生了Al3+,Al3+与水电离产生的OHˉ结合生成了氢氧化铝,氢氧化铝胶体粒子带有正电荷,与带负电的泥沙胶粒相遇,彼此电荷被中和。
失去了电荷的胶粒,很快就会聚结在一起,粒子越结越大,终于沉入水底。
这样,水就变得清澈干净了。
此外氢氧化铝也是一种空隙很多的物质,表面的吸附能很大,可以吸附水里面的沙子,灰尘等。
实验步骤:明矾的制备:废铝(2g)加入到盛有50mL 1.5mol?L-1 KOH溶液(自己配!)的烧杯中,加热加快反应*。
不再有气泡产生后抽滤,取滤液。
将滤液预热后,边加热边滴加9 mol?L-1 H2SO4溶液(1:1 H2SO4,实验室提供!)至沉淀全部溶解,浓缩溶液至50mL左右(过多损失,过少会形成聚铝。
32ml溶剂+16ml结晶水=50ml溶液)。
放入一次性杯子,自然冷却至室温后一周后观察晶体形貌。
抽滤,用乙醇淋洗后将食盐状晶体粉末放置于空气中晾干,即可得到明矾。
废旧易拉罐制明矾
【实验目的】
(1)了解绿色化学理念,学习变废为宝,合理利用废旧易拉罐
(2)了解明矾的制备方法
(3)熟悉普通过滤,抽滤,蒸发结晶等操作
【实验原理】
绿色化学又称“环境无害化学”“环境友好化学”“清洁化学”,是指:在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂和溶剂。
明矾:K2SO4·12H2O,又称白矾,钾矾,钾明矾,无色立方晶体,外表呈八面体,密度1.757g/cm3,熔点92.5C,溶于水,不溶于乙醇。
明矾有抗菌作用,收敛作用,可用作中药,制备铝盐,发酵粉,油漆,鞣料,澄清剂,媒染剂,造纸,防水剂等,还可用于食品添加剂。
易拉罐:铝制易拉罐主要成分有铝,硅以及少量的锰
铝是两性元素,既能溶于酸,又能溶于强碱,将其溶于浓氢氧化钾溶液后得可溶性的四羟基合铝酸钾K[Al(OH)4],再用稀H2SO4调节pH值,可将之转化为氢氧化铝Al(OH)3,氢氧化铝可溶于硫酸,生成硫酸盐。
硫酸铝能同碱金属硫酸盐如K2SO4在水溶液中结合生成溶解度较小的同晶复盐,即明矾。
冷却溶液时,明矾结晶出来。
整个过程涉及的化学方程式有:2Al+2KOH+2H2O==2KAlO2+3H2↑
2KAlO2+H2SO4+2H2O==2Al(OH)3↓+K2SO4
18H2O+K2SO4+2Al(OH)3+3H2SO4==2KAl(SO4)2·12H2O
利用Al2(SO4)3,K2SO4,KAl(SO4)2在水中溶解度的差异进行分离,用无水乙醇进行溶剂置换使明矾结晶出来。
【实验仪器与试剂】
仪器:100mL烧杯,25mL量筒,10mL量筒,三角漏斗,布氏漏斗,抽滤瓶,表面皿,蒸发皿,电子台秤,磁力搅拌加热器。
试剂:H2SO4(3mol/L),KOH(1mol/L),1:1的H2SO4,K2SO4(s),无水乙醇,pH试纸,易拉罐
【实验步骤】
氢氧化铝的制备
取废旧易拉罐的铝片,打磨并剪碎。
称取1.0g的剪碎的易拉罐,取40mL KOH溶于100mL烧杯中,水浴加热(反应激烈,防止溅出),分批加入碎易拉罐,并不断搅拌至无气泡产生。
反应完毕后,趁热用普通三角漏斗过滤
在上述溶液中逐渐加入3mol/L的H2SO4,调节溶液pH为7~8。
此时溶液中生成大量的白色氢氧化铝沉淀,用布氏漏斗抽滤并用蒸馏水洗涤。
KAl(SO4)3·12H2O的合成与结晶
取过滤后的固体于蒸发皿,加入1:1H2SO4 8mL,加热溶解,再加入3.2g K2SO4(补充溶液中的K2SO4),加热溶解。
将所得溶液在空气中自然冷却,加入5mL无水乙醇,待结晶完全后,抽滤,用1:1的水-乙醇洗涤晶体
用滤纸将晶体吸干,称重并计算产率
注意:对于杂质
Si在制备过程中发生如下变化:
Si+2KOH+H2O==K2SiO3+2H2↑
K2SiO3+H2SO4==H2SiO3↓+K2SO4
H2SiO3在(4)除去
Mn不溶于KOH在(1)除去
参考文献:【1】李梅.梁竹梅.韩莉.化学实验与生活——从实验中了解化学化学工业出版社【2】。