第一类医疗器械备案信息表
- 格式:doc
- 大小:133.00 KB
- 文档页数:12


第一类医疗器械生产备案表一、引言随着医疗技术的快速发展和公众对健康需求的不断提高,医疗器械的生产和使用已成为社会的重要议题。
第一类医疗器械作为医疗器械的重要组成部分,其生产和使用的管理显得尤为重要。
本文将详细解读第一类医疗器械生产备案表的相关内容。
二、第一类医疗器械生产备案表概述第一类医疗器械是指通过常规控制能够确保安全性和有效性的医疗器械,如普通诊察器械、物理治疗器械等。
根据《医疗器械监督管理条例》规定,从事第一类医疗器械生产的单位必须向食品药品监督管理部门提交第一类医疗器械生产备案表,方可从事生产活动。
三、第一类医疗器械生产备案表主要内容第一类医疗器械生产备案表主要包括以下内容:1、生产单位基本信息:包括单位名称、统一社会信用代码、住所、法定代表人、生产等。
2、生产产品信息:包括产品名称、注册证编号、规格型号、生产批量、生产工艺流程等。
3、原材料采购信息:包括主要原材料的种类、供应商、进货渠道等。
4、质量控制信息:包括质量控制标准、检验设备及人员资质、产品检验报告等。
5、销售及售后服务信息:包括销售渠道、售后服务承诺等。
四、第一类医疗器械生产备案表的填报注意事项在填报第一类医疗器械生产备案表时,需要注意以下几点:1、确保填写的信息真实、准确、完整,不得虚报、瞒报。
2、对于生产过程中的关键环节和质量控制点,应详细描述并附上相关证明材料。
3、对于涉及到的技术参数和性能指标,应严格按照相关标准填写。
4、提交的资料应当清晰明了,易于查阅和理解。
五、总结第一类医疗器械生产备案表是保证第一类医疗器械安全性和有效性的重要文件,也是监管部门对生产单位实施监督管理的依据。
各生产单位应认真填写备案表,遵守相关法规,确保医疗器械的质量和安全,为公众的健康提供有力保障。
监管部门也应加强对第一类医疗器械生产的监管力度,确保备案制度的落实和执行。
第一类医疗器械备案信息表一、概述第一类医疗器械备案信息表是用于记录和展示第一类医疗器械备案信息的表格。
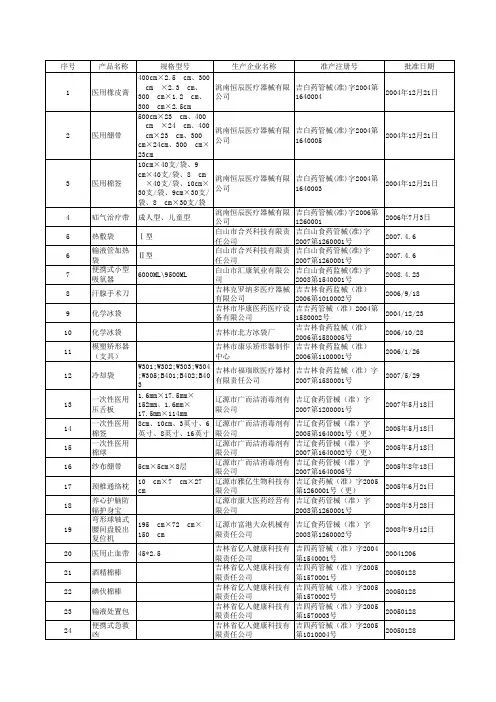
第一类医疗器械备案信息表备案号:鲁菏械备20140034号第一类医疗器械备案信息表备案号:鲁菏械备20150052号第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表备案号:鲁菏械备20160049号第一类医疗器械备案信息表备案号:鲁菏械备20160048号第一类医疗器械备案信息表备案号:鲁菏械备20160032号第一类医疗器械备案信息表备案号:鲁菏械备20160028号第一类医疗器械备案信息表备案号:鲁菏械备20160085号第一类医疗器械备案信息表备案号:鲁菏械备20160092号第一类医疗器械备案信息表备案号:鲁菏械备20160096号第一类医疗器械备案信息表备案号:鲁菏械备20160099号第一类医疗器械备案信息表备案号:鲁菏械备20160056号第一类医疗器械备案信息表备案号:鲁菏械备20140006号第一类医疗器械备案信息表备案号:鲁菏械备20140036号第一类医疗器械备案信息表备案号:鲁菏械备20140037号第一类医疗器械备案信息表备案号:鲁菏械备20140038号第一类医疗器械备案信息表备案号:鲁菏械备20140039号第一类医疗器械备案信息表备案号:鲁菏械备20150010号第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表备案号:鲁菏械备20170052号第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表备案号:鲁菏械备20180104号。

第一类医疗器械备案凭证
瑞海博医疗科技南通有限公司:
根据相关法规要求,对你单位第一类医疗器械:上肢综合训练器予以备案,备案号:苏通械备20190025号。
南通市行政审批局
(盖章)
日期:2019年9月29日
第一类医疗器械备案信息表
备案号:苏通械备20190025号
第一类医疗器械备案凭证
南通罗伯特医疗科技有限公司:
根据相关法规要求,对你单位第一类医疗器械:下颌骨牵引装置予以备案,备案号:苏通械备20190014号。
南通市行政审批局
(盖章)
日期:2019年9月27日
第一类医疗器械备案信息表
备案号:苏通械备20190014号
第一类医疗器械备案凭证
如皋市恒康医疗器材有限公司:
根据相关法规要求,对你单位第一类医疗器械:引流袋予以备案,备案号:苏通械备20170047号。
南通市行政审批局
(盖章)
日期:2019年10月8日
第一类医疗器械备案信息表
备案号:苏通械备20170047号。
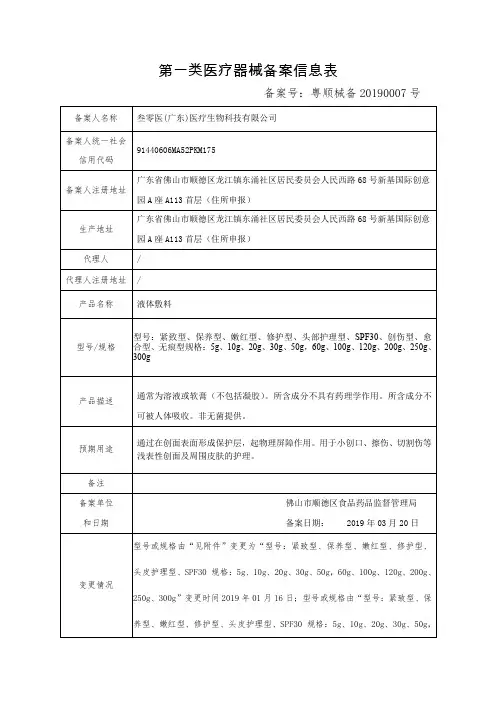
第一类医疗器械备案信息表备案号:粤顺械备20190007号备案人名称叁零医(广东)医疗生物科技有限公司备案人统一社会信用代码91440606MA52PKM175备案人注册地址广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)生产地址广东省佛山市顺德区龙江镇东涌社区居民委员会人民西路68号新基国际创意园A座A113首层(住所申报)代理人/代理人注册地址/产品名称液体敷料型号/规格型号:紧致型、保养型、嫩红型、修护型、头部护理型、SPF30、创伤型、愈合型、无痕型规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g产品描述通常为溶液或软膏(不包括凝胶)。
所含成分不具有药理学作用。
所含成分不可被人体吸收。
非无菌提供。
预期用途通过在创面表面形成保护层,起物理屏障作用。
用于小创口、擦伤、切割伤等浅表性创面及周围皮肤的护理。
备注备案单位和日期佛山市顺德区食品药品监督管理局备案日期: 2019年03月20日变更情况型号或规格由“见附件”变更为“型号:紧致型、保养型、嫩红型、修护型、头皮护理型、SPF30 规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”变更时间2019年01月16日;型号或规格由“型号:紧致型、保养型、嫩红型、修护型、头皮护理型、SPF30 规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”变更为“型号:紧致型、保养型、嫩红型、修护型、头部护理型、SPF30、创伤型、愈合型、无痕型规格:5g、10g、20g、30g、50g,60g、100g、120g、200g、250g、300g”。

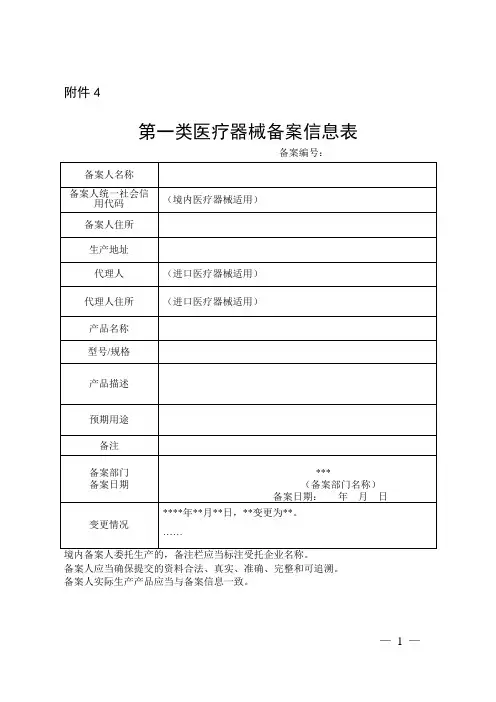

第一类医疗器械备案表产品名称(产品分类名称): 隔离衣备案人: 沈阳XX有限责任公司沈阳市市场监督管理局制填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(E×cel形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明。

备案号:沪械备号第一类医疗器械备案表
产品名称(产品分类名称):
备案人:
以下由备案单位填写
申请类型:第一类医疗器械备案
资料号:沪备案- (例:2014沪浦备案-001)
备案日期:年月日
上海市药品监督管理局制
授权委托书
:
现委托以下人员作为我方(单位名称)行政许可申请一事的代理人,代理我(单位)办理(许可事项):
1、姓名:性别:身份证号码:
工作单位:
职务:电话:
委托权限:
□代为提出、变更、放弃行政许可申请;
□接收询问,行使陈述申辩权利;
□要求和参加听证;
□提交和接收法律文书。
代理期限:□自许可提出申请日起至年月日
□自许可提出申请日起至此次许可决定作出之日止
2、姓名:性别:身份证号码:
工作单位:
职务:电话:
委托权限:
□代为提出、变更、放弃行政许可申请;
□接收询问,行使陈述申辩权利;
□要求和参加听证;
□提交和接收法律文书。
代理期限:□自许可提出申请日起至年月日
□自许可提出申请日起至此次许可决定作出之日止
委托人:
法定代表人:
年月日
第一类医疗器械产品备案资料核对要点(首次备案)
上述1-6项,任意一项标注“×”或“否”则不予备案。
上述7-8项,标注“×”或“否”则表明提交资料不齐全,或不符合规定形式。

潍坊市第一类医疗器械产品备案信息公告(第2020019号)根据《医疗器械监督管理条例》(国务院令第650号)、《关于第一类医疗器械备案有关事项的公告》(国家食品药品监督管理总局公告2014年第26号)等有关要求,对第一类医疗器械产品予以备案。
现将备案信息予以公开(见附件)。
附:第一类医疗器械备案信息表2020年8月14日第一类医疗器械备案凭证山东施恩堂生物科技有限公司:根据相关法规要求,对你单位第一类医疗器械:冷敷凝胶予以备案,备案号:鲁潍械备20200180号(盖章)日期:2020 年08 月07 日第一类医疗器械备案信息表备案号:鲁潍械备20200180号变更情况第一类医疗器械备案凭证潍坊市华星医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:牙龈冲洗器予以备案,备案号:鲁潍械备20200211号(盖章)日期:2020 年08 月07 日第一类医疗器械备案信息表备案号:鲁潍械备20200211号第一类医疗器械备案凭证潍坊祥瑞东升医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:骨锤予以备案,备案号:鲁潍械备20200212号(盖章)日期:2020 年08 月10 日第一类医疗器械备案信息表备案号:鲁潍械备20200212号第一类医疗器械备案凭证潍坊祥瑞东升医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:会阴牵开器予以备案,备案号:鲁潍械备20200213号(盖章)日期:2020 年08 月11 日第一类医疗器械备案信息表备案号:鲁潍械备20200213号第一类医疗器械备案凭证潍坊祥瑞东升医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:骨测量器予以备案,备案号:鲁潍械备20200214号(盖章)日期:2020 年08 月11 日第一类医疗器械备案信息表备案号:鲁潍械备20200214号潍坊祥瑞东升医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:丝锥予以备案,备案号:鲁潍械备20200216号(盖章)日期:2020 年08 月11 日备案号:鲁潍械备20200216号潍坊坤泽尔安全防护用品有限公司:根据相关法规要求,对你单位第一类医疗器械:医用隔离鞋套予以备案,备案号:鲁潍械备20200217号(盖章)日期:2020 年08 月13 日备案号:鲁潍械备20200217号潍坊坤泽尔安全防护用品有限公司:根据相关法规要求,对你单位第一类医疗器械:医用一次性隔离衣予以备案,备案号:鲁潍械备20200041号(盖章)日期:2020 年08 月14 日备案号:鲁潍械备20200041号变更情况变更日期:2020 年08 月14 日。
三明博峰生物科技有限公司:根据相关法规要求,对你单位第一类医疗器械:一次性使用病毒采样管予以备案,备案号:闽明械备20210002号。
三明市市场监督管理局(盖章)日期:2021-01-12备案号:闽明械备20210002号三明市和众生物技术有限公司:根据相关法规要求,对你单位第一类医疗器械:医用冷敷贴予以变更备案,备案号:闽明械备20190005号。
三明市市场监督管理局(盖章)日期:2021-01-12备案号:闽明械备20190005号三明市和众生物技术有限公司:根据相关法规要求,对你单位第一类医疗器械:口腔液体敷料予以变更备案,备案号:闽明械备20190011号。
三明市市场监督管理局(盖章)日期:2021-01-12备案号:闽明械备20190011号三明市和众生物技术有限公司:根据相关法规要求,对你单位第一类医疗器械:鼻腔液体敷料予以变更备案,备案号:闽明械备20190010号。
三明市市场监督管理局(盖章)日期:2021-01-12备案号:闽明械备20190010号三明市和众生物技术有限公司:根据相关法规要求,对你单位第一类医疗器械:冷敷凝胶予以变更备案,备案号:闽明械备20190004号。
三明市市场监督管理局(盖章)日期:2021-01-12备案号:闽明械备20190004号第一类医疗器械备案凭证三明市和众生物技术有限公司:根据相关法规要求,对你单位第一类医疗器械:液体敷料予以变更备案,备案号:闽明械备20190006号。
三明市市场监督管理局(盖章)日期:2021-01-12第一类医疗器械备案信息表备案号:闽明械备20190006号第一类医疗器械备案凭证三明市和众生物技术有限公司:根据相关法规要求,对你单位第一类医疗器械:一次性使用病毒采样管予以变更备案,备案号:闽明械备20210001号。
三明市市场监督管理局(盖章)日期:2021-01-12第一类医疗器械备案信息表备案号:闽明械备20210001号第一类医疗器械备案凭证三明市和众生物技术有限公司:根据相关法规要求,对你单位第一类医疗器械:真菌荧光染色液(一步法)予以备案,备案号:闽明械备20180001号。
第一类医疗器械备案凭证陕西文锐医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:穴位医用冷敷贴予以备案,备案号:陕械备20180001号。
西咸新区市场服务与监督管理局(盖章)日期:2018年05月19日第一类医疗器械备案信息表备案号:陕械备20180001号备案人名称:陕西文锐医疗器械有限公司备案人组织机构代码 :91611104059664557F备案人注册地址 :陕西省西咸新区沣东新城三桥新街236号嘉宝星城国际11403号生产地址:陕西省西咸新区沣东新城三桥新街236号连腾地产办公大楼一楼代理人:/代理人注册地址:/产品名称:穴位医用冷敷贴型号/规格:寒/热腹泻型、肠炎型、寒/热咳嗽、清火型、寒/热感冒型、健胃消食型、晕车型、痔疮型、咽炎型、失眠型;80mm*80mm、70mm*70mm;特殊尺寸根据客户要求产品描述:由无纺布背衬层、凝胶层、聚乙烯薄膜覆盖层等部分组成。
预期用途:用于人体穴位的冷敷理疗。
适用于痔疮、寒/热腹泻、肠炎、寒/热咳嗽、寒/热感冒、积食、晕车、失眠、咽炎等的辅助治疗。
仅用于闭合性软组织。
备注:备案单位和日期:西咸新区市场服务与监督管理局备案日期:2018年05月19日变更情况:第一类医疗器械备案凭证陕西文锐医疗器械有限公司:根据相关法规要求,对你单位第一类医疗器械:胆康医用冷敷贴予以备案,备案号:陕西械备20180002号。
西咸新区市场服务与监督管理局(盖章)日期:2018年05月22日第一类医疗器械备案信息表备案号:陕西械备20180002号备案人名称:陕西文锐医疗器械有限公司备案人组织机构代码 :91611104059664557F备案人注册地址 :陕西省西咸新区沣东新城三桥新街236号嘉宝星城国际11403号生产地址:陕西省西咸新区沣东新城三桥新街236号连腾地产办公大楼一楼代理人:/代理人注册地址:/产品名称:胆康医用冷敷贴型号/规格:胆囊炎型、胆结石型;80mm*80mm、70mm*70mm、特殊尺寸根据客户要求。
江苏省第一类医疗器械生产备案表
填表说明:
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人或投资人、注册资本、成立日期、营业期限等按照营业执照内容填写。
若为合伙企业,法定代表人或投资人栏填写“-”;企业负责人指法人资格企业的法定代表人或其授权的最高管理者;个人独资企业的投资人或授权的经营者;合伙企业指执行事务合伙人。
二、本表生产范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表应使用A4纸双面打印,不得手写。
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□
第一类医疗器械备案信息表
有源□无源体外诊断试剂□第一类医疗器械备案信息表
有源□无源体外诊断试剂□第一类医疗器械备案信息表
备案号:鲁菏械备20190028号
有源□无源体外诊断试剂□。
备案号:鲁潍械备20160001号备案号:鲁潍械备20160002号备案号:鲁潍械备20160003号第一类医疗器械备案信息表第一类医疗器械备案信息表第一类医疗器械备案信息表备案号:鲁潍械备20160006号第一类医疗器械备案信息表备案号:鲁潍械备20160007号附件.器械包所含组件的产品描述和预期用途主要组成:由基础器械6801和矫形外科(骨科)手术器械6810组成,以矫形外科(骨科)手术器械6810为主。
所有组件均为非无菌形式提供。
组件有:骨科钻孔瞄准器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于定位、导向和组织保护。
)、皮肤组织钻孔器(产品描述:通常是直杆状器械,近端有手柄,远端为锥形。
可重复使用。
预期用途:用于皮肤和组织钻孔,以便引流。
)、打孔器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于骨科手术时打孔、钻孔、扩孔。
)、导钻(产品描述:通常由手柄和导套组成,有双头或单头结构。
一般由不锈钢材料制成。
可重复使用。
预期用途:用于钻头或丝锥导向定位。
)、髓腔扩大器(产品描述:具有扩孔切削刃的切削刀具。
通常由不锈钢材料制成。
可重复使用。
预期用途:用于骨科手术中扩孔或铰孔、髓腔再造及扩大。
)、快装手柄(产品描述:骨科创伤手术配套工具。
通常由不锈钢材料制成。
可重复使用。
预期用途:用于骨折手术时,与其它手术器械配用辅助完成内固定器材安装。
)、打拔器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于将植入物或骨植入体内或者从体内取出。
)、打入器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于将植入物植入体内。
)、骨用丝锥(产品描述:通常由刃部和柄部组成,刃部一般由不锈钢材料制成,柄部可由不锈钢、铝材等材料制成。
可重复使用。
预期用途:用于骨科手术时在骨骼上攻螺纹孔。
)、测深器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于骨科手术时测量直径、深度、孔径、角度、弧度等。
)、骨科用螺丝刀(产品描述:由头部和手柄组成,头部通常有薄楔形、六方形、梅花形等形状。
头部一般由不锈钢材料制成。
手柄一般由不锈钢、胶木、聚碳酸酯、钛合金或铝合金等材料制造。
可重复使用。
预期用途:用于骨科手术时旋入或旋出螺钉。
)、锁针加压器(产品描述:骨科创伤手术配套工具。
通常由不锈钢材料制成。
可重复使用。
预期用途:用于骨折端加压与牵引达到理想的对位。
)、螺钉取出器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于将植入物从体内取出。
)、扳手(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于将植入物或骨植入体内或者从体内取出。
)、开路器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于骨科手术时打孔、钻孔、扩孔。
)、拔出器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于将植入物从体内取出。
)、骨探针(产品描述:通常由头部和柄部组成,有直型、弯型和角弯型。
一般由不锈钢材料制成。
可重复使用。
预期用途:用于骨科手术中探测方向和深度。
)、骨定位针(产品描述:通常由头部、针体和尾部组成,可分为螺纹型和光杆型两种型式。
一般由不锈钢材料或钛合金材料制成。
可重复使用。
预期用途:用于在骨折手术过程中牵引、导引或固定。
)、骨撬(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于骨科手术时作敲击、撬拨。
)、骨导引针(产品描述:通常由头部、针体和尾部组成,可分为螺纹型和光杆型两种型式。
一般由不锈钢材料或钛合金材料制成。
可重复使用。
预期用途:用于在骨折手术过程中牵引、导引或固定。
)、螺钉打滑取出器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于将植入物从体内取出。
)、骨锤(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于骨科手术时作敲击、撬拨。
)、骨刀(产品描述:由刀片和手柄组成,远端有坚硬、锋利、单刃配置的切割刀片,手柄位于其近端。
通常由不锈钢材料制成。
可重复使用。
预期用途:主要用于切除、截断骨。
)、骨凿(产品描述:切削器具,由柄部和刀头组成,刀头是斜面锋利刃口。
通常由不锈钢材料制成,或刀片为金属材料、手柄采用合成材料(如特氟龙)。
不用于脊柱。
可重复使用。
预期用途:用于骨科手术时修整骨骼、取骨和凿骨。
)、骨锯(产品描述:手持式手动外科器械,通常由带有附属手柄的金属架组成,附属手柄可以牢固的连接锯片,集成锯片也可设计成直线型或弧型切割刃口。
通常由不锈钢材料制成。
可重复使用。
预期用途:用于截锯骨骼。
)、骨钻(产品描述:通常由头部和手柄组成,远端头部有锥形尖端,近端有T形手柄。
头部一般由不锈钢材料制成,手柄一般由不锈钢、钛或合成材料(如特氟龙)制成。
可重复使用。
(不与有源器械联用)预期用途:用于钻孔、攻螺纹。
)、手枪式手摇骨钻(产品描述:通常由摇柄、主轴、传动体(齿轮等)、把手、钻夹头等部件组成;有普通摇钻和深部摇钻之分,前者多用于浅表骨的钻孔或穿针,后者适用于深部骨质的钻孔。
可重复使用。
预期用途:用于骨科手术时钻孔或将骨牵引针等钻入人体。
)、咬骨钳(产品描述:由钳柄、钳头、弹簧片和鳃轴螺钉组成,型式可有单关节、双关节、颅骨。
其中单关节咬骨钳钳头可分为直型和角(前)弯型,双关节咬骨钳钳头有直型、角(前)弯型和棘突型。
头部通常采用不锈钢材料制成。
可重复使用。
预期用途:用于咬除死骨或软组织息肉或修整骨残端。
)、持骨钳(产品描述:通常由钳柄、钳头、鳃轴螺钉构成,钳头内表面多设有齿,钳柄之间可设置锁合装置。
一般由不锈钢材料制成。
可重复使用。
预期用途:用于骨科手术中夹持并固定骨骼、植入物,或夹持器械。
)、骨科复位钳(产品描述:通常由钳柄、钳头、鳃轴螺钉构成,钳头内表面多设有齿,钳柄之间可设置锁合装置。
一般由不锈钢材料制成。
可重复使用。
预期用途:用于骨科手术中夹持并固定骨骼、植入物,或夹持器械。
)、持钉钳(产品描述:通常由钳柄、钳头、鳃轴螺钉构成,钳头内表面多设有齿,钳柄之间可设置锁合装置。
一般由不锈钢材料制成。
可重复使用。
预期用途:用于骨科手术中夹持并固定骨骼、植入物,或夹持器械。
)、钢丝钳(产品描述:由手柄和钳口通过单或双连接轴连接组成,具有直型或弯曲手柄,有各种尺寸。
通常由不锈钢材料或硬质合金制造。
可重复使用。
预期用途:用于骨科手术时剪断、弯曲、结扎。
)、骨钩(产品描述:由钩、手柄组成,钩的头部通常由不锈钢材料制成。
可重复使用。
预期用途:用于矫形外科手术时提拉骨骼。
)、骨膜剥离器(产品描述:通常由头部和柄部组成,柄的顶端为椭圆形或弧形的片状板,其刃有锐性和钝性之分。
一般由不锈钢材料制成。
可重复使用。
预期用途:用于剥离附着于骨面上的骨膜及软组织。
)、弯棒器(产品描述:骨科创伤手术配套工具。
通常由不锈钢材料制成。
可重复使用。
预期用途:用于骨科手术时弯棒。
)、电动石膏锯(产品描述:由电动主机、传动轴、传动钳、锯片、电源插头等组成。
预期用途:用于骨科手术固定复位后,切割拆除石膏绷带。
)、起子(产品描述骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于将植入物或骨植入体内或者从体内取出。
)、微创牵开器(产品描述:手动操作、自锁式手术器械。
通常由不锈钢材料制成。
可重复使用。
预期用途:用于显露手术视野,牵开错位组织,使手术易于进行,并保护组织,避免意外损伤。
)、持针镊(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于骨科手术时夹持骨针或螺钉。
)、骨拉钩(产品描述:手动操作的手术器械,包含有自锁式结构,有各种形式(如钝型、锐型、开窗型、深型)的钩状刀片。
通常由不锈钢材料制成。
可重复使用。
预期用途:用于显露手术视野,使手术易于进行,并保护组织,避免意外损伤。
)、手术剪(产品描述:由一对中间连接的叶片组成,头部有刃口,尾部为指圈。
可重复使用。
预期用途:用于剪切人体组织、皮肤。
)、骨科吸引器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于骨科手术时,吸引切口处的血液。
)、断钉取出器(产品描述:骨科手术配套基础工具,通常由不锈钢材料、钛合金或高分子材料制成。
可重复使用。
预期用途:用于将植入物从体内取出。
)。
根据规格型号进行包装组合。
第一类医疗器械备案信息表备案号:鲁潍械备20160008号第一类医疗器械备案信息表备案号:鲁潍械备20160009号第一类医疗器械备案信息表备案号:鲁潍械备20160010号。