NH3的电离平衡常数kb的测定
- 格式:doc
- 大小:73.00 KB
- 文档页数:3

吉林市普通高中2024-2025学年度高二年级上学期期中调研测试化学试题说明:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,贴好条形码。
2.答选择题时,选出每小题答案后,用2B 铅笔把答题卡对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
答非选择题时,用0.5毫米的黑色签字笔将答案写在答题卡上。
字体工整,笔迹清楚。
3.请按题号顺序在答题卡相应区域作答,超出区域所写答案无效;在试卷上、草纸上答题无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:Cl 35.5 Fe 56一、选择题:本题共15小题,每小题3分,共45分。
在每小题给出的四个选项中,只有一项符合题目要求。
1.下列溶液呈中性的是( )A. B. C. D.2.下列过程中,化学反应速率的增大对人类有益的是( )A.金属的腐蚀 B.食物的腐败 C.塑料的老化 D.氨的合成3.水凝结成冰的过程中,其焓变和熵变正确的是( )A.,B.,C.,D.,4.在氨水中存在电离平衡:。
下列情况能使电离平衡向左移动的是( )A.加水B.通HClC.加固体D.加5.下列操作可以使水的离子积常数增大的是( )A.通入少量氨气B.加入少量稀HClC.加热D.加入少量醋酸钠固体6.下列式子能正确表示盐类的水解过程的是( )A. B.C. D.7.研究、等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。
在一定条件下,将与以体积比置于密闭容器中发生的反应。
下列状态能说明反应达到平衡状态的是( )A.和NO 的体积比保持不变 B.混合气体的颜色保持不变C.每生成1mol 消耗1mol D.体系压强保持不变4NH Cl24Na SO 3CH COONa4NaHSO H 0∆>S 0∆<H 0∆<S 0∆>H 0∆>S 0∆>H 0∆<S 0∆<324NH H O NH OH +-⋅+ 4NH Cl 3CH COOHW K 222S 2H O H S 2OH --++ 323Al 3H O Al(OH)H ++++ 233HSO SO H --++ 3223HCO H O H CO OH --++ 2NO 2SO 2NO 2SO 1:2223NO (g)SO (g)SO (g)NO(g)++ 3SO 3SO 2NO8.下列措施对增大化学反应速率有明显效果的是( )A.溶液与溶液反应时,增大压强B.Al 与稀硫酸反应制取时,改用浓硫酸C.Na 与水反应时,增加水的用量D.大理石与盐酸反应制取时,将块状大理石改为粉末状大理石9.难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是( )A.沉淀的速率和溶解的速率相等B.难溶电解质在水中形成饱和溶液C.难溶电解质溶解形成的阴、阳离子的浓度一定相等D.再加入该难溶电解质,溶液中各离子的浓度不变10.下列说法中正确的是( )A.在100℃时,pH 约为6的纯水呈中性B.将的盐酸和醋酸各1mL 分别稀释至100mL ,所得醋酸的pH 略大C.将1mL 盐酸稀释至1000mL ,所得溶液的pH 为9D.强电解质溶液的导电能力一定比弱电解质溶液的强11.在容积不变的密闭容器中,一定量的与发生反应:。

氨水的电离平衡常数计算公式氨水是一种具有较强碱性的溶液,常用于农业领域。
它可以改变土壤的PH值,增加植物的养分吸收,刺激其根系发育,帮助植物复苏和预防病害等。
除此之外,氨水还有分析检测中的应用,即电离平衡常数测定法。
电离平衡常数是反映物质溶液理论中电离程度和各离子浓度之间关系的数值。
当一种物质被溶于水中时,水离子交换有限,其离子一部分会被弱酸或弱碱的影响而电离,此时该溶液的离子强度是不定的,并受电离平衡常数的影响。
氨水的电离平衡常数主要是NH3-H2O联合电离常数(Kb1)的计算,Kb1的计算公式为:Kb1= [NH4+][OH-]/[NH3]其中,[NH4+]为NH4+离子浓度,[OH-]为OH-离子浓度,[NH3]为氨气的浓度。
所以,要计算氨水的电离平衡常数,必须先测定其中NH4+, OH-和NH3的浓度。
一般来说,NH4+和OH-的浓度都是比较低的,要测量它们的浓度,只能采用特殊仪器。
另外,NH3是一种气态物质,要测量NH3浓度,可采用气相色谱分析仪检测。
由于上述检测所需的仪器较为复杂,故在实际应用中,一般都采用氨水的固定电离常数,即根据氨水的浓度来计算氨水的电离常数定值,公式如下:Kb1 = (0.0002×NH3) (25÷t)其中,Kb1为氨水的电离平衡常数;NH3为氨水中氨气的浓度,单位为mol/L;t为温度,单位为℃。
电离平衡常数计算公式的应用对工业领域尤为重要,对于石油、石化、农业等行业的洗涤、抗菌、测定电位等操作,都需要电离常数的测定。
此外,氨水也常用于自来水净化、垃圾处理和污水处理等,电离平衡常数的测定尤为重要,不仅可以保证工业生产的质量,还可以避免因电离平衡不好而导致的质量影响。
总之,氨水的电离平衡常数计算公式在工业领域具有重要作用,必须正确计算氨水的电离平衡常数,以保障其各项应用的质量和安全性。


几种平衡常数的计算1.一定条件下,将NO 2与SO2以体积比1:2置于密闭容器中发生NO2(g)+SO2(g)SO3(g)+NO(g),测得平衡时NO2与SO2体积比为1:6,则平衡常数K=。
2.已知在800K时,反应:CO(g)+H2O(g)CO2(g)+H2(g),若起始浓度c(CO)=2mol/L,c(H2O)=3mol/L,反应达到平衡时,CO转化成CO2的转化率为60%。
若将H2O的起始浓度加大为6mol/L,试求CO转化为CO2的转化率3.现有反应:CO(气)+H2O(气)CO2(气)+H2(气)放热反应;在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K__ ___l (填“大于”、“小于”、或“等于”)(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2和xmolH2,则:当x=5.0时,上述反应向___________________(填“正反应”或“逆反应”)方向进行。
若要使上述反应开始时向正反应方向进行,则x应满足的条件是________ 4.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)NH3(g)+HI(g) ②2HI(g)H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=3 mol·L-1,,则此温度下反应①的平衡常数为5.(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10 L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:在800℃时该反应的化学平衡常数K=(要求写出表达式及数值),6.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数,将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。

化学平衡常数的测定方法化学平衡常数(Kc)是描述在一定温度下,化学反应达到平衡时各生成物和反应物浓度比的一个数值。
化学平衡常数的测定方法有以下几种:1.实验测定法:通过实验测量反应物和生成物的浓度,然后根据化学平衡常数的表达式计算Kc值。
实验测定法包括等温滴定法、pH计法、电位滴定法等。
2.理论计算法:根据反应物和生成物的化学式和相对分子质量,以及反应的化学方程式,计算各物质的浓度,然后根据化学平衡常数的表达式计算Kc值。
3.平衡态法:在封闭系统中进行反应,通过改变温度、压力等条件,使反应达到平衡状态,然后根据实验数据计算Kc值。
4.光电滴定法:利用光电传感器检测反应物和生成物的浓度变化,通过数据处理计算Kc值。
5.温度梯度法:在不同温度下进行实验,测量各温度下的Kc值,然后根据温度对Kc值的影响关系,推算出在实际温度下的Kc值。
6.激光光谱法:利用激光光源和光谱仪,测量反应物和生成物的浓度,计算Kc值。
7.分子动力学模拟法:通过计算机模拟反应物和生成物的分子运动,计算平衡时的浓度比,从而得到Kc值。
8.线性代数法:根据反应物和生成物的化学式和相对分子质量,构建浓度矩阵,通过线性代数方法计算Kc值。
在实际操作中,可以根据具体反应和实验条件选择合适的测定方法。
需要注意的是,化学平衡常数Kc随着温度的变化而变化,因此在测定过程中应保持温度稳定。
此外,测定Kc值时还要注意避免实验误差,确保数据的准确性。
习题及方法:已知反应:N2(g) + 3H2(g) ⇌ 2NH3(g)在一定温度下,测得氮气、氢气和氨气的浓度分别为0.5 mol/L、1.5 mol/L和0.2 mol/L。
求该温度下反应的平衡常数Kc。
根据化学平衡常数的定义,Kc = [NH3]^2 / ([N2] * [H2]^3)。
将已知浓度代入公式计算Kc值。
某温度下,反应:2HI(g) ⇌ H2(g) + I2(g) 的平衡常数Kc为2。
若在该温度下,将HI的浓度从0.4 mol/L减半到0.2 mol/L,求新平衡时H2和I2的浓度。

不同温度氨水解离常数
氨水(NH3)是一种弱碱,它在水中发生部分解离产生氢氧根离
子(OH-)和氨离子(NH4+)。
氨水的解离常数(Kb)是衡量其解离
程度的指标,它表示氨水解离产生氨离子和氢氧根离子的平衡浓度。
氨水的解离常数与温度有关,随着温度的升高,解离常数通常
会增大。
这是因为温度升高会增加反应速率,使得更多的氨水分子
发生解离。
然而,具体的不同温度下氨水的解离常数数值需要通过实验测
定得出。
下面是一些常见温度下氨水的解离常数的参考数值:
1. 25°C下的氨水解离常数(Kb)约为1.8 x 10^-5。
需要注意的是,这只是一个大致的数值,实际数值可能会因实
验条件、氨水浓度等因素而有所不同。
此外,还可以通过酸碱反应的平衡常数(Ka和Kw)来计算氨水
的解离常数。
氨水的解离产生氨离子和氢氧根离子的反应可以看作
是氨离子与水分子之间的酸碱反应。
根据酸碱反应的平衡常数关系,
可以得到氨水解离常数与水的离子积(Kw)和氨离子的酸解离常数(Ka)之间的关系。
综上所述,氨水的解离常数与温度有关,一般随着温度的升高
而增大。
具体的不同温度下氨水的解离常数需要通过实验测定得出。

一、选择题1.硫酸是当今世界上最重要的化工产品之一,广泛应用于工业各个方面。
硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。
接触室中发生如下反应:2SO2 + O2催化剂Δ2SO3。
该反应是氧化还原反应,下列说法正确的是A.SO2是氧化剂B.O2发生氧化反应C.O2失去电子D.SO3既是氧化产物又是还原产物2.磷元素的最高价为+5价,次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关次磷酸及其盐的说法正确的是A.次磷酸的电离方程式为H3PO2=H++-22H POB.NaH2PO2是次磷酸的酸式盐C.利用(H3PO2)进行化学制银反应中,1个H3PO2分子最多还原4个Ag+离子D.白磷与氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为P4+9NaOH=3Na3PO2+PH3↑+3H2O3.室温下,下列各组离子在指定溶液中一定能大量共存的是A.0.1mol·L−1FeCl3溶液中:Na+、I−、NO-3、K+B.透明溶液中:Cu2+、NH4 、NO-3、SO2-4C.使紫色石蕊变红的溶液中:Ba2+、K+、CH3COO−、Cl–D.0.1mol·L−1NaOH溶液中:Mg2+、Na+、SO2-4、HCO-34.已知:①2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O②6FeCl2+3Br2=4FeCl3+2FeBr3③Cl2+2KBr=Br2+2KCl。
根据上述反应,判断下列结论错误的是A.溶液中可发生反应:2FeCl2+Cl2=2FeCl3B.少量KMnO4溶液加入HBr和HCl的混合溶液中:HBr先被氧化C.氧化性强弱顺序为:KMnO4>Cl2>FeCl3>Br2D.反应①中,MnCl2是KMnO4的还原产物5.下列物质的分类正确的一组是6.常温下,在溶液中可发生以下反应:①2KBr+Cl 2=2KCl+Br 2;②2KI+Cl 2=2KCl+I 2;③2KI+Br 2=2KBr+I 2由此判断下列说法正确的是()A .溴元素在①和③中均被氧化B .氧化性强弱顺序为:I 2>Br 2>Cl 2C .还原性强弱顺序为:KI >KBr >KClD .常温下也能进行如下反应:2KCl+Br 2=2KBr+Cl 2 7.能正确表示下列反应的离子方程式是A .高锰酸钾溶液中滴入双氧水:24MnO -+3H 2O 2+6H +=2Mn 2++4O 2↑+6H 2O B .电解MgCl 2水溶液:2Cl -+2H 2O电解2OH -+Cl 2↑+H 2↑C .溴乙烷与NaOH 水溶液共热:CH 3CH 2Br+OH -加热−−−−−→Br -+CH 3CH 2OH D .二氧化碳气体通入过量氨水:CO 2+NH 3·H 2O=43NH HCO +-+ 8.取某固体样品,进行如下实验:(1)取一定量的样品,加足量的水充分溶解,形成无色溶液; (2)取少量溶液,加入BaCl 2溶液,过滤得到滤液和滤渣; (3)取少量滤液,加AgNO 3和HNO 3溶液。

专题突破练十水溶液中的离子平衡(A)一、选择题1.(2021天津模拟)对于0.1 mol·L-1 Na2CO3溶液,下列说法正确的是()A.加入NaOH固体,溶液pH减小B.升高温度,溶液中c(OH-)增大C.稀释溶液,溶液中c(H+)减少D.c(Na+)+c(H+)=c(HC)+c(C)+c(OH-)2.(2021山东枣庄第三次质检)已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关三种酸的电离平衡常数(25 ℃),若已知下列反应可以发生:NaCN+HNO2HCN+NaNO2、NaCN+HF HCN+NaF、NaNO2+HF HNO2+NaF。
由此可判断下列叙述不正确的是()A.K(HF)=7.2×10-4B.K(HNO2)=4.6×10-4C.根据两个反应即可得出一元弱酸的强弱顺序:HF>HCN>HNO2D.K(HCN)<K(HNO2)<K(HF)3.(2021北京海淀模拟)为研究沉淀的生成及转化,同学们进行下图所示实验。
下列关于该实验的分析不正确的是()A.①中产生白色沉淀的原因是c(Ag+)·c(SCN-)>K sp(AgSCN)B.①中存在平衡:AgSCN(s)Ag+(aq)+SCN-(aq)C.②中无明显变化是因为溶液中的c(SCN-)过低D.上述实验不能证明AgSCN向AgI沉淀转化反应的发生4.(2021广东“六校联盟”第三次联考)室温时,下列有关电解质溶液的说法正确的是()A.pH相等的HNO3和HCN两种酸溶液中,c(N)>c(CN-)B.NaHB溶液呈酸性,可推知H2B在水中不能完全电离C.往NH4Cl溶液中加入镁粉,可生成两种气体D.Na2CO3溶液中通入CO2所得的中性溶液中:c(Na+)=2c(C)5.(2021湖北七市州教科协3月联考)下列关于电解质溶液的说法中错误的是()A.等浓度、等体积的HCOOH溶液与HCOONa溶液混合后pH<7:c(HCOO-)>c(Na+)>c(H+)>c(OH-)B.新制氯水中:c(ClO-)+c(HClO)=c(Cl-)C.已知K a(HF)>(H2S),则同浓度的NaHS和NaF溶液的pH:NaHS>NaFD.Na2CO3与NaHCO3的混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HC)+c(C)6.(双选)(2021山东烟台模拟)已知AG=lg 。

氨水电离平衡常数K b 的测定【实验目的】1. 掌握PH 计法测定NH 3的电离平衡常数2. 学习使用PH 计测定溶液的PH 值3. 巩固滴定管、移液管、容量瓶及分析天平的使用【实验原理】1. 氨水是一种弱碱,NH 3在水中存在以下电离平衡NH 3+H 2O=NH 4++OH -K b 代表电离平衡常数,C 为氨水的初始浓度,[NH 4+] [NH 3] [OH -]分别为其电离平衡浓度一定温度下则有电离平衡常数K b如果测出氨水的浓度和该溶液的PH 值就可以根据上述公式计算出K b ,C 可用HCl 标准溶液滴定测得,由于滴定突跃发生在酸性范围内,所以用甲基橙做指示剂,滴定终点由黄色变为橙红色。
2.[OH -]可由PH 值间接测出2. HCL 溶液的标定:由于盐酸易挥发出HCl 气体,所以不能有直接法配置,只能先配置近似浓度的溶液,再用适当的一级标准物Na 2CO 3标定之。
盐酸加入 Na 2CO 3溶液中:Na2CO3+2HCl ═2NaCl+H2O+CO2↑选用甲基橙做为指示剂,到滴定终点时,溶液由黄色变为橙红色 C (HCl )=)()32(5)32(2Hcl V CO Na M CO Na m x1000(mol/l )【仪器与试剂】仪器:PHS-2C 酸度计、滴定台、酸式滴定管(250ml )、锥形瓶(250mlX6)、 烧杯(100mlX4)、移液管(10ml 、20ml )、胶头滴管、玻璃棒、容量瓶 (100mlX2、50mlX2)、分析天平。
试剂:1mol/L 氨水、0.1mol/LHCl 溶液、甲基橙、蒸馏水、分析纯无水Na 2CO 3【实验步骤】1. 0.1mol/LHCl 溶液的标定(1).配置Na 2CO 3标准溶液,用分析天平称取0.4~0.6g (精确至+0.0001g )分析纯无水Na 2CO 3,溶解稀释,转移至100ml 容量瓶中定容备用。
(2).取20ml 洁净的移液管,用少量碳酸钠溶液0.1mol/LHCl 溶液,然后取20.00ml碳酸钠溶液于锥形瓶中,再加入2滴甲基橙做指示剂,摇匀,临近滴定终点时用蒸馏水将锥形瓶内壁冲洗一下。
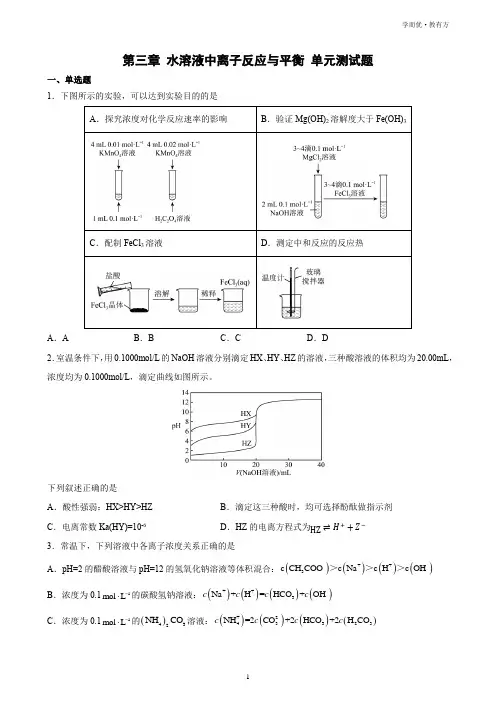
第三章 水溶液中离子反应与平衡 单元测试题一、单选题1.下图所示的实验,可以达到实验目的的是A .AB .BC .CD .D2.室温条件下,用0.1000mol/L 的NaOH 溶液分别滴定HX 、HY 、HZ 的溶液,三种酸溶液的体积均为20.00mL ,浓度均为0.1000mol/L ,滴定曲线如图所示。
下列叙述正确的是A .酸性强弱:HX>HY>HZB .滴定这三种酸时,均可选择酚酞做指示剂C .电离常数Ka(HY)=10-6D .HZ 的电离方程式为HZ ⇌H ++Z −3.常温下,下列溶液中各离子浓度关系正确的是A .pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合:()()()()-++-3c CH COO c Na c H c OH >>>B .浓度为0.11mol L -⋅的碳酸氢钠溶液:()()()()++--3Na+H =HCO +OH c c c cC .浓度为0.11mol L -⋅的()432NH CO 溶液:()()()()+2--43323NH =2CO +2HCO +2H CO c c c cD .浓度均为0.11mol L -⋅的醋酸溶液与NaOH 溶液混合后:()()()-+3c OH =c H +c CH COOH4.工业上以2SO 和纯碱为原料制备无水3NaHSO 的主要流程如图,已知:23H CO 的电离平衡常数分别为-7-11a1a2K =4.510K =4.710⨯⨯、,23H SO 的电离平衡常数分别为-a12-8a2K =1.410K =6.010⨯⨯、。
下列说法不.正确的是A .吸收后的溶液中:()()-2-33c HSO >c SOB .中和后溶液中主要溶质为3NaHSO 和3NaHCOC .纯碱溶液中:()()()()-+-323c OH =c H +c HCO +2c H COD .气流干燥湿料时温度不宜过高5.硫元素的很多化合物用途广泛。

一、选择题1.在下列溶液中,各组离子一定能够大量共存的是 A .加铝粉有氢气生成的溶液:K +、Na +、Cl -、HCO -3 B .使石蕊试液变红的溶液中:K +、SO 2-4、Cl -、Mg 2+ C .滴加KSCN 溶液显红色的溶液:Na +、Cl -、SO 2-4、OH - D .在某无色透明的溶液中:NH +4、K +、Cu 2 +、Cl - 2.下列说法正确的是A .在氧化还原反应中,氧化剂经化学变化变成还原剂B .在氧化还原反应中,氧化剂被氧化,还原剂被还原C .在氧化还原反应中,一定有电子的转移D .在化学反应中,还原剂能把其他物质氧化3.水热法制备Fe 3O 4纳米颗粒的总反应为:3Fe 2++2223S O -+O 2+xOH -=Fe 3O 4+246S O -+2H 2O ,下列说法正确的是 A .x=2B .Fe 2+、223S O -都是还原剂 C .硫元素被氧化,铁元素被还原D .每生成1molFe 3O 4则转移电子的物质的量为3mol 4.下列电子转移表示正确的是A .B .C .D .5.下列说法正确的是:A .铜、石墨均能导电,所以它们均是电解质B .NH 3、CO 2的水溶液均能导电,所以NH 3、CO 2均是电解质C .液态HCl 、固体NaCl 均不能导电,所以HCl 、NaCl 均是非电解质D .蔗糖、酒精在水溶液或熔融状态下均不能导电,所以它们均是非电解质6.反应物之间的用量不同,往往导致离子反应的书写也不相同,下列离子方程式能正确表示反应的是A .NaOH 溶液中通入过量CO 2:CO 2+2OH −=2-3CO +H 2O B .向碳酸钠溶液中通入少量CO 2:2-3CO +CO 2+H 2O =2-3HCOCO+2H+=H2O+CO2↑C.Na2CO3溶液中逐滴滴加少量盐酸:2-3SO+Ba2++2OH−=BaSO4↓+2H2O D.向Ba(OH)2溶液中滴加少量NaHSO4溶液:2H++ 2-47.下列关于NaCl的电离过程叙述正确的是A.在电流作用下电离出阴、阳离子B.不一定需要水C.在水分子作用下电离出钠离子和氯离子D.氯化钠溶液能导电,所以氯化钠溶液是电解质8.下列反应的离子反应方程式正确的是()A.Na与CuSO4溶液的反应:2Na+Cu2+=Cu+2Na+B.CuSO4溶液与Ba(OH)2溶液反应:Cu2++2OH-=Cu(OH)2↓C.NaHCO3溶液与NaOH溶液混合:HCO3-+OH-=H2O+CO23-D.Ca(ClO)2溶液中通入少量CO2:Ca(ClO)2+CO2+H2O=CaCO3↓+2H++2ClO-9.某固体混合物W可能含有NH4Cl、Na2SiO3、Na2SO3、CuSO4、AlCl3、FeCl3、MgSO4中的一种或多种,现进行如下实验:①往W中加足量浓NaOH溶液,得到白色沉淀A和溶液B,并有刺激性气昧的气体生成;②往溶液B加入一定量的稀硝酸,得到气体C、溶液D与沉淀E。
课时跟踪练22 氮及其氧化物 氨和铵盐[基础巩固]1.(2024·茂名质检)下列含氮物质的性质与用途具有对应关系的是( )A .NH 3具有还原性,可用作制冷剂B .N 2具有氧化性,可用作工业合成氨C .NH 3具有碱性,可用于制备硝酸铵D .NH 4Cl 易溶于水,可用作化肥解析:选B 。
A.NH 3的沸点低,易液化,液氨汽化时吸取大量的热,使四周环境温度降低,故可用作制冷剂,A 错误;B.N 2具有氧化性,与H 2发生反应生成NH 3,B 正确;C.NH 3 和水反应生成的一水合氨具有碱性,可用于制备硝酸铵,NH 3本身不具有碱性,C 错误;D.NH 4Cl 含有植物生长所需的氮元素,可用作化肥,D 错误。
2.(2024·广州第65中学开学考试)下列关于氨的试验装置正确的是( )A .装置甲用于试验室制取氨B .装置乙用于制备NaHCO 3C .装置丙用于干燥氨D .装置丁用于氨的尾气处理答案:D3.下列反应的离子方程式书写正确的是( )A .试验室用氯化铵和熟石灰制氨:NH +4 +OH -=====△ NH 3↑+H 2OB .NaOH 溶液与NH 4Cl 溶液混合加热:NH +4 +OH -=====△ NH 3·H 2OC .氨水中加入盐酸:NH 3·H 2O +H +===NH +4 +H 2OD .氨水中加入氯化铁溶液:Fe 2++2NH 3·H 2O===2NH +4 +Fe(OH)2↓解析:选C 。
A 项,该反应属于固固加热反应,不是离子反应;B 项,加热条件下NH 3·H 2O 分解为NH 3和H 2O ,离子方程式为NH +4 +OH -=====△ NH 3↑+H 2O ;D 项,氨水中加入FeCl 3溶液应生成Fe(OH)3 沉淀,离子方程式为Fe 3++3NH 3·H 2O===Fe(OH)3↓+3NH +4 。
广州市真光中学2022学年第一学期期中考试高二化学试卷命题人:周健审题人:周斯筠满分:100分考试时间:75分钟I441~10211~164441.下列设备工作时,将化学能转化为热能的是A.锂离子电池B.煤气灶C.太阳能光伏D.电暖风扇2.下列措施不是为了改变化学反应速率的是A.加工馒头时添加膨松剂B.将食物存放在冰箱中C.糕点包装袋内放置除氧剂D.冶铁时将铁矿石粉碎3.下列有关说法中,正确的是A.C(石墨,s)C(金刚石,s)ΔH>0,说明石墨比金刚石稳定B.月饼盒内放置还原性铁粉和发馒头加酵母粉都是为了加快反应速率C.大力开发太阳能、风能、电能等一次能源有利于实现“碳中和”D.化学反应速率理论可指导怎样提高原料的转化率和生成物的产率4.下图是某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。
下列说法正确的是A.该反应为吸热反应B.a与b相比,a的反应速率更快C.a与b相比,反应的平衡常数一定不同D.反应物断键吸收的总能量小于生成物成键释放的总能量5.设NA为阿伏加德罗常数的值,下列叙述正确的是A.1L0.1mol/L氨水中,NH4+的数量为0.1N AB .1mol Na 与足量O 2反应生成Na 2O 和Na 2O 2,转移的电子数为N AC .密闭容器中,1mol N 2和3mol H 2充分反应后分子总数为2N A D.25℃时,0.1mol/L 的H 2SO 4溶液中,含有的H +数目为0.2N A6.已知0.1mol/L 的醋酸溶液中存在电离平衡:CH3COOH CH 3COO -+H +,要使溶液中c(H +)/c(CH 3COOH)值增大,可以采取的措施是A.加少量烧碱固体B.降低温度C.加少量冰醋酸D.加水7.下列电离方程式中正确的是A .NaHSO4溶于水:NaHSO 4Na ++H ++SO 24-B .次氯酸电离:HClO ═ClO -+H +C .HF 溶于水:HF+H2O H 3O ++F -D .NH4Cl 溶于水:NH 4++H 2ONH 3•H 2O+H +8.下列叙述中,能用勒夏特列原理解释的是A .合成氨工业中,选择500℃有利于氨的合成B .用饱和食盐水吸收氯气中的HClC .由H 2、I 2、HI 三种气体组成的平衡体系加压后颜色变深D .向双氧水中加入二氧化锰有利于氧气生成9.一定条件下,CH 4与H 2O(g)发生反应:CH 4(g)+H 2O(g)⇌CO(g)+3H 2(g)。
NH 3的电离平衡常数k b 的测定 【实验目的】1、掌握PH 计法测定NH 3的电离平衡常数; 2、学习使用PH 计测定溶液的PH 值;3、巩固滴定管、移液管、容量瓶及分析天平的规范操作. 【实验原理】1、氨水是一种弱碱,NH 3在水中存在以下电离平衡 NH 3+H 2O →NH 4++OH -k b 代表其电离平衡常数,C 为氨水的初始浓度。
[NH 4+][ OH -] [NH 3]分别为其电离平衡浓度。
一定温度下,则有:k b =4[NH +][ OH-][NH3]≈[OH -]2/C(当解离度α<5%时C α可忽略)如果测出氨水的浓度和该溶液的PH 值便可以根据上述公式求出k b ,C 可用HCl 标准溶液滴定测得,由于滴定突跃发生在酸性范围内,所以用甲基橙作为指示剂,滴定终点时由黄色变为橙红色。
2、[OH -]可以用PH 计间接测出3、HCl 溶液的标定:由于盐酸溶液易挥发出HCl 气体,所以不能由直接法配置,只能先配置成近似浓度的溶液,再用适当的一级标准物质Na 2CO 3标定之。
盐酸加入Na 2CO 3溶液中:Na 2CO 3+2HCl=2NaCl+CO 2+H 2O选用甲基橙作为指示剂,到滴定终点时,溶液由黄色变为橙红色. C (HCl )=23232m(Na CO )10005(a )(l)M N CO V HC ⨯ (mol/L)【仪器与试剂】仪器:PHS-2C 酸度计、滴定台、酸式滴定管(25ml)、锥形瓶(250m l ×6)、烧杯(100ml ×4)、移液管(10ml 、20ml )、胶头滴管、玻璃棒、容量瓶(100m l ×2、50ml ×2)、分析天平试剂:1mol/L 氨水、0.1mol/L -1HCl 溶液、甲基橙、蒸馏水、分析纯无水Na 2CO 3【实验步骤】1、0.1mol/LHCl 酸溶液的标定:①配置Na 2CO 3标准溶液,用分析天平称取0.4~0.6g (精确至±0.0001g )分析纯无水Na 2CO 3,溶解稀释,转移至100ml 容量瓶中定容备用.②取20ml 洁净的移液管,用少量碳酸钠溶液润洗2~3次,然后移取20.00碳酸钠溶液于锥形瓶中,再加入2滴甲基橙作为指示剂,摇匀,临近滴定终点时用蒸馏水将锥形瓶的内壁冲洗一下。
2012级本科药学专业无机化学课程实验设计氨水的电离平衡常数kb的测定2012级本科药学专业17班3、4组姓名学号黄宗坪 201240127李格辉 201240139黄群夏201240136李月娥 201240132张晓艳 201240134氨水的电离平衡常数kb的测定【实验目的】1、掌握PH 计法测定NH 3的电离平衡常数; 2、学习使用P H 计测定溶液的PH 值; 3、巩固滴定管、移液管、容量瓶及分析天平的规范操作.【实验原理】1、氨水是一种弱碱,NH3在水中存在以下电离平衡 NH 3+H 2O→NH 4++OH -一定温度下,则有:k b =4[NH +][ OH-][NH3]kb 代表其电离平衡常数,C 为氨水的初始浓度。
[NH 4+]、[ OH -] 、[NH 3]分别为NH 4+、OH -、NH3电离平衡浓度。
在纯的NH 3溶液中,[NH 4+]=[ OH -]=C α [NH 3]=c(1-α)则α=[ OH -]/C, k b =4[NH +][ OH-][NH3]≈[OH -]2/C当解离度α<5%时C α可忽略如果测出氨水的浓度和该溶液的P H 值便可以根据上述公式求出kb ,C 可用HC l 标准溶液滴定测得,由于滴定突跃发生在酸性范围内,所以用甲基橙作为指示剂,滴定终点时由黄色变为橙红色。
2、[OH -]可以用PH 计间接测出3、HCl 溶液的标定:由于盐酸溶液易挥发出H Cl 气体,所以不能由直接法配置,只能先配置成近似浓度的溶液,再用适当的一级标准物质Na2C O 3标定之。
盐酸加入N a 2CO3溶液中: Na2CO 3+2HCl=2NaCl +CO 2+H 2O选用甲基橙作为指示剂,到滴定终点时,溶液由黄色变为橙红色. C (HCl )=23232m(Na CO )10005(a )(l)M N CO V HC (mol/L)【仪器与试剂】仪器:PHS-2C 酸度计、滴定台、酸式滴定管(25ml)、锥形瓶(250ml )、烧杯(100ml )、移液管(10ml 、20ml )、胶头滴管、玻璃棒、容量瓶(100ml 、50ml )、分析天平试剂:1mol/L 氨水、0.1mol/L -1HCl 溶液、甲基橙、蒸馏水、分析纯无水N a2CO 3【实验步骤】1、0.1mol/LHCl 酸溶液的标定: ①配置Na2C O3标准溶液,用分析天平称取0.4~0.6g (精确至±0.0001g)分析纯无水N a2CO3,溶解稀释,转移至100ml容量瓶中定容备用.②取20ml洁净的移液管,用少量碳酸钠溶液润洗2~3次,然后移取20.00碳酸钠溶液于锥形瓶中,再加入2滴甲基橙作为指示剂,摇匀,临近滴定终点时用蒸馏水将锥形瓶的内壁冲洗一下。
实验一 NH 3的电离平衡常数k b 的测定【实验原理】1、氨水是一种弱碱,NH 3在水中存在以下电离平衡NH 3+H 2O →NH 4++OH -k b 代表其电离平衡常数,C 为氨水的初始浓度。
[NH 4+][ OH -] [NH 3]分别为其电离平衡浓度。
一定温度下,则有:k b =4[NH +][ OH-][NH3]≈[OH -]2/C(当解离度α<5%时C α可忽略)如果测出氨水的浓度和该溶液的PH 值便可以根据上述公式求出k b ,C 可用HCl 标准溶液滴定测得,由于滴定突跃发生在酸性范围内,所以用甲基橙作为指示剂,滴定终点时由黄色变为橙红色。
2、[OH -]可以用PH 计间接测出3、HCl 溶液的标定:由于盐酸溶液易挥发出HCl 气体,所以不能由直接法配置,只能先配置成近似浓度的溶液,再用适当的一级标准物质Na 2CO 3标定之。
盐酸加入Na 2CO 3溶液中:Na 2CO 3+2HCl=2NaCl+CO 2+H 2O选用甲基橙作为指示剂,到滴定终点时,溶液由黄色变为橙红色.C (HCl )=23232m(Na CO )10005(a )(l)M N CO V HC ⨯ (mol/L)【仪器与试剂】仪器:PHS-2C 酸度计、滴定台、酸式滴定管(25ml)、锥形瓶(250m l ×6)、烧杯(100ml ×4)、移液管(10ml 、20ml )、胶头滴管、玻璃棒、容量瓶(100m l ×2、50ml ×2)、分析天平试剂:1mol/L 氨水、0.1mol/L -1HCl 溶液、甲基橙、蒸馏水、分析纯无水Na 2CO 3 【实验步骤】1、0.1mol/LHCl 酸溶液的标定:①配置Na 2CO 3标准溶液,用分析天平称取0.4~0.6g (精确至±0.0001g )分析纯无水Na 2CO 3,溶解稀释,转移至100ml 容量瓶中定容备用. ②取20ml 洁净的移液管,用少量碳酸钠溶液润洗2~3次,然后移取20.00ml 碳酸钠溶液于锥形瓶中,再加入2滴甲基橙作为指示剂,摇匀,临近滴定终点时用蒸馏水将锥形瓶的内壁冲洗一下。
氨水的电离平衡常数表达式氨水是一种混合的酸性溶液,其中包含氨,氢氧化钠和水,它具有良好的电离性能,可以用来满足特定的电化学反应要求。
为了计算氨水中电离平衡常数,首先要了解电离常数,它可以通过pH值以及电导率来测量。
电离常数(K)是指溶液中电离成分的组成比例,K 的值也可以用来衡量一种特定的溶液的离子化程度。
电离常数的大小可以通过一个电离平衡常数表达式来确定。
氨水的电离平衡常数表达式由式1来表示:K = [H3O +][NH3]/[NH4 +]其中,[H3O +]是溶液中氢离子的浓度,[NH3]是溶液中氨分子的浓度,[NH4 +]是溶液中铵离子的浓度。
式中所有的浓度均表示为摩尔浓度(mol/L)。
氨水在液态中可以利用氨水常数公式计算它的电离平衡常数。
氨水在气相中也可以用电离平衡常数表达式来计算电离平衡常数。
气相中氨水常数公式可以表示为:K = [H2O][NH3]/[NH3NH3]其中,[H2O]是水分子的浓度,[NH3]是氨分子的浓度,[NH3NH3]是二氨分子的浓度。
所有的浓度均表示为摩尔浓度(mol/L)。
由于氨水是一种混合的酸性溶液,它的电离平衡受到氨水溶液中的氨分子的浓度限制,也取决于氨水溶液的pH值和电导率的大小。
当pH值降低,电离平衡常数K也会降低,因为酸性溶液中的氨分子愈多愈容易形成水合物;当氨水溶质的电导率增加,K也会增加,因为电离离子的浓度会增加,这可能会导致氨分子容易被分解形成质子离子。
由于电离平衡常数K的大小取决于pH值和电导率,所以氨水的电离平衡常数K可以通过测量它们来确定。
当K值较低时,氨水溶液中的氨分子较少,质子离子较多,这反映了溶液中存在较弱的酸性;当K值较高时,氨水溶液中的氨分子较多,质子离子较少,这表明溶液中有较强的酸性。
因此,氨水的电离平衡常数表达式可以帮助我们研究溶液中电离反应的氨分子浓度,从而更好地控制氨水溶液的离子化程度,有效地满足某些特定的电化学反应的要求。
NH 3的电离平衡常数k b 的测定 【实验目的】1、掌握PH 计法测定NH 3的电离平衡常数; 2、学习使用PH 计测定溶液的PH 值;
3、巩固滴定管、移液管、容量瓶及分析天平的规范操作. 【实验原理】1、氨水是一种弱碱,NH 3在水中存在以下电离平衡 NH 3+H 2O →NH 4++OH -
k b 代表其电离平衡常数,C 为氨水的初始浓度。
[NH 4+][ OH -] [NH 3]分别为其电离平衡浓度。
一定温度下,则有:k b =4[NH +][ OH-]
[NH3]
≈[OH -]2/C(当解离度α<5%时C α
可忽略)
如果测出氨水的浓度和该溶液的PH 值便可以根据上述公式求出k b ,C 可用HCl 标准溶液滴定测得,由于滴定突跃发生在酸性范围内,所以用甲基橙作为指示剂,滴定终点时由黄色变为橙红色。
2、[OH -]可以用PH 计间接测出
3、HCl 溶液的标定:由于盐酸溶液易挥发出HCl 气体,所以不能由直接法配
置,只能先配置成近似浓度的溶液,再用适当的一级标准物质Na 2CO 3标定之。
盐酸加入Na 2CO 3溶液中:
Na 2CO 3+2HCl=2NaCl+CO 2+H 2O
选用甲基橙作为指示剂,到滴定终点时,溶液由黄色变为橙红色. C (HCl )=
23232m(Na CO )
10005(a )(l)
M N CO V HC ⨯ (mol/L)
【仪器与试剂】仪器:PHS-2C 酸度计、滴定台、酸式滴定管(25ml)、锥形瓶(250m l ×6)、
烧杯(100ml ×4)、移液管(10ml 、20ml )、胶头滴管、玻璃棒、容量瓶(100m l ×2、50ml ×2)、分析天平
试剂:1mol/L 氨水、0.1mol/L -1HCl 溶液、甲基橙、蒸馏水、分析纯无水
Na 2CO 3
【实验步骤】1、0.1mol/LHCl 酸溶液的标定:
①配置Na 2CO 3标准溶液,用分析天平称取0.4~0.6g (精确至±0.0001g )分
析纯无水Na 2CO 3,溶解稀释,转移至100ml 容量瓶中定容备用.
②取20ml 洁净的移液管,用少量碳酸钠溶液润洗2~3次,然后移取20.00碳
酸钠溶液于锥形瓶中,再加入2滴甲基橙作为指示剂,摇匀,临近滴定终点时用蒸馏水将锥形瓶的内壁冲洗一下。
将酸式滴定管用少量待装的0.1mol/L 的盐酸溶液润洗2~3次,然后装满待标定的盐酸溶液(排除尖端气泡).调整并记下滴定管的初读数。
用待标定的盐酸溶液进行滴定,直至溶液变为橙红色30s 不退色,记下末读数。
按上述方法重复滴定3次,并在下表做好记录并处理。
2、0.1mol/L的氨水的配制:
用10ml的移液管吸取10.00ml 1mol/L氨水于100ml容量瓶中,配制成100.00溶液
3、NH3·H2O溶液浓度的测定:
用20ml移液管吸取20.00ml 0.1mol/L的氨水于锥形瓶中,加入2滴甲基橙作为指示剂,用已知浓度的盐酸标准液进行滴定,至溶液变为橙红色,且30s不退色。
下表记录数据并处理,平行滴定3次。
C(NH3)=C HCl V HCl)
V(NH3)
()(
mol/L
室温:
4、PH值的测定:
取两个50ml容量瓶,分别加入已知准确浓度的氨水5.00ml、20.00分别稀
释成50.00ml溶液
取稀释后的氨水和稀释前的分别装入3个干燥的小烧杯中,用PHS-2C酸
度计测其PH值,利用公式P(OH-)=14-PH求出P (OH-)从而得出[OH-].
计算k
室温:。