实验八 醋酸电离度和电离平衡常数的测定
- 格式:doc
- 大小:66.51 KB
- 文档页数:3


实验1 醋酸电离度和电离常数的测定[目的要求]1.测定醋酸的电离度和电离常数。
2.学习使用pH 计和电导率仪。
[实验原理]1. 酸度法HAcH + + Ac -起始浓度 c 0 0 平衡浓度 c-c α c α c α电离常数 α1c αc αc )α(c [HAc]]][Ac [H 22−=−==−+K (1)在一定温度下,用酸度计测定一系列已知浓度的醋酸溶液的pH 值,根据pH=lg[H +]和α=[H +]/c 可以求得一系列对应的α和K 值。
所取得的一系列K 值的平均值,即为该温度下醋酸的电离常数。
2. 电导法电解质溶液导电能力的大小可用电阻R 的倒数——电导L (单位:西门子,S )来描述(RL 1= ) 根据欧姆电阻定律,在电极面积为A ,距离为l 时,溶液的电导为l A L κ= 或 A l L =κ(Al为电极常数,κ为电导率)。
对于给定电极,A 与l 都是固定值,因此,电导与电极的结构无关。
在一定温度下,电解质溶液的电导决定于溶液的性质及浓度。
为了比较不同电解质的导电能力,引入摩尔电导(Λm )这一概念,它是把含有1mol 溶质的电解质置于相距为1m 、面积为1m 2的两个电极之间的电导,它代表1mol 电解质的导电能力。
Λm =κV =c310−×κ(电导率κ由实验测定) (2)(κ单位:S ·m -1,Λm 单位:S ·m 2·mol -1,c 单位:mol ·L -1)弱电解质溶液在无限稀释时,可看作完全电离(α→1),此时溶液的摩尔电导叫做极限摩尔电导(Λ∞)。
在一定温度下,弱电解质的电离度α等于在溶液浓度c 时的摩尔电导Λm 与溶液的极限摩尔电导Λ∞之比,即∞ΛΛ=mα (3) 这样,由实验测定浓度为c 的HAc 溶液的电导率κ,带入(2)式,算出其电导摩尔Λm ;代入(3)式,算出α;再代入(1)式,可算出电离常数K[实验步骤]1.配制不同浓度的醋酸溶液用移液管分别取25.00 mL 、5.00 mL 、2.50 mL 的标准醋酸溶液于3个50 mL 容量瓶中,再用蒸馏水稀释到刻度,摇匀。

醋酸电离度和电离平衡常数的测定一、实验目的1.测定醋酸的电离度和电离平衡常数。
2.学会正确地使用pH计。
3.练习和巩固容量瓶、移液管、滴定管等仪器的基本操作。
二、实验原理醋酸CH3COOH(简写为HAc)是一元弱酸,在溶液中存在下列电离平衡:HAc(aq)+H2O(l)H3O+(aq)+Ac-(aq)忽略水的电离,其电离常数:[H3O+][Ac-][H3O+]2Ka[HAc][HAc]首先,一元弱酸的浓度是已知的,其次在一定温度下,通过测定弱酸的pH值,由pH=-lg[H3O+],可计算出其中的[H3O+]。
对于一元弱酸,当c/Ka≥500时,存在下列关系式:[H3O+]2[H3O+]Kacc由此可计算出醋酸在不同浓度时的解离度()和醋酸的电离平衡常数(Ka)。
或者也可由Kac2计算出弱酸的解离常数(Ka)。
三、仪器和试药仪器:移液管、吸量管、容量瓶、碱式滴定管、锥形瓶、烧杯、量筒、pHS-3C型酸度计。
试药:冰醋酸(或醋酸)、NaOH标准溶液(0.1mol·L-1)、标准缓冲溶液(pH=6.86,4.00)酚酞溶液(1%)。
四、实验内容1.配置250mL浓度为0.1mol·L-1的醋酸溶液用量筒量取4mL36%(约6.2mol·L-1)的醋酸溶液置于烧杯中,加入250mL蒸馏水稀释,混匀即得250mL浓度约为0.1mol·L-1的醋酸溶液,将其储存于试剂瓶中备用。
2.醋酸溶液的标定用移液管准确移取25.00mL醋酸溶液(V1)于锥型瓶中,加入1滴酚酞指示剂,用标准NaOH溶液(c2)滴定,边滴边摇,待溶液呈浅红色,且半分钟内不褪色即为终点。
由滴定管读出所消耗的NaOH溶液的体积V2,根据公式c1V1=c2V2计算出醋酸溶液的浓度c1。
平行做三份,计算出醋酸溶液浓度的平均值。
3.pH值的测定分别用吸量管或移液管准确量取2.50、5.00、10.00、25.00mL上述醋酸溶液于四个50mL的容量瓶中,用蒸馏水定容,得到一系列不同浓度的醋酸溶液。
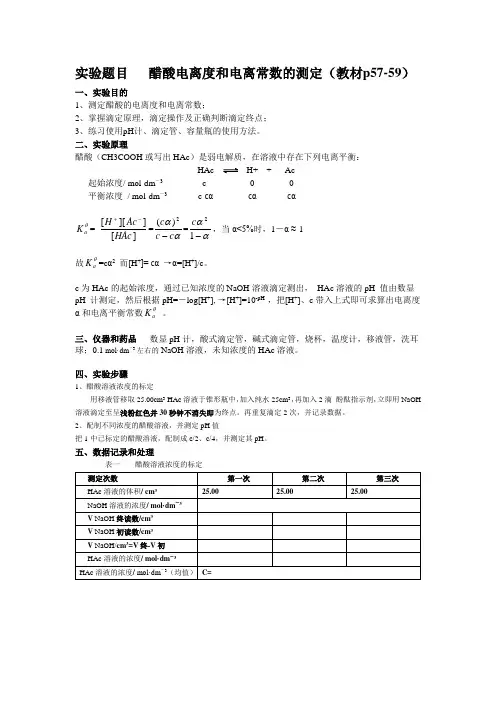
实验题目 醋酸电离度和电离常数的测定(教材p57-59)一、实验目的1、测定醋酸的电离度和电离常数;2、掌握滴定原理,滴定操作及正确判断滴定终点;3、练习使用pH 计、滴定管、容量瓶的使用方法。
二、实验原理醋酸(CH3COOH 或写出HAc )是弱电解质,在溶液中存在下列电离平衡: HAc H+ + Ac-起始浓度/ mol·dm -3c 0 0平衡浓度 / mol·dm -3 c-cα cα cαθa K = ][]][[HAc Ac H -+=ααc c c -2)(=αα-12c ,当α<5%时,1-α ≈ 1故θa K =c α2 而[H +]= cα →α=[H +]/c 。
c 为HAc 的起始浓度,通过已知浓度的NaOH 溶液滴定测出, HAc 溶液的pH 值由数显pH 计测定,然后根据pH=-log[H +],→[H +]=10-pH ,把[H +]、c 带入上式即可求算出电离度α和电离平衡常数θa K 。
三、仪器和药品 数显pH 计,酸式滴定管,碱式滴定管,烧杯,温度计,移液管,洗耳球;0.1 mol·dm -3左右的NaOH 溶液,未知浓度的HAc 溶液。
四、实验步骤1、醋酸溶液浓度的标定用移液管移取25.00cm 3 HAc 溶液于锥形瓶中,加入纯水25cm 3,再加入2滴 酚酞指示剂,立即用NaOH 溶液滴定至呈浅粉红色并30秒钟不消失即为终点。
再重复滴定2次,并记录数据。
2、配制不同浓度的醋酸溶液,并测定pH 值把1中已标定的醋酸溶液,配制成c/2、c/4,并测定其pH 。
五、数据记录和处理表一 醋酸溶液浓度的标定表二六、结果与讨论(是对实验结果进行讨论,分析结果是偏大还是偏小的原因)以上就是正式实验报告的格式!注意事项:请认真看书(近代化学实验教材p9-12)(一)、醋酸溶液浓度的标定1、正确选用所需仪器(25cm3移液管,碱式滴定管,烧杯,洗耳球,锥形瓶,洗瓶等)2、·查漏——检查滴定管是否漏液;·润洗——分别用自来水、蒸馏水、待取液(NaOH溶液)洗滴定管3次;分别用自来水、蒸馏水、HAc溶液洗移液管3次·装液——在碱式滴定管中装满NaOH溶液,固定在滴定管夹上,除去尖嘴部分气泡,调整液面至零刻度或零刻度以下,并记录数据;用移液管移取25.00cm3 HAc 溶液于锥形瓶中,加入纯水25cm3,再加入2滴酚酞指示剂。
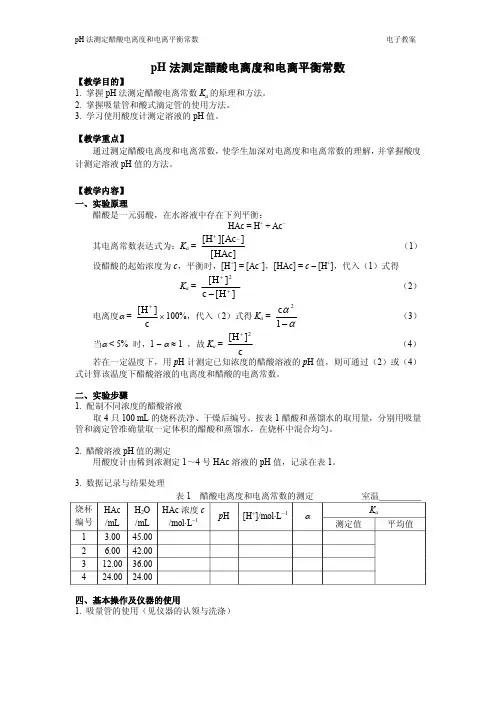
pH 法测定醋酸电离度和电离平衡常数【教学目的】1. 掌握 pH 法测定醋酸电离常数 K a 的原理和方法。
2. 掌握吸量管和酸式滴定管的使用方法。
3. 学习使用酸度计测定溶液的 pH 值。
【教学重点】通过测定醋酸电离度和电离常数,使学生加深对电离度和电离常数的理解, 并掌握酸度 计测定溶液 pH 值的方法。
【教学内容】一、实验原理醋酸是一元弱酸,在水溶液中存在下列平衡:HAc = H + + Ac– 其电离常数表达式为:K a = ]HAc [ ] Ac ][ H [ _ + (1) 设醋酸的起始浓度为c ,平衡时,[H + ] = [Ac – ],[HAc] = c –[H + ],代入(1)式得 K a = ] H [ c ] H [ 2 + + - (2)电离度a = c ] H [ + ´ 100%,代入(2)式得 K a = a a - 1 c 2 (3)当a < 5% 时,1 - a » 1 ,故 K a = c] H [ 2 + (4) 若在一定温度下,用 p H 计测定已知浓度的醋酸溶液的 p H 值,则可通过(2)或(4) 式计算该温度下醋酸溶液的电离度和醋酸的电离常数。
二、实验步骤1. 配制不同浓度的醋酸溶液取 4 只 100 mL 的烧杯洗净、干燥后编号。
按表 1 醋酸和蒸馏水的取用量,分别用吸量 管和滴定管准确量取一定体积的醋酸和蒸馏水,在烧杯中混合均匀。
2. 醋酸溶液 pH 值的测定用酸度计由稀到浓测定 1~4号 HAc 溶液的 pH 值,记录在表 1。
3. 数据记录与结果处理 表 1 醋酸电离度和电离常数的测定室温K a 烧杯 编号 HAc/mLH 2O /mL HAc 浓度 c /mol∙L -1 p H [H + ]/mol∙L -1 a 测定值 平均值 13.00 45.00 26.00 42.00 312.00 36.00 4 24.00 24.00四、基本操作及仪器的使用1. 吸量管的使用(见仪器的认领与洗涤)2. 酸式滴定管的使用滴定管是准确测量溶液体积的量出式量器,分为酸式滴定管和碱式滴定管。
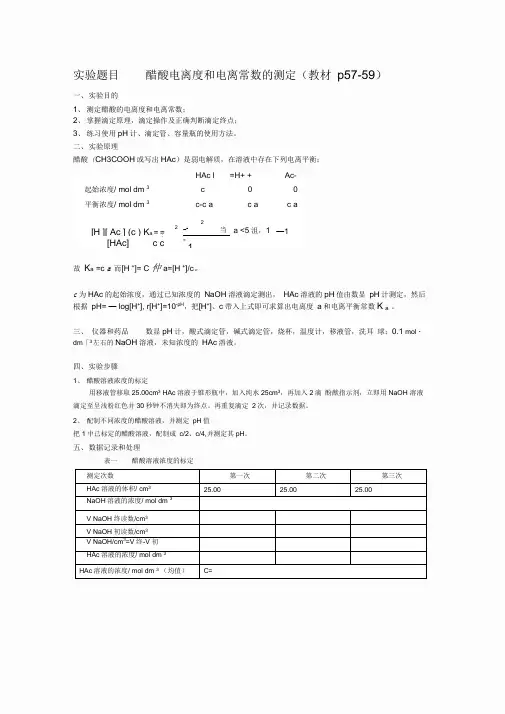
实验题目醋酸电离度和电离常数的测定(教材p57-59)一、实验目的1、测定醋酸的电离度和电离常数;2、掌握滴定原理,滴定操作及正确判断滴定终点;3、练习使用pH计、滴定管、容量瓶的使用方法。
二、实验原理醋酸(CH3COOH或写出HAc)是弱电解质,在溶液中存在下列电离平衡:HAc l=H+ +Ac-起始浓度/ mol dm 3c00平衡浓度/ mol dm 3c-c a c a c a2 [H ][ Ac ] (c ) K a = =:[HAc] c c2-c当 a <5沮,1—1 -1故K a=c a而[H +]= C 仲 a=[H +]/c。
c为HAc的起始浓度,通过已知浓度的NaOH溶液滴定测出,HAc溶液的pH值由数显pH计测定,然后根据pH= — log[H+], r[H+]=10-pH,把[H+]、c带入上式即可求算出电离度a和电离平衡常数K a。
三、仪器和药品数显pH计,酸式滴定管,碱式滴定管,烧杯,温度计,移液管,洗耳球;0.1 mol・dm「3左右的NaOH溶液,未知浓度的HAc溶液。
四、实验步骤1、醋酸溶液浓度的标定用移液管移取25.00cm3 HAc溶液于锥形瓶中,加入纯水25cm3,再加入2滴酚猷指示剂,立即用NaOH 溶液滴定至呈浅粉红色并30秒钟不消失即为终点。
再重复滴定2次,并记录数据。
2、配制不同浓度的醋酸溶液,并测定pH值把1中已标定的醋酸溶液,配制成c/2、c/4,并测定其pH。
五、数据记录和处理表一醋酸溶液浓度的标定测定次数第一次第二次第三次HAc溶液的体积/ cm325.0025.0025.00NaOH溶液的浓度/ mol dm 3V NaOH终读数/cm3V NaOH初读数/cm3V NaOH/cm3=V 终-V 初HAc溶液的浓度/ mol dm 3HAc溶液的浓度/ mol dm 3(均值)C=表二醋酸电离度和电离常数的测定(温度°C)HAc溶液编号V HAc/cm3V H2O/cm3C(HAc)mol dm 3pH[H+] mol dm 3a K a测定值平均值测定值平均值125.0075.00225.0025.00350.000.00六、结果与讨论(是对实验结果进行讨论,分析结果是偏大还是偏小的原因)以上就是正式实验报告的格式!注意事项:请认真看书(近代化学实验教材p9-12)(一)、醋酸溶液浓度的标定1、正确选用所需仪器(25cm3移液管,碱式滴定管,烧杯,洗耳球,锥形瓶,洗瓶等)2、查漏一一检查滴定管是否漏液;润洗一一分别用自来水、蒸熠水、待取液(NaOH溶液)洗滴定管3次;分别用自来水、蒸熠水、HAc溶液洗移液管3次装液一一在碱式滴定管中装满NaOH溶液,固定在滴定管夹上,除去尖嘴部分气泡,调整液面至零刻度或零刻度以下,并记录数据;用移液管移取25.00cm3 HAc溶液于锥形瓶中,加入纯水25cm3,再加入2滴酚猷指示剂。

实验八 (一)醋酸电离常数的测定——pH 法【目的要求】1、掌握利用pH 法测定电解质的电离常数的基本原理;2、学习pH 计的使用方法;3、巩固滴定管、移液管、吸量管、容量瓶的使用操作。
3、进一步熟悉溶液的配置与标定,规范称量、滴定的操作。
【实验原理】醋酸在水溶液中存在电离平衡:+HAcH +Ac -,由电离度和电离常数的定义有:+[H ]100%cα=⨯,2a [H ][Ac ][H ][HAc][H ]K c +-++==-当5%α<时,2a [H ]K c+≈,由此计算醋酸的电离度和电离常数。
【实验步骤】1、250mL 0.2 mol ·L -1的NaOH 溶液的配制与标定。
①称量NaOH 2.0g ,放入小烧杯中,加水溶解,转入试剂瓶,充分混合摇匀。
②称量KHC 8H 4O 4(-1204.2mol L M =⋅)0.8~1.0 g ,分别加入到标号为1~3的锥形瓶中,加40mL 水溶解。
加入2滴0.2%的酚酞溶液,用待测定NaOH 溶液滴定至微红色且30s 不变色。
平行滴定3份,要求精密度良好。
2、300mL 0.2 mol ·L -1的HAc 溶液的配配制与标定。
①用10mL 量筒量取冰乙酸(17.5mol ·L -1)3.4~3.5mL ,注入小烧杯中,加去离子水稀释后转入试剂瓶,再加水至300mL ,充分混合摇匀。
②用移液管分别向标号为1~3的三个锥形瓶中放入待测HAc 溶液25.00mL ,并加入2滴0.2%的酚酞溶液,用已标定浓度的NaOH 溶液滴定其至微红色且30s 不变色。
平行滴定3份,要求精密度良好。
3、配制不同浓度的HAc 溶液。
①用吸量管分别吸取2.50mL 、5.00mL 已知浓度醋酸溶液,用移液管移取25.00mL 已知浓度醋酸溶液,分别注入三只50mL 容量瓶中,定容,摇匀。
②将原醋酸溶液和新配制的醋酸溶液分别注入标号为1~4的四个干燥小烧杯中,按照由稀到浓的顺序用pH 计测定1~4号烧杯中不同浓度的HAc 的pH 。
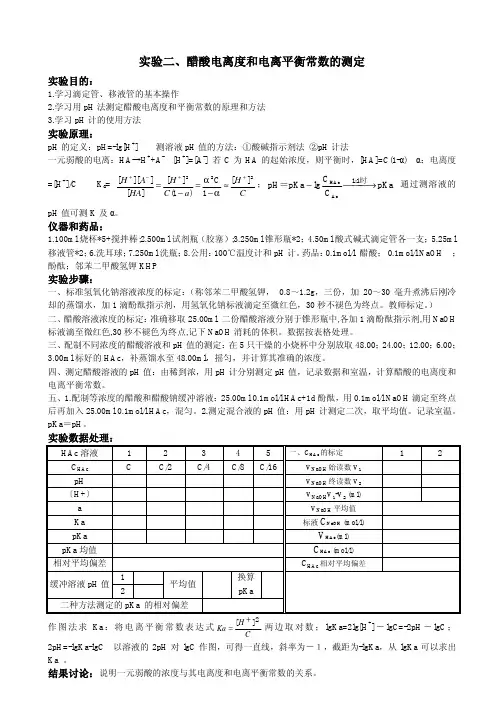

化学实验:醋酸电离常数的测定一、实验目的① 掌握弱酸的电离度和电离常数的测定方法 ② 学会pH 酸度计的使用方法 二、实验原理醋酸在水溶液中的电离平衡:-++⇔Ac H HAc其电离平衡常数关系式;[][][][][][])1(22α-=-==+++-+c H H c H HAc Ac H Ka当α<5%时,)1(α-c ≈c ,此时=SPK []cH 2+,电离度α=[]cH +⊗100%通过用pH 酸度计测定已知准确浓度的HAc 溶液的pH 值,由[]pHH-+=10求算出[]+H ,便可进一步求出HAc 溶液的电离度和平衡常数。
三、主要仪器与试剂容量瓶(50ml ),烧杯(50ml ),pH 酸度计,移液管(10ml ) HAc (0.3798mol/l) 四、实验内容1、 配制不同浓度的HAc 溶液用移液管分别移取10.00ml ,5.00ml ,2.5ml 准确浓度的HAc 溶液,分别加入三个已经 洗净的50ml 容量瓶中,稀释至刻度,摇匀,计算浓度。
2、 测定醋酸溶液的pH 值,计算醋酸的电离度和电离平衡常数 ① 安装酸度计将复合电极用电极夹固定,插头插入仪器背部的电极插孔中,打开电源开关,预热30min. ② 标定pH 酸度计 a 。
、用去离子水清洗电极,用洁净滤纸吸去表面水分,然后将电极放入装有pH 值为6.86的标准的缓冲溶液中,轻摇烧杯,消除气泡并使溶液尽快达扩散平衡,把选择开关置于“温度”位,调节“温度补偿”使仪器显示的温度值与被测溶液温度与当前温度一致。
b 、把选择开关置于“pH ”为,显示pH 值,调节“定位”旋钮,使显示值与标准缓冲液当前温度下的pH 值一致。
c .取出电极,清洗并清除表面水后,再把电极放入pH=4.003的第二种标准缓冲液中,调节“斜率”旋钮,使显示值与该标准缓冲液当前温度下pH 值一致。
3、测量先将少量待测HAc 溶液润戏洗洁净的50ml 的烧杯,再加入HAc 溶液,由稀到浓的次序表1,2,3,4,洗净电极,吸干水后依次插入被测液,待仪器显示的数稳定后记下读数,计算电离度和电离平衡常数。

醋酸电离度和电离常数的测定——pH 计的使用[实验目的]测定醋酸的电离度和电离常数。
进一步掌握滴定原理,滴定操作及正确判断滴定终点。
学习使用pH 计。
醋酸(CH 3COOH 或HAc )是弱电解质,在水溶液中中存在以下电离平衡:+-HAc H +Ac其平衡方程式为[]+-H Ac H Ac iK ⎡⎤⎡⎤⎣⎦⎣⎦=c 为HAc 的起始浓度,[H +]、[Ac -]、[HAc]分别为H +、Ac -、HAc 的平衡浓度,α为电离度,K i 为电离平衡常数。
在纯的HAc 溶液中,[H +]=[Ac -]=c α,[HAc]=c (1-α)。
则H 100%cα+⎡⎤⎣⎦=⨯[]2H A c H H A c H i K c +-++⎡⎤⎡⎤⎡⎤⎣⎦⎣⎦⎣⎦==⎡⎤-⎣⎦当α<5%时,c -[H +]≈c ,故2H iKc+⎡⎤⎣⎦=根据以上关系,通过测定已知浓度的HAc 溶液的pH ,就知道其[H +],从而可以计算该HAc 溶液的电离度和平衡常数。
[思考题]1.若所用的醋酸浓度极稀,醋酸的电离度>5%时,是否还能用2H iKc+⎡⎤⎣⎦=式计算电离平衡常数?为什么?2.实验中[HAc]和[Ac -]浓度是怎样测定的?3.同温度下不同浓度的HAc 的溶液的电离度是否相同?电离平衡常数是否相同? [实验用品]仪器:碱式滴定管、吸量管(10mL)、移液管(25mL)、锥形瓶(50mL)、烧杯(50mL)、pH 计。
液体药品:HAc (0.20mol·L -1)、NaOH (0.20mol·L -1)标准溶液、酚酞指示剂 [基本操作]1.滴定管的使用,参见第四章二。
2.移液管、吸量管的使用,参见第四章二。
3.容量瓶的使用,参见第四章二。
4.pH 计的使用,参见第七章一。
[实验内容]一、醋酸溶液浓度的测定[思考题]本实验应选用哪些仪器?如何正确地进行滴定操作?二、配制不同浓度的HAc溶液用移液管和吸量管分别取25.00mL、5.00mL、2.50mL已测得准确浓度的HAc溶液,把它们分别加入三个50mL容量瓶中(并依次编为3#、2#、1#),再用纯水稀释至刻度,摇匀,并计算出这三个容量瓶中HAc溶液的准确浓度。

醋酸电离度和电离常数的测定实验报告下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!引言实验目的实验原理3.1 醋酸电离度。
实验八醋酸电离度和电离平衡常数的测定一、实验目的1、测定醋酸电离度和电离平衡常数。
2、学习使用pH 计。
3、掌握容量瓶、移液管、滴定管基本操作。
二、实验原理醋酸是弱电解质,在溶液中存在下列平衡:HAcH++ Ac-1][]][[2c HAc Ac H K a式中[ H +]、[ Ac -]、[HAc]分别是H +、Ac -、HAc 的平衡浓度;c 为醋酸的起始浓度;aK 为醋酸的电离平衡常数。
通过对已知浓度的醋酸的pH 值的测定,按pH=-lg[H +]换算成[H +],根据电离度cH ][,计算出电离度α,再代入上式即可求得电离平衡常数a K 。
三、仪器和药品仪器:移液管(25mL ),吸量管(5mL ),容量瓶(50mL ),烧杯(50mL ),锥形瓶(250mL ),碱式滴定管,铁架,滴定管夹,吸气橡皮球,Delta320-S pH 计。
药品:HAc (约0.2mol ·L -1),标准缓冲溶液(pH=6.86,pH=4.00),酚酞指示剂,标准NaOH 溶液(约0.2mol ·L -1)。
三、实验内容1.醋酸溶液浓度的标定用移液管吸取25mL 约0.2mol ·L-1HAc 溶液三份,分别置于三个250mL 锥形瓶中,各加2~3滴酚酞指示剂。
分别用标准氢氧化钠溶液滴定至溶液呈现微红色,半分钟不褪色为止,记下所用氢氧化钠溶液的体积。
从而求得HAc 溶液的精确浓度(四位有效数字)。
2.配制不同浓度的醋酸溶液用移液管和吸量瓶分别取25mL ,5mL ,2.5mL 已标定过浓度的HAc 溶液于三个50mL容量瓶中,用蒸馏水稀释至刻度,摇匀,并求出各份稀释后的醋酸溶液精确浓度(2c ,10c,20c )的值(四位有效数字)。
3.测定醋酸溶液的pH值用四个干燥的50mL烧杯分别取30~40mL上述三种浓度的醋酸溶液及未经稀释的HAc溶液,由稀到浓分别用pH计测定它们的pH值(三位有效数字),并纪录室温。
实验 醋酸电离度和电离常数的测定——pH 计的使用一、实验目的1.学习测定醋酸的电离度和电离常数的方法;2.进一步掌握滴定原理、滴定操作及正确判断滴定终点;3.学习使用pH 计。
二、实验原理醋酸在水溶液中存在电离平衡:HAcH + + Ac 平衡常数关系式:] [ ] ][ [ HAc Ac H K a - + =HAcH + + Ac 始C 0 0 平衡 CC α C α C α当α< 5%时,[HAc] = C(1α) ≈ C则 cH HAc Ac H K a 2 ] [ ] [ ] ][ [ + - + = = cK H a = + ] [ % 100 ] [ ´ = + cH a 测定已知浓度醋酸溶液的pH 值,便知[H + ],从而可求出醋酸的电离度和电离常数。
三、实验用品仪器:碱式滴定管、吸量管(10mL)、移液管(25mL)、锥形瓶(250mL)、烧杯(50mL)、pH计、容量瓶(50mL)液体药品:HAc(0.2mol/L)、NaOH 标准溶液、酚酞指示剂四、实验内容1.醋酸溶液浓度的测定用标准氢氧化钠溶液标定醋酸的准确浓度,酚酞指示剂。
滴 定 序 号Ⅰ Ⅱ Ⅲ NaOH 溶液的浓度/ mol/LHAc 溶液的用量 / mLNaOH 溶液的用量 / mL测定值 HAc 溶液的浓度mol/L平均值 2.配制不同浓度的 HAc 溶液分别移取 25.00mL 、5.00mL 、2.50mL 上面已测出准确浓度的醋酸溶液,分别定容 在50mL 容量瓶中,计算三个容量瓶中醋酸的准确浓度。
3.测定醋酸溶液的 pH 值,计算醋酸的电离度和电离常数由稀到浓的次序测定四种不同浓度的 HAc 溶液(溶液分别置于干燥、洁净的小烧 杯中或烧杯不干燥,用所盛装溶液润洗)的pH ,记录数据,计算电离度和电离常数。
温度℃ 电离平衡常数 K 溶液编号C mol/L pH [H + ] mol/L α 测定值平均值 1234五、实验基本操作1.强化碱式滴定管的使用方法及滴定操作;2.强化由液体试剂准确配制溶液的操作;3.酸度计的使用方法(1) 仪器的安装;(2) 电极的安装;(3) 仪器校正;(4) 定位;(5) 测量——重点指导。
醋酸电离度和电离常数的测定一、实验目的与要求:1. 测定醋酸的电离度和电离常数。
2. 进一步掌握滴定原理,滴定操作及正确判断滴定终点。
3. 学习使用pH 计。
实验原理:醋酸是弱电解质,在溶液中存在如下电离平衡:HAc ⇌ H + + Ac -c 0 0c- cα cα cα α1c α[HAc]]][Ac [H 2-==-+a K [H +]、[Ac -]和[HAc]分别为H +、Ac -和HAc 的平衡浓度,K a 为HAc 的电离常数,c 为醋酸的初浓度,α为醋酸的电离度。
醋酸溶液的总浓度可以用标准NaOH 溶液滴定测得。
其电离出来的H +的浓度,可在一定温度下用数字酸度计测定醋酸溶液的pH 值,根据pH=-lg[H +]关系式计算出来。
另外,再根据[H +]=cα,便可求得电离度α和电离平衡常数K a 。
电离度α随初浓度c 而变化,而电离常数与c 无关,因此在一定温度下,对于一系列不同浓度的醋酸溶液,α1c α2-值近似地为一常数,取所得一系列α1c α2-的平均值,即为该温度下醋酸的电离常数K a 。
在纯的HAc 中[H +]=[Ac -]=Cα、[HAc]=C(1-α),则α=[H +]/C×100%。
Ki=[ H +][ Ac -]/[ HAc]=[ H +]2/(C-[ H +]),当α<5%时,C-[ H +]≈C ,故Ki=[ H +]2/C 。
根据以上关系,通过测定已知浓度的HAc 浓度的pH ,就知道其[H +],从而可以计算该HAc 溶液的电离度和平衡常数。
醋酸(CH 3COOH 或HAc )是弱电解质,在水溶液中存在以下电离平衡: HAcH + + Ac -其平衡关系式为 [H ][A c ][H A c ]i K +-= c 为HAc 的起始浓度,[H +]、[Ac -]、[HAc]分别为H +、Ac -、HAc 的平衡浓度,α为电离度,K i 为电离平衡常数。
醋酸电离度和电离常数的测定实验醋酸电一离度和离电数的测常定1.定醋酸测的离电和电度离数常。
ch++a-0平衡度浓-cc c c离数常()在1定一度温,下酸度计用测一系定列已知度的醋酸溶液浓p的值h,据p根=hl[g+]h和=[h+]/c可以得求一列对系的和应值。
k取所的得一列k系值平的值,即为该温均下度醋酸电离的数常.2导电法互换电机质解液溶导能力的大小电用可阻电的r数倒—电—导l单位(西门子,:s)描来(述)根据姆电欧阻定律,电极面在为积a,离距l为,时液的溶导电或为(为电极数,为常导电)。
率对给与定极,电a与l都固是定值因此,电导,与电的极构并无结关在一定温度。
下电解质溶液的电导,订于决液溶性质及的浓度为。
了比不较电解同的导质能力,电引摩入电尔导(m)这一概,它读就是不含把存有1ml溶o 质电解质复置的于距离为1m、后厝仔庄内积m1的两个电极之2的间导电。
=m=v电(率导由实测验)定()(2单位:s•-m1,m单位s•:2•mom-l1c单位:m,lo•-l)弱电1质解溶在无液限释时,稀可看作完电全(离→1,)时此溶液的尔摩电导做极叫限摩尔导电(∞。
)一在温定下度弱电,质解电离的度于在溶液浓度c等的摩尔电导时m与溶液极限摩的尔电∞导比之即这3,样由验测量浓度为c的实hc溶液的a导率,电入拎()式2算是,出来其电摩尔Auron;代入m(3)式,出来算是;再进(1代),式已是出来电离数常k配不同制浓度的醋溶液酸管液别挑2分后.050ml5.00、m、l.205ml的标准酸溶醋液3个于50ml量瓶孟,中用煎再水馏吸收镌刻至,度挥。
坯测.定酸溶醋的ph值和电液导率(,并计)醋酸的电算度离和电离常把数以四种不上浓度的醋酸同液分别重新加入4溶洁只天量潮湿50m的烧杯l,中按稀到浓由的次序酸在计度测量上它们ph值,的记数录据室温。
和计电算度距和电常数,结离果入填下。
表中酸度1法测结果定novh.acchacphh+][=[h+]/ck=c/2(1-)表2导率电测法定结果o.hvccaac h(/s)1(s1=0-4sm/)m s(2/mol)mk=c/(1-)2测量平值温如军1250.2.500325.00本实测量k检在1.值100-5~2010-.范围5内格1[.杯烧是必须烘干?还否以作可怎样理处?.如果2变小改测醋酸所液的温溶度浓度或,的它距电和度离电常有无数化变?存有若变,会化hsp-d3ph型计使方用1法.电极用馏水清蒸洗脸、吸水纸喷后,干入插复电极再分插座。
实验八 醋酸电离度和电离平衡常数的测定
一、实验目的
1、测定醋酸电离度和电离平衡常数。
2、学习使用pH 计。
3、掌握容量瓶、移液管、滴定管基本操作。
二、实验原理
醋酸是弱电解质,在溶液中存在下列平衡:
HAc
H +
+ Ac -
α
αθ
-⋅==-+1][]][[2
c HAc Ac H K a
式中[ H +]、[ Ac -]、[HAc]分别是H +、 Ac -、HAc 的平衡浓度;c 为醋酸的起始浓度;θ
a
K 为醋酸的电离平衡常数。
通过对已知浓度的醋酸的pH 值的测定,按pH=-lg[H +]换算成[H +],
根据电离度c
H ][+=α,计算出电离度α,再代入上式即可求得电离平衡常数θ
a K 。
三、仪器和药品
仪器:移液管(25mL ),吸量管(5mL ),容量瓶(50mL ),烧杯(50mL ),锥形瓶(250mL ),碱式滴定管,铁架,滴定管夹,吸气橡皮球,Delta320-S pH 计。
药品:HAc (约0.2mol·L -1),标准缓冲溶液(pH=6.86,pH=4.00),酚酞指示剂,标准NaOH 溶液(约0.2mol·L -1)。
三、实验内容
1.醋酸溶液浓度的标定
用移液管吸取25mL 约0.2mol·L -1 HAc 溶液三份,分别置于三个250mL 锥形瓶中,各加2~3滴酚酞指示剂。
分别用标准氢氧化钠溶液滴定至溶液呈现微红色,半分钟不褪色为止,记下所用氢氧化钠溶液的体积。
从而求得HAc 溶液的精确浓度(四位有效数字)。
2.配制不同浓度的醋酸溶液
用移液管和吸量瓶分别取25mL ,5mL ,2.5mL 已标定过浓度的HAc 溶液于三个50mL 容量瓶中,用蒸馏水稀释至刻度,摇匀,并求出各份稀释后的醋酸溶液精确浓度(
2c ,10
c
,20
c
)的值(四位有效数字)。
3.测定醋酸溶液的pH值
用四个干燥的50mL烧杯分别取30~40mL上述三种浓度的醋酸溶液及未经稀释的HAc溶液,由稀到浓分别用pH计测定它们的pH值(三位有效数字),并纪录室温。
4.计算电离度与电离平衡常数
根据四种醋酸的浓度pH值计算电离度与电离平衡常数。
五、数据纪录和结果
1.醋酸溶液浓度的标定
滴定序号 1 2 3
标准NaOH溶液的浓度/ mol·L-1
所取HAc溶液的量/mL
标准NaOH溶液的用量/ mL
实验测定HAc 测定值
溶液精确浓度/ mol·L-1 平均值
2.醋酸溶液的pH值测定及平衡常数、电离度的计算t = ℃
HAc溶液编号c HAc/ mol·L-1pH [H+]/ mol·L-1α/% a K
1 (c/20)
2 (c/10)
3 (c/2)
4 (c)
六、预习要求及思考题
1.预习要求
(1)认真预习电离平衡常数与电离度的计算方法,以及影响弱酸电离平衡常数与电离度的因素。
(2)pH计的型号不同使用方法也略有区别,使用前应认真预习,熟悉实验所用型号的
pH计的使用方法。
2.思考题
(1)标定醋酸浓度时,可否用甲基橙作指示剂?为什么?
K值是否随醋酸溶液浓度变化而变化?(2)当醋酸溶液浓度变小时,[H+]、α如何变化?
a
(3)如果改变所测溶液的温度,则电离度和电离常数有无变化?。