口服固体聚乙烯瓶标准
- 格式:doc
- 大小:48.00 KB
- 文档页数:4

目的:明确固体药用聚烯烃塑料瓶的质量标准和规范药用聚烯烃塑料瓶的检验。
适用范围:适用于包装非芳酸性、非油酸性、非挥发性及易氧化的固体药品(片剂、胶囊、制剂)的塑料瓶。
责任者:化验员。
引用标准:YY0057-91 GB28281、材料高密度聚乙烯树脂或聚丙烯树脂为主要原料。
2、技术要求2.1药用塑料瓶的外观质量:应具有均匀一致的乳白色泽,不得有明显的色差。
瓶的表面应光洁、平整、不允许有变形和明显的擦痕。
不允许有砂痕、油污、气泡。
瓶口应平整、光滑。
2.2物理性能应符合表1规定:表12.3化学性能符合表2规定:表22.4菌检验应符合以下规定:小于108ml的塑料细菌总数不超过1500个/瓶,霉菌总数不得超过150个/瓶;100ml至250ml的塑料瓶细菌总数不超过3000个/瓶,霉菌总数不得超过300个/瓶;大于250ml的塑料瓶细菌总数不得超过3500个/瓶,霉菌总数不得超过350个/瓶。
所有规定的塑料瓶大肠肝菌均不得检出。
2.5异常毒性:无异常毒性3、试验方法3.1外观在自然光线明亮处目测检验。
3.2密封性试验每个瓶装进一定量的玻璃球,紧盖后(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表3)置于带有抽气装置的容器内,用水浸没,抽真空到26.67kpa维持2min, 瓶内不得有进水或冒泡现象。
表33.3振荡试验每个瓶装入酸性水为标示剂、紧盖后(带有螺旋盖的试瓶用测力扳手将盖与瓶旋紧,扭力见表3)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡器频率每分钟200次土5%振荡30min后,溴酚蓝试纸不变色为合格。
3.4水蒸气渗透量试验每个试瓶用绸布擦净,将瓶盖连续开、关30次后,在试瓶内加入无水氯化钙干燥剂(除去过4目筛过细粉,置110C干燥1h),20ml或20ml以上的试瓶,加干燥剂量为13mm 高,小于20ml的试瓶,加入干燥剂量为容积2/3 ;如试瓶高度超过63mm加入干燥剂量为50mm高,立即将盖盖紧。

聚乙烯瓶是指以聚乙烯为主要原料,通过吹塑工艺,生产的药用高密度聚乙烯瓶。
其质量标准可参考口服固体药用高密度聚乙烯瓶、口服液体药用高密度聚乙烯瓶质量标准。
聚乙烯瓶质量标准有以下几点:
1、外观色泽均匀一致,无明显色差;表面光洁、凭证,五边形和明显擦痕;无砂眼、油污、气泡;瓶口平整、光滑。
2、密封性用水浸没, 抽真空至真空度为27kPa , 维持2分钟, 瓶内不得有进水或冒泡现象
3、炽灼残渣取本品 2.0g ,依法检查(中国药典2015年版通则0841) ,遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过3.0%)。
4、微生物限度细菌数每瓶不得过 1000cfu ,霉菌和酵母菌数每瓶不得过100cfu ,大肠埃希菌每瓶不得检出
5、异常毒性不得查出依法检查 (中国药典2015年版通则1141),应符合规定。

口服固体药用聚酯瓶(含垫片)质量标准Q/CX 002-20182018-12-01制定 2019-02-27实施广西陆川县诚信包装材料厂(普通合伙)Q/CX 002-2018口服固体药用聚酯瓶(含垫片)Koufuguti Yaoyong Juzhi Ping(Handianpian)本标准适用于以聚对苯二甲酸乙二醇酯(PET)为主要原料,采用注吹成型工艺生产的口服固体制剂用塑料瓶。
用于生产药品包装用聚酯/铝/聚酯封口垫片应符合药用聚酯/铝/聚酯封口垫片(YBB00142005-2015)的各项规定。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】(1)红外光谱取本品适量,照包装材料红外光谱测定法(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
(2)密度取本品2g,加水100ml,回流2小时,放冷,80℃干燥2小时后,照密度测定法(YBB00132003-2015)测定,应为1.31~1.38g/cm3。
【密封性】取本品适量(瓶盖附上垫片),于每个瓶内装入适量玻璃球,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1),置于抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭矩【振荡试验】取本品适量(瓶盖附上垫片),于每个瓶内装入酸性水为标示剂,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸应不变色。
【水蒸气透过量】取本品适量(瓶盖附上垫片),照水蒸气透过量测定法(YBB00092003-2015)第三法(2),在试瓶中加无水氯化钙,在对照瓶加入相等量玻璃小球后,将盖子旋紧,热封垫片后,再去掉垫片中的纸片层。

上海标准文件
标题:药用聚烯烃塑料瓶质量标准
分发部门:总经理室、质量技术部、生产制造部、物资部、行政部(存档)
药用聚烯烃塑料瓶质量标准
【来源】固体药用聚烯烃塑料瓶必须符合YY0057-91质量标准。
【外观要求】 1.1 应具有均匀一致的乳白的色泽,不得有明显的色差,瓶的表面应光洁、平整、不允许有变形和明显的皱痕,不允许有砂眼、油污、气泡。
瓶口应平整光滑,不应有飞边和缺陷。
(不合格率允许≤2.0%)
1.2 瓶盖和瓶口吻合严密,保险圈与瓶体咬合准确到位,且保险圈应随瓶盖的旋开而断裂分离。
(注:瓶盖不合格率允许≤
2.0%)
1.3 瓶盖及瓶体的文字、商标、规格刻印清晰无误。
【微生物限度】细菌总数不得超过1000个/瓶
霉菌总数不得超过25个/瓶
【原辅料生产厂报告单检验项目】生产厂家提供的出厂检验报告上必须符合本质量标准所有项目。
【原辅料进厂检验项目】感官、微生物限度。

口服固体药用高密度聚乙烯瓶质量标准依据:国家药监局国家药品包装容器标准YBB00122002本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服固体药用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】 (1)红外光谱取本品适量,敷于微热的溴化钾晶片上,照分光光度法测定,应与对照图谱一致。
(2)密度取本品2g,加水100ml,回流2小时,放冷,80?干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按公式计算: HDPE的密度应为0.935,0.965(g/cm3)。
【密封性】取本品适量,于每个瓶内装入适量玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭力盖直径(mm) 扭力(N?cm)15,22 59,7823,48 98,11849,70 147,176【振荡试验】取本品适量,于每个瓶内装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率为每分钟200?10次)振荡30分钟后,溴酚蓝试纸不得变色。
【水蒸气渗透】取本品适量,用绸布擦净每个试瓶,将瓶盖连续开、关30次后,在试瓶内加入干燥剂无水氯化钙(除去过4目筛的细粉,置110?干燥1小时):20ml或20ml以上的试瓶,加入干燥剂至距离瓶口13mm处;小于20ml的试瓶,加入的干燥剂量为容积的2/3,立即将盖盖紧。
另取两个试瓶装入与干燥剂相等量的玻璃小球,作对照用。
试瓶紧盖后分别称定重量,然后将试瓶置于相对湿度为95?5%,温度为25??2?的环境中,放置72小时,取出,室温放置45分钟,分别称重。

YBB00122002口服固体药用高密度聚乙烯瓶本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服固体药用塑料瓶。
[外观] 取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
[鉴别] (1)红外光谱 取本品适量,敷于微热的溴化钾晶片上,照分光光度法(中华人民共和国药典2000年版二部附录ⅣC)测定,应与对照图谱基本一致。
(2)密度 取本品2g ,加水lOOml ,回流2小时,放冷,80℃干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按公式计算:× dHDPE 的密度应为0.935-0.965(g /cm 3)。
[密封性] 取本品适量,于每个瓶内装入适量玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa ,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭力盖直径(mm)扭力(N·cm) 15~2259~78 23~4898~118 49~70147~176[振荡试验] 取本品适量,于每个瓶内装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡器频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸不得变色。
[水蒸气渗透] 取本品适量,用绸布擦净每个试瓶,将瓶盖连续开、关30次后,在试瓶内加入干燥剂无水氯化钙(除去过4目筛的细粉,置110℃干燥1小时):20ml WaWa - Ws或20ml 以上的试瓶,加入干燥剂至距瓶口13mm 处;小于20ml 的试瓶,加入的干燥剂量为容积的2/3,立即将盖盖紧。
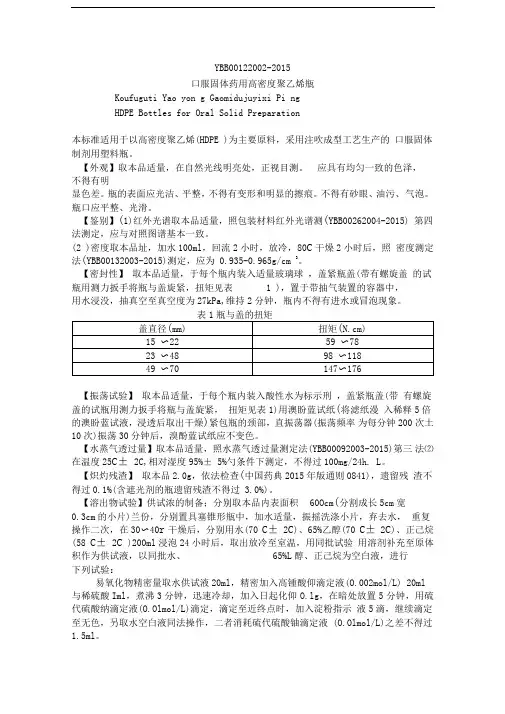
YBB00122002-2015口服固体药用高密度聚乙烯瓶Koufuguti Yao yon g Gaomidujuyixi Pi ngHDPE Bottles for Oral Solid Preparation本标准适用于以高密度聚乙烯(HDPE )为主要原料,采用注吹成型工艺生产的口服固体制剂用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】(1)红外光谱取本品适量,照包装材料红外光谱测(YBB00262004-2015) 第四法测定,应与对照图谱基本一致。
(2 )密度取本品址,加水100ml,回流2小时,放冷,80C干燥2小时后,照密度测定法(YBB00132003-2015)测定,应为 0.935-0.965g/cm 3。
【密封性】取本品适量,于每个瓶内装入适量玻璃球,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表 1 ),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1瓶与盖的扭矩【振荡试验】取本品适量,于每个瓶内装入酸性水为标示刑,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1)用澳盼蓝试纸(将滤纸漫入稀释5倍的澳盼蓝试液,浸透后取出干燥)紧包瓶的颈部,直振荡器(振荡频率为每分钟200次土10次)振荡30分钟后,溴酚蓝试纸应不变色。
【水蒸气透过量】取本品适量,照水蒸气透过量测定法(YBB00092003-2015)第三法⑵在温度25C± 2C,相对湿度95%± 5%勺条件下测定,不得过100mg/24h. L。
【炽灼残渣】取本品2.0g,依法检查(中国药典2015年版通则0841),遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过 3.0%)。

口服固体药用高密度聚乙烯瓶 YBB00122002 国家药品监督管理局国家药品包装容器(材料)标准(试行)口服固体药用高密度聚乙烯瓶Koufuguti Yaoyong Gaomidujuyixi PingHDPE Bottles for Oral Solid Preparation本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服固体药用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】 (1)红外光谱取本品适量,敷于微热的溴化钾晶片上,照分光光度法(中华人民共和国药典2000年版二部附录?C)测定,应与对照图谱一致。
(2)密度取本品2g,加水100ml,回流2小时,放冷,80?干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按公式计算: Wa?d Wa-WbHDPE的密度应为0.935,0.965(g/cm3)。
【密封性】取本品适量,于每个瓶内装入适量玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭力【振荡试验】取本品适量,于每个瓶内装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率为每分钟200?10次)振荡30分钟后,溴酚蓝试纸不得变色。
【水蒸气渗透】取本品适量,用绸布擦净每个试瓶,将瓶盖连续开、关30次后,在试瓶内加入干燥剂无水氯化钙(除去过4目筛的细粉,置110?干燥1小时):20ml或20ml以上的试瓶,加入干燥剂至距离瓶口13mm处;小于20ml的试瓶,加入的干燥剂量为容积的2/3,立即将盖盖紧。

口服药用低密度聚乙烯瓶盖标准
口服药用低密度聚乙烯瓶盖标准是指在医药行业中用于口服药
品包装的瓶盖所需符合的标准要求。
首先,口服药用低密度聚乙烯
瓶盖需要符合国家药典或者药品包装材料的相关标准,确保其质量
和安全性。
其次,瓶盖的材质应符合相关的医药包装材料的标准,
保证不会对药品产生不良影响。
此外,瓶盖的设计应符合人体工程
学原理,方便患者开启和关闭,保证药品的密封性和易用性。
同时,瓶盖的生产应符合相关的生产标准和工艺要求,确保生产出的产品
符合质量要求。
最后,瓶盖的印刷和标识应清晰可辨,包括药品名称、规格、生产日期、有效期等信息,以便患者正确识别和使用药品。
总的来说,口服药用低密度聚乙烯瓶盖标准涉及材料、设计、
生产和标识等多个方面,旨在保障口服药品的质量和安全性。
Q/KX 重庆康希塑料制品有限公司企业标准Q/KXHDPE01-2018口服固体药用高密度聚乙烯热封垫瓶2018-12-01发布2018-12-01实施重庆康希塑料制品有限公司发布Q/KXHDPE01-2018前言本产品因无国家标准和行业标准,为保证产品质量以及为产品出厂检验与交付提供依据,根据国家和行业的有关要求,结合用户需求,特制定本企业标准。
本标准参照GB/T1.1-2009《标准化工作指导第一部分:标准结构和编写》要求编写。
本标准由重庆康希塑料制品有限公司公司公司负责起草。
本标准主要起草人:刘思路。
本标准主要修订人:柳巧玲。
本标准批准人:徐元勋本标准于2018年12月01日修订发布。
本标准备案有效期3年。
质量标准起草说明一:编制目的按照国家标准化法规定,企业标准在无国家标准或行业标准时,必须制定企业标准。
本公司生产的口服固体药用高密度聚乙烯热封垫瓶,是以高密度聚乙烯为主要原料,采用注吹成型工艺生产的口服固体制剂用塑料瓶;以高密度聚乙烯为主要原料,采用注塑成型工艺生产口服固体制剂要用塑料盖,再组装药用聚酯/铝/聚乙烯封口垫片,经热合而成。
经索引该产品目前没有国家标准和行业标准,为保护消费者权益和企业利益,本公司根据国家标准化法的规定制定了企业标准,作为组织生产和检验的依据。
二、编制的依据口服固体药用高密度聚乙烯热封垫瓶由瓶身、瓶盖、封口垫片三部分组成,直接接触药品的为瓶身和封口垫片封口层,瓶盖部分为瓶子的组成部分,但不直接接触药品。
瓶身标准是依据国家药包材标准YBB00122002-2015《口服固体药用高密度聚乙烯瓶》制定的,其外观、鉴别、密封性、振荡试验、水蒸气透过量、炽灼残渣、溶出物试验、微生物限度、异常毒性的各项指标均引用该标准;由于密封性、振荡试验、水蒸气透过量因与垫片配合检查,增加了封口后、封口破坏后的检测;密封后水蒸气透过量的检测方法参考USP测试方法(在温度23℃±2℃,相对湿度75%±3%的环境下,放置14天测定);开启后测试条件按照YBB方法(在温度25℃±2℃,相对湿度95%±3%的环境下,放置3天)测定;封口垫片启破力没有相关的国家标准和行业标准,根据产品的检测数据以及客户协商制定。
目的:建立药用聚乙烯塑料瓶内控质量标准,避免差错和混淆。
范围:适用药用聚乙烯塑料瓶接收和检验。
职责:质量管理部经理、物料管理部经理、检验室主任、QA。
规程:
检验依据:YY0057-91
质量标准:
1. 材质高密度聚乙烯或高密度药用聚氯乙烯.
2. 外观质量应具有均匀一致的色泽,不得有明显的色差,瓶的表面应光洁平整,不允许有变形
和明显的皱痕,不允许有砂眼、油污、气泡。
瓶口应平整光滑。
3. 规格尺寸请参见附表
4. 密封性抽真空26.67kPa,2分钟不得有进水或冒泡现象。
5. 微生物限度
细菌总数不得超过150个/瓶
霉菌总数不得超过50个/瓶
活螨不得检出
大肠杆菌不得检出
7. 标志、包装和贮存
7.1 标志每箱应有产品合格证,并注明生产厂名称、产品名称、规格、批号、数量检验员
代号以及生产日期和防潮标志。
7.2 包装产品的包装分内外二层,内层用清洁、防潮材料包装;外层用纸箱包装。
7.3 贮存
7.3.1 应存放在清洁、干燥通风处。
7.3.2 贮存期限一年。
XXXXXXX有限公司
一、目的:建立口服固体药用高密度聚乙烯瓶的质量标准,确保所用口服固体药用高密度聚乙烯瓶的质量。
二、范围:本规定适用于口服固体药用高密度聚乙烯瓶的质量控制。
三、责任:
四、内容:
1.标准来源:
国家药品包装容器(材料)标准YBB00122002-2015 口服固体药用高密度聚乙烯瓶。
2.技术要求
3.贮存条件:密封,存于干燥,清洁处处。
4.相关标准操作规程:口服固体药用高密度聚乙烯瓶检验操作规程(SOP-ZL-JG(BC)-009)、物料取样标准操作规程(SOP-ZL-QA-001)。
5.企业统一指定的物料名称:口服固体药用高密度聚乙烯瓶。
6.内部使用的物料代码:详见产品所对应的口服固体药用高密度聚乙烯瓶物料代码。
7.经批准的供应商:见合格供应商目录。
8.印刷包装材料的实样或样稿:见包装材料样稿。
9.注意事项:密闭,遮光。
10.复验期:执行“物料有效期及复验期管理规程(SMP-WL-008)”相关规定。
11.文件附件:共0份。
12.修订及变更历史:。
附件一:山东凤凰制药股份有限公司标准(内包材)口服固体药用聚乙烯塑料瓶Koufugutiyaoyongjuyixi Suliaoping标准依据:国家药品监督管理局《国家药品包装容器(材料)标准》YBB00122002。
【材质】以高密度聚乙烯(HD PE)为主要原料,采用吹注成型工艺生产的口服固体药用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测:应具有均匀一致的乳白色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕,不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【物理性能】密封性试验取本品适量,于每个试瓶内装入适量的玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,抽真空至真空度为27kpa,维持2min,瓶内不得有进水或冒泡现象。
振荡试验取本品适量,于每个试瓶装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1),用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸不得变色水蒸气透过量试验取本品适量,用绸布擦净每个试瓶,将瓶盖连续开、关30次后,在试瓶内加入无水氯化钙干燥剂(除去过4号目筛的细粉,置110℃干燥1小时),20ml或20ml以上的试瓶,加入干燥剂至距瓶口13mm处;小于20ml的试瓶,加入干燥剂量为容积的2/3,立即将盖盖紧。
另取两个试瓶装入与干燥剂相等量的玻璃小球,作对照用。
试瓶紧盖后分别称定重量。
然后将试瓶置于相对湿度为95%±5%,温度为25℃±2℃的环境中,放置72小时,取出,室温放置45分钟,分别称重。
按式(1)计算水蒸汽渗透量。
水蒸气透过量(mg/24h.L)=[1000/3V]×[(T t-T i)-(C t-C i)] (1)V:试瓶的容积,ml;T I:试瓶试验前的重量,mg;C I:对照瓶试验前的平均重量,mg;T t:试瓶试验后的重量,mg;C t:对照瓶试验后的平均重量,mg。
口服固体药用高密度聚乙烯热封垫瓶企标本标准的编写参照引用了《国家药包材变准》YBB00122002-2015口服固体药用高密度聚乙烯瓶的规定,适用于以高密度聚乙烯 (HDPE ) 为主要原料,采用注吹成型工艺生产的带封口垫片的口服固体制剂用塑料瓶。
【外观】取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
【鉴别】 (1)红外光谱取本品适量,照包装材料红外光谱测(YBB00262004-2015)第四法测定,应与对照图谱基本一致。
( 2 )密度取本品址,加水100ml,回流2小时,放冷,80℃干燥2小时后,照密度测定法(YBB00132003-2015)测定,应为0.935-0.965g/cm3。
【密封性】取本品适量(瓶盖附上铝泊垫片),于每个瓶内装入适量玻璃球,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表 1 ) ,高频热封,置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1瓶与盖的扭矩【振荡试验】取本品适量(瓶盖附上铝泊垫片),于每个瓶内装入酸性水为标示剂,盖紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭矩见表1),高频热封,用溴酚蓝试纸(将滤纸漫入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,直振荡器(振荡频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸应不变色。
【水蒸气透过量】取本品适量(瓶盖附上铝泊垫片),高频热封,照水蒸气透过量测定法(YBB00092003-2015)第三法(2)在温度25℃±2℃,相对湿度95%±5%的条件下测定,不得过100mg/(24h. L)。
【炽灼残渣】取本品2.0g,依法检查(《中国药典》2015年版四部通则0841),遗留残渣不得过0.1%(含遮光剂的瓶遗留残渣不得过3.0%)。
国家药品监督管理局
国家药品包装容器(材料)标准
(试行)
YBB00122002 口服固体药用高密度聚乙烯瓶
Koufuguti Yaoyong Gaomidujuyixi Ping
HDPE Bottles for Oral Solid Preparation
本标准适用于以高密度聚乙烯(HDPE)为主要原料,采用注吹成型工艺生产的口服固体药用塑料瓶。
[外观]取本品适量,在自然光线明亮处,正视目测。
应具有均匀一致的色泽,不得有明显色差。
瓶的表面应光洁、平整,不得有变形和明显的擦痕。
不得有砂眼、油污、气泡。
瓶口应平整、光滑。
[鉴别](1)红外光谱取本品适量,敷于微热的溴化钾晶片上,照分光光度法(中华人民共和国药典2000年版二部附录ⅣC)测定,应与对照图谱基本一致。
(2)密度取本品2g,加水lOOml,回流2小时,放冷,80℃干燥2小时后,精密称定(Wa)。
再置适宜的溶剂(密度为d)中,精密称定(Ws)。
按公式计算:
Wa
—————× d
Wa—Ws
HDPE的密度应为0.935~0.965(g/cm3)。
[密封性]取本品适量,于每个瓶内装入适量玻璃球,旋紧瓶盖(带有螺旋盖的试瓶,用测力扳手将瓶与盖旋紧,扭力见表1),置于带抽气装置的容器中,用水浸没,抽真空至真空度为27kPa,维持2分钟,瓶内不得有进水或冒泡现象。
表1 瓶与盖的扭力
[振荡试验]取本品适量,于每个瓶内装入酸性水为标示剂,旋紧瓶盖(带有螺旋盖的试瓶用测力扳手将瓶与盖旋紧,扭力见表1)用溴酚蓝试纸(将滤纸浸入稀释5倍的溴酚蓝试液,浸透后取出干燥)紧包瓶的颈部,置振荡器(振荡器频率为每分钟200次±10次)振荡30分钟后,溴酚蓝试纸不得变色。
[水蒸气渗透]取本品适量,用绸布擦净每个试瓶,将瓶盖连续开、关30次后,在试瓶内加入干燥剂无水氯化钙(除去过4目筛的细粉,置110℃干燥1小时):20ml或20ml以上的试瓶,加入干燥剂至距瓶口13mm处;小于20ml的试瓶,加入的干燥剂量为容积的2/3,立即将盖盖紧。
另取两个试瓶装入与干燥剂相等量的玻璃小球,作对照用。
试瓶紧盖后分别称定重量,然后将试瓶置于相对湿度为95%±5%,温度为25℃±2℃的环境中,放置72小时,取出,室温放置45分钟,分别称重。
按下式计算水蒸气渗透量,不得过100mg/24h·L。
1000
水蒸气渗透量(mg/24h·1)= ——— [(Tt—Ti)—(Ct—Ci)]
3V
式中:V——试瓶的容积(ml);
Ci——对照瓶试验前的平均重量(mg);
Ti——试瓶试验前的重量;
Tt——试瓶试验后的重量;
Ct——对照瓶试验后的平均重量(mg)。
[炽灼残渣]取本品2.0g,依法检查(中华人民共和国药典2000年版二部附录ⅧN),不得过0.1%。
(含遮光剂的瓶炽灼残渣不得过3.0%)。
[溶出物试验]溶出物试液的制备分别取本品内表面积600cm2(分割成长5cm,宽0.3cm的小片)三份置具塞锥形瓶中,加水适量,振摇洗涤小片,
弃去水,重复操作二二次。
在30℃~40℃干燥后,分别用水(70℃±2℃)、65%乙醇(70℃±2℃)、正己烷(58℃±2℃)200ml浸泡24小时后,取山放冷至室温,用同批试验用溶剂补充至原体积作为浸出液,以同批水、65%乙醇、正己烷为空白液。
易氧化物精密量取水浸液20ml,精密加入高锰酸钾滴定液(0.002mol /L)20ml与稀硫酸1ml,煮沸3分钟,迅速冷却,加入碘化钾0.1g,在暗处放置5分钟,用硫代硫酸钠滴定液(0.01mol/L)滴定,滴定至近终点时,加入淀粉指示液0.25ml,继续滴定至无色,另取水空白液同法操作,二者消耗滴定液之差不得过1.5ml。
重金属精密量取水浸液20ml,加醋酸盐缓冲液(pH3.5)2ml,依法检查(中华人民共和国药典2000年版二部附录ⅧH第一法),含重金属不得过百万分之一。
不挥发物分别取水、65%乙醇、正己烷浸出液与空白液各50ml置于已恒重的蒸发皿中,水浴蒸干,105℃干燥2小时,冷却后精密称定,水不挥发物残渣与其空白液残渣之差不得过12.0mg;65%乙醇不挥发物残渣与其空白液残渣之差不得过50.0mg:正己烷不挥发物残渣与其空白液残渣之差不得过75.0mg。
[微生物限度]取数个试瓶,加入标示容量1/3量的氯化钠注射液,将盖旋紧,振摇1分钟,取提取液照微生物限度法(中华人民共和国药典2000年版二部附录ⅪJ)测定。
细菌数每瓶不得过1000个,霉菌、酵母菌数每瓶不得过100个,大肠杆菌每瓶不得检出。
[异常毒性]*将试瓶用水清洗干净后,剪碎,取500cm2(以内表面积计),加入氯化钠注射液50ml,110℃湿热灭菌30分钟后取出,冷却后备用,静脉注射,依法测定(中华人民共和国药典2000年版二部附录ⅪC),应符合规定。
[贮藏]固体瓶的内包装用符合药用要求的聚乙烯塑料袋密封,保存于干燥、清洁处。
附件:
检验规则外观、密封性、振荡试验、水蒸气渗透、微生物限度检验按批检查计数抽样程序及抽样表(GB/T2828—87)规定进行,检验项目、合格
质量水平(AQL)及检查水平见表2
表2检验项目、检验水平及合格质量水平
注:
1、带*的项目半年内至少检验一次。
2、与瓶身配套的瓶盖可根据需要选择不同的材料,按标准中的溶出物试验、异常毒性项目进行试验,应符合有关项下的规定。