水环境化学复习资料-终极版.doc
- 格式:doc
- 大小:176.65 KB
- 文档页数:11

水环境化学复习重点绪论水体(水质系):水以及水中悬浮物、溶解性物质、水生生物、底泥在内的一个完整的综合体系。
水质:指水及其中所存在的各类物质(包括物理、化学物质及生物)所共同表现出来的综合特性(物理、化学和生物学)。
水环境化学:主要研究水中的化学物质,包括各种污染物在水体中的环境行为及化学过程关系等的科学我国水资源现状:•循环利用率比发达国家低50%•人均水资源≈美国同比的1/4•我国大中等城市2/3缺水•100多座城巿废水排放超标82%•75%的湖泊富营养化•我国东部、南部地区水资源相对比较丰富,而西部、北部地区水资源比较缺乏•缺水:水量、分布不均、水质型(污染)水环境与水产养殖的关系:水产养殖讲授天然水中存在的物质的种类、形态、迁移转化的规律。
掌握这些规律,可以指导我们进行养殖水质的调控,帮助我们进行有关水域生态学的研究。
一个地区水产养殖业的发展,不能超越水域环境的自净能力,过度的发展,养殖废水无任何处理地向自然水体、包括海域排放,将加速水域富营养化,恶化水质,引起疾病传播。
水产养殖的稳产高产离不开养殖水环境的调控。
水质的好坏直接影响到水产平的质量与产量。
如:①盲目施用氮肥造成氨中毒,使全池种鱼死亡。
②杀灭浮游动物引起气泡病,造成夏花鱼苗大量死亡。
③水质变坏后盲目大量投放鱼种造成损失。
第一章天然水中主要离子:4种阳离子(Ca2+,Mg2+,Na+,K+)和4种阴离子(HCO3^2-,CO3^2-,SO4^2-,Cl-)☆含盐量:指天然水中含有可溶性无机盐为主的物质总量,以∑S表示,是判定天然水性质的依据。
(是天然水的一项重要水质指标,反映天然水含盐量的参数通常有离子总量(ST)、矿化度(TDS)、盐度(S%0)和氯度(Cl%0)。
)☆盐度:当海水中的碘和溴被相当量的氯所取代、碳酸盐全部变为氧化物、有机物完全氧化时,海水中所含全部固体物的质量与海水质量之比,以10^-3或%0为单位,用符号S%0表示。

养殖水环境化学复习资料养殖13级第一章天然水的主要理化性质1、名词解释(1)海水常量成分恒定性原理:海水的总含盐量或盐度是可变的,但常量成分浓度之间的比值几乎保持恒定。
“海水常量成分恒定性原理"又称为“主要成分恒比关系原理”、“海水组成的恒定性原理”、“Marcet原理”和“Dittmar定律”。
(2)离子总量:离子总量是指天然水中各种离子的含量之和。
单位: mg/L 、mmol/L或g/kg、mmol/kg。
(3)矿化度:用蒸干称重法得到的无机矿物成分的总量,标准温度:105~110℃,反映淡水水体含盐量的多少。
(4)天然水的依数性:指稀溶液蒸气压下降(Δp),沸点上升(Δt b),冰点下降(Δt f)值都与溶液中溶质的质量摩尔浓度(b)成正比,而与溶质的本性无关。
(5)电导率:为在相距1m(或1cm),面积为1m2(或1cm2)的两平行电极之间充满电解质溶液时两电极间具有的电导。
测定的标准温度为25℃。
(6)补偿深度:有机物的分解速率等于合成速率的水层深度称为补偿深度.(7)离子强度:是指电解质溶液中参与电化学反应的离子的有效浓度。
离子活度(a)和浓度(c)之间存在定量的关系,其表达式为:a=γc·c。
(8)离子活度:衡量溶液中存在离子所产生的电场强度的量度。
溶液中离子的浓度越大,离子所带的电荷数越多,粒子与它的离子氛之间的作用越强,离子强度越大。
(9)水体自净:在自然条件下,一方面由于生物代谢废物等异物的侵入、积累导致水体经常遭受污染;另一方面,水体的物理、化学及生物作用,又可将这些有害异物分解转化,降低以至消除其毒性,使受到污染的水体恢复正常机能,这一过程称为水体的“自净作用”。
2、天然水中的常量元素。
海水与淡水中都有的常量元素:阳离子:K+、Na+、Ca2+、Mg2+阴离子:HCO—、SO42-、Cl—淡水中有CO32-,海水中有H4BO4-、Br、Sr。
3、哪些参数能反映天然水的含盐量?相互间的关系?§常用的有离子总量、矿化度、氯度还有盐度。

水是人类宝贵的自然资源,它关系到人类的命运、民族的身体素质。
水质的优劣影响着人类的生活、生产及健康。
可以说水是―万物之本‖,是人类与生物赖以生存和发展必不可缺少的物质。
地球上水的总量是固定的,约13.6亿km3,但可供人类利用的淡水只占水总量的0.26%。
虽然淡水资源有限,但如果时空分布得当,并保持恰当水质,还是可以满足全球目前和将来的淡水需要。
遗憾的是,地球上淡水资源的时空分布极其不均匀,加上水污染日益严重以及工农业和生活用水量的增加,许多国家和地区出现了水资源严重短缺的局面。
水的短缺和污染不仅影响了生物生存,而且直接或间接地给人类生存带来威胁和危害,同时也造成重大的经济损失。
水环境化学是研究化学物质在天然水体中的存在形态、反应机制、迁移转化、归趋的规律与化学行为及其对生态环境的影响。
它是环境化学的重要组成部分,这些研究将为水污染控制和水资源的保护提供科学依据。
第一节水环境化学基础一、天然水的基本特性1、天然水的组成天然水中一般含有可溶性物质和悬浮物质(悬浮物、颗粒物、水生生物等)或胶体物质。
可溶性物质的成分十分复杂,主要是在岩石的风化过程中,经水溶解迁移的地壳矿物质。
(1)天然水的主要离子组成:K+, Na+, Ca2+ , Mg2+, HCO3-, NO3-, Cl-, SO42-为天然水中常见的八大离子,占天然水离子总量的95~99%。
天然水中常见主要离子总量可以粗略地多为水的总含盐量(TDS)TDS=[Ca2+ + Mg2+ + Na+ + K+] + [HCO3-+ SO42- + Cl- + NO3-][2Ca2+ + 2Mg2+ + Na+ + K+] = [HCO3-+ 2SO42- + Cl- + NO3-]此原则可以核对水质分析结果的合理性河水中阴、阳离子的平均含量顺序:[ Ca2+]>[Na+]>[Mg2+] >[K+][HCO3-]>[SO42-]>[Cl-] >[NO3-]海水中主要成分含量:[Na+]>[Mg2+] > [ Ca2+]>[[K+][Cl-] >[SO42-]> [HCO3-] >[NO3-](2)水中的金属离子水中金属离子常常以多种形态存在。


可编辑修改精选全文完整版水环境化学讲义水圈包括海洋水、大气水、陆地水。
陆地水包括:地下水:潜水,承压水,冻土水,岩石、土壤分子水。
地表水:冰帽水、径流水、湖泊水、沼泽水。
生物水。
从分子与溶液的角度看水与天然水作为分子的水的组成、结构、特性:易作溶剂:氢键、异性相吸、六边形、较大分子间隙。
作为溶液的天然水的物理化学性质粘度:流体运动过程中,分子之间形成的剪切应力的物理量,水的粘度相对较大且随温度升高而急剧减少。
离子活度(ɑ)及离子强度(L)离子活度系数:反映溶液体系中某离子表现活性的物理量。
当量数:相当于1摩尔氢离子所含电子量的物理化学量。
当量浓度:1L溶液中所有某种物质的当量数的量。
当量=【M Zi】/|Zi| ,摩尔浓度【M Zi】=|Zi|*当量。
一切化学反应都是当量平衡。
离子缔合体。
范德华力包括静电力、诱导力、色散力。
溶液体系中因分子与分子间碰撞作用形成的离子束称为离子缔合体。
第二章天然水化学成分最早形成于大气层(凝结核),成分的直接影响因素包括生物、土壤、岩石。
生物是最大来源;成分的间接影响因素包括气候、地貌(接触时间)、水文要素(容量、流速等)天然水主要离子化学水化学反应回顾:(1)中和反应(2)沉淀-溶解反应:CaCO3<==>Ca2++CO32-(3)氧化还原反应(4)水解反应Fe3++3OH-<==>Fe(OH)3↓Fe(OH)3+3OH-<==>Fe(OH)63-未脱水而先形成配位体(配位反应特例)(5)配位反应Fe3++CN-<==>Fe(CN)63-氰化物处理(6)置换反应(7)吸附-解吸反应:2Na++Mg(胶体)2+<==>(Na胶体Na)2++Mg2+ 2Na++Cd(胶体)2+<==>(Na胶体Na)2++Cd2+骨痛病(8)缔和反应:在离子强度很高的条件下发生。
AgCl+Cl -<==>AgCl2-标准海水矿化度35.5g/L ,碱金属一般不发生配位反应。

第三章水环境化学1、水中八大离子:K+、Na+、Ca2+、Mg2+、HCO3-、NO3-、Cl-和SO42-为常见八种离子2、溶解气体与Henry定律:溶解于水中的气体与大气中的气体存在平衡关系,气体的大气分压P G与气体的溶解度的比表现为常数关系,称为Henry定律,该常数称为Henry定律常数K H。
[G(aq)] = K H PG K H-气体在一定温度下的亨利定理常数 (mol/L.Pa) PG -各种气体的分压 (Pa)3、水体中可能存在的碳酸组分 CO2、CO32-、HCO3-、H2CO3 ( H2CO3*)4、天然水中的碱度和酸度:碱度:水中能与强酸发生中和作用的全部物质,即能够接受质子H+的物质总量;酸度:凡在水中离解或水解后生成可与强碱(OH-)反应的物质(包括强酸、弱酸和强酸弱碱盐)总量;即水中能与强碱发生中和作用的物质总量。
5、天然水中的总碱度=HCO3-+2CO32-+ OH- —H+6、水体中颗粒物的类别(1)矿物微粒和粘土矿物(铝或镁的硅酸盐)(2)金属水合氧化物(铝、铁、锰、硅等金属)(3)腐殖质 (4)水体悬浮沉积物 (5)其他(藻类、细菌、病毒等)影响水体中颗粒物吸附作用的因素有:颗粒物浓度、温度、PH。
7、水环境中胶体颗粒物的吸附作用有表面吸附、化学吸附、离子交换吸附和专属吸附。
8、天然水的PE随水中溶解氧的减少而降低,因而表层水呈氧化性环境。
9、吸附等温线:在一定温度,处于平衡状态时被吸附的物质和该物质在溶液中的浓度的关系曲线称为吸附等温线;水环境中常见的吸附等温线主要有L-型、F-型和H-型。
10、无机物在水中的迁移转化过程:分配作用、挥发作用、水解作用、光解作用、生物富集、生物降解作用。
11、PE:pE 越小,电子活度越高,提供电子的倾向越强,水体呈还原性。
pE 越大,电子活度越低,接受电子的倾向越强,水体呈氧化性。
pe影响因素:1)天然水的pE随水中溶解氧的减少而降低;2)天然水的pE随其pH减少而增大。


养殖水环境化学复习要点精选文档TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-水环境化学复习要点水环境化学复习要点:名词解释:3×4=12分填空:1×10=10分判断1×20(或24)简答:30分(6道);或26分(5道)计算:8分论述:20分(2道)一、名词1 水质:指水及其中所存在的各类物质所共同表现出来的综合性特征。
2 水体自净:污染物进入天然水体后,通过一系列物理、化学、生物因素的共同作用,使污染物总量减少或浓度下降,受污水体部分或者全部恢复原状的现象。
3 水体污染:由于人类活动或自然过程中将过量的污染物质引入了水体而超过其自净能力导致水质恶化进而影响水体用途的现象。
4水生态系统:各种局部的环境条件以及由其提供的环境因素,同存在于其中的多种水生生物群落组成的严密的统一体。
5 盐度:1kg海水中的Br-和I-含量全部被等当量的Cl-置换,且所有的碳酸盐都转化为氧化物,所有的有机物均已被氧化之后的全部固体物质的总重。
6 酸度:指水体中所含有能与强碱发生中和作用的物质的总量,亦即能释放处质子H+或经过水解能产生H+的物质总量。
7 碱度:指水中所含有的能与强酸发生中和反应的全部物质,即能接受质子H+的物质总量。
8 饱和量:在一定的溶解条件下气体达到溶解平衡以后,1L水中所含该气体的量。
9 饱和度:溶解氧的实际含量(C)与其具有相同温度和盐度条件下的饱和量(CS)之比。
10 絮凝作用:由于某些作用,使胶粒的动电位降到临界值以下(25-30MV)时,胶粒间的电斥力太弱,无法阻止相互的碰撞,导致胶粒相互聚集沉淀的过程。
11 水化学:专门研究各类天然水体化学组成、分析方法以及水体中各类物质的来源、存在形式、迁移转化过程和分布变化规律的一门学科,是环境化学的分支学科。
12 矿化度:是指以一定量过滤水样在105-112℃蒸干称重测定其可溶性固体物质的量,包括水中溶解的非挥发性的有机物。
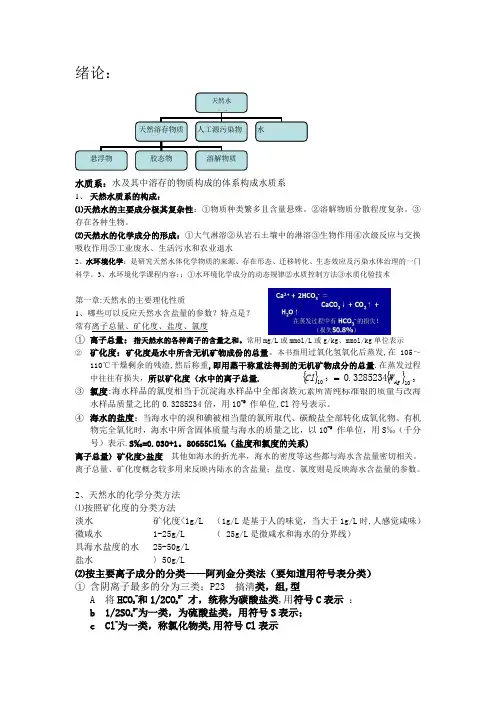
绪论:水质系:水及其中溶存的物质构成的体系构成水质系1、 天然水质系的构成:⑴天然水的主要成分极其复杂性:①物质种类繁多且含量悬殊。
②溶解物质分散程度复杂。
③存在各种生物。
⑵天然水的化学成分的形成:①大气淋溶②从岩石土壤中的淋溶③生物作用④次级反应与交换吸收作用⑤工业废水、生活污水和农业退水2、水环境化学:是研究天然水体化学物质的来源、存在形态、迁移转化、生态效应及污染水体治理的一门科学。
3、水环境化学课程内容::①水环境化学成分的动态规律②水质控制方法③水质化验技术第一章:天然水的主要理化性质1、哪些可以反应天然水含盐量的参数?特点是? 常有离子总量、矿化度、盐度、氯度① 离子总量:指天然水的各种离子的含量之和。
常用mg/L 或mmol/L 或g/kg 、mmol/kg 单位表示②矿化度:矿化度是水中所含无机矿物成份的总量。
本书指用过氧化氢氧化后蒸发,在105~110℃干燥剩余的残渣,然后称重,即用蒸干称重法得到的无机矿物成分的总量.在蒸发过程中往往有损失,所以矿化度〈水中的离子总量.③ 氯度:海水样品的氯度相当于沉淀海水样品中全部卤族元素所需纯标准银的质量与改海水样品质量之比的0.3285234倍,用10-3作单位,Cl 符号表示。
④ 海水的盐度:当海水中的溴和碘被相当量的氯所取代、碳酸盐全部转化成氧化物、有机物完全氧化时,海水中所含固体质量与海水的质量之比,以10-3作单位,用S ‰(千分号)表示.S ‰=0.030+1。
80655Cl ‰(盐度和氯度的关系)离子总量〉矿化度>盐度 其他如海水的折光率,海水的密度等这些都与海水含盐量密切相关。
离子总量、矿化度概念较多用来反映内陆水的含盐量;盐度、氯度则是反映海水含盐量的参数。
2、天然水的化学分类方法 ⑴按照矿化度的分类方法淡水 矿化度<1g/L (1g/L 是基于人的味觉,当大于1g/L 时,人感觉咸味) 微咸水 1-25g/L ( 25g/L 是微咸水和海水的分界线) 具海水盐度的水 25-50g/L 盐水 〉50g/L⑵按主要离子成分的分类——阿列金分类法(要知道用符号表分类) ① 含阴离子最多的分为三类:P23 搞清类,组,型A 将HCO 3-和1/2CO 32- 才,统称为碳酸盐类,用符号C 表示 : b 1/2SO 42-为一类,为硫酸盐类,用符号S 表示; c Cl -为一类,称氯化物类,用符号Cl 表示天然水 质系天然溶存物质 人工源污染物 水悬浮物胶态物溶解物质{}{}3310103285234.0--=Ag W Cl②含阳离子最多分为三组:Ca-钙组、Mg-镁组、Na,K-钠组③阴阳离子比例分为四个型:每组仅有三个型的水存在.一单位电荷为基本单元④> 在每一组内一般只能有其中3个型的水存在。


水环境化学复习题(课程代码322073)一、填空题1、天然淡水中含有的主要阳离子有、、、。
2、某水中的优势阴离子为SO42- ,优势阳离子为Ca2+,不含CO32-或HCO3-离子,该类型水用符号表示为。
3、按照阿列金分类法,海水一般是型水,淡水一般是型水。
4、海水盐度为时,最大密度时的温度等于冰点温度。
5、天然水的盐度增大会使蒸汽压,渗透压。
6、在陆地水水质调查中,K+与Na+含量的测定方法是计算阴离子量与总量之差。
7、海水总碱度可简化为 ALK= 。
8、水中氧气的来源主要是水生植物,水中氧气的消耗主要是。
9、贫营养型湖泊,夏季形成温跃层,上层水温高、氧气溶解度,下层水温低、氧气溶解度。
10、淡水中,pH = 时,HCO3-最多; pH >10.4时,占优势。
随着海水氯度和温度增大,二氧化碳系统各分量与pH的关系曲线向移动。
11、水的溶氧升高,硫化氢的毒性;pH升高,硫化氢的毒性。
12、水中加入1mol/L的碳酸钠后,水体的碳酸总量增大 mol/L,碱度增大 mol/L。
13、若米氏常数KM平均为1 umol/L ,则有效磷浓度应不低于 umol/L 的范围。
14、一般情况下,若天然水或养殖用水中的氧化还原电位为 V左右时,可认为该水体处于良好的氧化状态。
15、淡水中的主要阴离子成分有、。
16、某水中的优势阴离子为Cl -,优势阳离子为Mg2+[CO32- ]=0,[HCO3-]=0,该类型水用符号表示为。
17、海水盐度为24.7‰时,最大密度时的温度冰点温度。
18、海水的盐度原来是用氯度来表示,现在不用氯度的原因是现在用来测盐度。
19、天然水的依数性表现在、、。
20、在天然水正常pH条件下,淡水的总碱度可简化为ALK = 。
21、晴天时,养殖池水白天的硬度比夜晚的硬度。
22、水中溶氧的主要来源有:大气中、、。
23、海水溶氧最小层通常出现在,再往深处,溶氧浓度又开始回升, 其回升原因是。
水环境化学考试复习题一、名词解释:1、水环境化学:研究各类天然水体化学组成.分析方法以及水体中各类物质来源.存在形式.迁移转化过程和分布变化规律的一门学科,是环境科学的分枝学科.2、水质:水的性质,它是水中各种成分的组成和含量不同而导致水的感官性状(色嗅味浑浊)物理化学性质(温度电导率放射性等)化学成分微型生物组成的综合特性.3、透明度:是太阳光能进入水体内大小的一种量度,也是反应水体肥力的指标,由水体含颗粒物质及色度决定。
4、补偿点:植物的呼吸作用等于光合作用时的光照强度叫该种植物的补偿点,即植物能维持生命的光照强度。
5、温跃层:水体上层有一水温变化不大的较高温水层,水体下层有一水温变化不大的较低温水层,两水层之间有一温度随深度增加而迅速降低的水层即为温跃层.6、海水常量成分恒定性:海水的总含盐量或盐度是可变的,但常量成分浓度之间的比值几乎保持恒定。
“海水常量成分恒定性原理”又称为“主要成分恒比关系原理”、“海水组成的恒定性原理”、“Marcet原理”和“Dittmar定律”。
7、双膜理论:在气、液界面两侧,分别存在相对稳定的气膜和液膜;即使气相、液相呈湍流状态,这两层膜内仍保持层流状态。
无论如何扰动气体或液体,都不能将这两层膜消除,只能改变膜的厚度。
8、水呼吸:即水中微型生物耗氧,主要包括:浮游动物、浮游植物、细菌呼吸耗氧以及有机物在细菌参与下的分解耗氧。
9、氨化作用:指含氮有机物在微生物的参与下降解产生氨的过程。
含氮有机物需氧生物NH++CO2+SO42-+H2O含氮有机物厌氧生物 NH++CO2+SO42-+胺类有机酸类10、硝化作用首先氨在亚硝化细菌的作用下氧化为亚硝酸盐;接着在硝化菌的作用下继续氧化成硝酸盐。
硝化作用的反应过程如下:2 NH++ 3O2 4H++2NO2-+2 H2O+能量2NO2-+O2 2NO3-+能量11、奢侈吸收:藻类处于缺乏营养元素的环境下,一旦接触含量高的有效形式的营养元素,其吸收利用速度极快,并能过量的吸收营养元素存储于细胞中.12、半致死浓度(LC50):指在一定时间内能引起试验生物群体中50%生物个体死亡的水中化合物的最低浓度。
第一章天然水的主要理化性质1.★★★盐度方法的测定:(1)电导盐度计直接测定(2)光学折射盐度计直接测定(3)化学法测定(4)海水密度计或比重计测定2.盐度:盐度是反映含盐量的指标。
3.天然水的密度是温度、含盐量、盐分组成、压力的函数。
★4.从图中可以看出(1)S=24.95时,T冰= T最密= -1.35℃(2)随着盐度的逐渐增加,最大密度下的温度逐渐降低(3)S<24.95时,T最密> T冰(4)S>24.95时,T最密< T冰★★★5.阿列金分类法:(1)阴离子:碳酸盐类、硫酸盐类、氯化物类(2)阳离子:钙、镁、钠(3)比例:(碳酸盐类没有Ⅳ型)★6.天然水的依数性:指稀溶液蒸汽压下降、沸点上升、冰点下降值都与溶液中溶质的质量摩尔浓度成正比,而与溶质的本质无关。
7.电导G:电阻R的倒数,等于电流I与电压U的比。
G= 1/R : 1/U8.电导率κ:是电阻率(ρ)的倒数,是单位面积截面(A)、单位长度(L)的导体所具有的电导。
κ= 1/ρ = G · L/A9.湖泊(水库)四季的典型温度分布:(1)冬季逆分层期(2)夏季正分层期(停滞期)★★★温跃层:造成上层有一水温垂直变化不大的较高温水层,下层也有一层水温垂直变化不大的较低温水层,两层中间夹有一温度随深度增加而迅速降低的水层,称为温跃层,也叫间温层。
(3)春季全同温期(4)秋季全同温期水俣病(Hg);痛风病(Cr)第二章天然水的主要离子1.硬度:指水中二价及多价金属离子含量的总和。
(单位:mmol/L)2.淡水:Ca2+ >Mg2+海水:Mg2+>Ca2+3.暂时硬度:在水加热煮沸后,绝大部分可以生成CaCO3沉淀而除去。
★永久硬度:一般用煮沸的方法不能将CaCO3等沉淀从水中除去。
★4.碱度:指水中所存在的能与酸起中和作用的物质的总量。
(单位:mmol/L)5.淡水:HCO3->SO42->Cl-海水:Cl->SO42->HCO3-6.硫在水中的转化:(1)蛋白质分解作用(2)氧化作用(3)还原作用(反硫化作用):①缺溶解氧②含有丰富的有机物③有微生物的参与④硫酸根离子的含量(4)沉淀与吸附作用(Fe2+、Fe3+可限制水中H2S含量,降低硫化物的毒性)第三章溶解气体(★计算题p68-71五道题必出一道)★1.溶解度:在一定条件下,某气体在水中的溶解达到平衡以后,一定量的水中溶解气体的量,称为该气体在所指定条件下的溶解度。
养殖水环境化学综合复习资料绪论1、水质系:水及其中溶存的物质构成的体系。
2、天然水:①把天然水理解为自然界没有经受人为污染的水;②指海洋、江河、湖泊(水库)、沼泽、冰雪等地表水与地下水,也就是指自然水体中的水。
3、天然水质系=天然溶存物质(悬浮物质+胶态物质+溶解物质)+人工源污染物质+水4、水环境化学:指研究天然水中存在的物质的种类、形态、迁移转化等规律的学科。
5、养殖水环境化学:指研究水体中各种化学成分的来源、存在形式、转化、迁移及化学特性与养殖生产的关系的一门学科。
(水环境化学成分的动态规律+水质控制方法+水质化验技术)6、典型案例:①盲目施用氮肥造成氨中毒,使全池种鱼死亡;原因:氨态氮肥过剩与浮游植物发展过快,造成氨态氮在高pH条件下的毒性使鱼致死。
②杀灭浮游动物引起气泡病,造成夏花鱼苗的大批死亡;原因:浮游动物杀灭太彻底,浮游植物发展太快,造成溶氧极度过饱和,引起气泡病。
③水质变坏后盲目大量投放鱼种造成损失。
第一章天然水的主要理化性质第一节盐度、密度和化学分类1、含盐量①含盐量的参数:离子总量(各种离子含量之和,mg/L等表示)、矿化度、海水的氯度、海水的盐度。
②含盐量对水产养殖的影响:a水生生物对水的含盐量有一定的适应范围,不同种类生物的适应范围不同。
b水中一定的含盐量是保持生物体液一定渗透压的需要,超过了生物渗透压调节的能力,生物就会“渴死”或“胀死”。
c淡水鱼类只能生活在含适量盐分的水中,不同鱼类或同一种鱼类的不同生长阶段所能适应的含盐量的范围是不同的,即耐盐限度不同。
值得注意的是鱼类的耐盐限度与盐分的组成有关。
d海水鱼在盐度过低的水中会死亡,但依然存在一些广盐性鱼类,能够在较大盐度范围内生存。
2、密度①纯水的密度:纯水的密度是温度和压力的函数,纯水在4℃(严格为3.98℃)时密度最大。
天然水的密度是温度、含盐量、盐分组成、压力的函数。
对于淡水可以近似比照纯水的参数看待,以4℃密度最大。
第一章、天然水的理化性质1、离子总量:天然水中各离子总量之和,常用S T表示,单位为mg/L或mmol/L。
4种阳离子(钙离子、镁离子、钠离子、钾离子)4种阴离子(碳酸氢根、碳酸根、硫酸根、氯)2、矿化度:以一定量过滤水样在105-110℃烘干称重的方法测定其可溶性总固体物质的量 ,包括水中溶解的非挥发性有机物3、氯度:沉淀0.3285234Kg海水中全部卤素离子所需纯标准银的克数 ,在数值上即为海水的氯度 ,用符号Cl表示 ,单位为1×10-34、盐度:当海水中的溴和碘被相当量的氯所取代、碳酸盐全部变为氧化物、有机物完全氧化时,海水中所含全部固体物的质量与海水质量之比3、天然水的依数性:稀溶液蒸气压下降、沸点上升、冰点下降值都与溶液中溶质的质量摩尔浓度成正比,而与溶质的本性无关。
4、透明度:光线进入水中的程度,适宜透明度为20~40cm5、真光层:光照充足,光合作用速率大于呼吸作用速率的水层6、营养生成层;植物光合作用合成的有机物多于呼吸作用消耗的有机物,有机物的净合成大于零的水层。
光照不足,光合作用速率小于呼吸作用速率的水层为营养分解层。
7、补偿深度:有机物的分解速率等于合成速率的水层深度,大约为透明度的2~2.5倍8、离子活度:离子的有效浓度。
9、水体流转混合的两个因素:风力引起的涡动混合,密度差引起的对流混合10、温跃层:水温在垂直方向出现急剧变化的水层。
北方鱼类在室外越冬时,要注意防风处理,避免池水对流使池底水温变化,影响鱼类生长,室外海水越冬池底保温关键:添加低盐度的海水或者淡水。
常量>50mmol/L 50umol/L<微量<50mmol/L 恒量<50umol/L通过水面进入水中的太阳辐射,一部分被水中的溶存物质吸收,一部分被散射,一部分继续向深处穿透。
几种淡水鱼耐盐能力:草鱼>团头鲂>鲢鱼盐度与温度的线性关系,在(24.9 -1.35)处达到最大的密度11、水体的温度分布规律一、湖泊(水库)四季典型温度分布(1)冬季的逆分层期水温随着深度的增加而缓慢升高,到底层水温可以达到或小于密度最大时的温度(2)春季全同温期水温在密度最大的温度以下时,温度的升高会使密度增大,表面温度较高的水就会下沉,下面较低的水就会上升,形成密度流。
密度流使上下水对流交换,直到上下水温都是密度最大时的温度为止。
(3)夏季正分层期(停滞期)出现温跃层,上下水体无法相互混合,上层水温较高,下层水温较低(4)秋季的全同温期气温转凉,温度低于水温,表层水温要下降,密度增大,表层以下水温较高,密度较小,此时发生密度环流二、越冬池的水温平均值的变化反映了温度变化趋势——整个越冬期底层水温先下降后回升,这与气温的变化有关。
修建室外越冬池时要注意防风处理。
12、天然水中化学成分的形成:大气淋溶、从岩石土壤中淋溶、生物作用、次级反应与交换吸收作用、工业废水、生活污水与农业退水环境化学:研究有害化学物质在环境介质中的来源、存在形态、化学特性、行为和效应、控制和治理的化学原理和方法的科学。
天然水质系的复杂性:1、水中含有的物质种类繁多,含量相差悬殊2、水中溶存物质的分散程度复杂3、存在各种生物第二章、天然水的主要离子1、硬度;水中二价及多价金属离子含量的总和,单位是mmol/L。
按阳离子种类可分为钙硬度和镁硬度。
按阴离子可分为永久硬度和暂时硬度;碳酸盐硬度是指水中与碳酸氢根、碳酸根所对应的硬度。
这种硬度在在水加热煮沸后 ,绝大部分以碳酸钙沉淀而除去 ,故又称“暂时硬度”。
非碳酸盐的硬度是对应于硫酸盐和氯化物的硬度 ,即由Ca2+、Mg2+构成的硫酸盐和氯化物的硬度 ,它虽经煮沸但仍不能除去 ,故又名“永久硬度”。
常用单位有三种:(a)mmol/L:以1L水中各种形成硬度的离子总量表示。
(b)德国度(o H G):每升水含10mg氧化钙为1 o H G。
(c)毫克CaCO3/升:用每升水所含形成硬度的离子所相当的碳酸钙的毫克数。
上述三种单位的换算:1mmol/L=2.804 o H G=50.05mgCaCO3/L2、碱度:指水中所含的能与强酸发生中和作用的全部物质的总量 ,亦即能接受质子H+的物质总量。
新开挖的水池养鱼时,需要经常换水,以调节降低水中的硬度,防止鱼类死亡3、钙、镁离子在水产养殖中的意义(1)钙、镁是生物生命过程所必须的营养元素,它们不仅是生物体液及骨骼的组成成分。
还参与体液新陈代谢的调节。
(2)钙离子可以降低重金属离子和一价金属离子的毒性。
(3)钙、镁离子可以增加水的缓冲性,即具有很好的保持PH的能力。
(4)水中钙镁离子比例,对鱼、虾、贝的存活有重要影响。
4、碱度与水产养殖的关系(1)降低重金属的毒性(2)调节二氧化碳的产耗关系、稳定水的PH(3)碱度过高对养殖生物的毒害作用(适宜1~3mmol/L,最大临界值10mmol/L)5、硫在水中的转化1、蛋白质的分解作用2、氧化作用3、还原作用硫酸盐还原条件:缺乏溶氧、含有丰富的有机物、有微生物参与、硫酸根离子的含量4、沉淀与吸附作用水质恶化时,有硫化氢时,可以泼洒含铁药剂起到解毒的作用5、同化作用6、为什么天然水中的钾离子含量远比钠离子低?1、钾离子比较容易被土壤胶粒吸附,移动性不如钠离子;2、钾离子被植物的吸收利用第三章、溶解气体1、影响气体在水中溶解度的因素(除了气体本身的性质以外)(1)温度在较低温条件下的温度变化对气体的溶解度影响显著,且气体溶解度随温度的升高而降低。
(2)含盐量当温度、压力一定时,水中含盐量增加,气体在水中的溶解度降低。
在相同温度和分压力下,气体在海水中的溶解度比在淡水中小得多。
氧气在大洋海水中溶解度大约是在淡水中的80~82%。
淡水来说含盐的变化幅度很小,对气体在水中的溶解度影响不大,一般不考虑含盐量的影响,而近似地釆用在纯水中的溶解度值。
(3)气体的分压力在温度与含盐量一定时,气体在水中的溶解度随气体分压的增加而增加-享利定律c= K H ×P道尔顿分压定律由几种气体组成的混合气体中组分B的分压力PB等于混合气体的总压力PT乘以气体B 的分压系数φB。
P B=P T×φB2、气体溶解速率中得双模理论(1)靠湍流从气体主体内部到达气膜;(2)靠扩散穿过气膜到达气—液界面 ,并溶于液相;(3)靠扩散穿过液膜;(4)靠湍流离开液膜进入液相内部。
当气体分子在气相主体与液相主体中迁移时 ,靠的是湍流 ,运动速度快 ,混合均匀 ,可认为在气相主体与液相主体中都不存在浓度梯度。
而气膜和液膜内只存在层流 ,气体分子只能靠扩散通过假定气体到达界面后瞬间即能达到溶解平衡 ,并符合亨利定律关系。
3、池塘水体溶解氧的来源与消耗水中氧气的来源:空气的溶解、水生植物光合作用、补水水中氧气的消耗:①鱼、虾等养殖生物呼吸②水中微型生物耗氧-“水”呼吸(浮游动物、浮游植物、细菌呼吸)③底质的耗氧-“泥”呼吸④逸出。
4、溶解氧的变化特点(1)与大洋海水存在一定的差异(2)更多的是受温度、盐度、压力、水生生物生命活动过程(光合作用、呼吸作用)、有机质的分解、光照等的影响,且影响较大,使水体溶解氧呈昼夜变化5、溶解速度及其影响因素水的单位体积表面积扰动状况气体的不饱和度6、池塘水体溶解氧的变化规律溶解氧的垂直变化白天:随着温度的升高和光照强度的增大,表层水体浮游植物的光合作用增强,水体溶解氧的含量逐渐增大,至下午15: 00-16: 00时表层水体溶解氧含量达最大值;而下层水体由于光照强度较弱,水中溶解氧的含量低于表层水中溶解氧的含量。
夜间:上层水温随气温的下降而下降,密度变大,形成密度流,下层水中的溶解氧得到补充,而上层水中溶解氧逐渐下降,至清晨04:00-05:00左右,上层水中溶解氧降到最低值。
此时,上下水层溶解氧差基本消失,整个池水溶解氧条件最差,鱼虾的浮头多出现在这个时刻。
溶解氧水平分布的特征:不均一性白天:下风处浮游植物产氧量和从空气中溶入的氧量比上风处多。
夜间:溶解氧水平分布与白天相反,上风处溶解氧大于下风处,这与集中在下风处的浮游生物和有机物较多,夜间耗氧量大有关。
风力越大,上下风处的溶解氧含量差别就越大。
影响水平分布的因素:风力、风向及生物。
7、改善水体溶解氧状况的措施降低水体耗氧速率及数量清淤合理施肥投饵明矾、黄泥浆凝聚沉淀水中有机物微生态制剂使用加强增氧作用,提高水中溶氧浓度生物增氧—保持水体具有适宜的浮游植物生物量人工增氧—机械增氧和化学增氧(过氧化钙、活性沸石、过氧化氢(H2O2))1、有一养鱼池,面积为1.00 hm2 ,水深平均为1.5m。
池水pH=9.5 ,A T=2.00mmol/L ,现拟用浓度为12mol/L的浓盐酸将池水pH中和到9.0 ,问需用多少升的浓盐酸?(pH = 9.0时α = 0.959;pH = 9.5时α = 0.886)(5分)解:水量V =1.00×104m2×1.5m=1.5×104m3,(1分)C T= α A T; (1分)A T’= C T/ α’= A Tα / α’ =2 mmol/L×0.886/0.959= 1.85 mmol/L (1分)ΔA T = A T - A T’ = ( 2.00 – 1.85 ) mmol/L = 0.15 mmol/L (1分)V HCl=ΔA T×V / C HCl = 0.15mmol/m3×1.5×104m3 / 12 mol/L = 188 L (1分)需要浓盐酸188 L2、某对虾池水的Cl‰ = 19.00 ,pH = 9.00 ,总铵氮NH3-N t =1.60mmol/L ,γH+= 0.693 ,K a'= 4.47×10-10 ,求该对虾池中分子态氨氮UIA为多少mmol/L?分子态氨氮在总氨氮中所占的比例UIA%为多少?(5分)解:C NH3 =a NH3 C T = K a'/(a H+/γH+ + K a') C T = 0.378mmol/L (3分)UIA% =0.378/1.60×100% = 23.6% (2分)第四章天然水的PH和酸碱平衡酸度 :指每升水中所含能与强碱发生中和作用的物质总量略去水体中含量极少的H2PO4-、HPO42-和有机酸根据测定时使用的指示剂不同,分为总碱度(用酚酞作指示剂,PH8.3)和无机酸(又称强酸酸度,用甲基橙作指示剂,pH 3.7)天然水按pH值的不同可以划分为如下五类:强酸性PH<5.0 弱酸性PH5.0~6.5 强碱性PH8.0~10.0 强碱性PH>10.0 中性PH6.5~8.0 大多数天然水为中性到弱碱性 ,pH在6.0-9.0之间。