水环境化学实验
- 格式:ppt
- 大小:609.50 KB
- 文档页数:17

养殖水环境化学水质调查报告一、调查目的(1)综合所学养殖水环境化学理论知识和实验分析技能,完成海水养殖区水质监测与评价。
(2)掌握渔业水域水质调查的基本程序。
二、调查内容与方法1、调查时间与地点地点:广东海洋大学西湖1号调查点经纬度:110.304512,21.157934时间:2023年12月30日上午9:00~10:002、调查项目与方法1现场测定项目1.1西湖水温测定1.1.1实验目的温度是水样的一个根底性指标,准确测量出水样的温度对养殖水体起着重要的作用。
1.1.2实验原理温度计液泡里的水银对温度变化很敏感,它会随着所接触温度的不同而伸缩。
1.1.3实验仪器和材料仪器:水银温度计、烧杯。
实验材料:西湖采集的水样。
1.1.4测定步骤挑选两个适合取水的位置,用烧杯从西湖内取出适量的水样,将温度计的液泡置于液面以下,待温度计的度数不再变化后,准确读出水样的温度并记录。
1.2西湖pH测定1.2.1实验目的水质中pH值的变化会影响藻类对氧气的摄入能力及动物对食物的摄取敏感度;会影响细胞膜转运物质的活性和速率,影响其正常代谢,进而对整个食物网产生影响。
1.2.2实验原理pH值是一个描述溶液酸碱性质的重要参数,用于评价溶液的酸碱程度,ph值越小,酸性越强;ph值越大,碱性越强;pH值为7时,为中性。
pH计是常用的测量pH值的仪器,它通过电极和在水溶液中的离子的作用产生电机势差,并将其显示为数字。
1.2.3实验仪器与试剂仪器:pH计、电极、烧杯、吸管、小勺。
试剂:氢氧化钠、盐酸、酸碱指示剂。
1.2.4测定步骤(1)测前准备1)将pH计接通电源并调节为标定状态。
2)取容量瓶并用纯净水冲洗干净。
3)用滴定管取一定数量的盐酸溶液并加入到容量瓶中,用同样的方法加入氢氧化钠溶液。
4)使用第三步配置的酸碱溶液,检验pH计是否正常工作。
(2)开始实验1)用烧杯从西湖中取水。
2)把PH计的电极插入容量瓶中的溶液内,并轻轻搅拌10秒。

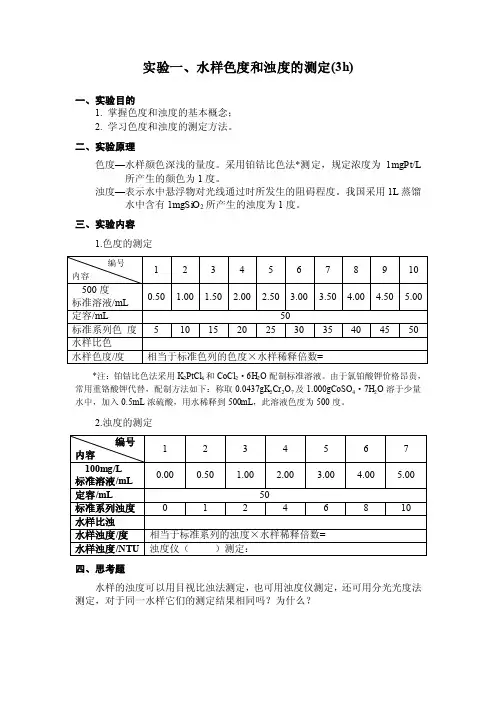
实验一、水样色度和浊度的测定(3h)一、实验目的1. 掌握色度和浊度的基本概念;2. 学习色度和浊度的测定方法。
二、实验原理色度—水样颜色深浅的量度。
采用铂钴比色法*测定,规定浓度为1mgPt/L 所产生的颜色为1度。
浊度—表示水中悬浮物对光线通过时所发生的阻碍程度。
我国采用1L蒸馏水中含有1mgSiO2所产生的浊度为1度。
三、实验内容1.色度的测定编号1 2 3 4 5 6 7 8 9 10 内容500度0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 4.50 5.00 标准溶液/mL定容/mL 50标准系列色度 5 10 15 20 25 30 35 40 45 50 水样比色水样色度/度相当于标准色列的色度×水样稀释倍数=*注:铂钴比色法采用K2PtCl6和CoCl2·6H2O配制标准溶液。
由于氯铂酸钾价格昂贵,常用重铬酸钾代替,配制方法如下:称取0.0437gK2Cr2O7及1.000gCoSO4·7H2O溶于少量水中,加入0.5mL浓硫酸,用水稀释到500mL,此溶液色度为500度。
2.浊度的测定编号1 2 3 4 5 6 7内容100mg/L0.00 0.50 1.00 2.00 3.00 4.00 5.00 标准溶液/mL定容/mL 50标准系列浊度0 1 2 4 6 8 10水样比浊水样浊度/度相当于标准系列的浊度×水样稀释倍数=水样浊度/NTU 浊度仪()测定:四、思考题水样的浊度可以用目视比浊法测定,也可用浊度仪测定,还可用分光光度法测定,对于同一水样它们的测定结果相同吗?为什么?实验二、水样酸度和碱度的测定(3h)一、目的和要求1. 掌握酸度和碱度的基本概念;2. 学习酸度和碱度的测定方法。
二、实验原理酸度—指水中含有能与强碱发生中和作用的物质的总和。
①OH- + H+ = H2O (pHeq=7.0)②OH- + H2CO3 = HCO3- + H2O(pHeq=8.3)③OH-+ HCO3- = CO32- + H2O(pHeq=10.8)(甲基橙为指示剂—无机酸度①;酚酞为指示剂—CO2酸度①②)碱度—指水中含有能与强酸发生中和作用的物质的总和。

水污染综合实验报告一、实验目的本次实验的目的是研究水中有害物质对水质的影响,并通过实验探索水污染的来源、危害以及相应的防治方法。
二、实验材料与仪器1. 水样:我们选择了地下水、河水和污水作为实验水样。
2. 化学物质:实验中所使用的化学物质包括重金属离子、农药和有机溶剂等。
3. 仪器设备:pH计、溶解氧测定仪、紫外可见分光光度计、离子色谱仪等。
三、实验步骤与结果1. pH值对水质的影响我们分别取地下水、河水和污水样品,使用pH计测定各样品的pH 值,并记录结果,如下表所示:样品 pH值地下水河水污水通过对比,我们发现地下水的pH值基本维持在中性范围,河水稍偏碱性,而污水则呈酸性。
这表明污水中可能含有酸性物质,对水质产生不良影响。
2. 溶解氧含量对水质的影响我们利用溶解氧测定仪分别检测了地下水、河水和污水样品中的溶解氧含量,并记录结果,如下表所示:样品溶解氧含量(mg/L)地下水河水污水可以明显发现,地下水和河水中溶解氧含量较高,符合水生态系统的需求,而污水中溶解氧含量明显降低,可能导致水生生物缺氧,造成生态破坏。
3. 有害物质对水质的影响我们选取重金属离子、农药和有机溶剂等有害物质,通过紫外可见分光光度计和离子色谱仪等仪器对水样进行分析。
(1)重金属离子检测我们首先测定了地下水、河水和污水样品中重金属离子的含量,如下表所示:重金属含量(mg/L)地下水河水污水铅(Pb)镉(Cd)汞(Hg)结果显示,河水中重金属离子的含量略高于地下水,而污水中重金属离子含量显著升高,超过了水质标准。
(2)农药检测我们使用离子色谱仪检测了地下水、河水和污水样品中农药残留的种类和含量。
农药种类含量(mg/L)地下水河水污水杀虫剂A除草剂B杀菌剂C实验结果表明,污水中农药残留量显著增加,且污水中检测到的农药种类较多,对水生态环境造成潜在威胁。
(3)有机溶剂检测我们利用紫外可见分光光度计检测了地下水、河水和污水样品中有机溶剂的含量,结果如下表所示:有机溶剂含量(mg/L)地下水河水污水苯甲苯二甲苯结果显示,污水中有机溶剂的含量明显增加,对水体造成严重污染。

实验一水中化学需氧量的测定(4学时)一、实验目的和要求掌握化学需氧量的测定原理及方法。
二、实验原理化学需氧量的测定是在强酸性溶液中,用一定量的重铬酸钾氧化水样中还原性物质,过量的重铬酸钾以试亚铁灵作指示剂,用硫酸亚铁铵溶液回滴。
根据硫酸亚铁铵的用量算出水样中还原性物质消耗氧的量。
酸性重铬酸钾氧化性很强,可氧化大部分有机物,加入硫酸银作催化剂时,直链脂肪族化合物可完全被氧化,而芳香族有机物却不易被氧化,吡啶不被氧化,挥发性直链脂肪族化合物、苯等有机物存在于蒸气相,不能与氧化剂液体接触,氧化不明显。
氯离子能被重铬酸盐氧化,并且能与硫酸银作用产生沉淀,影响测定结果,故在回流前向水样中加入硫酸汞,使成为络合物以消除干扰。
氯离子含量高于1000mg/L的样品,应先做定量稀释,使其含量降低至1000mg/L以下再行测定。
用0.25mol/L的重铬酸钾溶液可测定COD值大于50mg/L 的水样,未经稀释水样的测定上限是700mg/L,用浓度0.025 mol/L的重铬酸钾溶液可测5~50mg/L的COD值,但COD值低于10mg/L时,测量准确度较差。
三、实验内容1. 仪器、试剂主要仪器:(1)回流装置。
带250mL锥形瓶的全玻璃回流装置(如取样量在30mL以上,采用500mL锥形瓶的全玻璃回流装置)。
(2) 加热装置:变阻电炉。
(3) 50mL酸式滴定管。
主要试剂:(1) 重铬酸钾标准溶液(1/6K2CrO7=0.2500mol/L)。
称取预先在120℃烘干2h 的基准或优级纯重铬酸钾12.258g 溶于水中,移入1000mL 容量瓶,稀释至标线,摇匀。
(2) 试亚铁灵指示液。
称取1.458g 邻菲罗啉(C 12H 8N 2·H 2O ,1,10-phenanthroline )0.695g 硫酸亚铁(FeSO 4·7H 2O) 溶于水中,稀释至100mL ,储于棕色瓶内。
(3) 硫酸亚铁铵标准溶液[(NH 4)2Fe(SO 4)2·6H 2O≈0.lmol/L]。


一、实验目的1. 了解环境污染的化学原因及危害;2. 掌握一些常见的化学实验方法在环境保护中的应用;3. 培养学生的环保意识和实践能力。
二、实验原理环境污染是指有害物质进入环境,使环境质量下降,影响生态系统和人类健康的现象。
化学实验在环境保护中具有重要作用,通过实验可以了解环境污染的化学原因,掌握一些常见的化学实验方法在环境保护中的应用。
三、实验内容1. 实验一:测定水体中化学需氧量(COD)(1)实验目的:测定水体中化学需氧量,了解水体污染程度。
(2)实验原理:化学需氧量(COD)是指在一定条件下,水体中所有可被强氧化剂氧化的物质的总质量。
COD越高,水体污染越严重。
(3)实验步骤:①取一定量的水样;②加入一定量的重铬酸钾溶液;③加热煮沸,使重铬酸钾氧化水体中的有机物;④测定剩余重铬酸钾的浓度;⑤计算化学需氧量。
2. 实验二:测定空气中的二氧化硫浓度(1)实验目的:测定空气中二氧化硫浓度,了解大气污染程度。
(2)实验原理:二氧化硫是一种有毒气体,对环境和人体健康有害。
测定空气中二氧化硫浓度,可以了解大气污染程度。
(3)实验步骤:①取一定体积的空气样品;②加入一定量的碘溶液;③加入一定量的硫酸溶液,使碘与二氧化硫反应;④测定反应后碘的浓度;⑤计算空气中二氧化硫浓度。
3. 实验三:测定土壤中的重金属含量(1)实验目的:测定土壤中重金属含量,了解土壤污染程度。
(2)实验原理:重金属对土壤环境和人体健康有害。
测定土壤中重金属含量,可以了解土壤污染程度。
(3)实验步骤:①取一定量的土壤样品;②加入一定量的盐酸溶液,使重金属离子溶解;③加入一定量的显色剂,使重金属离子显色;④测定显色剂的浓度;⑤计算土壤中重金属含量。
四、实验结果与分析1. 实验一:测定水体中化学需氧量(COD)实验结果表明,水体中的化学需氧量(COD)较高,说明水体污染较为严重。
应采取措施,如加强污水处理、控制工业废水排放等,以降低水体污染。

水质监测方案的制定一实验目的:1.1锻炼学生动手能力,提高综合运用能力。
1.2培养学生独立思考与独立解决问题能力。
1.3掌握水质监测各项指标测定的原理及方法。
1.4掌握实验所需仪器的使用方法。
1.5了解监测区域水质污染状况。
二实验方案的制定程序:2.1基础资料的收集经度:117.097纬度:39.088宽度:19m深度:3m海拔:4m2.2实验采样布点在城建正门前桥边进行采样,左右各取一个。
监测项目温度pH值电导率溶解氧COD高锰酸钾指数硫化物磷悬浮物六价铬铵态氮硝态氮亚硝态氮砷汞镉铅铁TOC总氯2.3样品保存与运输1.水样采集后应使用冷藏箱冷藏并尽快运到实验室。
2.测定溶解氧的水样应当场固定处理、且必须充满容器。
3.测定金属离子时应加入HNO3调节水样pH至1~2。
4.测定pH、温度电导率的水样应尽快送往实验室进行测定。
三现场采样与监测3.1实验仪器分光光度计、火焰原子检测器、原子荧光检测器、TOC分析仪仪器规格数量(个)仪器规格数量(个)三角瓶250ml 6 比色管架 1碘量瓶250ml 2 电炉1000w 1磨口三角瓶250ml 1 剪刀把 1冷凝管 1 乳胶管根 2烧杯100ml 2 吸耳球 2烧杯200ml 2 玻璃棒根 2烧杯500ml 2 滤膜张 5烧杯1000ml 1 滤纸张10容量瓶100ml 1 漏斗个 1容量瓶250ml 1 镜头纸本 1容量瓶500ml 1 移液管1ml 2容量瓶1000ml 1 移液管2ml 2试剂瓶50ml 2 移液管5ml 2试剂瓶125ml 2 移液管10ml 2试剂瓶500ml 2 移液管25ml 1试剂瓶1000ml 2 移液管50ml 1滴瓶50ml 2 移液管架 1比色管50ml 10 酸式滴定管50ml 1取样瓶500ml 2 碱式滴定管50ml 1量筒500ml 1 量筒100ml 23.2实验材料(化学药品)3.3现场采样及处理方法需要现场测的指标可当时完成如温度、电导率、溶解氧、如条件不允许,应立即送往实验室测定;测定悬浮物、pH、生化需氧量等项目需要单独采样,测定溶解氧,生化需氧量和有机污染物等项目的水样,必须充满容器。


污水中酸度和碱度的测定一、目的和要求(1)了解酸度和碱度的基本概念。
(2)掌握酸度和碱度的测定方法。
二、原理水中酸度和碱度均是衡量水质的重要指标,现将它们的定义和测定方法简述如下:1.酸度酸度是指水中含有能与强碱发生中和作用的物质的总量,主要来自水样中存在的强酸、弱酸和强酸弱碱盐等物质。
酸度采用氢氧化钠标准溶液滴定水样测得。
通常把用甲基橙作为指示剂滴定的酸度(pH 4.3)称为甲基橙酸度或强酸酸度;用酚酞作为指示剂滴定的酸度(pH 8.3)称为酚酞酸度或总酸度。
2.碱度碱度是指水中含有能与强酸发生中和作用的全部物质,主要来自水样中存在的碳酸盐、重碳酸盐及氢氧化物等。
碱度可用盐酸标准溶液进行滴定,其反应为2OH H H O -++→323CO H HCO -+-+→ 322HCO H H O CO -++→+↑用酚酞作为指示剂的滴定结果称为酚酞碱度,表示氢氧化物已经中和,32CO -全部转化为3HCO -。
以甲基橙作为指示剂的滴定结果称为甲基橙碱度或总碱度。
通过计算可以求出相应的碳酸盐、重碳酸盐和氢氧根离子的含量,但对废水、污水等由于其组分复杂,这种计算是没有实际意义的。
酸度和碱度单位常用mg L 表示,现在常以碳酸钙的mg L 表示。
此时l mg L 的酸度或碱度相当于50mg L 的碳酸钙。
三、实验步骤 1.酸度的测定I)酚酞酸度取25.0mL 水样于250mL 锥形瓶中,加2滴酚酞指示剂,以0.020mol L 氢氧化钠溶液滴定至溶液粉红色不退,准确读出消耗氢氧化钠溶液的毫升数(1V =18.5mL )。
2)甲基橙酸度取25.0mL 水样于250mL 锥形瓶中,加入2滴甲基橙,用氢氧化钠溶液滴定至溶液呈黄色,准确读出消耗氢氧化钠溶液的毫升数(2V =11.7mL )。
2.碱度的测定吸取10.0mL 水样于250mL 锥形瓶中,加入2滴酚酞指示剂,以0.0200mol L盐酸滴定至溶液粉红色刚退去,准确读出消耗盐酸溶液的毫升数(3V =24.8mL ),随后再加入2滴甲基橙指示剂,继续用盐酸滴定至溶液橙红色,准确读出消耗盐酸的毫升数(4V =4.8mL )。

养殖水环境化学实验Waters environmental chemistry for aquaculture experiment(学时:18)1、本实验教学的作用:养殖水环境化学实验(Experiments of Water Environmental Chemistry for Aquaculture)是水产养殖专业教学计划中的一门重要的专业基础课,是《养殖水环境化学》课程教学内容的一部分。
它是在本科生已学习了无机、分析化学理论和实验的基础上,开设的一门实验课,是后续专业课的前期课程。
2、本课程实验教学目的及学生能力标准:本课程的教学目标是,通过化学综合应用实验使学生掌握养殖水域化学组成的测定方法和有代表性常用化学分析仪器的使用方法;掌握养殖水域的水质调查方法,能够利用水质调查结果综合分析水质特点、优劣及与渔业利用的关系。
学生上完实验课后应具备如下实验操作技能:(1)熟练掌握滴定分析的基本技能,熟练掌握分析天平的使用。
重点掌握比色分析的有关原理和实验操作技能。
(2)掌握几种常见仪器(离心机、721分光光度计、酸度计、真空抽滤泵)的使用方法和注意事项。
(3)基本掌握常用的水样预处理方法(絮凝法、离心法、过滤法)(4)掌握水域水质调查方法和小型综合性实验的实验方法实验一pH测定—电位法(3学时)实验目的:掌握电位法测定pH的原理以及有关操作和注意事项。
实验方法:用电位法测定pH1、实验仪器:pH、复合电极等2、实验操作方法:(1)标准缓冲溶液及其配制,(2)仪器校准,(3)水样测定实验二天然水溶解氧的测定(3学时)1.实验目的:(1)重点掌握碘量法测定溶解氧的原理、方法、注意事项;(2)了解溶氧测定的干扰因素;(3)掌握亚硝酸氮干扰的原理及消除方法。
2.实验方法:用碘量法测定水体中的溶解氧。
以淀粉作指示剂,用硫代硫酸钠标准溶液滴定反应生成的碘,并由此计算水样中溶解氧的浓度。
3.实验仪器:碘量瓶、滴定管等4.实验操作方法:(1)硫代硫酸钠标准溶液的配制与标定,(2)指示剂和其它试剂的配制,(3)水样的采集、固定与测定实验三天然水中亚硝酸氮的测定(3学时)1.实验目的:(2)掌握比色法测定亚硝酸盐的原理和操作,(2)复习工作曲线的制作和比色分析的基本原理。
水环境化学实验指导一、银量法测定水体中的氯度实验目的:1、学习和掌握水体中氯离子含量的测定方法2、滴定指示剂的作用原理原理:在中性或弱碱性条件下用AgNO3滴定海水水样,以荧光黄钠盐-淀粉吸附指示剂指示滴定终点,终点时溶液由黄绿色转变为浅玫瑰红,用相同的方法滴定氯度标准液(NaCI或标准海水),从而计算水体的氯度。
二、实验用品:AgNO3标准溶液、荧光黄—淀粉指示剂、氯度标准溶液、250ml三角锥瓶、棕色酸式滴定管等。
三、配制:AgNO3标准溶液:取4.92克AgNO3 固体溶解于100 ml dd H2O中,棕色瓶保存;荧光黄—淀粉指示剂:(1)取50 ml dd H2O, 溶解NaOH 块0.2 g, 从中取10 ml 该溶液,加0.1 g 荧光黄,搅拌溶解,并逐步加稀HNO3 进行中和,当pH值为7.0时,最终溶液到100 ml.(2)淀粉溶液(10%), 将250 ml ddH2O中,加入25 g 可溶性淀粉,搅拌,加水后煮沸,冷却后即可。
(3)取(1)溶液12.5 ml + 250 ml 溶液(2)氯度的标准溶液:NaCl 16.37 g 溶解于500 ml dd H2O中,定容至500 ml , 即此溶液氯度值19.375实验步骤:一、AgNO3标准溶液的标定1、取氯度的标准溶液10 ml 于烧杯中,加几滴荧光黄—淀粉指示剂2、将AgNO3标准溶液加入到酸式滴定管中3、对烧杯中的氯度标准溶液进行滴定,记录开始,终止时的刻度读数,二者的差值为Vn(单位ml);注意烧杯中的颜色变化由黄绿色变为玫瑰红,即可。
校准因子f = 19.375/ Vn二、水样的测定准确移取水样10.00mL于三角锥瓶中,按步骤一)操作,其消耗AgNO3标准溶液的体积记为Vw。
3. 结果计算按下式计算海水氯度值CI‰=Vw· f +k =Vs+k氯度标准溶液的氯度值(本次实验为19.375),k—计算氯度的校正值(Vs为17‰左右时,k=0.05)。
海南大学《养殖水环境化学》综合实验报告题目:“海院路边水塘”水质综合评价实验组员: X X X 指导教师: X X X 专业:水产养殖时间:二〇一四年五月二十日一.实验背景水是鱼虾的唯一生存场所,在缸、池养殖水生植物和水生动物需要相当的学问。
目前水族行业的水处理产品严重制约着水族爱好者和经营者对水质的管理,全球有90%以上的观赏鱼虾养殖爱好者只能采用生活用水水源。
自来水的溶解氧、温度、硬度和地表水的标准有很大差异,直接应用于养殖导致观赏鱼虾和水生植物的健康保障值很低,通常要在容器里将水放两天后使水溶解氧达到和接近地表水。
中国也和全球其它国家一样执行地表水质标准,自来水除了水指标中的溶解氧外大部分水质用于景观养殖是标准的.无论家庭鱼虾缸及景观养殖观赏主要需要考虑以下六个方面的水质指标问题。
1.硬度;硬度问题也是衡量水质的大问题,大家都知道在玻璃杯中倒满水后放到阳光下让水在常态下自然蒸发,会发现当水蒸发完时玻璃杯内壁会有碳酸钙等复合物,就是这些物资决定着水的硬度,水中的碳酸钙在常态下很水随水分子蒸发试验表明水的硬度超过1800mg/L时,碳钙等复合物有相当数量是不容于水了,水分子吸收已经饱和,多余的形成了其它复合物质或沉淀,水的硬度越大对热带鱼虾有相应的危害程度。
硬度在国家地表水标准没有明确要求,自来水的生活用水标准是每毫升小于800mg/L,养殖用水碳酸钙越低越好。
热带观赏鱼虾400mg/L以下最适宜家庭鱼虾缸养殖观赏2.PH值; PH值问题是水中是很重要的数据,在国家地表水水质标准中表示酸度和碱度单位,国家标准是在6-9的范围内水族箱养殖应该是6.5-8是最好,因为是中性的水,其实6-9范围内都适用决大部分鱼虾种类的要求。
有少部分的观赏鱼虾在繁殖期间对PH值存在生理习性问题,但只要水的PH值在6-9范围内对鱼虾和水生植物的健康并没有危害性。
水中的生命凡是能够通过几百万年进化生存到现在的物种是具有一定程度适应性,否则是很难生存到现在。
水环境化学实验课开放式教学法研究【摘要】水化学实验课开放武教学法即学生全程参与实验课前准备,实验过程和综合实验设计。
充分强调实验中学生的主体地位,突出对学生创新精神和实践能力的培养。
经实践证明学生的动手操作能力和实验思维能力均得到较大提高,实验教学效果明显。
【关键词】实验课;开放;教学法“水环境化学”是水产养殖专业重要的专业基础课程,是研究各类天然水体化学组成、分析方法,以及水体中各类物质的来源、存在形式、迁移转化过程和分布变化规律的一门学科,是一门实验性和实践性都非常强的课程。
水环境化学实验课教学效果的好坏直接影响着其他专业基础课和专业课的学习,也影响到学生今后解决生产实际问题的能力。
如何培养和训练学生提高动手操作能力和掌握科学的实验思维能力是水化学实验教学的价值所在。
我们在教学实践过程中,以这一思想为指导,摸索出一套较为实用的循序渐进的教学方法,即学生全程参与实验课前准备,实验过程中突出学生主体地位和综合实验设计的开放式教学法。
一、学生充分参与实验课准备工作现在高校普遍存在这样一种现象:实验课前的准备工作几乎全部都由教师和实验人员准备好了,学生进入实验室后照搬实验讲义照单抓药就可以了。
这虽然可以节省实验时间,但却在一定程度上剥夺了学生自己动手进行独立思考实验的机会。
使学生对实验的目的、意义、如何着手能得到正确答案知之甚少,甚至有这样的笑话:本科学生竟然连蒸馏水是如何制取这样简单的问题都不知道,成为被动的实验应付者。
这是其弊之一;弊病之二是部分学生面对实验有“走过场”的思想。
出现学生做实验草草了事或不愿意动手的现象。
其实大学中许多的实验过程并不复杂,相反它的前期准备工作却需要花费相当时间做许多的基础工作,实验中出现的不正常现象也需从实验准备中去寻找原因,如:试剂的配制顺序、仪器的校准等。
如果学生没有接触到实验前期的准备工作,在分析解决问题时就会感到茫然,思路上受局限,不利于实验思维能力的培养。
实验一、酸碱标准容液的配制及标定废水酸度的测定一、目的1. 掌握酸、碱标准溶液的配制与标定方法。
2. 掌握滴定操作.3. 了解酸度的基本概念;掌握水样酸度的测定方法二、原理用直接法配标准溶液的物质,需符合①纯度达到一定要求;②组成与化学式符合;③稳定等三个条件。
市售的盐酸,氢氧化钠不能满足上述要求,因此采用间接法配制盐酸,氢氧化钠标准溶液,然后用基准物进行标定。
NaOH溶液可用邻苯二甲酸氢钾标定,由于邻苯二甲酸的Ka=2.9x 10-6,化学计量点附近的pH突跃与酚酞的变色范围重合,故可用酚酞为指示剂,HCl溶液可用碳酸钠标定,用甲基橙做指示剂.标定了碱或酸的浓度后,另一溶液的浓度也可根据酸与碱溶液滴定的体积比计算得出。
在水中,由于溶质的解离或水解(无机酸类,硫酸亚铁和硫酸铝等)而产生的氢离子,与碱标准溶液作用至一定pH值所消耗的量,定为酸度。
酸度数值的大小,随所用指示剂指示终点pH值的不同而异。
滴定终点的pH值有两种规定,即8.3和3.7。
用氢氧化钠溶液滴定到pH8.3(以酚酞作指示剂)的酸度,称为“酚酞酸度。
又称总酸度,它包括强酸和弱酸。
用氢氧化钠溶液滴定到pH3.7(以甲基橙为指示剂)的酸度,称为“甲基橙酸度”,代表一些较强的酸。
三、仪器1. 称量瓶2. 250 ml锥形瓶3. 50ml滴定管四、试剂1. 无二氧化碳水:pH不低于6.0的蒸馏水,如蒸馏水的pH较低,应蒸沸15分钟,加盖后冷却至室温。
2. 酚酞指示剂:称取0.5克酚酞,溶于50毫升95%乙醇中,再加入50毫升水。
3. 甲基橙指示剂:称取0.05克甲基橙,溶于100毫升水中。
4. 无水碳酸钠:优级纯5. 邻苯二甲酸氢钾:优级纯。
五、步骤1.0.1mol/L盐酸及0.1mol/L氢氧化钠溶液的配制0.1mol/L盐酸溶液的配制:用清洁量筒量取纯浓盐酸(比重1.19)4.3毫升,倒入清洁的试剂瓶中,用蒸馏水稀释至500毫升,以玻塞塞住瓶口,充分摇匀,贴上标签。